河蚬多糖分离纯化及抗氧化、抗肿瘤活性研究
2017-07-05杨玉娈陈丽丽袁美兰白春清
赵 琪 赵 利 杨玉娈 - 陈丽丽 - 袁美兰 - 白春清 -
(1. 江西科技师范大学生命科学学院,江西 南昌 330013;2. 国家淡水鱼加工技术研发分中心〔南昌〕,江西 南昌 330013)
河蚬多糖分离纯化及抗氧化、抗肿瘤活性研究
赵 琪1ZHAOQi1赵 利1ZHAOLi1杨玉娈1YANGYu-luan1陈丽丽1CHENLi-li1袁美兰1YUANMei-lan1白春清1BAIChun-qing1
(1. 江西科技师范大学生命科学学院,江西 南昌 330013;2. 国家淡水鱼加工技术研发分中心〔南昌〕,江西 南昌 330013)
采用DEAE-52纤维素色谱法和SephadexTMG-100葡聚糖凝胶色谱法对河蚬多糖进行分离纯化,获得CFP-1和CFP-2两个纯化组分,并对两组分进行紫外光谱和红外光谱扫描,结果表明:两组分中没有蛋白质和核酸,并证明它们是多糖类物质。液相色谱分析得到CFP-1和CFP-2的平均相对分子质量分别为1 172,3 627 kD。对河蚬多糖的抗肿瘤、抗氧化活性研究结果表明:CFP-1对人肝癌细胞(HepG-2)抑制作用较CFP-2明显,作用48 h时,CFP-1对人肝癌细胞的抑制活性IC50值为0.24 mg/mL;而在抗氧化活性方面CFP-2优于CFP-1。
河蚬;多糖;分离纯化;抗氧化
多糖参与生物体内各项生理活动,是生命有机体不可缺少的重要成分[1-2]。有机体中的多糖大多与其它大分子物质聚合在一起,其提取方法主要有水提法、碱提法、氯化钠溶液提取法、酶提取法等[3-4]。为了得到单一的多糖组分需要进行纯化,多糖的分级纯化方法有沉淀法、盐析法、柱层析法等[5]。近年来,人们相继发现了多糖具有抗肿瘤、抗氧化等活性[6-7]。目前关于研究贝类多糖的抗肿瘤作用的报道特别多。范秀萍等[8]研究发现,从珠母贝中提取的多糖对体外肿瘤细胞的生长具有显著的抑制作用。胡健饶等[9]发现,从三角帆蚌中提取的多糖对HepA癌细胞的增殖具有明显的抑制作用。贝类多糖对肿瘤细胞的抑制作用可能是具有细胞毒性作用,抑制了肿瘤细胞DNA的合成[10]。多糖的抗氧化活性可能是对肿瘤细胞抑制作用的机理之一。恶性肿瘤患者血液或组织中的脂质过氧化物含量增高,而过氧化氢酶活性和超氧化物歧化酶的活性明显下降,DNA被活性氧持续氧化损伤而不能得到有效修复导致细胞癌变。
河蚬(Corbiculafluminea)又称为黄蚬,是一种淡水类贝壳,在中国的江河湖泊中分布广泛,天然资源十分丰富。本试验拟研究DEAE-52纤维素柱以及葡聚糖凝胶SephadexTMG-100对河蚬多糖的分离纯化效果;河蚬多糖对体外培养的人肝癌HeGp-2细胞活性的抑制效果,通过研究河蚬多糖对DPPH·、·OH、O2-·的清除率以及对铁离子的还原力,建立体外抗氧化模型来评价河蚬多糖的抗氧化活性,为更好地了解河蚬多糖的抗氧化和抗肿瘤性提供依据。
1 材料与方法
1.1 材料与试剂
河蚬:壳长1.5~2.5 cm,采自鄱阳湖水域的鲜活河蚬。
DEAE-52纤维素、葡聚糖凝胶SephadexTMG-100:北京索莱宝科技有限公司;
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH):纯度 > 97%,美国Sigma公司;
三吡啶吖嗪:纯度 > 98%,美国Sigma公司;
邻菲罗啉:分析纯,国药集团化学试剂有限公司;
其它试剂:分析纯,南康市华亿化工有限公司;
人肝癌HeGp-2细胞:南昌大学第一附属医院。
1.2 仪器与设备
全自动部分收集器:DBS型,上海沪西仪器有限公司;
电脑定时恒流泵:DHL-B型,上海沪西仪器有限公司;
层析柱:φ 2.5 cm×60 cm,上海华美实验仪器厂;
高效液相色谱仪:1100series型,美国Agilent公司;
红外光谱仪:L-8900型,日本日立公司;
全自动酶标仪:Mode 680型,美国Bio-rad公司。
1.3 试验方法
1.3.1 河蚬粗多糖的提取 取新鲜的河蚬吐沙48 h(每12 h换一次清水),取肉、匀浆。取河蚬浆于酶反应器中进行水解,水解所用的酶为碱性蛋白酶Alcalase,条件为水解温度50 ℃,加酶量2%,底物浓度2%,起始pH为8.5,水解得到河蚬酶解液[11]。河蚬酶解液流经大孔吸附树脂层析柱,达到穿透点后,用去离子水冲洗至电导率与纯水相当,此流出液经减压浓缩、冷冻干燥得河蚬粗多糖粉末。
1.3.2 河蚬多糖的分离纯化
(1) DEAE-52纤维素凝胶的预处理[12]:称取100 g DEAE-52纤维素凝胶,先用大量蒸馏水浸泡24 h使其充分溶胀后,用碱液—酸液—碱液依次浸泡。每一次换浸泡液之前用大量蒸馏水洗反复冲洗至中性后再浸泡,浸泡所用酸液和碱液浓度为0.5 mol/L的盐酸溶液和氢氧化钠溶液,浸泡时间为0.5 h,体积为1 500 mL。
(2) DEAE-52纤维素色谱柱法分离:称取60 mg河蚬粗多糖溶于3 mL蒸馏水中,缓慢加入层析柱中,然后打开层析柱下端止水夹使多糖溶液进入柱填料内,再缓慢加入3 mL蒸馏水,随后打开恒流泵用浓度分别为0.0,0.1,0.2,0.3 mol/L的NaCl溶液进行梯度洗脱,流速为1.0 mL/min,5 mL自动收集1管,每梯度共收集50管[13]。用苯酚—硫酸法[14]检测各管在490 nm处吸光值,绘制DEAE-52纤维素色谱柱的洗脱曲线。收集峰值处的多糖溶液,经减压浓缩、蒸馏水透析、冷冻干燥得到粗多糖。
(3) SephadexTMG-100葡聚糖凝胶色谱柱的分离:SephadexTMG-100凝胶干粉100 g加入大量蒸馏水浸泡12 h后,进行湿法装柱,平衡备用[15]。取河蚬粗多糖20 mg,溶于5 mL蒸馏水中,从上端缓慢加入凝胶柱中,以蒸馏水洗脱,流速0.2 mL/min,每4 mL自动收集1管,用苯酚—硫酸法检测各管多糖溶液在490 nm处的吸光度值,绘制SephadexTMG-100凝胶色谱柱洗脱曲线。收集主峰的部分多糖溶液,蒸馏水透析2 d,45 ℃减压浓缩冷冻干燥即得多糖纯化产品。
1.3.3 河蚬多糖的紫外扫描图谱 用紫外可见分光光度计对浓度为0.5 mg/mL的河蚬多糖溶液进行扫描,波长范围为200~400 nm。
1.3.4 河蚬多糖的红外扫描图谱 用溴化钾压片法来测河蚬多糖的红外图谱。
1.3.5 河蚬多糖分子量的测定以及纯度鉴定
(1) 分子量标准曲线的制作:用流动相将已知分子量的标准多糖配制成1.0 mg/mL的标准溶液,并用0.45 μm的滤膜进行过滤,采用Agilent 1100series型高效液相色谱仪进行分析,色谱柱为PL aquagel-OH MIXED 8 μm,以静态光散射检测器和示差检测器进行检测。具体操作条件:检测器及柱温均为25 ℃,流动相为浓度为0.1 mol/L的NaNO3的磷酸盐缓冲液,流速为0.8 mL/min,进样体积为20 μL。
(2) 样品多糖平均分子量的测定:称取多糖样品配制1.0 mg/mL 溶液,测定方法同标准品的测定,并计算出多糖样品的平均分子量,鉴定其纯度。
1.3.6 河蚬多糖的抗氧化活性研究
(1) DPPH自由基清除率的测定:参照Li等[16]的方法。分别向试管中加入经过纯化的不同质量分数的河蚬多糖CFP-1、CFP-2,然后再加入0.1 mmol/L DPPH溶液各2 mL,漩涡振荡混匀,在暗室中反应30 min,测波长517 nm处的吸光度值,并计算清除率。

(1)
式中:
K——DPPH自由基清除率,%;
A1——样品的吸光值;
A0——以水代替河蚬提取液的对照试验的吸光值;
A2——以无水乙醇代替DPPH溶液的样品干扰试验的吸光值。
(2) 羟自由基(·OH)清除率的测定:参照文献[17],在10mL试管中依次加入邻二氮菲(5mmol/L)1.0mL,PBS缓冲液(0.2mol/LpH7.4)2.0mL,1.0mL纯化的河蚬多糖CFP-1、CFP-2,H2O2(0.1mL/100mL)1.0mL,37 ℃水浴1h。用紫外-可见分光光度计测波长536nm处的吸光度值,并计算清除率。
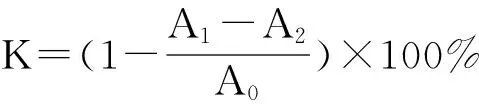
(2)
式中:
K——·OH清除率,%;
A0——双蒸水代替样品的空白对照试验的吸光值;
A1——样品的吸光值;
A2——双蒸水代替除样品以外的物质的干扰实验的吸光值。
(3) 铁离子还原力的测定:将0.02mol/L的氯化铁溶液、0.3mol/L,pH3.7的醋酸盐缓冲液和0.01mol/L的三吡啶吖嗪溶液,用0.04mol/L的盐酸溶液配制,以1∶10∶1的比例混合均匀,即可获得FRAP试剂。
FeSO4标准曲线的绘制:分别取1.0mmol/L硫酸亚铁溶液0.00,0.10,0.20,0.30,0.40,0.50,0.60mL,按顺序加入双蒸水2.0,1.9,1.8,1.7,1.6,1.5,1.4mL再加入10.0mLFRAP试剂。摇匀,37 ℃反应10min,测定其在波长593nm处的吸光度值,绘制标准曲线。
样品的测定:10mLFRAP溶液中加入2mL样品(纯化的河蚬多糖CFP-1、CFP-2),摇匀,37 ℃反应10min后,593nm记录吸光度值,以蒸馏水代替河蚬多糖溶液做空白对照,A1为样品的吸光度,A2为以蒸馏水代替氯化铁溶液做干扰试验吸光度,以每毫克样品达到相同吸光度(A1-A2)时所需FeSO4的微摩尔数表示样品的抗氧化能力。
(4) 超氧阴离子自由基(O2-·)清除率的测定:按表2加入样品和试剂,迅速混匀,倒入比色皿中,在420nm波长处测定邻苯三酚的自氧化速率(0~5min),计算对O2-·的清除率:

(3)
式中:
SA——超氧阴离子自由基(O2-·)清除率,%;
V0——对照管吸光度随时间的变化率,%;
VS——样品管吸光度随时间的变化率,%。
pH=8.2Tri—HCl缓冲液(0.1mol/L)用2mmol/LEDTA配制;邻苯三酚(60mmol/L)用10mmol/LHCl配制。

表1 超氧阴离子自由基清除活性测定加样表Table 1 Determination of superoxide anion radicalscavenging activity mL
1.3.7 河蚬多糖的抗肿瘤活性研究
(1) 肿瘤细胞的复苏:采用快速融化法。一般要求在20 s内完全融化,以避免水分渗入细胞内再结晶对细胞造成损害[18]。将无菌RPMI-1640完全培养基(含10%胎牛血清)置入37 ℃、5%的CO2培养箱中,放置 30 min;取出冻存管后迅速放入 37 ℃水浴锅中复温,轻轻振动融化,待冻存管中融化90%左右时取出;在无菌操作台中用75%的乙醇消毒冻存管后开启,用移液器吸出细胞悬液注入离心管,并滴加10倍左右的 RPMI-1640 培养基,混匀后1 000 r/min 离心 5 min,弃去培养液;用无菌的RPMI-1640 完全培养基重新配成细胞悬液,并转移至细胞培养瓶中,计数并检查细胞活力,然后置于CO2培养箱中静置培养。
(2) 细胞的传代与培养:以无菌操作,打开瓶口过火后,用移液枪轻轻吸去上层培养液;用2 mL无菌PBS缓冲液洗涤2次,加入胰蛋白酶800 μL,放入CO2培养箱中进行消化。待贴壁细胞如流沙状脱落时(约2~3 min)加入RPMI-1640完全培养基4 mL终止消化,用吸管轻轻吹打制成均匀的细胞悬液。将细胞悬液分置于3个培养瓶中,分别加入5 mL RPMI-1640 完全培养基轻轻混匀置于培养箱中培养[19]。
(3) 抗肿瘤活性的测定:采用MTT法[20-21]。培养人肝癌HepG-2细胞至对数生长期,经胰酶消化后加入培养液终止消化,离心后去除上清液,加入适量的培养基调节细胞浓度为1×105个/mL。在96孔培养板中接种细胞悬液100 μL,待细胞贴壁后(一般需要6 h)加多糖溶液100 μL;每组设6个复孔;置于CO2培养箱中培养24 h或48 h后取出做MTT检测,试验方法为:每孔加入5.0 mg/mL MTT溶液(以PBS配制,并用0.22 μm滤膜过滤除菌)20 μL,继续培养4 h后弃去上清液,每孔加入150 μL 二甲基亚砜,低速振荡10 min后,用酶标仪于492 nm处测吸光度,重复3次,取平均值,并按式(4)计算不同浓度纯化河蚬多糖CFP-1、CFP-2对人肝癌HepG-2肿瘤细胞的抑制率。绘制抑制率与多糖浓度关系曲线。

(4)
式中:
A——抑制率,%;
OD1——样品的吸光值;
OD2——对照试验的吸光值。
1.3.8 数据分析及作图 试验数据用SPSS13.0分析,Origin8.0作图。
2 结果与分析
2.1 河蚬多糖的分离及纯化
2.1.1DEAE-52纤维素色谱柱的初步分离 由图1可知,经不同浓度NaCl溶液梯度洗脱,以苯酚—硫酸法示踪检测到2个主要洗脱峰,得到河蚬粗多糖2个主要组分并命名,分别是以蒸馏水洗脱得到的CFP-1和以0.1mol/LNaCl溶液洗脱所得CFP-2。合并相同组分经减压浓缩、蒸馏水透析、冷冻干燥之后得到CFP-1和CFP-2 2个多糖产品,之后再通过凝胶层析柱进行更进一步的纯化。

图1 DEAE-52纤维素色谱柱的梯度洗脱曲线Figure 1 Gradient elution curve of DEAE-52 cellulosechromatography column
2.1.2SephadexTMG-100葡聚糖凝胶色谱柱的分离 葡聚糖G-100凝胶柱对CFP-1和CFP-2的洗脱曲线见图2,3,经葡聚糖G-100凝胶柱分离CFP-1和CFP-2两组分的洗脱峰都为单一峰且峰型对称性良好。收集合并相同组分,经减压浓缩、蒸馏水透析、冷冻干燥得到棉絮状的纯化多糖CFP-1和CFP-2。

图2 CFP-1流经 SephadexTM G-100 柱洗脱曲线Figure 2 CFP-1 SephadexTM G-100 column elution curves

图3 CFP-2流经 SephadexTM G-100 柱洗脱曲线Figure 3 CFP-2 SephadexTM G-100 column elution curves
2.2 河蚬多糖的紫外扫描图谱分析
由图4可知,粗多糖和分离纯化的2个多糖组分在200nm附近都有一大的吸收峰;该吸收峰为多糖的特征吸收峰,在260~280nm处,粗多糖有吸收峰,而经分离纯化的多糖CFP-1和CFP-2均没有此峰,说明经分离纯化的多糖组分已无蛋白质和核酸。
2.3 河蚬多糖的红外扫描图谱
图5、6为河蚬多糖CFP-1、CFP-2的红外光谱图。在图5,6中,3 370nm-1左右处2种组分都出现了明显的吸收峰,在3 700~3 100nm-1处出现的吸收带是羟基的O—H伸缩振动;2 928nm-12种组分都都出现了明显吸收峰,在3 000~2 800nm-1处出现的吸收峰是由烷基的C—H伸缩振动引起的,由此可知CFP-1和CFP-2含有多糖类物质的特征基团。在1 700~1 600nm-1处2种组分出现的强吸收峰可能是羧基的C═O非对称伸缩振动引起的,也可能是氨基的N—H变角振动引起的,1 400~1 300nm-1处2种组分都出现了强吸收峰是羧基的C═O对称伸缩振动,说明这2种河蚬多糖组分都含有羧基基团;在1 200~900nm-1处2种组分都出现一组强的吸收峰,它是由羟基(O—H)的变角振动和吡喃糖环中醚键(C—O—C)的伸缩振动引起[22]。CFP-1在840nm-1处的吸收峰表明该多糖含有a-型糖苷键[23]。
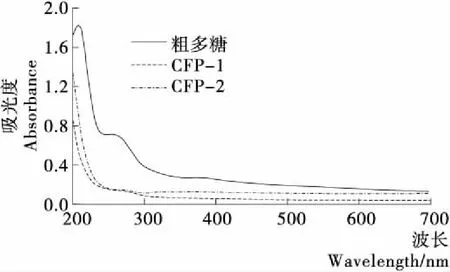
图4 河蚬多糖的紫外吸收图谱Figure 4 UV absorbance spectra of polysaccharides ofCobicula fluminea

图5 河蚬多糖纯化组分CFP-1傅立叶变换红外光谱图
Figure5IsolationandPurificationcomponentsCFP-1ofFourierTransformInfraredspectrumfromCorbicula flumineaPolysaccharide

图6 河蚬多糖纯化组分CFP-2傅立叶变换红外光谱图
Figure 6 Isolation and Purification components CFP-2 of Fourier Transform Infrared spectrum fromCorbiculaflumineaPolysaccharide
2.4 河蚬多糖的分子量测定及纯度鉴定
由图7可知,经DEAE-52纤维素柱和sephadexTMG-100凝胶柱纯化后的多糖组分CFP-1经2种检测器得到的结果显示,出现且峰型尖锐对称性好的单一峰,与凝胶色谱图结果相吻合,说明河蚬粗多糖经两步柱层析分离纯化后得到的多糖CFP-1分子量相对均一。由图8可知,静态光散射检测器检测结果显示有一个峰形尖锐且对称的峰,而示差检测器检测结果显示有多个峰,说明河蚬多糖CFP-2中还含有一定的其他物质。经计算河蚬多糖CFP-1与CFP-2的平均相对分子质量分别为1 172,3 627 kD。

a为示差检测器对CFP-1的检测结果,b为静态光散射检测器对CFP-1的检测结果
图7 河蚬多糖纯化组分CFP-1的高效液相色谱图
Figure 7 Isolation and Purification components CFP-1 of High performance liquid chromatography fromCorbiculaflumineaPolysaccharide

a为示差检测器对CFP-2的检测结果,b为静态光散射检测器对CFP-2的检测结果
图8 河蚬多糖纯化组分CFP-2的高效液相色谱图
Figure 8 Isolation and Purification components CFP-2 of High performance liquid chromatography fromCorbiculaflumineaPolysaccharide
2.5 河蚬多糖的体外抗氧化活性分析
2.5.1 对DPPH自由基的清除率 由图9可知,随着河蚬多糖浓度的增大,河蚬多糖CFP-2对DPPH·的清除率显著增大,CFP-1对DPPH·的清除能力增加缓慢,当浓度为3 mg/mL时,CFP-2对DPPH·的清除率为52.04%,CFP-1对DPPH·的清除率为16.60%,所以CFP-2表现出了更强的清除DPPH·活性。显著性分析结果显示CFP-1浓度升高到2.5 mg/mL之后,清除率的变化不显著;CFP-2在各浓度条件下对DPPH·的清除率变化均显著。

图9 河蚬多糖对DPPH自由基的清除作用Figure 9 Scavenging effect of Polysaccharide from Corbicula fluminea on DPPH Free Radical
2.5.2 对羟自由基的清除率 由图10可知,随着河蚬多糖浓度的增大,CFP-1对·OH的清除率减小,CFP-2对·OH的清除率增大,当CFP-1浓度为0.5 mg/mL时,对·OH的清除率为27.81%,当浓度增大为3 mg/mL时,对·OH的清除率下降到15.63%;当CFP-2 浓度为0.5 mg/mL时,对·OH的清除率为16.88%,当浓度增大为3 mg/mL时,对·OH的清除率增大到63.75%。由此可知,对比2种多糖对·OH的清除率,结果显示CFP-2表现出更强的活性,显著性分析结果显示CFP-2在各浓度条件下对·OH的清除率变化均显著。
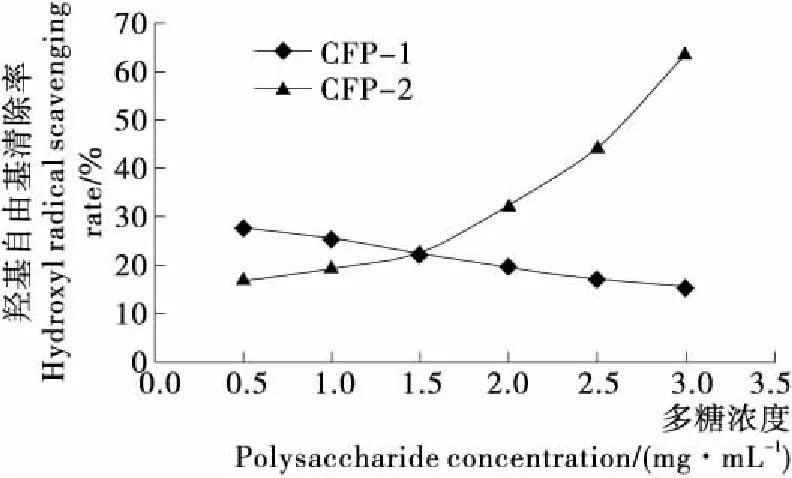
图10 河蚬多糖对·OH的清除作用Figure 10 Scavenging effect of Polysaccharides fromCorbicula fluminea on Hydroxyl radical
2.5.3 对铁离子的还原力 由图11可知,随着河蚬多糖浓度的增大,CFP-2吸光度明显增大,而CFP-1吸光度变化缓慢,说明CFP-2对铁离子还原力强于CFP-1。当多糖浓度为3 mg/mL时,CFP-1和CFP-2的FRAP值分别为24.64,65.24 μmol/mg。显著性分析结果显示CFP-2在各浓度条件下对铁离子还原力的变化均显著。
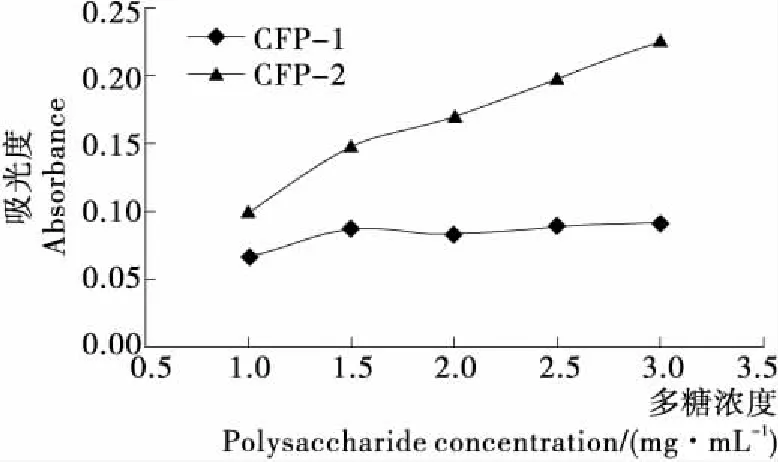
图11 河蚬多糖的铁离子还原力Figure 11 Reducing power of Corbicula flumineaPolysaccharide
2.5.4 对超氧阴离子自由基的清除率 由图12可知,河蚬多糖CFP-1和CFP-2对O2-·的清除能力都随着浓度的增大呈增大趋势。CFP-2 对O2-·的清除率增加缓慢,CFP-1 对O2-·的清除率增加明显,当CFP-2浓度为0.5 mg/mL时,对O2-·的清除率为0.32%,当浓度为3 mg/mL时,对O2-·的清除率增加到2.86%;当浓度为0.5 mg/mL时,CFP-1对O2-·的清除率为1.59%,当浓度为3 mg/mL时,CFP-1对O2-·的清除率增大到16.19%。由此可知,CFP-1 对O2-·的清除活性高于CFP-2。但试验结果显示2种多糖对O2-·的清除活性都较弱。

图12 河蚬多糖对O2-·的清除作用
Figure 12 Scavenging effect of Polysaccharides fromCorbiculaflumineaon Superoxide anion
2.6 河蚬多糖的体外抗肿瘤活性分析
由图13可知,加药培养 24 h和48 h后,河蚬多糖CFP-1对体外培养的人肝癌HeGp-2细胞生长都有一定的抑制作用,当河蚬多糖CFP-1浓度为0.2 mg/mL时,作用24 h抑制不明显,作用48 h其抑制率达到44.17%,表现出了较强的体外抑瘤活性。

图13 CFP-1对体外培养的HeGp-2细胞的生长抑制作用Figure 13 Effect of CFP-1 on proliferation of HeGp-2 cells
由图14可知,加药培养 24 h和48 h后,河蚬多糖CFP-2对体外培养的人肝癌HeGp-2细胞生长都有一定的抑制作用,当河蚬多糖CFP-2浓度为0.2 mg/mL时,作用24 h抑制不明显,作用48 h其抑制率达到37.56%,比CFP-1的抗肿瘤活性稍弱。
3 结论
通过DEAE-52纤维素色谱法,获得河蚬粗多糖2个初步分离组分,再利用SephadexTMG-100葡聚糖凝胶色谱法对初步分离的2个组分进行进一步纯化,得到CFP-1和CFP-2 2个组分。经计算得到河蚬多糖CFP-1与CFP-2的平均相对分子质量分别为1 172,3 627 kD。对河蚬粗多糖、CFP-1、CFP-2的紫外光谱扫描得出经分离纯化的多糖组分已无蛋白质和核酸。对其进行红外扫描得出CFP-1和CFP-2均为多糖类物质。河蚬多糖对人肝癌细胞HepG-2抑制结果表明:CFP-1对人肝癌细胞HepG-2抑制作用效果显著;纯化多糖CFP-1和CFP-2都具一定的抗氧化能力,在对DPPH·、·OH、O2-·的清除率以及铁离子还原力方面,CFP-2的抗氧化活性均优于CFP-1。

图14 CFP-2对体外培养的HeGp-2细胞的生长抑制作用Figure 14 Effect of CFP-2 on proliferation of HeGp-2 cells
本试验对河蚬多糖的分离纯化,得到了2种纯化产品CFP-1和CFP-2,并对其纯度、分子量、抗肿瘤活性和抗氧化活性进行了研究,但是对2种多糖的结构特征等还不是很了解,可以进行进一步的试验研究,对其它可能存在的一些性质也可以进行试验分析。
[1] XIE Jing-tian, WU Ji-an, MEHENDALE S, et al. Anti-hyperglycemic effect of the polysaccharides fraction from American ginseng berry extract in ob/ob mice[J]. Phytomedicine International Journal of Phytotherapy & Phytopharmacology, 2004, 11(2/3): 182-187.
[2] MATSUNAGA K, IIJIMA H, KOBAYASHI H. Neonatal Inoculation with the Protein-bound Polysaccharide PSK Increases Resistance of Adult Animals to Challenge with Syngeneic Tumor Cells and Reduces Azoxy methane-induced Precancerous Lesions in the Colon [J]. Cancer Epidemiology Biomarkers & Prevention, 2000, 9(12): 1 313.
[3] 叶凯贞, 黎碧娜, 王奎兰, 等. 多糖的提取、分离与纯化[J]. 广州食品工业科技, 2004, 20(3): 144-145.
[4] ALBANO R M, MOURAO P A. Isolation, fractionation and preliminary characterization of anovel class of sulfated glycans from the tunic of Styda plicata(Chordata Tunicata)[J]. J Biol Chem, 1986, 261(2): 758-765.
[5] LUO Ao-xue, HE Xing-jin, ZHOU Song-dong, et al. Purification, composition analysis and antioxidant activity of the polysaccharides from Dendrobium nobile Lindl[J]. Carbohydrate Polymers, 2010, 79(4): 1 014-1 019.
[6] LEUNG M Y, LIU C, ZHU L F, et al. Chemical and biological characterization of a polysaccharide biological response modifier from Aloe veral. var. chinensis (Haw.) Berg[J]. Glycobiology, 2004, 14(6): 501-510.
[7] HUANG Qi-lin, JIN Yong, ZHANG Li-na, et al. Structure, molecular size and antitumor activities of polysaccharides from Poria cocos mycelia produced in fennenter[J]. Carbohydrate Polymers, 2007, 70(3): 324-333.
[8] 范秀萍, 吴红棉, 雷晓凌. 珠母贝氛基多糖的分离纯化及其抗肿瘤活性的初步研究[J]. 中国海洋药物, 2005, 24(2): 32-36.
[9] 胡健饶, 曹明富. 三角帆蚌多糖抑瘤作用的实验研究[J]. 中国现代应用药学, 2003, 20(1): 11-13.
[10] 范秀萍, 吴红棉, 雷晓凌, 等. 菲律宾蛤仔氨基多糖的分离提取及其抗肿瘤活性的初步研究[J]. 食品工业科技, 2003, 24(9): 73-76.
[11] 杨玉娈. 河蚬精的制备及活性物质的研究[D]. 南昌: 江西科技师范大学, 2016: 26-34.
[12] CAI Wei-rong, GU Xiao-hong, TANG Jian. Extraction, Purification, and characterization of the Polysaceharides fromOPuntiamilPaalta[J]. Carbohydrate Polymers, 2008, 71(3): 403-410.
[13] WANG Chia-Chi, CHANG Shyh-Chang, CHEN Bing-Huei. Chromatographic determination of polysaccharides in Lycium barbarum Linnaeus[J]. Food Chemistry, 2009, 116(2): 595-603.
[14] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 1956, 28(3): 350-356.
[15] LIU Jun, LUO Jian-guang, YE Hong, et al. Production, characterization and antioxidant activities in vitro of exopolysaccharides from endophytic bacterium Paenibacillus polymyxa EJS-3[J]. Carbohydrate Polymers, 2009, 78(2): 275-281.
[16] LI Xiao-lan, ZHOU Ai-guo, HAN Yong. Anti-oxidation and anti-microorganism activities of purification polysaccharide from Lygodium japonicum in vltro[J]. Carbohydrate Polymers, 2006, 66(1): 34-42.
[17] ROGINSKY V, LISSI E A. Review of methods to determine chain breaking antioxidant activity in food[J]. Food Chemistry, 2005, 92(2): 235-254.
[18] 高林. MCP多糖的制备、分析鉴定及其抗肿瘤作用的研究[D]. 天津: 天津大学, 2005: 49.
[19] 李雪梅. 海湾扇贝多糖的提取、纯化及抗肿瘤活性研究[D]. 保定: 河北农业大学, 2014: 33.
[20] MOSMANN T. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays[J]. Journal of Immunological Methods, 1983, 65(2): 55-63.
[21] 吕俊, 李璐, 毕富勇. 银耳多糖抑制肝癌HepG-2细胞体外增殖机制的实验研究[J]. 中国肿瘤, 2009, 18(5): 413-415.
[22] KACDURDKOVD M, CAPEK P, SASINKOVD V, et al. FT-IR study of plant cell wall model compounds: pectic polysaccharides and hemicelluloses[J]. Carbohydrate Polymers, 2000, 43(2): 195-203.
[23] YE S N, KIM W J, KIM S M, et al. Purification, characterization and immunostimulating activity of water-soluble polysaccharide isolated from Capsosiphon fulvescens[J]. International Immunopharmacology, 2010, 10(3): 364-370.
收稿日期:2017-01-22
Study onisolation, antioxidation and anti-tumor activites of polysaccharide inCorbiculafluminea
(1.CollegeofLifeScience,JiangxiScienceandTechnologyNormalUniversity,Nanchang,Jiangxi330013,China;2.NationalR&DBranchCenterforFreshwaterFishProcessing,Nanchang,Jiangxi330013,China)
CFP-1 and CFP-2 were purified fromCorbiculaflumineaby DEAE-52 cellulose anion-exchange chromatography and SephadexTMG-100 gel-filfration chromatography. The molecule structure was analyzed by ultraviolet spectrum scanning and infraned spectrum. Ultraviolet spectrum showed that CFP-1 and CFP-2 contained little DNA and protein, and infraned spectrum showed that both of them were polysaccharides. Purity of CFP-1 and CFP-2 was further confirmed by using HPLC, they were homogenous with a molecular weight of 1 172 kD and 3 627 kD. The result showed that CFP-1 could significantly inhibit proliferation of HepG-2 than CFP-2. with theIC50value of 0.24 mg/mL after 48 h treating. In addition, radical scavenging tests revealed that CFP-2 showed significant function of antioxidation activity.
Corbiculafluminea; polysaccharide; separation and purification; antioxidation activity
10.13652/j.issn.1003-5788.2017.04.025
福建省中青年教师教育科研项目(编号:JA15390);泉州市科技计划项目(编号:2015Z135);福建省大学生创新创业训练计划项目(编号:201510399041)
陈洪彬(1989-),男,泉州师范学院讲师,在读博士研究生。E-mail:yummyway@qq.com
2017—02—16
基金项目:湖南省林业厅项目(编号:XLK201664,XKL201735);湖南省科技重大专项(编号:2016NK1001);湖南省大学生研究性学习和创新性实验计划(编号:XJT2016﹝283﹞-254)
钟海雁(1963-),男,中南林业科技大学教授,博士。 E-mail: zhonghaiyan631210@126.com
作者简介:包莉圆,女,中南林业科技大学在读硕士研究生。
