一种三足四齿Schiff碱的Cu(Ⅱ)、Co(Ⅲ)配合物的合成、晶体结构与表征
2017-07-05解庆范姚勇刚姜岩洪思雨陈延民
解庆 范姚勇 刚姜岩 洪思雨 陈延民
(泉州师范学院化工与材料学院,泉州362000)
一种三足四齿Schiff碱的Cu(Ⅱ)、Co(Ⅲ)配合物的合成、晶体结构与表征
解庆 范姚勇 刚姜岩 洪思雨 陈延民*
(泉州师范学院化工与材料学院,泉州362000)
制备了一种水杨醛类多齿Schiff碱(H3Lds,1),并合成了2种金属配合物[CuCl(H2Lds)]·H2O(2)和[Co2(H2O)2(Lds)2]·5H2O(3)。X射线单晶衍射分析结果表明,1属正交晶系P212121空间群,分子间氢键将该化合物H3Lds连接成二维超分子网络。2属正交晶系Pbca空间群,它是一种具有平面四边形构型的单核铜配合物。而3属单斜晶系P21/c空间群,它是一种双核钴配合物,其中Co处于畸变的八面体配位环境。2和3借助分子间氢键均形成了一维超分子链。
席夫碱;配合物;晶体结构;多羟基配体
所谓超分子是指以氢键、范德华力、亲水-疏水相互作用、π-π堆积作用和配位键等非共价键形成的有序的且具有某种功能的分子聚集体。自从1978年Lehn提出超分子化学概念以来,超分子化学在与材料科学、信息科学、生命科学、能源科学、纳米科学与技术等其他学科的交叉融合中,已发展成为超分子科学,被认为是21世纪新概念和高新技术的重要源头之一。它的发展也为配位化学研究注入了新的活力和生长点,利用有机配体结构的特点和金属离子电子构型与配位特性以及阴离子和溶剂分子的诱导作用,设计合成新颖结构的超分子配合物是十分活跃的研究领域[1-3]。具有半刚性结构特性的三足体有机配体与不同客体分子作用时,其侧链或是聚集呈笼状、或是向四周呈辐射状同客体分子相结合,表现出丰富多变的立体配位结构[4~11]。本文以2-氨基-2-甲基-1,3-丙二醇与水杨醛反应合成了一种新的三足四齿配体H3Lds(Scheme 1),并制备了2种配合物[CuCl(H2Lds)]·H2O和[Co2(H2O)2(Lds)2]·5H2O,在此主要报导它们的晶体结构和光谱性质。
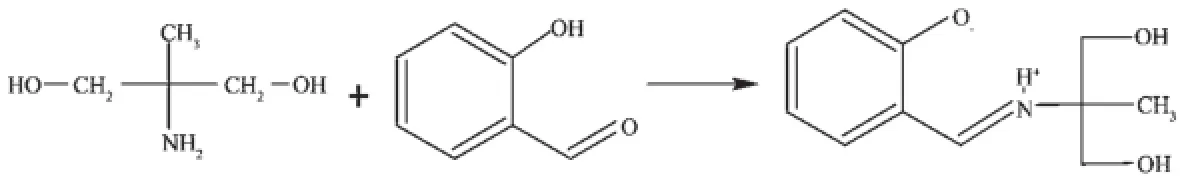
Scheme 1
1 实验部分
1.1 仪器及试剂
Elmentar Vario EL元素分析仪(德国);Nicolet is10型FTIR红外光谱仪(美国);美普达UV-1800PC型紫外-可见分光光度计(上海);Bruker Smart Apex CCD单晶衍射仪(德国),理学Rigaku Saturn724 CCD单晶衍射仪(日本)。所用试剂均为市售分析纯。
1.2 合成方法
1.2.1 配体H3Lds(1)的合成
将20 mmol的1-氨基-1,1-二羟甲基乙烷与20 mmol的水杨醛溶解于20 mL无水乙醇,置于50 mL圆底烧瓶,在80℃下搅拌回流5 h,自然冷却挥发,析出浅黄色针状晶体。室温下真空干燥备用。对C11H13NO3的元素分析的实测值(计算值,%):C 63.66(63.76),H 6.26(6.32),N 6.71(6.76)。IR(cm-1):3 332,3 048,2 971,2 818,1 636,1 608,1 523,1 490,1 459,1 387,1 375,1 237,1 167,1 132,1 061,761,737。
1.2.2 配合物[CuCl(H2Lds)]·H2O(2)的合成
将0.3 mmol氯化铜和0.3 mmol H3Lds溶于20 mL体积比为1∶1的乙醇水溶液,用四甲基氢氧化铵调pH值为6.5,60℃下搅拌2 h,冷却,过滤,静置,2周后,得到绿色块状晶体。对C11H16ClCuNO4的元素分析的实测值(计算值,%):C 40.58(40.62),H 5.02(4.96),N4.33(4.31)。IR(cm-1):3 417,2 925,2 853,1 628,1 602,1 541,1 476,1 451,1 384,1 350,1 238,1 190,1 134,1 070,756。
1.2.3 配合物[Co2(H2O)2(Lds)2]·5H2O(3)的合成
将0.3 mmol乙酸钴和0.3 mmol H3Lds溶于20 mL体积比为1∶1的乙醇水溶液,60℃下搅拌2 h,冷却,过滤,静置,2周后,得到红色块状晶体。对C22H38Co2N2O13的元素分析的实测值(计算值,%):C 40.19(40.26),H 5.77(5.84),N 4.22(4.27)。IR(cm-1):3 434,2 926,2 861,1 634,1 600,1 541,1 384,1 350,1 238,1 190,1 134,1 070,756。
1.3 晶体结构测试
选取合适大小的1~3单晶置于单晶衍射仪上,用经石墨单色器单色化的Mo Kα射线(λ=0.071 073 nm)分别在1.95°<θ<28.78°(1)、3.09°<θ<25.01°(2)和3.08°<θ<27.00°(3)范围内以~扫描方式于293(2)K下收集单晶衍射数据。全部强度数据均经Lp因子校正,并进行了经验吸收校正,晶体结构由直接法解出,对全部非氢原子坐标及其各向异性热参数进行全矩阵最小二乘法修正,氢原子由理论加氢法得到。结构解析和精修采用SHELXTL[13]程序包完成。晶体学数据详见表1。
CCDC:1443146,1;1440517,2;1440577,3。
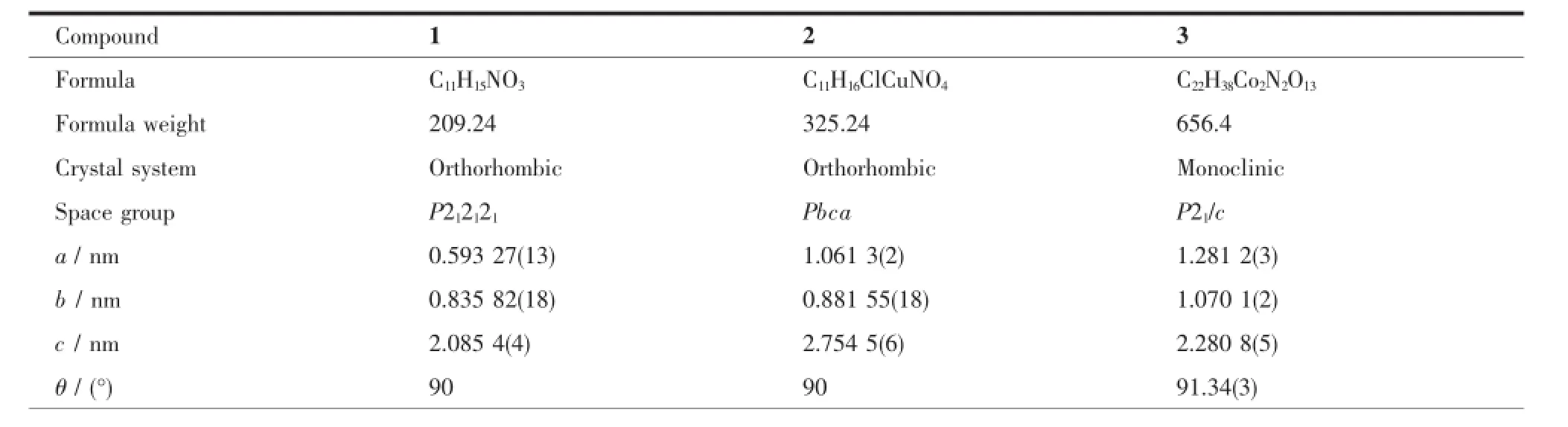
表1 化合物的晶体学数据Table 1Crystallographic data for the compounds

2 结果与讨论
2.1 晶体结构描述
2.1.1 1的晶体结构
H3Lds的分子结构见图1,主要键长列于表2,它是一种三足四齿Schiff碱,C7-N1键长为0.128 24(17)nm,属典型C=N双键。C1-O1键长小于一般的酚羟基的C-O键,为0.127 92(17)nm,属于典型的C=O双键;这是因为该Schiff碱的酚羟基脱除质子的结果。脱除的质子与N1结合,并与O1形成分子内氢键,这种现象在其他Schiff碱中也偶有发生[14];氢键O1…H1长度为0.188 1 nm,键角∠O1…H1-N1为136.76°(表5)。其他键长均在正常范围之内。羟基O2与羟基O3之间的分子间氢键和O2与酚氧O1之间的分子间氢键将H3Lds扩展为平行于ab面的二维超分子网络(图2)。
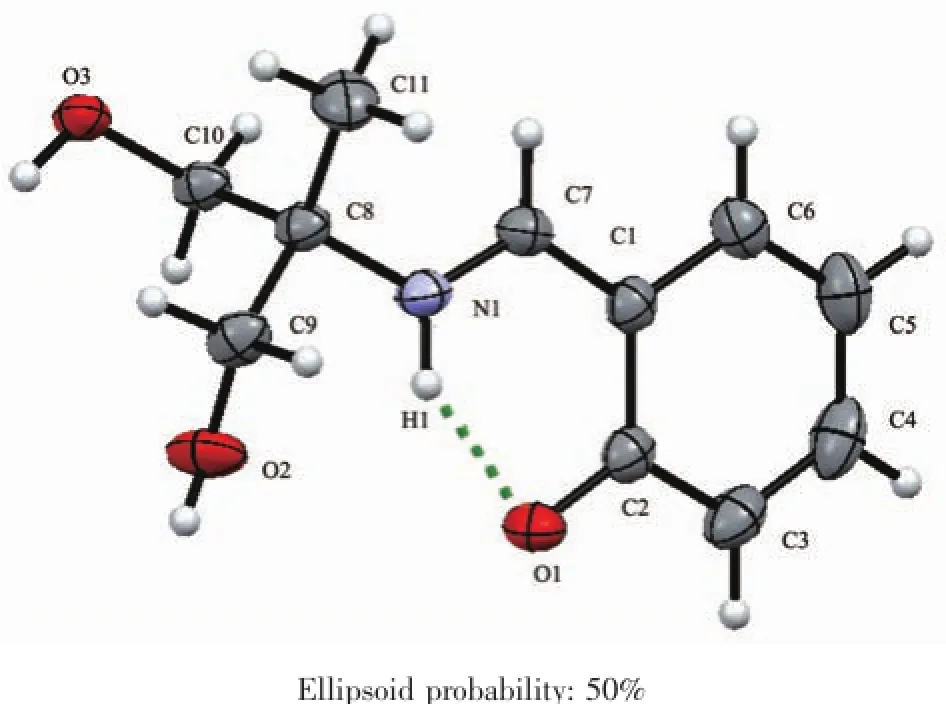
图1 H3Lsd的分子结构Fig.1Molecular structure of H3Lsd

表2 化合物1的主要键长Table 2Selected bond lengths for 1 nm
2.1.2 配合物的晶体结构
H3Lds与CuCl2反应形成一种单核配合物[CuCl (H2Lds)]·H2O(2),分子结构见图3。主要键长和键角列于表3。Cu与1的醇羟基O2、去质化的酚羟基氧O1、亚胺基氮N1和氯原子Cl1形成略有畸变的平面正四边形的配位几何构型,Cu1-O1键长0.187 7(2)nm,Cu1-O2键长0.196 0(2)nm,Cu1-N1键长0.194 7(2)nm;Cu1-Cl1键长为0.223 6(8)nm,与文献[15-16]相似;键角在82.26(9)°~173.87(9)°之间,扭转角Cl1-Cu1-O1-C1和O2-Cu1-N1-C7分别为-176.6(2)°和-176.0(2)°。
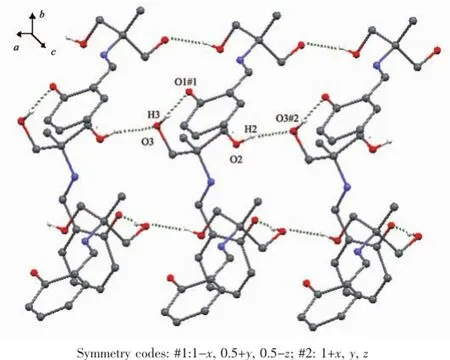
图2 配体1中平行于ab面的二维氢键网络Fig.2Two-dimension hydrogen-bonding network parallel to ab plane in 1
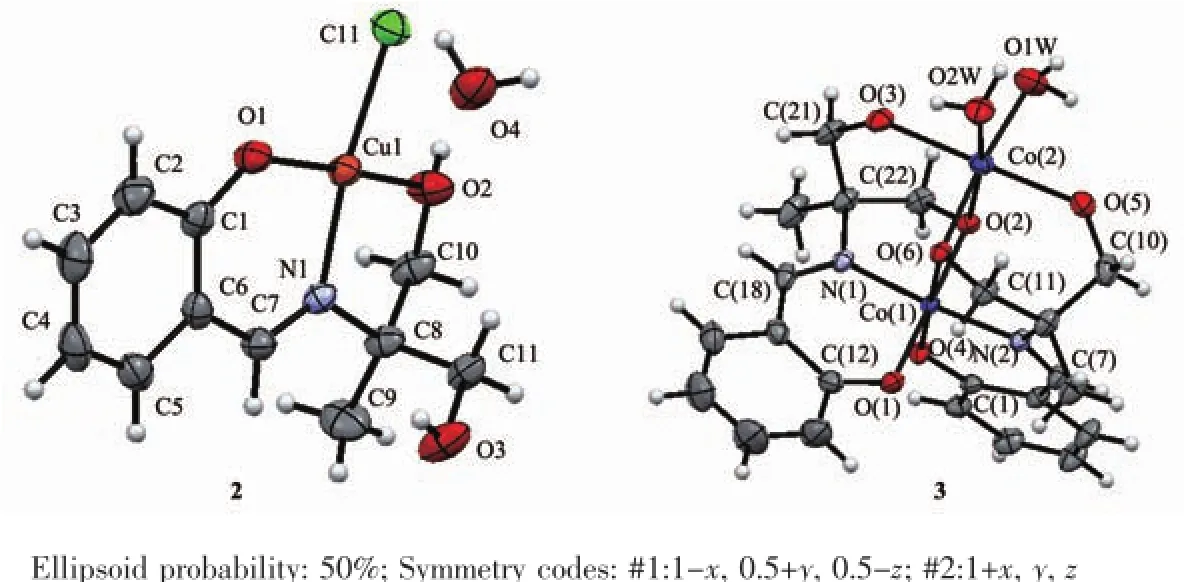
图3 化合物2和3的分子结构Fig.3Molecular structures of 2 and 3
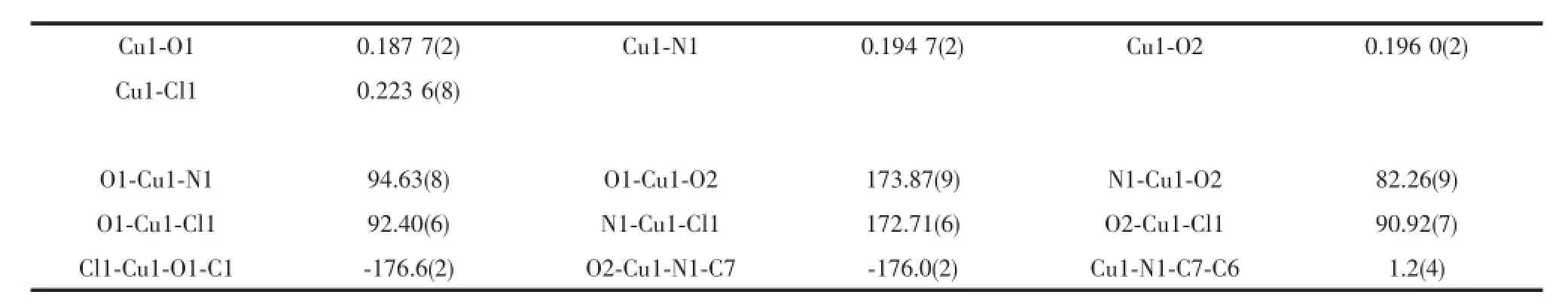
表3 化合物2的主要键长和键角Table 3Selected bond lengths(nm)and bond angles(°)for 2
H3Lds与乙酸钴反应则生成一种双核配合物[Co2(H2O)2(Lds)2]·5H2O(3),分子结构见图4。主要键长和键角列于表4。在形成配合物3中钴离子为+3价,2个Co(Ⅲ)离子与2个配位水和2个Lds3-形成2种配位环境不同的畸变的八面体构型。其中Schiff碱H3Lds配体的3个羟基均脱除质子,以Lds3-形式参与配位。Co1与来自2个Lds3-的酚羟基氧原子O1和O4、亚胺基氮原子N1和N2、醇羟基的氧原子O2和O6配位,键长Co-O和Co-N分别为0.189 0(3)~0.191 1(3)nm和0.189 0(3)~0.189 7(3)nm,与某些水杨醛Schiff碱的钴配合物相似[17-18];键角分别在84.74(12)°~95.56(11)°和174.93(12)°~178.12(11)°。Co2则与来自2个配位水O7和O12、2个Lds3-的醇羟基氧原子O2、O3、O5和O6配位,Co-O键长为0.203 2(3)~0.214 5(3)nm,键角在79.21(10)°~96.02(14)°和170.07(12)°~178.92(11)°。正是因为μ2-O2和μ2-O6的桥联作用,导致双核结构的形成,Co1…Co2的间距为0.296 5(9)nm。
在2中晶格水分子与配合物的配体的醇羟基之间、相邻配合物基元醇羟基O3与酚羟基氧原子O1之间存在着强烈的氢键(表5),氢键键长在0.182 3~0.203 2 nm之间,键角为144.62~164.79°。这些氢键将化合物2沿b轴方向联接成一维链状超分子(图4)。

图4 化合物2沿b轴形成方向的一维超分子链Fig.41-D supramolecular chain along b axis by intermolecular hydrogen-bonding
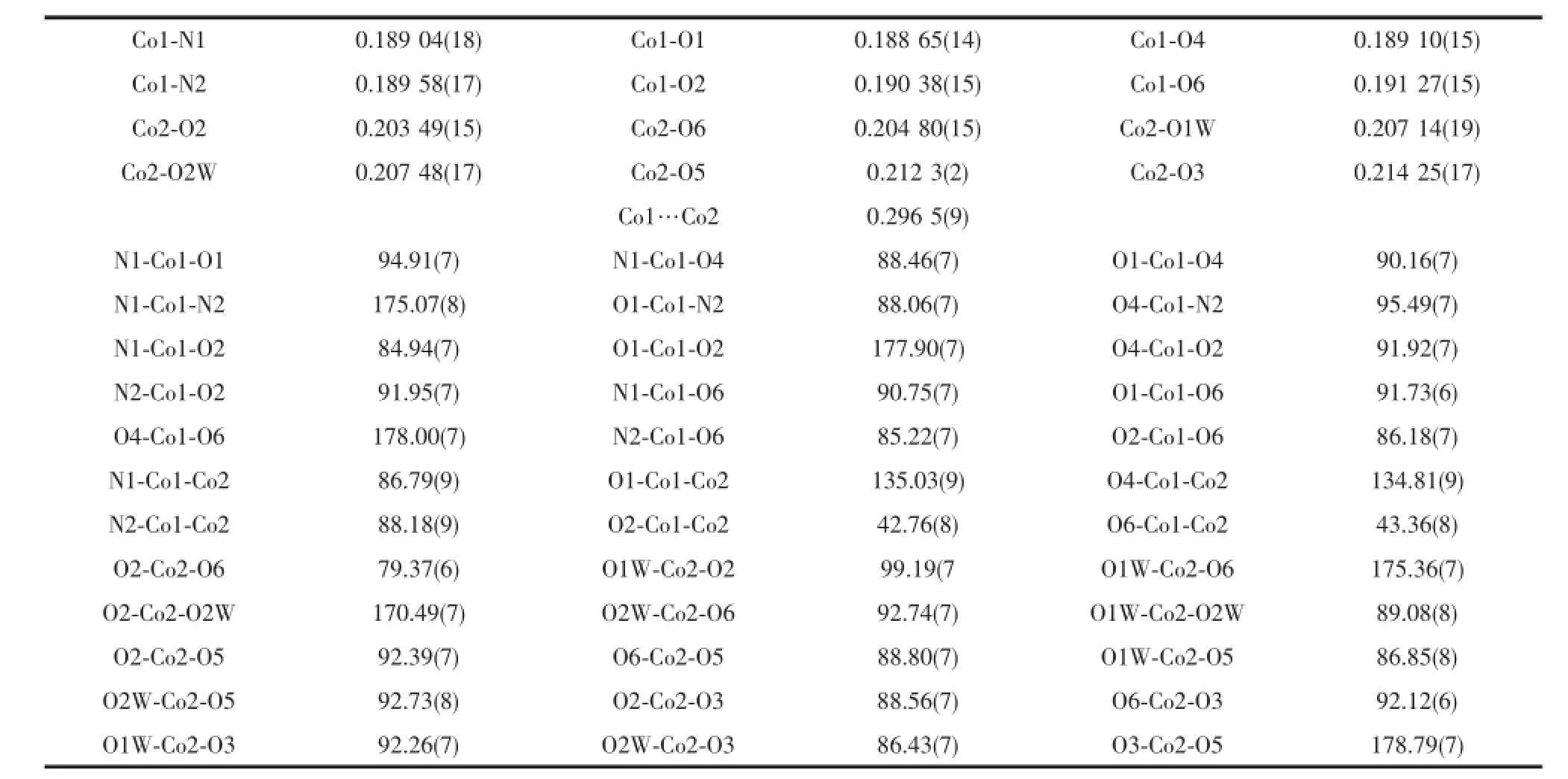
表4 化合物3的主要键长和键角Table 4Selected bond lengths(nm)and bond angles(°)for 3
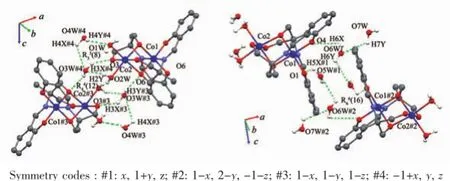
图5 化合物3中的氢键Fig.5Intermolecular hydrogen bonds in 3

表5 化合物1~3中的氢键参数Table 5Hydrogen bonds parameters for 1~3
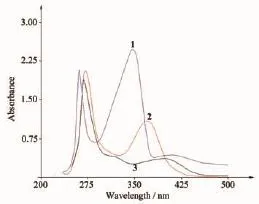
图6 化合物的紫外光谱Fig.6UV spectra of the compounds
在3中则存在更加丰富的氢键(图5)。首先配位水O1W和O2W与晶格水O3W#4和O4W#4 (Symmetry codes:#4:-1+x,y,z)形成R33(8)环形氢键,O…H键长0.218~0.251 nm,键角113.0°~150.4°(表4)。晶格水O3W#3(Symmetry codes:#3:1-x,1-y,1-z)同时与醇羟基氧原子O6形成氢键(氢键键长0.206 nm,键角139.0°),于是又形成一种R44(12)环形氢键,并将配合物连接成二聚体形态。相邻二聚体的配体的酚羟基氧原子O1、O4与晶格水O5W#1(Symmetry codes:#1:x,1+y,z)、O6W则形成R66(16)大环氢键,O…H键长0.196~0.257 nm,键角98.0°~174.0°;这种R66(16)环形氢键将二聚体扩展为链状超分子。这些氢键不仅扩展了配合物维度,无疑对晶体的稳定也起着重要的作用。
2.2 红外光谱和电子光谱特征
Schiff碱H3Lds及其配合物的红外光谱具有相似的特征。3 434~3 332 cm-1处的吸收峰由醇羟基、配位水和晶格水的O-H伸缩振动所产生,由于存在分子间氢键缔合作用,谱峰较宽。2 971~2 818 cm-1和1 387~1 375 cm-1范围的2组吸收峰分别来自配体H3Lds中的亚甲基的伸缩振动和弯曲振动。1 608~1 451 cm-1的一组吸收峰归属苯环骨架的伸缩振动。亚胺基的伸缩振动出现在1634~1628cm-1,呈现极强的吸收;由于游离态H3Lds的亚胺基实际是以质子化形态(-C=NH+-)存在,氮原子上的部分电荷转移至H+上,所以配位后配体的亚胺基的伸缩振动的强度和位置并未发生明显改变。
H3Lds及其配合物的紫外可见光谱如图6所示。其中配体1在262和347 nm有2个强吸收带,分别归属于π*→π电子跃迁和分子内的电荷转移跃迁(IMCT)。形成配合物后π*→π电子跃迁略有红移,位移至272和270 nm;而IMCT消失。在铜配合物的电子光谱中,370 nm处的吸收峰可能来自配体与中心离子之间的荷移跃迁(LMCT);在钴配合物中,LMCT位于398 nm,而吸收峰296 nm归属于n→π电子跃迁。
[1]Su F,Lu L P,Zhu M L,et al.J.Mol.Struct.,2016,1108: 451-457
[2]Xiao Z Y,Yang X,Zhao S W,et al.J.Solid State Chem., 2016,234:36-47
[3]Yi L J,Xu G C,Zhang L,et al.Inorg.Chem.Commun., 2014,45:36-39
[4]Jiang G Q,Li S J,Zhang Y Q,et al.Inorg.Chem.Commun., 2014,46:172-175
[5]YANG Xiao-Xun(杨晓迅),LENG Ji-Dong(冷际东),LIU Jun-Liang(刘俊良),et al.Chinese J.Inorg.Chem.(无机化学学报),2015,31(9):1831-1838
[6]Hoshiko J A,Wang G,Ziller J W,et al.Dalton Trans.,2008: 5712-5714
[7]Brechin E K.Chem.Commun.,2005:5141-5153
[8]Murugesu M,Wernsdorfer W,Abboud K A,et al.Angew Chem.Int.Ed.,2005,44:892-896
[9]Moragues-Canovas M,Talbot-Eeckelaers C,Catala L,et al. Inorg.Chem.,2006,45:7038-7040
[10]Oshio H,Hoshino N,Ito T,et al.J.Am.Chem.Soc.,2004, 126:8805-8812
[11]Oshio H,Nihei M,Yoshida A,et al.Chem.Eur.J.,2005, 11:843-848
[12]Piligkos S,Rajaraman G,Soler M,et al.J.Am.Chem.Soc., 2005,127:5572-5580
[13]Sheldrick G M.SHELXTL,Program for X-ray Crystal Structure Solution and Refinement,University of Göttingen, Germany,1997.
[14]Eltayeb N E,Teoh S G,Fun H K,et al.Acta Crystallogr. Sect.E,2010,E66:o1262-o1263
[15]Gao Y L,Peng X J,Sun S G,et al.Chinese J.Struct.Chem., 2004,23(11):1262-1265
[16]Zhang R L,Zhao J S,Xi X L,et al.Russ.J.Coord.Chem., 2009,35(9):6912-697
[17]Rodionova L I,Smirnov A V,Borisova N A,et al.Inorg. Chim.Acta,2012,392:221-228
[18]Khalaji A D,Maghsodlou Rad S,Grivani G,et al.Chin.J. Chem.,2011,29:1613-1616
Syntheses,Structures and Characterization of Cuand CoComplexes Formed by a Tripodal Tetradentate Schiff Base
XIE Qing-FanYAO Yong-GangJIANG YanHONG Si-YuCHEN Yan-Min*
(College of Chemical Engineerng and Material,Quanzhou Normal University,Quanzhou,Fujian 362000,China)
A multidentate Schiff base ligand(H3Lds,1)with[NO3]donor set,derived from the condensation of salicylaldehyde and 2-Amino-2-methyl-1,3-propanediol,reacted with copperchloride or cobaltacetate to yield two complexes[CuCl(H2Lds)]·H2O(2)and[Co2(H2O)2(Lds)2]·5H2O(3).The ligand and complexes were characterized by elemental analysis,IR,UV spectra and X-ray diffraction analysis.The results reveal that 1 crystallizes in orthorhombic space group P212121,2 with Cuin distorted square-planar coordination in orthorhombic space group Pbca,3 with Coin distorted coordination octahedron in monoclinic space group P21/c,respectively.The H3Lds is linked by intermolecular H-bonds to form two-dimension supramolecular network,while both complexes are connected by intermolecular hydrogen-bonding interactions to form a supramolecular chains,respectively.CCDC: 1443146,1;1440517,2;1440577,3.
schiff base;complexes;crystal structure;hydroxyl-rich ligand
O614.121;O614.81+2
A
1001-4861(2017)05-0867-07
10.11862/CJIC.2017.101
2017-01-03。收修改稿日期:2017-03-16。
泉州师范学院学科建设资金和福建省大学生创新创业训练计划项目(No.201610399058)资助。
*通信联系人。E-mail:qzucym@163.com;会员登记号:S06N5449M1311(解庆范);S06N2113M1304(陈延民)。
猜你喜欢
杂志排行
无机化学学报的其它文章
- 火焰辅助热解方法制备Ag2O/TiO2及其光催化制氢性能
- Tm3+/Er3+/Ho3+共掺SiO2-Bi2O3-AlF3-BaF2玻璃发光性能
- Syntheses, Crystal Structures and Insulin-like Activity of Maltolato- and Ethylmaltolato-Coordinated Oxovanadium(Ⅴ) Complexes Derived from 4-Fluoro-N′-(3-ethoxy-2-hydroxybenzylidene)benzohydrazide
- Electrochemically Self-Assembled Fe/Cu Nanocomposite with Improved High-Rate and Low-Temperature Performances for Nickel-Iron Alkaline Battery
- 碳化硅衍生碳的制备及其超级电容性能
- Crystal Structures and DNA Interaction Properties of Niand Ni(Ⅱ) and Cd(Ⅱ)Complexes with a Semicarbazone Ligand Bearing Pyrazine Unit
