熔盐法合成电化学性能优异的富锂层状正极材料Li1.5Ni0.25Mn0.75O2.5
2017-07-05郑卓杨秀山滑纬博唐艳
郑卓 杨秀山 滑纬博 唐艳*,
(1四川大学高分子研究所,成都610065) (2四川大学化学工程学院,成都610065)
熔盐法合成电化学性能优异的富锂层状正极材料Li1.5Ni0.25Mn0.75O2.5
郑卓1杨秀山2滑纬博2唐艳*,1
(1四川大学高分子研究所,成都610065) (2四川大学化学工程学院,成都610065)
采用氢氧化物共沉淀和熔盐法相结合的方法制备得到了电化学性能优异的富锂锰基Li1.5Ni0.25Mn0.75O2.5正极材料。借助X射线衍射(XRD)分析、扫描电镜(SEM)、感应耦合等离子体原子发射光谱(ICP-AES)、X射线光电子能谱(XPS)、电化学阻抗谱(EIS)和恒电流充放电测试等表征手段对材料的颗粒形貌、晶体结构和电化学性能进行了系统研究。XRD结果表明该材料具有完善的α-NaFeO2层状结构(空间群为R3m)和较低的Li+/Ni2+阳离子混排。电化学性能测试表明该材料的首次不可逆容量损失较小,且倍率性能和循环稳定性能十分优异。具体而言,在2.0~4.8 V,0.1C时的首次不可逆容量损失为50 mAh·g-1(首次库伦效率84%);在10C时的放电比容量还能达到102 mAh·g-1;在0.5C下循环100次后,放电比容量为205 mAh·g-1(容量保持率90%)。
熔盐法;氢氧化物共沉淀法;富锂正极材料;电化学性能;锂离子电池
0 引言
锂离子电池作为最具前景的新能源材料被广泛应用于便携式电子设备、大型储能设备、电动汽车(EVs)和混合动力汽车(HEVs)[1-3]。为了满足人们日益增长的高能量需求,制备性能优异的锂离子电池正极材料尤为重要。当前,具有高放电比容量的富锂层状正极材料Li1+yM1-yO2(xLi2MnO3·(1-x)LiMO2,M=Ni、Co、Mn)引起了人们广泛的关注,其在使用电压高于4.5 V时,容量能达到250 mAh·g-1以上[4-6]。在这类材料中,富锂锰基Li1.5Ni0.25Mn0.75O2.5是最受瞩目的材料之一,因为它不但放电比容量高,而且成本低、安全性能好和低毒性[7-9]。但是这种材料也存在其缺陷,比如倍率循环性能较差、首次不可逆容量大,在长循环过程中由于主体结构的不可逆相转变(层状→尖晶石)导致工作电压衰减较快[10-11]。
为了缓解这些问题,研究者们采取了很多措施,特别是针对合成方法,因为合成方法会极大影响材料的纯度、晶体结构、颗粒形貌以及晶体内部的原子混排[12]。通常制备富锂锰基正极氧化物的方法有固相法[13]、共沉淀法[14]、溶胶-凝胶法[15]和熔盐法[16]等。在这些方法中,熔盐法是一种简单可行的合成工艺,通过采用过量的熔盐(KCl、NaCl、Li2CO3、LiCl、LiNO3、NaNO3)作为熔剂或者反应物可制得高结晶度的正极材料,通常n过渡金属∶n熔盐为1∶3或1∶4或者更多。在熔盐法中反应主要是依靠化学平衡来控制,其反应速率要快于靠扩散迁移控制的固相反应[16-17]。虽然在熔盐法中的反应是由化学平衡所决定,但如果原料在一开始就没有混合均匀,那么在材料成品中就会有不均相的成分存在,对最终电化学性能不利。一般而言,在传统的熔盐法中,化学计量比的锂盐、过渡金属盐和大量的熔盐是采用简单的机械研磨混合在一起,因此这些原料很难实现分子水平的混合。但幸运地是,共沉淀法正好可以弥补这个缺陷,能够较容易地实现原料分子水平的混合,可制备出成份均匀、结构完整的正极材料。
在我们的工作中,采用将氢氧化物共沉淀和熔盐法相结合的方法来制备富锂材料Li1.5Ni0.25Mn0.75O2.5。值得一提的是,我们采用的熔盐法与传统的熔盐法不同,主要的区别在于没有使用过量很多的熔盐(n过渡金属∶n熔盐=1∶1),因为在氢氧化物共沉淀法中制得的Ni0.25Mn0.75(OH)2前驱体已经实现了Ni、Mn的原子水平混合。研究结果表明,采用此方法制得的材料倍率循环性能都得以提升,首次不可逆容量较大以及工作电压快速衰减的现象也都得到了一定程度的缓解。
1 实验部分
1.1 材料合成
结合氢氧化物共沉淀法和熔盐法制备层状富锂锰基Li1.5Ni0.25Mn0.75O2.5材料。首先采用氢氧化物共沉淀法制备Ni0.25Mn0.75(OH)2前驱体,实现Ni和Mn的原子级别混合。NiSO4·6H2O和MnSO4·H2O(nNi∶nMn=1∶3)溶于去离子水中,然后在N2气保护下逐滴加入到反应釜中。同时,NaOH溶液(8 mol·L-1)和NH3H2O溶液(2 mol·L-1)分别作为沉淀剂和配位剂也逐滴加入到反应釜中,反应温度为50℃,pH值控制在11.0±0.2,搅拌速度保持在800 r·min-1左右。待反应沉淀完全后,在60℃下陈化12 h,然后抽滤洗涤除去多余的SO42-和Na+,再在100℃下干燥12 h得到Ni0.25Mn0.75(OH)2前驱体粉末。最后前驱体粉体与化学计量比的Li2CO3(过量5%)、NaCl-KCl(物质的量之比1∶1)熔盐一起混合研磨均匀(n过渡金属∶n熔盐=1∶1),再在空气中550℃预烧5 h,800℃下煅烧10 h,将得到的混合物用热去离子水反复洗涤除去NaCl-KCl熔盐后,充分干燥得到样品Li1.5Ni0.25Mn0.75O2.5(命名为LNM-1)。
作为对比,将前驱体粉体与化学计量比的Li2CO3(过量5%)一起混合研磨,再在空气中550℃预烧5 h,900℃下煅烧10 h制得Li1.5Ni0.25Mn0.75O2.5材料(命名为LNM-0)。
1.2 材料表征
采用菲利普公司的PW1730多晶转靶X射线衍射仪(工作条件:管压40 kV,管流30 mA,Cu Kα靶,λ=0.154 18 nm)分析样品的晶体结构,扫描速度为2°· min-1,扫描角度范围为10°~70°。样品中的各金属元素物质的量之比通过美国安捷伦710ES型号的感应耦合等离子体原子发射光谱(ICP-AES)进行确定。采用日本日立(Hitachi)S-4800型电场发射式扫描电子显微镜(SEM)对材料的形貌和粒径进行表征(工作电压30 kV)。X射线光电子能谱(XPS,ESCALAB 250Xi,Al Kα,hν=1 486.68 eV)用于分析Ni、Mn元素的价态情况,测得的元素结合能用C1s=284.60 eV进行校正。
1.3 材料的电化学性能测试
按照质量比为80∶13∶7将活性物质、乙炔黑、粘结剂(PVDF)混合均匀,并加入适量的N-甲基吡咯烷酮调配成浆。将这些湿浆料均匀涂覆在铝箔集流体上,在真空下100℃干燥12 h,再用切片机将干燥好的铝箔切成直径为14 mm的圆片,并在20 MPa下压实,每个极片上的活性物质质量约3~4 mg·cm-2。最后在充满Ar气的手套箱中将正极片、锂片(负极)、隔膜(Celgard 2400)和电解液组装成CR2032扣式电池。电解液为1 mol·L-1的LiPF6与碳酸乙烯酯(EC)和碳酸二甲酯(DMC)(体积比为1∶1)。本文在室温下进行充放电性能测试,充放电电压为2.0~4.8 V,1C=200 mA·g-1。采用德国Zennium IM6电化学工作站对电池的电化学阻抗谱(EIS)进行测试,测试频率范围在100 kHz~10 mHz,扰动电压为5 mV,得到的数据用Zview 2软件进行电化学元件模型数值拟合分析。
2 结果与讨论
采用X射线衍射(XRD)对材料的晶体结构进行分析,如图1所示。两样品的主要衍射峰均可以索引为α-NaFeO2型六方层状结构(空间群为R3m)[18],在20°~25°之间还可观察到一些较弱的衍射峰,是由于单斜Li2MnO3相(空间群C/2m)中Li和Mn超晶格LiMn6排列产生的超晶格峰[18]。同时,对这两样品中的各金属元素物质的量之比进行ICP-AES测试,测试结果表明在LNM-0样品中nLi∶nNi∶nMn=1.49∶0.24∶0.76,LNM-1样品中nLi∶nNi∶nMn=1.48∶0.24∶0.73,都与我们目标产物Li1.5Ni0.25Mn0.75O2.5中的原子计量比相吻合。同时,也对LNM-1样品中的Na和K原子的含量进行了测试,测试结果表明这两种元素在材料中的含量都是低于0.1%(w/ w),可以忽略。结合XRD和ICP-AES的结果可以证实这种熔盐法的可行性。表1为采用jade 6.0软件对两样品的XRD图进行精修后的晶胞参数值。对于六方α-NaFeO2结构,氧原子的最密堆积可认为是在[111]方向或[001]方向稍扭曲的面心立方结构,c/a值代表三角扭曲程度,如果立方结构不发生扭曲,则该理想立方结构的c/a值就为其值越大,说明层状结构越完整。LNM-1样品的c/a值(4.997 5)相对较大,说明其具有更加完整的层状结构,有序性更好。I(003)/I(104)值用于评判Li+和Ni2+阳离子混排程度,此值越大,则阳离子混排越小[20-21]。LNM-1样品的I(003)/I(104)值为1.696 3,比LNM-0样品的1.556 8要大,说明LNM-1样品的阳离子混排程度较低。XRD分析结果表明采用我们这种合成路线成功制得了具有优异层状结构和较低Li+/ Ni2+阳离子混排的富锂材料。
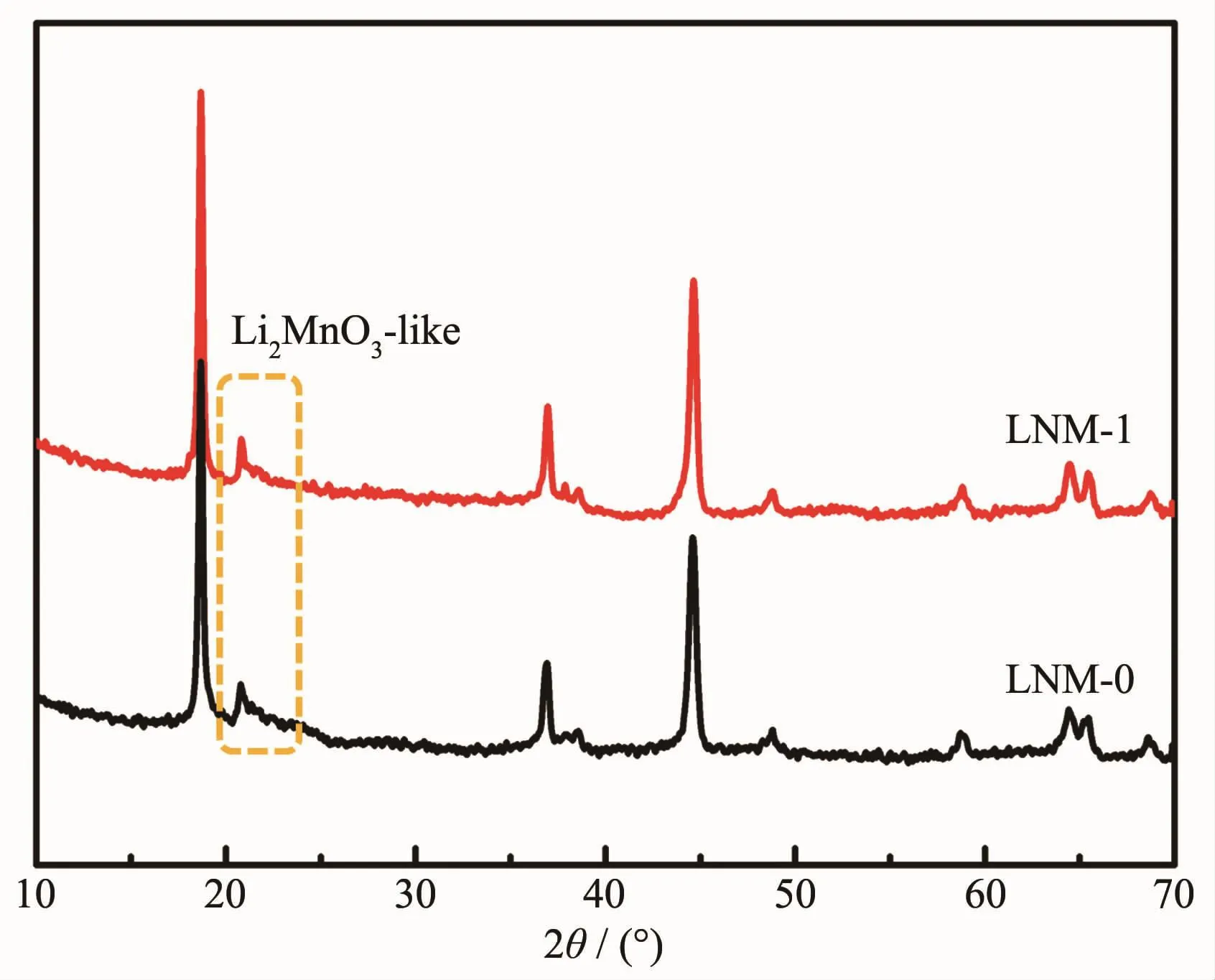
图1样品的XRD图Fig.1XRD patterns of the samples
图2 (a)(b)为Ni0.25Mn0.75(OH)2前驱体的SEM图。由图可发现,前驱体是由很多一次纳米片团聚而成。图2 (c)(d)和(e)(f)分别为LNM-1和LNM-0样品的SEM图,两样品的一次颗粒都为纳米片状,与前驱体的形貌具有一定延续性。同时经对比两样品的一次颗粒径可发现,LNM-1样品的一次颗粒径(300 nm左右)要明显小于LNM-0样品(600 nm左右),其原因可归结于两者的合成方法不同,因为熔盐法中加入了熔盐NaCl-KCl,其熔盐在高温下变成液相贯穿于颗粒之间,可以起到阻止颗粒间相互连结的作用,相当于把各个颗粒隔离开,这就使得前驱体片状颗粒Ni0.25Mn0.75(OH)2和锂源Li2CO3在高温条件下的反应是尽可能在每一个单独的前驱体片状颗粒上原位发生,不与其他颗粒相互作用,避免了因为颗粒之间的相互连结导致生成的成品材料颗粒径较大。一般认为,一次颗粒径越小,则Li+的扩散路径就越短,对电化学性能有利,尤其是倍率性能[22]。
采用X射线光电子能谱(XPS)对LNM-1和LNM-0样品中Ni和Mn的氧化状态进行研究,相应的能谱图如图3所示。在Ni2p的XPS图中,峰强度最高的Ni2p3/2峰在854.5 eV左右,并伴随着在861.0 eV处观察到一个卫星峰,这个现象在很多关于Ni2+的氧化物材料文献报道中都被观察到[22-23]。Mn2p的XPS图中,结合能在654.1 eV处对应Mn2p1/2峰,642.5 eV对应Mn2p3/2峰,两峰的差值为11.6 eV,表明材料中的Mn原子主要为+4[22,24]。这两种材料中Ni、Mn的XPS图相同,说明这两种不同的合成方法对过渡金属原子的价态没有影响。
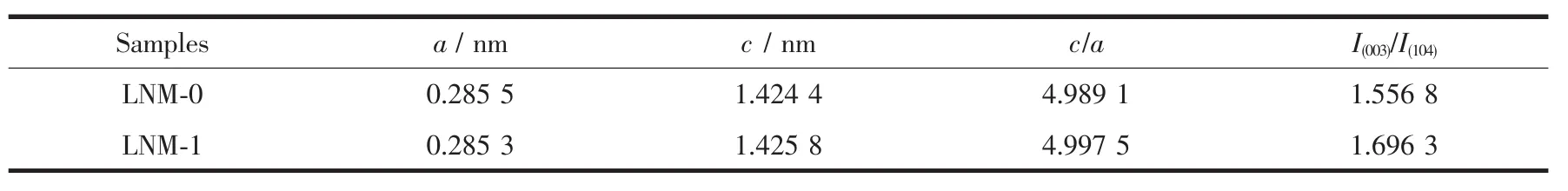
表1 样品精修后的晶胞参数Table 1Refined lattice parameters of these samples

图2 样品的SEM图Fig.2SEM images of the samples
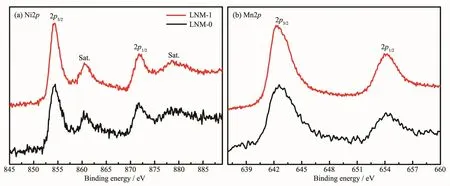
图3 LNM-1和LNM-0样品的Ni2p和Mn2p的XPS图Fig.3XPS spectra of Ni2p and Mn2p for LNM-1 and LNM-0 samples
LNM-1和LNM-0样品在2.0~4.8 V,0.1C(20 mA· g-1)时的首次充/放电曲线如图4(a)所示。由图可明显观察到这两个样品在首次充电时的充电曲线是由低于4.5 V的平滑斜线和4.5 V左右的充电平台两部分组成。低于4.5 V的平滑斜线可归因于Ni2+氧化成Ni4+时,对应的Li+从晶格中的脱出[25-26]。4.5 V左右的充电平台是由于Li2MnO3相的首次激活,不可逆的脱出Li2O,导致富锂材料的首次放电比容量损失较大[25-26]。LNM-1和LNM-0样品的首次库伦效率分别为84%和78%,不可逆容量损失分别为50和72 mAh·g-1。LNM-1样品的首次库伦效率高于LNM-0样品的主要原因可归结于其稳定的层状晶体结构(如前面XRD分析结果所示),这种稳定的晶体结构相比于易坍塌的材料结构而言,更加易于随后的嵌锂过程,即Li+更加容易回到主体晶格中。图4(b)为这两种材料的首次dQ/dV曲线。可发现两材料的首次dQ/dV曲线基本一致,在4.5 V左右为Li2MnO3相的首次激活氧化峰,在4.0 V左右的氧化峰对应着Ni2+→Ni4+的氧化反应。
图5(a)为样品的倍率性能图。LNM-1样品在2.0~4.8 V,0.1C、0.2C、0.5C、1C、3C、5C和10C时的放电比容量分别为265、253、227、199、181、147和102 mAh· g-1,而LNM-0样品的放电比容量仅为256、238、210、178、146、101和67 mAh·g-1。LNM-1样品的倍率性能和放电比容量都相对于LNM-0样品有了较大提升。同时,相比于其他文献报道[15,27-29],LNM-1样品的高倍率性能优势明显,其优异的倍率性能可归结于完善的α-NaFeO2层状结构和较低的Li+/Ni2+阳离子混排,这种稳定的晶体结构相比于不稳定易坍塌的结构更加易于在高倍率下锂离子的快速脱嵌;另外其一次颗粒尺寸较小,Li+的扩散路径较短,故而对高倍率性能有利。此外,为了更加直观比较两材料的倍率性能,图5(b)给出了两样品在不同倍率下的容量保持率,可发现LNM-1样品的容量保持率一直相对较高。
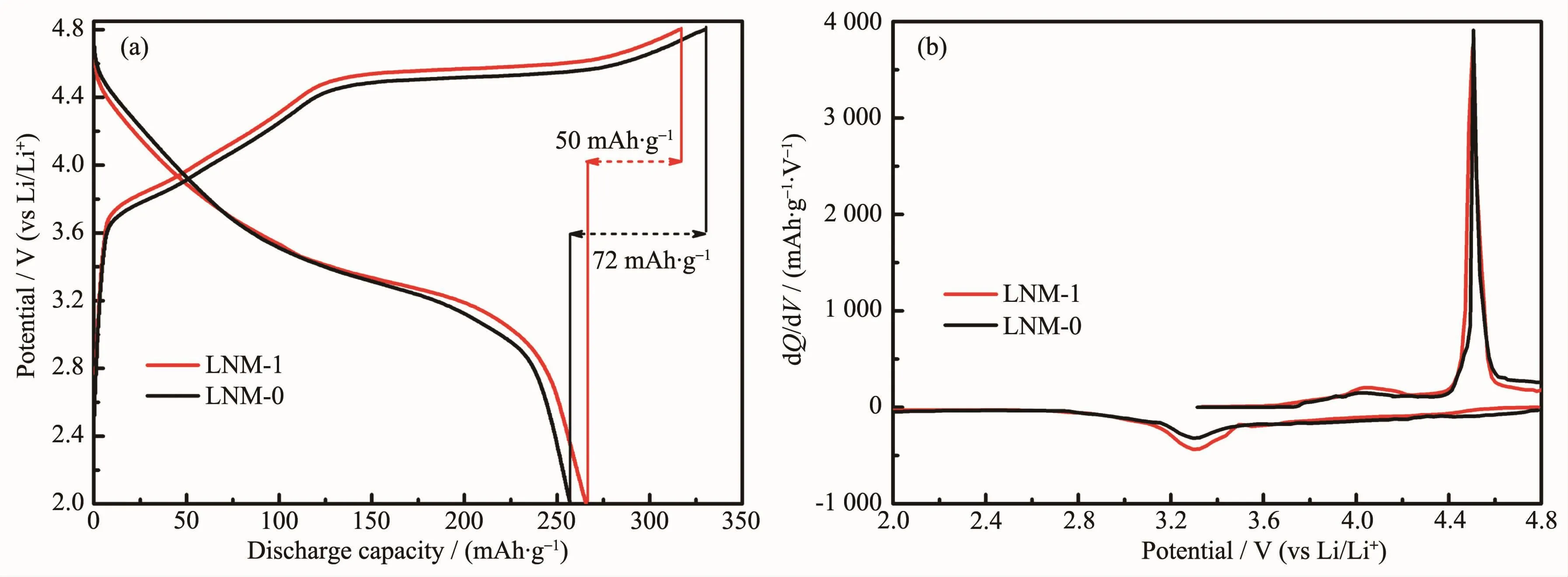
图4 LNM-1和LNM-0样品在2.0~4.8 V,0.1C下的(a)首次充/放电曲线;(b)相应的dQ/dV曲线Fig.4(a)Initial charge/discharge curves;(b)Corresponding charge/discharge dQ/dV plots of the LNM-1 and LNM-0 samples at 0.1C(20 mA·g-1)between 2.0 and 4.8 V
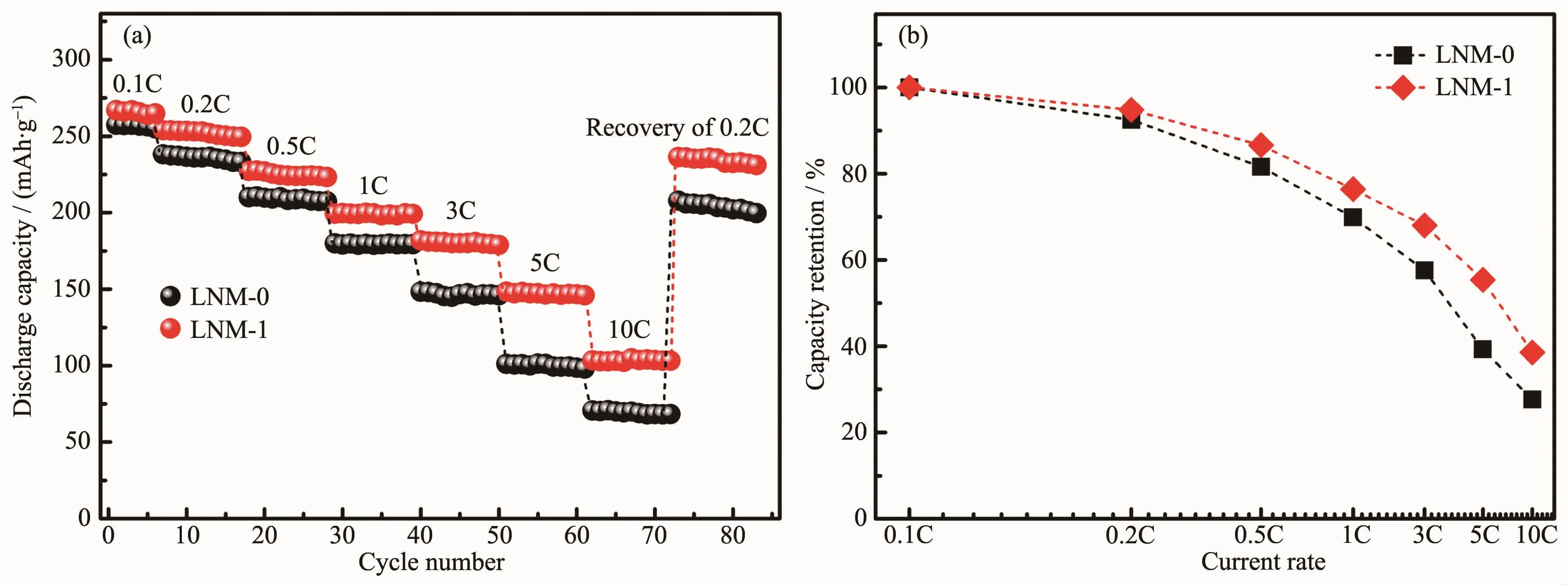
图5 (a)样品的倍率性能;(b)不同倍率下的容量保持率Fig.5(a)Rate capability;(b)Corresponding capacity retentions of these samples
图6(a)(b)为材料在2.0~4.8 V,0.5C下的循环性能测试。在循环100次后,LNM-0样品仅释放出171 mAh·g-1的放电比容量,容量保持率为81%。LNM-1样品在首次的放电比容量为228 mAh·g-1,循环100次后为205 mAh·g-1,表现出优异的循环稳定性(容量保持率为90%)。另外,两材料的库伦效率都是接近100%,说明电极材料的可逆性较好。为了更加直观比较两材料在长循环过程中使用电压衰减的情况,我们对放电比容量进行了归一化处理,排除了容量衰减的影响,研究了放电曲线的电压平台随着循环次数增加而降低的情况。图6(c)(d)给出了在0.5C循环测试中第1次、50次和100次的归一化放电曲线。由图可明显观察到,LNM-1样品的电压衰减程度相比于LNM-0样品要慢,以一半的放电比容量所对应的电压值为例,LNM-1和LNM-0样品在第1次和100次的归一化放电曲线中值电压差值(ΔV)分别为0.58 V和1.21 V,结果表明采用我们这种全新熔盐法制得的富锂材料能够缓解工作电压快速衰减的问题。
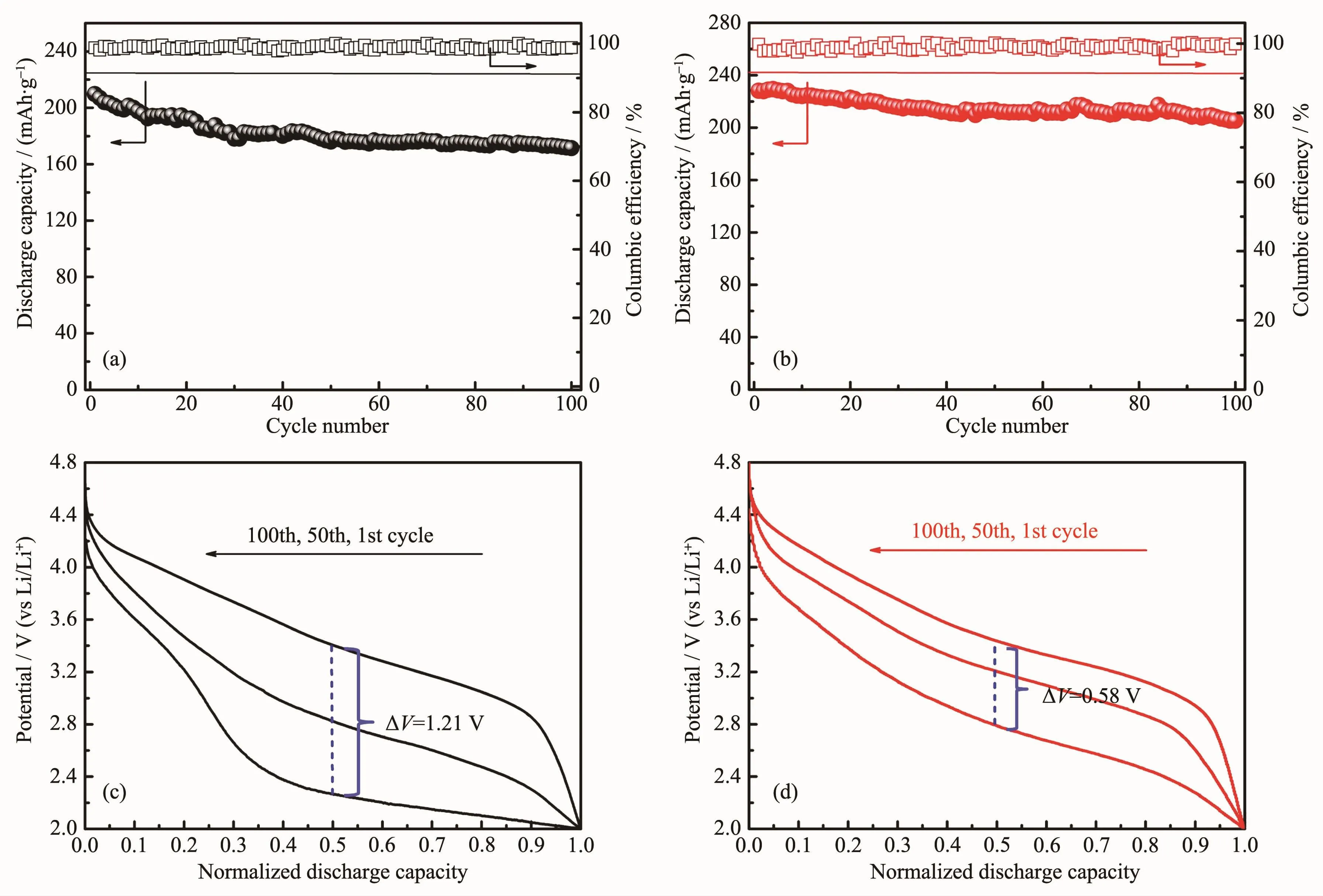
图6 样品在2.0~4.8 V,0.5C时的循环稳定性以及在不同循环次数下的归一化放电曲线:(a,c)LNM-0;(b,d)LNM-1Fig.6Cycling performance of these samples between 2.0 and 4.8 V at 0.5C,and the discharge curves at selected cycles after normalization of capacity for(a,c)LNM-0;(b,d)LNM-1
采用电化学阻抗图谱(EIS)测试对这两个材料电化学性能差异的原因进行更深层次研究,所有测试的电池都经过了图6的循环性能测试。Nyquist曲线和经Zview软件拟合的等效电路图(内嵌图)如图7所示。由图可发现,样品的阻抗谱都由高频区的一个半圆和低频区的一条斜线组成。在高频区阻抗谱与Z′轴的截距表示电池的固有阻抗(Rs)。半圆代表电极材料和电解液之间的界面阻抗(Rct),反映Li+界面反应的难易程度,越小则反应越易进行。斜线为Warburg阻抗(W1),表示Li+在固相材料中的扩散阻力[30-32]。通过对比两样品高频区半圆的直径可发现LNM-1样品的Rct值比LNM-0样品要小,表明Li+在界面的动力学扩散速率较大,从而倍率性能优异,这与LNM-1样品完善的α-NaFeO2层状结构和较小的一次颗粒径密切相关,因为样品的一次纳米颗粒粒径小,可缩短离子/电子传输路径,提高反应速率,且晶体结构完整更加易于锂离子在高电流密度下的快速脱嵌。
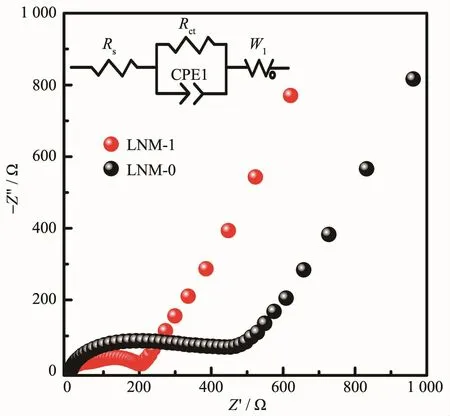
图7 样品的EIS图谱,内嵌图为等效电路图Fig.7EIS plots of the LNM-0 and LNM-1 electrodes with an equivalent circuit(inset)
3 结论
本文采用氢氧化物共沉淀和熔盐法相结合的方法制备得到了富锂锰基Li1.5Ni0.25Mn0.75O2.5正极材料,氢氧化物共沉淀法可以实现Ni、Mn的原子水平混合,然后以适度过量的NaCl-KCl(物质的量之比1∶1)熔盐作为熔剂(n过渡金属∶n熔盐为1∶1)。XRD结果表明采用此方法制得的材料具有更有序的层状α-NaFeO2结构,更小的Li+/Ni2+阳离子混排。电化学性能测试结果也进一步证实了该样品的倍率循环性能优异,且首次不可逆容量较大和使用电压快速衰减的问题也都有一定程度的缓解。在2.0~4.8 V,0.1C时的首次不可逆容量损失为50 mAh·g-1;在10C时的放电比容量还能达到102 mAh·g-1;在0.5C下循环100次后,放电比容量仍为205 mAh·g-1(容量保持率为90%)。此外,电化学阻抗谱(EIS)的结果也表明该样品在长循环之后还能保持较小的界面电荷转移阻抗(Rct)。这种全新的熔盐法工艺简单,为合成和制备电化学性能优异的富锂材料提供了一种新的思路,同时该方法对于制备其他高倍率、高容量的层状结构材料也具有一定的工艺参考价值。
[1]Tarascon J M,Armand M.Nature,2001,414(6861):359-367
[2]Dunn B,Kamath H,Tarascon J M.Science,2011,334(6058): 928-935
[3]Goodenough J B,Kim Y.Chem.Mater.,2010,22(3):587-603
[4]Fu F,Deng Y P,Shen C H,et al.Electrochem.Commun., 2014,44:54-58
[5]Xu G,Li J,Xue Q,et al.J.Power Sources,2014,248:894-899
[6]YIN Yan-Ping(尹艳萍),LU Hua-Quan(卢华权),WANG Zhong(王忠),et al.Chinese J.Inorg.Chem.(无机化学学报),2015,31(10):1966-1970
[7]Lin J,Mu D,Jin Y,et al.J.Power Sources,2013,230(10): 76-80
[8]Zhang L,Wu B,Li N,et al.J.Power Sources,2013,240(1): 644-652
[9]Cheng F,Xin Y,Chen J,et al.J.Mater.Chem.A,2013,1 (17):5301-5308
[10]Mohanty D,Kalnaus S,Meisner R A,et al.J.Power Sources, 2013,229(9):239-248
[11]Xu B,Fell C R,Chi M,et al.Energy Environ.Sci.,2011,4 (6):2223-2233
[12]Lin B,Wen Z,Gu Z,et al.J.Power Sources,2008,175(1): 564-569
[13]Li D,Muta T,Noguchi H.J.Power Sources,2004,135(1/2): 262-266
[14]DU Ke(杜柯),ZHAO Jun-Feng(赵军峰),WANG Wei-Gang (王伟刚),et al.Chinese J.Inorg.Chem.(无机化学学报), 2012,28(1):74-80
[15]ZHAO Xue-Ling(赵雪玲),TANG Dao-Ping(唐道平),MAI Yong-Jin(麦永津),et al.Chinese.J.Inorg.Chem.(无机化学学报),2013,29(5):1013-1018
[16]He X,Wang J,Kloepsch R,et al.Nano Res.,2013,7(1):110 -118
[17]Reddy M V,Rao G V S,Chowdari B V R.J.Phys.Chem. C,2007,111(31):11712-11720
[18]Thackeray M M,Kang S H,Johnson C S,et al.J.Mater. Chem.,2007,17(30):3112-3125
[19]Huang Z D,Liu X M,Oh S W,et al.J.Mater.Chem.,2011, 21(29):10777-10784
[20]Conry T E,Mehta A,Cabana J,et al.Chem.Mater.,2012, 24(17):3307-3317
[21]Zhang X,Jiang W J,Mauger A,et al.J.Power Sources,2010, 195(5):1292-1301
[22]Fu Q,Du F,Bian X,et al.J.Mater.Chem.A,2014,2(20): 7555-7562
[23]Noh H J,Chen Z,Yoon C S,et al.Chem.Mater.,2013,25 (10):2109-2115
[24]Li J,Xiong S,Liu Y,et al.Nano Energy,2013,2(6):1249-1260
[25]Fu C,Li G,Luo D,et al.J.Mater.Chem.A,2014,2(5):1471-1483
[26]Luo D,Li G,Guan X,et al.J.Mater.Chem.A,2013,1(4): 1220-1227
[27]Wang Z Y,Li B,Ma J,et al.Electrochim.Acta,2014,117 (4):285-291
[28]Zhang Q T,Mei J T,Xie X L,et al.Mater.Res.Bull., 2015,70:397-402
[29]Xu G F,Xue Q R,Li J L,et al.Solid State Ionics,2016, 293:7-12
[30]Liu Y,Gao Y,Dou A.J.Power Sources,2014,248(4):679-684 [31]Li Q,Li G,Fu C,et al.ACS Appl.Mater.Interfaces,2014,6 (13):10330-10341
[32]Wang S,Wu Y,Li Y,et al.Electrochim.Acta,2014,133(7): 100-106
Effective Enhancement of the Electrochemical Performance of Layered Li-Rich Cathode Li1.5Ni0.25Mn0.75O2.5by a Facile Molten Salt Method for Lithium-Ion Batteries
ZHENG Zhuo1YANG Xiu-Shan2HUA Wei-Bo2TANG Yan*,1
(1Polymer Research Institute,Sichuan University,Chengdu 610065,China) (2School of Chemical Engineering,Sichuan University,Chengdu 610065,China)
A Li-rich Mn-based Li1.5Ni0.25Mn0.75O2.5cathode material with excellent electrochemical performance is prepared using a combination of hydroxide co-precipitation and molten salt method.Powder X-ray diffraction (XRD),scanning electron microscopy(SEM),inductively coupled plasma-atomic emission spectrometer(ICPAES),X-ray photoelectron spectroscopy(XPS),electrochemical impedance spectroscopy(EIS)and galvanostatic charge-discharge tests are employed to analyze the particle morphology,crystal structure,and electrochemical properties of the as-prepared material.XRD results indicate that this sample has a more ordered α-NaFeO2structure(space group R3m),and reduced Li+/Ni2+cation mixing.Electrochemical results confirm that this sample has a dramatically decreased initial irreversible capacity loss,and excellent rate performance and cycling stability. Specifically,it delivers a small initial irreversible capacity loss of 50 mAh·g-1(the first coulombic efficiency is 84%)between 2.0 and 4.8 V at 0.1C.At 10C rate,it can still exhibit a high discharge capacity of 102 mAh·g-1. After 100 cycles at 0.5C,the cathode also shows a discharge capacity of 205 mAh·g-1with capacity retention of 90%.
molten salt method;hydroxide co-precipitation method;Li-rich cathode material;electrochemical performance; lithium-ion battery
O646
A
1001-4861(2017)06-0963-07
10.11862/CJIC.2017.114
2016-11-28。收修改稿日期:2017-04-13。
国家自然科学基金(No.21506133)和四川省科技支撑计划(No.2014GZ0077)资助项目。
*通信联系人。E-mail:ytang@scu.edu.cn
猜你喜欢
杂志排行
无机化学学报的其它文章
- 过渡元素掺杂Fe3O4(001)表面磁电性能的理论研究
- Syntheses,Crystal Structures and Properties of Two d10Metal Complexes Constructed from 1,5-bis(2-ethyl-imidazolyl)pentane
- Efficient Synthesis and Application in Heck Reaction of Pd/Fe3O4Magnetic Nanoparticles
- Syntheses,Crystal Structures and Catalytic Activity of Rhenium Carbonyl Complexes Containing Aryl-Substituted Tetramethylcyclopentadienyl Ligands
- Characterization,Photocatalytic Property and Kinetics of ZnO Nanoparticles Synthesized by One Step Solid State Reaction
- Syntheses,Characterization and Radical Scavenging Activity of Two Copper(Ⅱ)Complexes Containing Pyrazoles
