两个可调的四核铜Schiff碱配合物:自组装、晶体结构和抗癌活性
2017-07-05陈延民姜岩洪思雨姚勇刚解庆范
陈延民 姜岩 洪思雨 姚勇刚 解庆范
(泉州师范学院化工与材料学院,泉州362000)
两个可调的四核铜Schiff碱配合物:自组装、晶体结构和抗癌活性
陈延民 姜岩 洪思雨 姚勇刚 解庆范*
(泉州师范学院化工与材料学院,泉州362000)
通过水热反应制备了2个中心对称的四核铜Schiff碱配合物[Cu4(H2O)2(μ-Brsth)2(μ3-Brsth)2](1)和[Cu4(H2O)2(Brsth)2(μ-Brsth)2(μ2-4,4′-bipy)2](2),其中H2Brsth为5-溴水杨醛缩噻吩-2-甲酰腙。2个配合物晶体属单斜晶系,空间群分别为P21/c和C2/c。2个配合物中所有的铜原子都是五配位,但每个配合物中4个Cu(Ⅰ)都处于2种类型的四方锥配位环境。在配合物1中4个铜原子被4个Schiff碱配体的酚盐氧分别以μ3-O和μ-O方式桥联形成椅式{Cu4O4}单元,而在配合物2中2对铜原子分别被2个Schiff碱配体的酚盐氧μ-O和2个桥联的μ2-4,4′-联吡啶连接形成环状的四核结构。体外抗癌活性的研究结果表明,配合物1和2对人肝癌细胞HEPG2均有较强的增殖抑制作用。
铜配合物;Schiff碱;晶体结构;抗癌活性
多核配合物广泛存在于金属蛋白和金属酶中,参与许多代谢活动、能量的转换与传递、电荷转移和氧气输送等过程[1-2]。在这类配合物中金属离子间的磁相互作用和金属离子与桥连配体间的相互作用,使它们呈现了许多不同于单核配合物的物理化学性质和生物活性。因此研究多核配合物不仅有助于揭示生命本质,而且多核配合物在人工模拟、生物制剂和功能材料等方面具有广阔的应用前景[3-4]。铜是生物体必须的微量元素,参与电子传递、氧化还原等生命过程;它的配合物具有很好的稳定性,配位数具有多变性,尤其是它的四方锥配位构型使其更具有形成多核配合物倾向[5-10]。而酰腙类Schiff碱及其配合物往往呈现良好的生物活性,如抑菌、抗病毒、抗肿瘤等,因而受到研究者的广泛关注[11-12]。值得一提的是水杨醛类Schiff碱,其酚羟基氧原子的配位方式非常灵活,如有单齿配位、单齿双桥联配位和单齿三桥联配位方式,在多核配合物的构建中扮演着重要的角色[13-15]。5-溴水杨醛缩噻吩-2-甲酰腙(H2Brsth)是一种三齿Schiff碱,我们曾合成了它的单核铜配合物[Cu(Brsth)(phen)]和双核镉配合物[Cd2(μ-Brsth)2(Phen)2][16]。而本文则合成了一种μ3-O和μ-O桥联的四核铜配合物[Cu4(H2O)2(μ-Brsth)2(μ3-Brsth)2](1);同时,根据1的中心对称性和4,4′-联吡啶的μ2-配位特点[17-18],在1的两组双核基元之间插入了一对4,4′-联吡啶配体,通过自组装合成了另一种四核铜配合物[Cu4(H2O)2(Brsth)2(μ-Brsth)2(μ2-4,4′-bipy)2](2)。在此主要报导它们的晶体结构、光谱性质和抗肿瘤活性。
1 实验部分
1.1 仪器与试剂
德国Elmentar公司Vario EL型元素分析仪;美国Nicolet公司is10型FT-IR红外光谱仪;上海美普达UV-1800PC型紫外-可见分光光度计;德国Bruker公司Smart ApexⅡCCD单晶衍射仪。所用试剂均为分析纯。
1.2 配合物的合成
1.2.1 配合物[Cu4(H2O)2(μ-Brsth)2(μ3-Brsth)2](1)的合成
0.1 mmol H2Brsth、0.1 mmol乙酸铜、6 mL蒸馏水和2 mL乙醇置于20 mL内衬聚四氟乙烯自动升压不锈钢反应釜中,于150℃下反应2 d,得到绿色块状晶体。对C48H32Br4Cu4N8O10S4的元素分析结果实测值(%,括号内为计算值):C 36.32(36.39),H 2.01 (2.04),N 7.09(7.08)。IR(KBr,cm-1):3 417s(H2O),3104 w(Ar-H),1 621m(C=N),1 595w,1 540m,1 495vs,1 471 vs,1 431s(C=C),1 268m,1 234m(Ar-O),826s,789m,732s(Ar-H),709s(C-S),644w,619m(C-Br)。
1.2.2 配合物[Cu4(H2O)2(Brsth)2(μ-Brsth)2(μ2-4,4′-bipy)2](2)的合成
0.1 mmol H2Brsth、0.1 mmol乙酸铜、0.1 mL4,4′-联吡啶、6 mL蒸馏水和2 mL乙醇置于20 mL内衬聚四氟乙烯自动升压不锈钢反应釜中,于150℃下反应2 d,得到暗绿色针状晶体。对C68H48Br4Cu4N12O10S4的元素分析实测值(%,括号内为计算值):C 43.03(43.10),H 2.51(2.56),N 8.83(8.86)。IR(KBr,cm-1):3 417s(H2O),3 105w(Ar-H),1 610s(C=N),1 534 m,1 497vs,1 472m,1 433s(C=C),1 222s(Ar-O),816 s,806m,733m(Ar-H),708s(C-S),641m,620w(C-Br)。
1.3 晶体结构的测试
分别选取0.20 mm×0.22 mm×0.24 mm(1)和0.20 mm×0.22 mm×0.24 mm(2)的单晶置于单晶衍射仪上,用经石墨单色器单色化的Mo Kα射线(λ= 0.071 073 nm)分别在293(2)K和291(2)K于1.4°~26.0°(1)和3.0°~27.0°(2)范围内用φ~ω扫描方式收集衍射点,衍射强度经过了吸收校正和Lp校正,晶体结构由直接法解出,对氢原子和非氢原子分别采用各向同性和各向异性热参数进行全矩阵最小二乘法修正,有机氢原子由理论加氢法得到,无机氢原子从差值傅立叶图中找出。结构解析和精修分别采用SHELXTL[19]程序包在计算机上完成。晶体数据列于表1。
CCDC:1058056,1;1048382,2。
2 结果与讨论
2.1 配合物1的晶体结构
配合物1的分子结构见图1,主要键长和键角见表2。中心对称的四核配合物分子由4个铜离子、4个Schiff配体Brsth2-阴离子和2个配位水分子组成,分子式为[Cu4(H2O)2(μ-Brsth)2(μ3-Brsth)2]。水杨醛类Schiff碱多核配合物中酚盐氧原子往往充当着多重桥联作用,形成立方烷{Cu4O4}单元是此类四核铜配合物经常呈现的特点[15,20]。然而配合物1中,铜离子和酚盐氧交替排列形成一种椅式结构的{Cu4O4}单元,其中Cu2、Cu2i、O2、O2i完全共平面,Cu1…Cu2和Cu2…Cu2i距离分别为0.296 8和0.333 5nm。4个Schiff碱的酚盐氧采用2种模式与铜配位,一种是双重桥联μ-O,另一种是三重桥联μ3-O。Schiff碱H2Brsth采用烯醇式与铜配位,并去质子化形成阴离子配体Brsth2-。4个铜离子都是五配位的四方锥配位几何构型,但所处配位环境不同。Cu1与1个配体μ3-Brsth2-的羰基氧原子O1、亚胺基的氮原子N2和酚盐氧原子μ3-O2以及另一配体μ-Brsth2-的酚盐氧原子μ-O4配位,形成锥底,Cu1-O1、Cu1-N2、Cu1-O2和Cu1-O4键长分别为0.194 5(3)、0.192 2(4)、0.195 2(3)和0.193 6(3)nm,锥底键角在80.41(12)°~104.22(13)°范围;而锥顶位置被配位水分子占据,Cu1-O1W键长0.226 5(3)nm,相关的键角在85.61(11)°~104.79(12)°范围。Cu2则与μ-Brsth2-羰基氧原子O3、亚胺基的氮原子N4和酚盐氧原子μ-O4以及另一配体μ3-Brsth2-的酚盐氧原子μ3-O2配位,形成锥底,Cu2-O3、Cu2-N4、Cu2-O4和Cu2-O2键长分别为0.191 8(3)、0.192 7(4)、0.191 4(3)和0.199 3(3)nm,锥底键角在79.92(12)°~104.08(13)°范围;而锥顶位置被O2i(Symmetry codes:ix,-y,-z)占据,由于Jahn-Teller效应,Cu2-O2i距离(0.263 0(3) nm)被拉长,相关的键角在88.69(10)°~102.82(14)°范围。正是O2和O2i的三重桥联作用构建了椅式的{Cu4O4}四核结构基元。Cu2-O2i键长(0.263 0(3)nm)比Cu1-O1W(0.226 5(3)nm)长的原因可能与配体间的排斥作用有关。
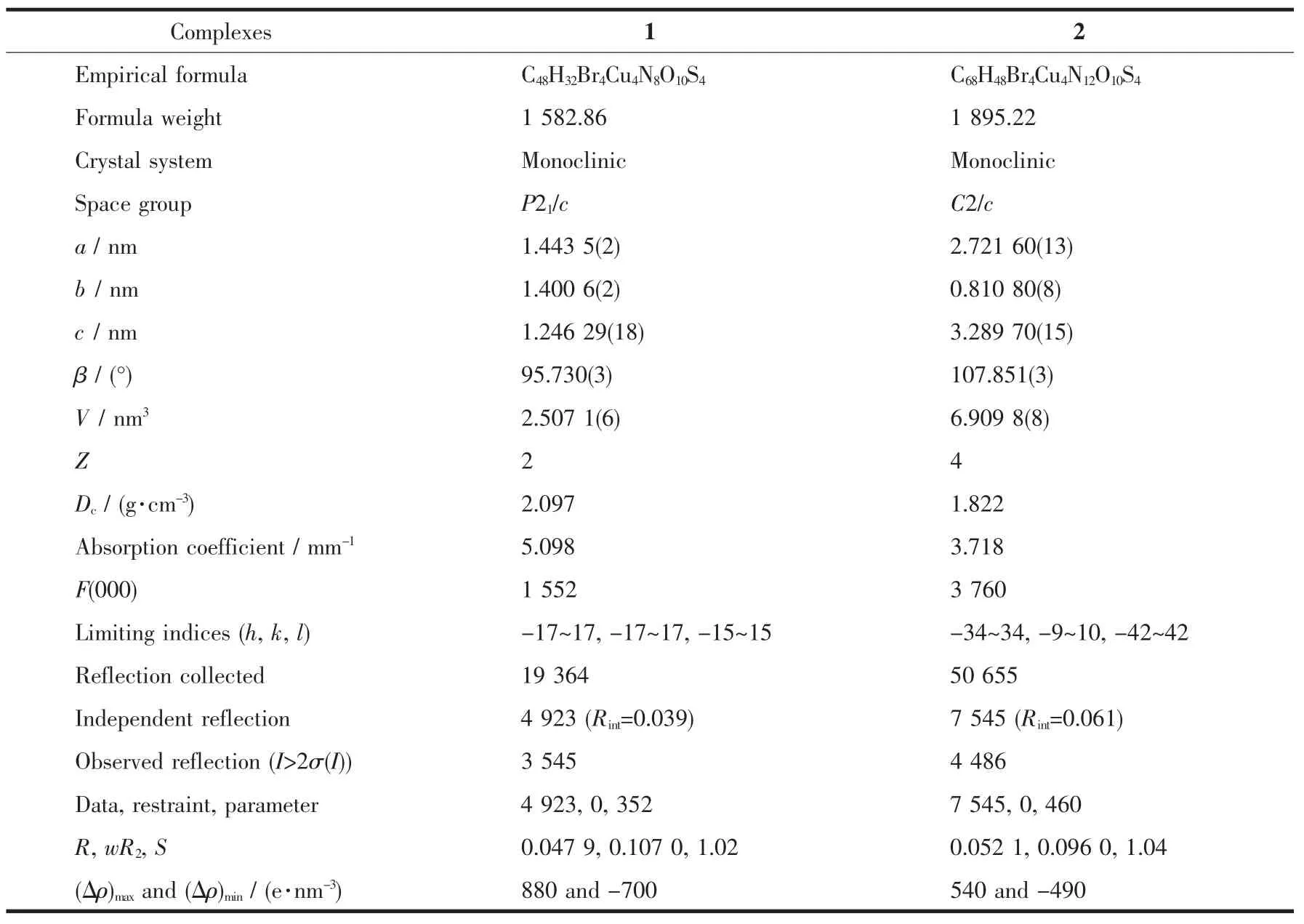
表1 配合物1和2的晶体学数据Table 1Crystallographic data for 1 and 2
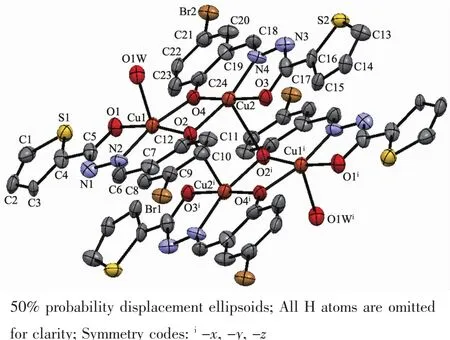
图1 配合物1的分子结构Fig.1Molecular structure of 1
酰腙配体的噻吩环与苯环的二面角分别为17°和18°。四核分子内噻吩环与噻吩环、苯环与苯环之间存在弱的π-π相互作用,质心间距分别为0.389 4和0.373 5 nm。四核分子内存在着C-H…O类型的氢键(如C11-H11…O3和C23-H23…O1);同时四核分子之间存在着如O1W-H1X…N1ii和O1W-H1Y…N3iii等典型的氢键(表3),它们对于稳定分子结构起着重要的作用。分子间氢键将配合物扩展为平行于bc平面的二维层状结构(图2)。
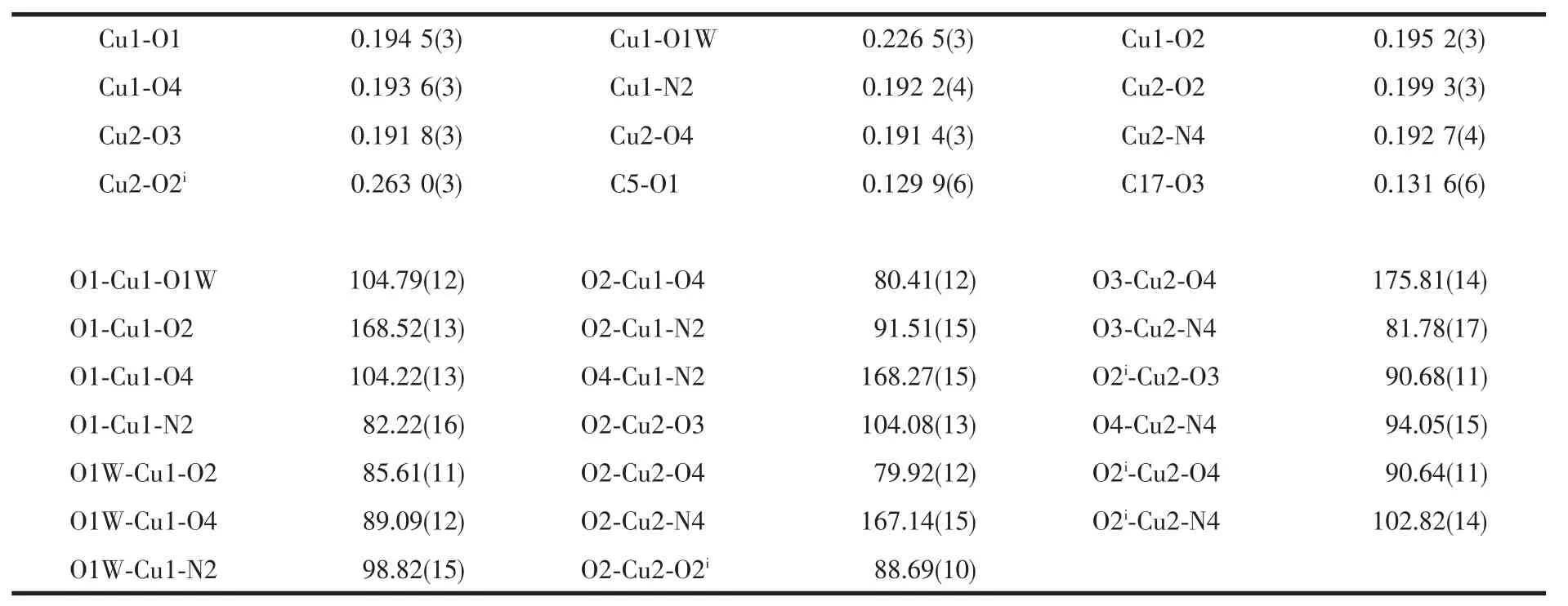
表2 配合物1的主要键长(nm)和键角(°)Table 2Selected bond lengths(nm)and angles(°)of 1
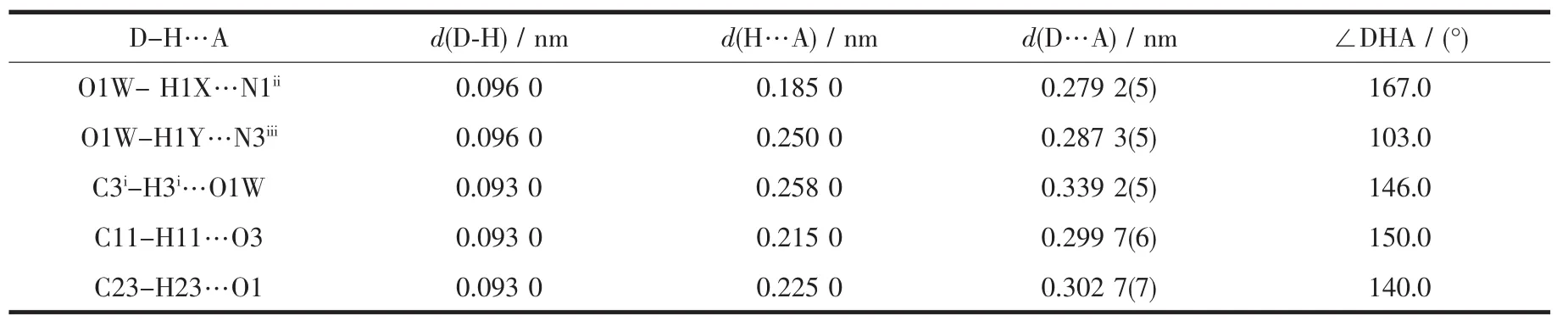
表3 配合物1中的氢键参数Table 3Hydrogen bond parameters for 1
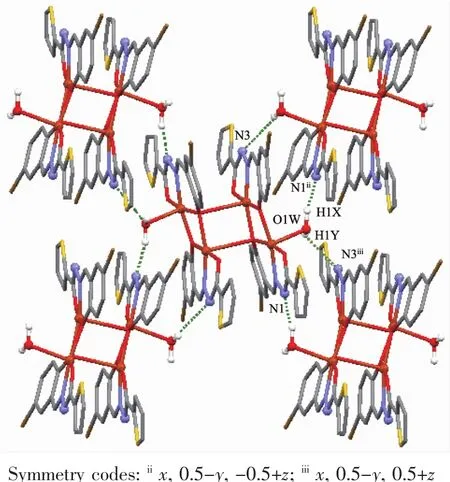
图2 配合物1中的分子间氢键Fig.2Hydrogen bonds in 1
2.2 配合物2的晶体结构
配合物2的分子结构见图3,主要键长和键角见表4。2也是一种中心对称的四核配合物。由图3可见,2就相当于1的四核结构被对称地分割成2个双核基元,二者之间插入2个4,4′-联吡啶,重新将铜离子桥联形成一种新的四核结构(Scheme 1),由此可见这类四核结构具有可控性。
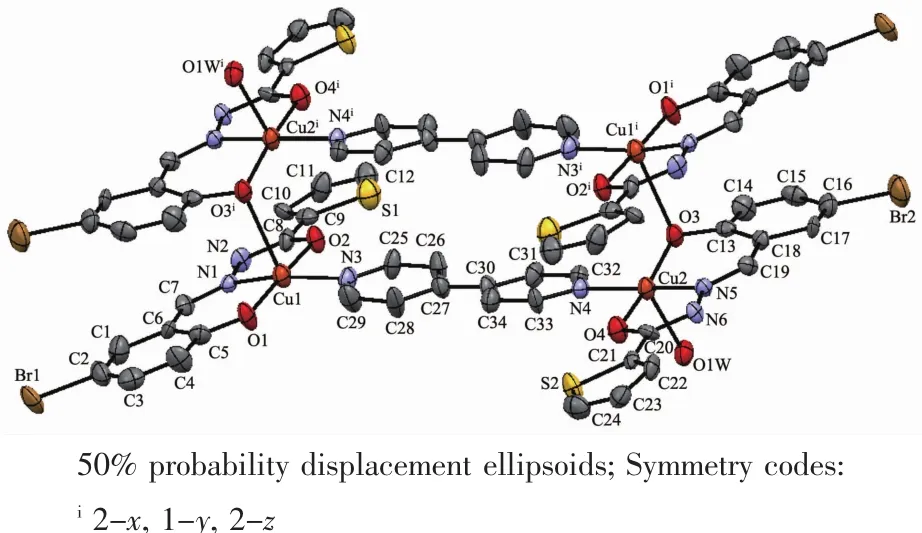
图3 配合物2的分子结构Fig.3 Molecular structure of 2
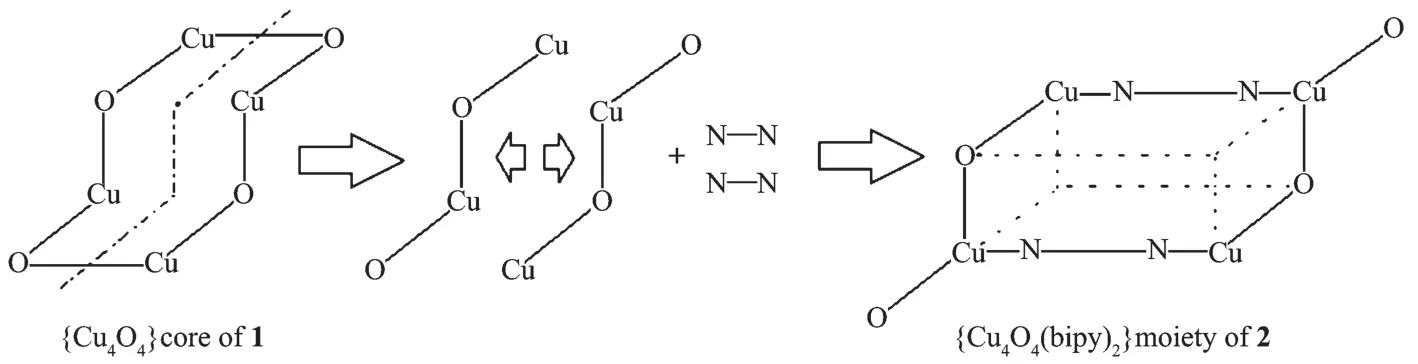
Scheme 1
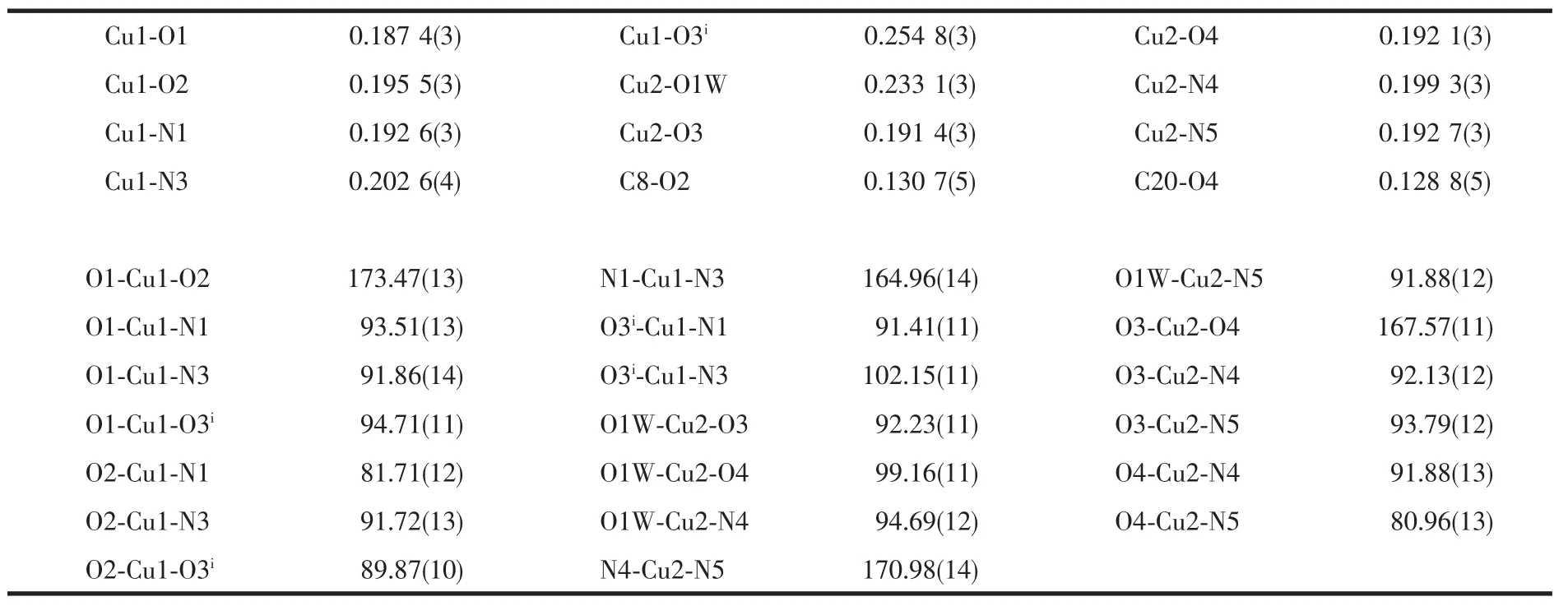
表4 配合物2的主要键长(nm)和键角(°)Table 4Selected bond lengths(nm)and angles(°)of 2
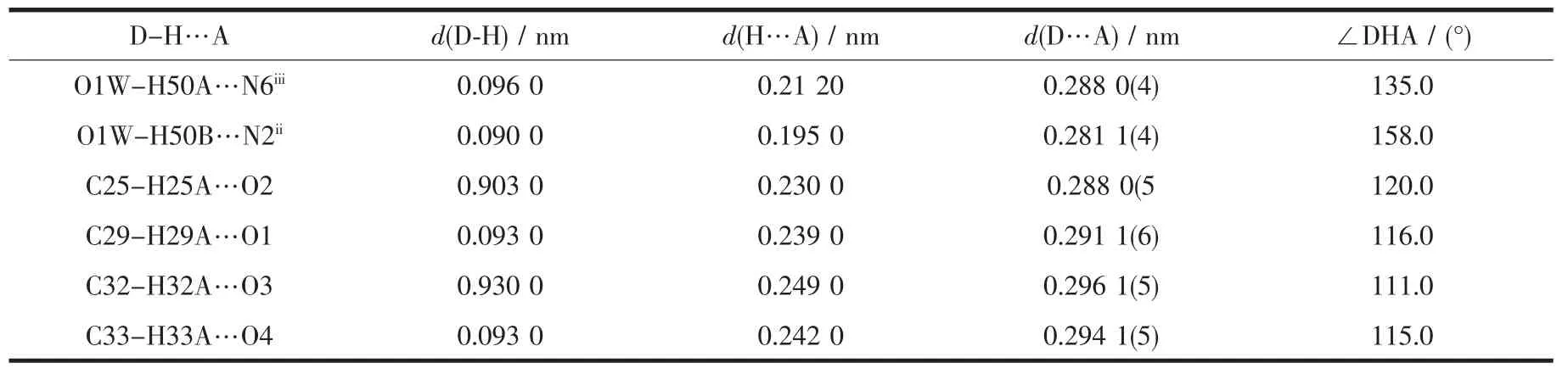
表5 配合物2中的氢键参数Table 5Hydrogen bond parameters for 2
4个中心离子Cu(Ⅰ)同样处于两类四方锥配位环境,锥底的Cu-O和Cu-N键长0.187 4(3)~0.202 6(4) nm,平均键长0.194 6 nm,与配合物1的平均键长0.193 8 nm比较接近。但是一个四方锥的锥顶配位水与Cu(Ⅰ)的键长比配合物1的略长,Cu2-O1W为0.233 1(3)nm;而另一个四方锥的锥顶配原子O与Cu(Ⅰ)的键长则略短,Cu1-O3i为0.254 8(3)nm。键角在81.71(12)°~102.15(11)°和164.96(14)°~173.47(13)°。四核基元分子内,4,4′-联吡啶之间、酰腙配体的苯环之间和噻吩杂环之间均存在着π→π相互作用(质心间距分别为0.377 2(2)、0.376 8(2)和0.403 6(2) nm),它们对稳定配合物的结构起着重要的作用。四核基元的配位水分子与另外2个相邻的配合物的配体酰胺N原子之间形成强烈的氢键(键长0.195 0~0.212 0 nm),从而将配合物连接成波浪形的二维超分子网络(图4)。此外,分子间还存在着丰富的CH…O类型的氢键(表5),它们对于稳定晶体结构同样功不可没。
2.3 配合物电子吸收光谱
配合物的紫外可见光谱如图5所示。配合物1和2的电子跃迁行为与[Cd2(μ-Brsth)2(Phen)2]和[Cu(Brsth)(Phen)][16]非常相似,403和404 nm处的强吸收带归属配体与金属离子间的荷移跃迁(LMCT)。310~339 nm范围的一组吸收峰,可指认为n→π*电子跃迁,与配体H2Brsth相比发生了一定程度的红移。在1中275 nm处配体的π→π*电子跃迁,与H2Brsth相比强度和宽度都增加,是因为配体以烯醇式配位增加分子的共轭程度。而2中π→π*电子跃迁(264 nm)强度显著增大,是因为有4,4′-联吡啶配位的结果。
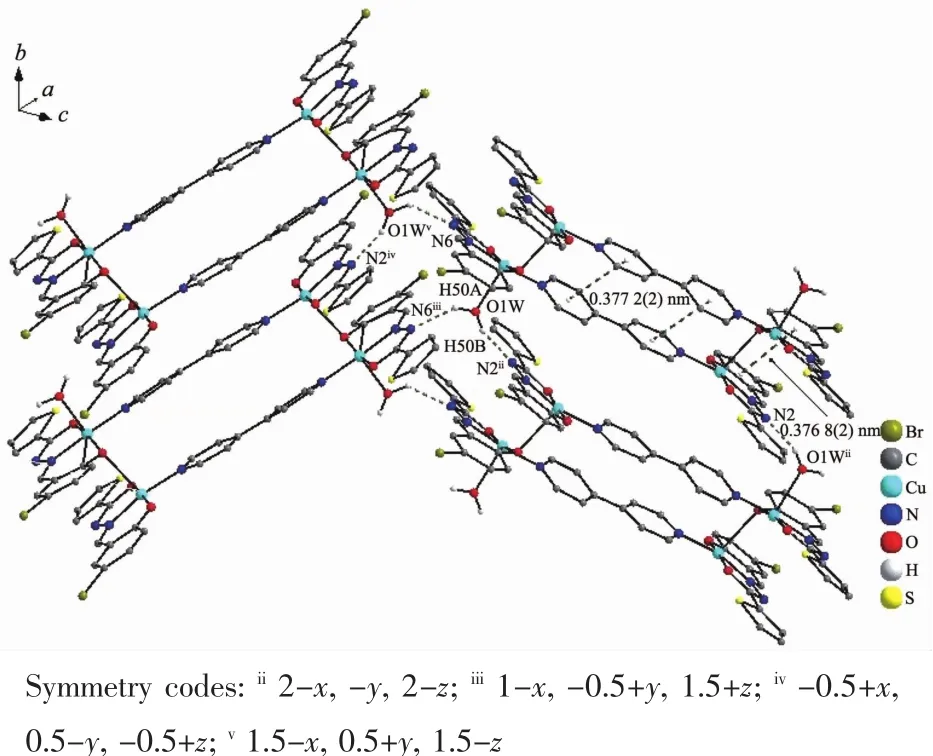
图4 配合物2中氢键构建的二维超分子结构Fig.42D supramolecular structure linked via hydrogen bonds of 2
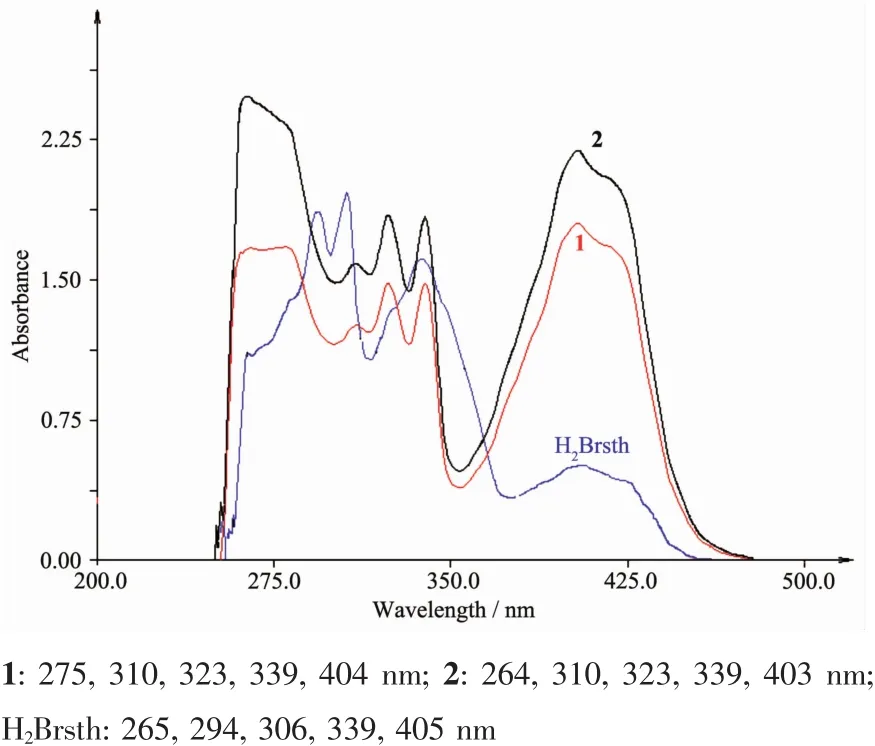
图5 配体H2Brsth和配合物的紫外可见光谱图Fig.5UV-Vis spectra of the ligand and complexes
2.4 抗肿瘤活性
参照文献[21]方法采用MTT法初步研究了配体H2Brsth及其配合物对人肝癌细胞HEPG2体外增殖的抑制作用,配合物的半数抑制浓度IC50列于表6。按照抗肿瘤生物活性体外筛选试验的结果评定标准,药物浓度为1 μmol·L-1时,对肿瘤细胞生长抑制率高于50%,则视为弱效;浓度为0.1 μmol·L-1时抑制率高于50%则视为强效。实验结果表明,配合物1和2对人肝癌细胞HEPG2有较强的增殖抑制作用,属强效抗癌药物。它们的活性都比相应的配体强得多,且与浓度的增加正相关,呈浓度依赖性(图6)。而同是五配位的铜的三元单核配合物[Cu (Brsth)(Phen)][16]的活性则弱得多,活性与配体相近,对人肝癌细胞HEPG2的半数抑制浓度IC50为19.5 μmol·L-1,配合物1和2对人肝癌细胞HEPG2的半数抑制浓度IC50分别为0.841和0.760 μmol·L-1,约是[Cu(Brsth)(Phen)]的IC50值的1/23~1/25。由此可见,具有大平面结构的配合物更有利于与DNA发生作用,从而使其生物活性增强。5-硝基水杨醛缩噻吩-2-甲酰腙的铜双核配合物[Cu(Him)L]2(Him=咪唑)[21]对HEPG2的半数抑制浓度IC50为1.54 μmol· L-1,约是配合物1和2的2倍,进一步证明铜含量的增高和暴露程度的增多,使底物更易与金属离子接触,生物活性更强[22]。
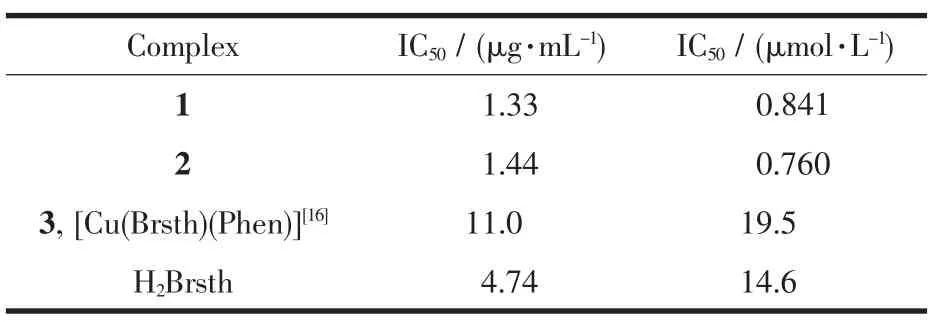
表6 配合物对癌细胞HEPG2的半数抑制浓度IC50Table 6IC50values of the complexes on HEPG2 cancer cell
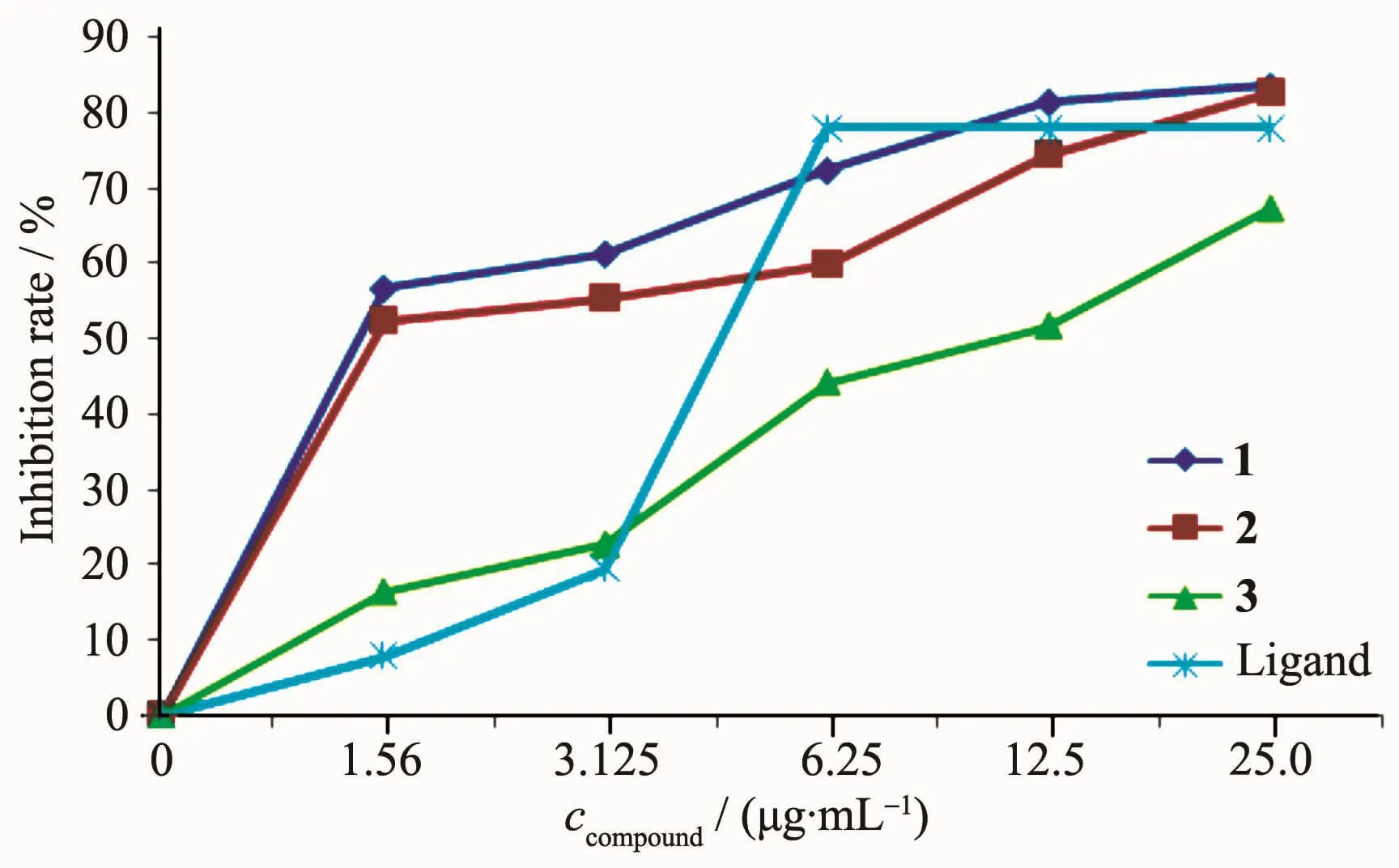
图6 配体和配合物对HEPG2的抑制作用Fig.6Inhibition effects of the ligand and complexes on cell HEPG2
[1]Garbutcheon-singh K B,Grant M P,Harper B P,et al.Curr. Top.Med.Chem.,2011,11:521-542
[2]Wilcox D E.Chem.Rev.,1996,96:2435-2458
[3]Fernandes T A,Mendes F,Roseiro A P S,et al.Polyhedron, 2015,87:215-219
[4]Thakurta S,Roy P,Butcher Ray J,et al.Eur.J.Inorg.Chem., 2009(29/30):4385-4395
[5]Gupta S,Pal S,Barik A K,et al.Polyhedron,2008,27(12):2519-2528
[6]Tuna F,Pascu G I,Sutter J-P,et al.Inorg.Chim.Acta,2003, 342:131-138
[7]QIU Xiao-Yang(仇晓阳).Chinese J.Inorg.Chem.(无机化学学报),2014,30(7):1667-1672
[8]Pattanayak P,Pratihar J L,Patra D,et al.Inorg.Chim.Acta, 2014,418:171-179
[9]Xiang H,Lan Y H,Jiang L,et al.Inorg.Chem.Commun., 2012,16:51-54
[10]He M H,Zhang W,Yu Z W.Inorg.Chim.Acta,2010,363 (13):3619-3623
[11]Tyagi P,Chandra S,Saraswat B S,et al.Spectrochim.Acta Part A,2015,145:155-164
[12]Kumar P,Narasimhan B.Mini Rev.Med.Chem.,2013,13 (7):971-987
[13]Räisänen M T,Korpi H,Sundberg M R,et al.Inorg.Chim. Acta,2013,394:203-209
[14]XIE Qi-Wei(谢齐威),CUI Ai-Li(崔爱莉),KOU Hui-Zhong (寇会忠).Chinese J.Inorg.Chem.(无机化学学报),2015,31 (9):1798-1804
[15]Chakraborty J,Thakurta S,Pilet G,et al.Polyhedron,2009, 28(4):819-825
[16]CHEN Yan-Min(陈延民),WANG Jing-Mei(王景梅),CHEN Fei-Peng(陈飞鹏),et al.Chinese J.Inorg.Chem.(无机化学学报),2016,32(3):434-440
[17]Conerney B,Jensen P,Kruger P E,et al.CrystEngCommun, 2003,5:454-458
[18]Liu P,Wang Y Y,Li D S,et al.Chin.J.Chem.,2005,23: 204-210
[19]SheldrickG M.SHELXTL,Program for X-ray Crystal Structure Solution and Refinement,University of Göttingen,Germany, 1997.
[20]Shit S,Rosair G,Mitra S.J.Mol.Struct.,2011,991(1/2/3): 79-83
[21]GAO Ping-Zhang(高平章),CHEN Ya-Xin(陈雅心),ZHENG Min-Min(郑敏敏),et al.Chinese J.Inorg.Chem.(无机化学学报),2016,32(9):1572-1578
[22]Ismail K Z.Transition Met.Chem.,2000,25(5):522-528
Two Adjustable Tetranuclear Copper(Ⅱ)Schiff Base Complexes: Self-Assembly,Crystal Structures and Antitumor Activities
CHEN Yan-MinJIANG YanHONG Si-YuYAO Yong-GangXIE Qing-Fan*
(College of Chemical Engineering and Material,Quanzhou Normal University,Quanzhou,Fujian 362000,China)
A tridentate Schiff base ligand(H2Brsth),derived from the condensation of 5-bromosalicylaldehyde and 2-acetylthiophene,hydrothermally reacted with Cu(Ⅰ)acetate in mixed-solvent of ethanol and water to yield tetranuclear complexes[Cu4(H2O)2(μ-Brsth)2(μ3-Brsth)2](1)and[Cu4(H2O)2(Brsth)2(μ-Brsth)2(μ2-4,4′-bipy)2](2), which were characterized by elemental analyses,IR,electronic spectra,thermogravimetric analysis and single crystal X-ray diffraction.The X-ray diffraction analyses reveal that 1 crystallizes in the monoclinic space group P21/c with Z=2 while 2 in monoclinic space group C2/c with Z=4.In 1 and 2 each Cu(Ⅰ)atoms are fivecoordinated with both distorted square pyramidal geometries.In 1 four Cu(Ⅰ)atoms are held together by four μ-O and/or μ3-O type phenoxo oxygen atoms from four individual Schiff base ligands to form a chair-shaped{Cu4O4} unit.In 2 two pairs of Cu(Ⅰ)atoms join two μ2-4,4′-bipy molecules and two μ-phenoxo oxygen atoms from two Schiff base,respectively,to form a cyclic tetranuclear structure.The in vitro antitumor activities of ligand and complexes were tested by MTT method,which results show that the complexes have strong in vitro antitumor activity against HEPG2 cancer cells lines.CCDC:1058056,1;1048382,2.
copper complex;Schiff base;crystal structure;antitumor activity
O614.121
A
1001-4861(2017)06-1023-07
10.11862/CJIC.2017.122
2017-01-17。收修改稿日期:2017-04-17。
泉州师范学院学科建设资金和福建省大学生创新创业训练计划项目(No.201610399058)资助。
*通信联系人。E-mail:xqf360@163.com;会员登记号:S06N2113M1304(陈延民),S06N5449M1311(解庆范)。
猜你喜欢
杂志排行
无机化学学报的其它文章
- CoAl2O4/蜂窝陶瓷催化剂的制备及其催化臭氧化性能
- Photocatalytic Hydrogen Production Based on Cobalt-Thiosemicarbazone Complex with the Xanthene Dye Moiety
- 两种金属-有机钙钛矿材料的负热膨胀性质
- Pyrazolate-Based Dipalladium(Ⅱ,Ⅱ)Complexes:Syntheses,Characterization and Catalytical Performance in Suzuki-Coupling Reaction
- 以滤纸为模板合成新型介孔生物活性玻璃微管材料
- Br-掺杂Bi2WO6的水热法合成及其可见光催化性能
