2017 年高考化学模拟试题
2017-07-05河北省武邑中学葛春艳
■河北省武邑中学 葛春艳
2017 年高考化学模拟试题
■河北省武邑中学 葛春艳
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 V-51
第Ⅰ卷
一、选择题(本题包括7小题,每小题6分,共42分。每小题只有一个选项符合题意)
1.化学与生活、社会发展息息相关,下列有关说法不正确的是( )。
A.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
B.“霾尘积聚难见路人”,雾霾所形成的气溶胶能产生丁达尔效应
C.“青蒿一握,以水二升渍,绞取汁”,上述对青蒿素的提取过程属于化学变化
D.某古剑“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
2.设NA表示阿伏加德罗常数的值,下列叙述正确的有( )。
(1)0.5mol·L-1的MgCl2溶液,含有Cl-个数为NA;
(2)标准状况下,22.4L溴苯中含有氢原子数为5NA;
(3)500mL2mol·L-1NH4NO3溶液中,含有NH+4数小于NA;
(4)用惰性电极电解足量CuSO4溶液,生成22.4L气体时转移电子数为4NA;
(5)常温下,10.4g苯乙烯中含碳碳双键0.1NA;
(7)1mol铁与1mol氯气在点燃条件下完全反应,转移的电子数为3NA;
(8)8.4gNaHCO3和MgCO3的固体混合物中含有的阴阳离子总数为0.2NA。
A.2个 B.3个
C.5个 D.6个
3.某研究小组采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程如下。该方法对H2S的吸收率达99%以上,并可制取H2和S。下列说法正确的是( )。
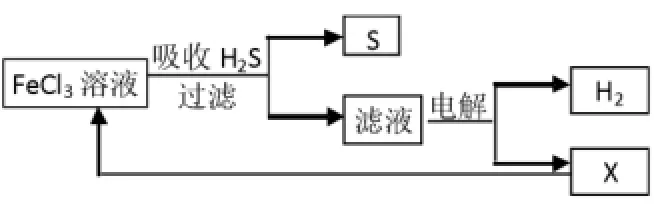
A.吸收H2S的离子方程式为Fe3+
B.电解过程中的阳极反应主要为2Cl--
C.实验室可用点燃充分燃烧的方法消除H2S污染
D.该工艺流程体现绿色化学思想
4.布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的儿童抗炎退烧药,其结构如图1所示,下列说法不正确的是( )。
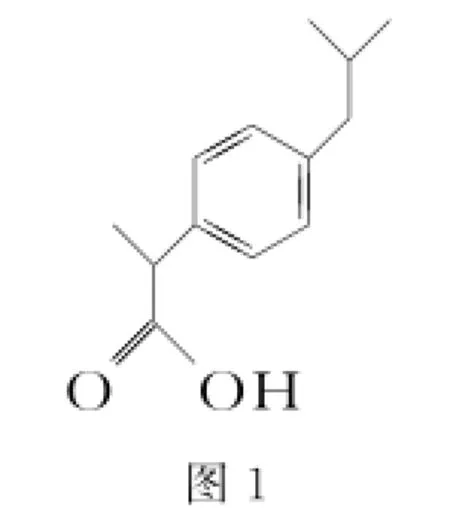
A.布洛芬的分子式为C13H18O2
B.布洛芬与苯丙酸互为同系物
C.丁苯丙酸共有12种可能的结构
D.布洛芬能发生加成、取代等反应
5.下列根据实验操作和现象所得出的结论正确的是( )。
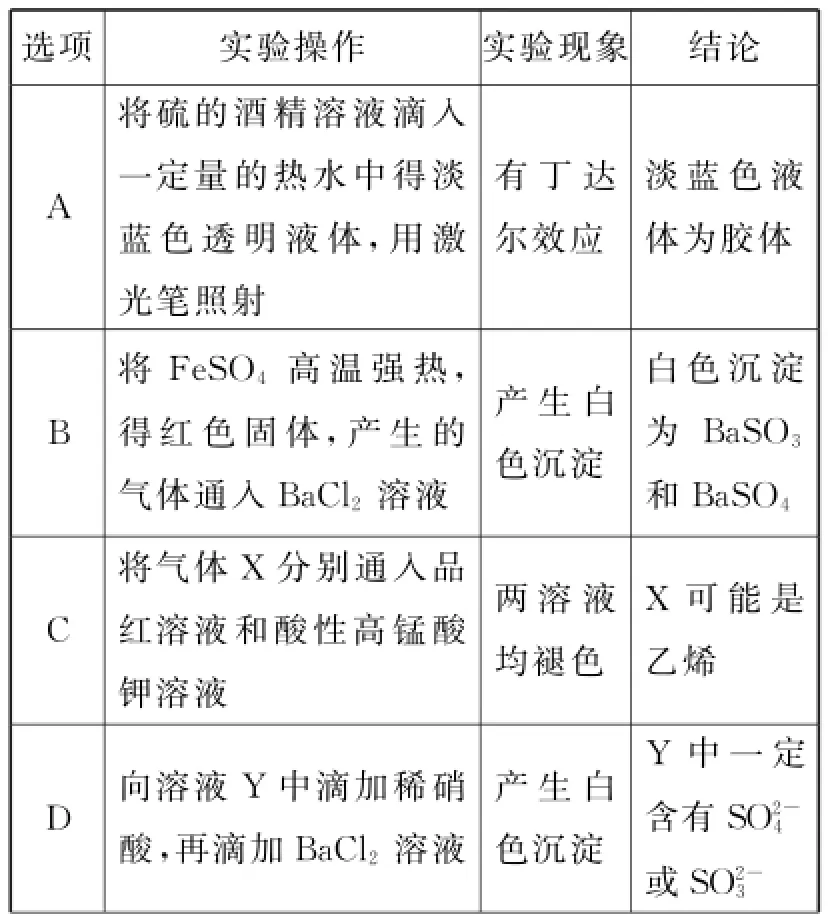
选项______实验操作实验现象结论A将硫的酒精溶液滴入一定量的热水中得淡蓝色透明液体,用激_____ _____________________ ________ __________ _光笔照射有丁达尔效应淡蓝色液体为胶体B将FeSO4高温强热,得红色固体,产生的_____气体通入BaCl2溶液产生白色沉淀白色沉淀为BaSO3和BaSO4__C将气体X分别通入品红溶液和酸性高锰酸______ _______________________ __________ ________ ___钾溶液两溶液均褪色X可能是乙烯D向溶液Y中滴加稀硝酸,再滴加BaCl2溶液产生白色沉淀Y中一定含有SO2-4或SO2-3
6.香花石被誉为“矿石熊猫”,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层相等,X、Z位于同主族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法正确的是( )。
A.原子半径:Y〈Z〈R〈T
B.气态氢化物的稳定性:W〈R〈T
C.化合物XR2和XT2中所含化学键的种类相同
D.XR2、WR2两化合物中R的化合价相同
7.常温常压下,将NH3缓慢通入饱和食盐水中至饱和,然后向所得溶液中缓慢通入CO2,整个实验进程中溶液的pH随通入气体体积的变化曲线如图2所示(实验中不考虑氨水的挥发)。下列叙述正确的是( )。
A.由a点到b点的过程中,溶液中由水电离的c(OH-)不断增大

图2
C.c点所示溶液中,c(NH4+)+c(H+)= 2c(CO23-)+c(OH-)+c(Cl-)+c(HCO3-)
D.d点所示溶液中,c(NH4+)+ c(NH3·H2O)+c(NH3)〉c(HCO3-)+ c(CO23-)+c(H2CO3)
第Ⅱ卷(非选择题共58分)
8.(15分)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物,现某兴趣小组对其展开研究。
实验Ⅰ:制取NaClO2晶体。
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。Ba(ClO2)2可溶于水。现利用图3所示装置进行实验。

图3
(1)装置②中产生ClO2的化学方程式为____。装置③的作用是____。装置④中制备NaClO2的化学方程式为____。
(2)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③____;④低于60℃干燥,得到成品。
(3)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4。操作与现象是:取少量晶体溶于蒸馏水,___。
(4)通过分析说明装置①在本实验中的作用:___。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品mg于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用cmol·L-1Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为VmL(已知:
(5)滴定使用的指示剂是____,达到滴定终点时的现象为____。
(6)该样品中NaClO2的质量分数为____(用含m、c、V的代数式表示)。
(7)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为____。
9.(14分)近年以来全国各地都遭遇“十面霾伏”。其中,二氧化硫、氮氧化物和可吸入颗粒物是雾霾的主要组成成分,综合治理其污染是环境化学当前的重要研究内容。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化。发生反应如下:


表1
②若上述反应在绝热、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则图4中不符合题意的是____(填选项序号)。(图4中ω、M、v正分别表示质量分数、混合气体平均相对分子质量、正反应速率)
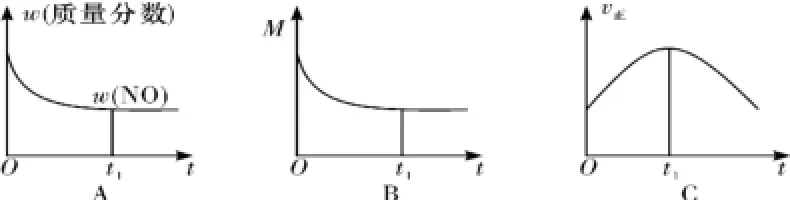
图4
(2)尾气中的SO2可先催化氧化生成SO3,再合成硫酸。已知:2SO2(g)+O2(g)ΔH=-196.0kJ·mol-1。在某温度时,向10L的密闭容器中加入4.0molSO2和10.0molO2,发生反应建立平衡,请回答以下问题:
则A点的v逆(SO2) ____(填“大于”“小于”或“等于”)B点的v正(SO2)。此温度下的平衡常数为____。
②反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平衡浓度和原来平衡浓度相同的是____(填选项序号)。

图5
A.在其他条件不变时,减小容器的容积
B.保持温度和容器内压强不变,再充入2.0molSO2和5.0molO2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的2倍
(3)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,其原理如图6所示。
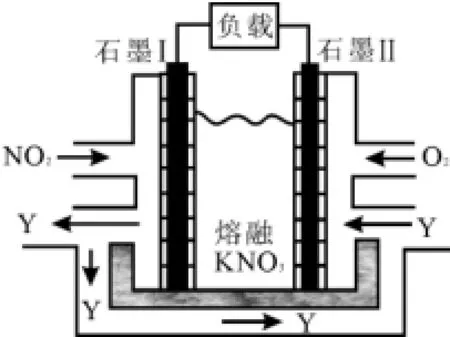
图6
该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用。石墨Ⅱ是电池的____极,石墨Ⅰ附近发生的电极反应式为____。
(4)尾气中氮氧化物(NO和NO2)也可用尿素[CO(NH2)2]溶液除去,反应生成对大气无污染的气体。1mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1∶1)的质量为____g。
10.(14分)某工厂用回收钒渣(含VOSO4、K2SO4、SiO2))制取V2O5时工艺流程如下。

已知:②③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n(水层)+2nHA(有机层)(有机层)+nH2SO4(水层)。
请回答下列问题:
(1)操作Ⅰ的名称为____。
(2)步骤②中必须加入适量碱,其原因是____。
(3)步骤③中反萃取所用的试剂X为____(填写试剂名称)。
(4)步骤④中,氧化剂是____(填写试剂名称),氧化产物与还原产物的物质的量之比为____。
(5)沉淀Y的摩尔质量为598g·mol-1,且仅含有四种元素。取59.8g沉淀Y的样品充分焙烧,得到产品54.6g,将产生的气体通过足量碱石灰,碱石灰增重1.8g,剩余的气体再通入稀硫酸被完全吸收。通过计算确定沉淀Y的化学式为____。
(6)成品V2O5可通过铝热反应来制取金属钒,写出该反应的化学方程式:___。
(7)钒沉淀率和溶液pH之间关系如图7所示。
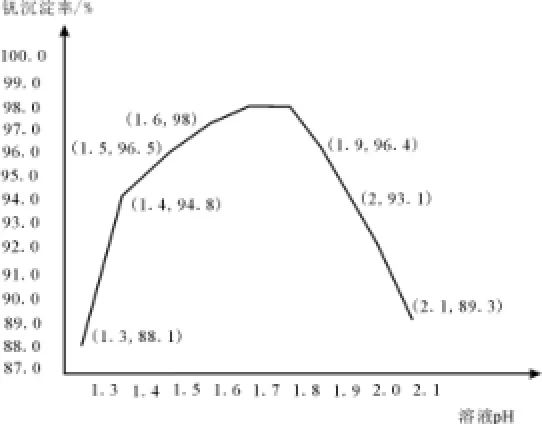
图7
11.【化学——选修3:物质结构与性质】(15分)有M、X、Y、Z、Q五种元素。M元素的电负性在所有元素中最大,X原子最外层电子数比内层电子总数多1;Y原子s轨道和p轨道电子数相同,且有2个单电子;Z原子核外有3种能级,每种能级所含电子数相同; Q的原子序数为M、Y、Z原子序数之和。
(1)Q元素的元素符号为____,该元素原子的价层电子排布式为____。
(2)M、Y、Z电负性由大到小顺序为____ (用元素符号表示)。
(3)将X、Y形成的化合物与单质Z在电炉中高温,得到化合物X4Z,该反应的化学方程式为____,化合物X4Z熔、沸点高,硬度大,试解释原因:___。
(4)M与X形成的化合物的键角为____;如果把该化合物与乙醚(CH3CH2—O—CH2CH3)放在一起,X原子的杂化方式发生了变化,键长增加。请说明X原子杂化方式的变化及其原因:___。
(5)Q2Y5溶解在NaOH溶液中,可得到某酸钠(Na3QY4),该盐阴离子的空间构型为____;也可以得到偏某酸钠,其阴离子呈如图8所示的四面体无限链状结构(四面体的顶点为Y,Q位于四面体的体心),则偏某酸钠的化学式为____。
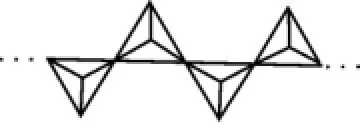
图8
12.【化学——选修5:有机化学基础】(15分)聚芳酯(PAR)是分子主链上带有苯环和酯基的特种工程塑料,在航空航天等领域应用广泛。利用乙酰丙酸合成聚芳酯E的路线如下(部分产物省略)。

(1)A中含有的官能团是____(填官能团名称)。
(2)B与D的反应类型为____,B的结构简式为____。
(3)C生成D的反应化学方程式为____。
(4)C分子的核磁共振氢谱中有____个吸收峰,同时符合下列要求的C的同分异构体有____种。
①能发生银镜反应
②能与NaHCO3溶液反应
③遇FeCl3溶液显紫色
F与C属于官能团异构的同分异构体,且只含一种官能团,则1molF与足量NaOH溶液反应时消耗NaOH的物质的量为____。
(5)根据合成聚芳酯E的路线,请你以苯酚及2-丙醇为原料(无机试剂任选),设计合成G

1.C 2.B 3.D 4.C 5.A 6.B 7.D

(2)38℃~60℃的温水洗涤
(3)滴加几滴用盐酸酸化的BaCl2溶液,若有白色沉淀出现,则含有Na2SO4;若无白色沉淀出现,则不含有Na2SO4
(4)吸收装置中未反应的ClO2,防止外逸污染空气
(5)淀粉溶液 滴加最后一滴液体时溶液由蓝色变成无色且半分钟内不变色

(4)76
10.(1)过滤
(2)加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率
(3)硫酸
(4)氯酸钾 6∶1
(5)V6H8N2O16[或(NH4)2V6O16等其他合理表达形式都给分]
(7)1.7~1.8 2.6×10-3mol·L-1
11.(1)V 3d34s2
(2)F〉O〉C
(4)120° B原子有空轨道,接受乙醚中O原子提供的孤对电子形成配位键,B原子由sp2杂化变为sp3杂化
(5)正四面体 NaVO3
12.(1)羟基、羧基 (2)缩聚反应

(责任编辑 谢启刚)
