PRV感染PK-15细胞对prv-miR-LLT11a表达时相的影响
2017-07-05李新果李双双时庆贺郑关民王玉国王川庆
杨 利,石 昂,李新果,李双双,时庆贺,郑关民,王玉国,陈 陆,王川庆
(河南农业大学 牧医工程学院,河南 郑州450002)
PRV感染PK-15细胞对prv-miR-LLT11a表达时相的影响
杨 利,石 昂,李新果,李双双,时庆贺,郑关民,王玉国,陈 陆*,王川庆
(河南农业大学 牧医工程学院,河南 郑州450002)
为研究伪狂犬病病毒(PRV)的致病机制,将PRV QBA株按0.5个感染复数(MOI)的剂量接种PK-15细胞,分别在感染后0、1、2、4、6、8、12、24 h收取细胞并提取microRNA(miRNA),采用茎环引物实时荧光定量PCR(RT-qPCR)检测prv-miR-LLT11a的表达时相。RT-qPCR扩增结果显示,熔解曲线峰值单一,扩增曲线拐点清晰。RT-qPCR检测结果表明,PRV QBA株感染PK-15细胞1 h后,prv-miR-LLT11a表达量极显著升高,随后表达量下调,在感染6 h后表达量降至最低,感染8 h后表达量持续急剧升高。
伪狂犬病病毒; prv-miR-LLT11a; 茎环RT-qPCR; 表达时相
伪狂犬病病毒(pseudorabies virus,PRV)是α-疱疹病毒亚科的重要成员,具有嗜神经性和潜伏感染性[1-4]。PRV能引起新生仔猪的神经症状和成年种猪的繁殖障碍以及呼吸系统疾病,在世界范围内给养猪业造成了巨大的经济损失[5-8]。由于PRV具有典型的潜伏感染特性,在生产上增加了该病的防控难度[9-11]。因此,深入研究PRV的潜伏机制对于防控该病至关重要。
microRNA(miRNA)是一类广泛表达于动植物细胞中的内源性非编码单链小RNA分子,长度约为22个核苷酸,能够在转录后通过互补配对的方式结合到mRNA的3′非编码区(3′UTR)发挥调控基因表达的功能[12]。miRNA具有重要的生物学功能,参与机体的生长发育、代谢凋亡、免疫反应和肿瘤形成等[13-14]。近年来,在人巨细胞病毒(human cytomegalovirus,HCMV)、卡波氏肉瘤病毒(Kaposi’s sarcoma-associated herpes virus,KSHV)、Epstein-Barr病毒(EBV)等疱疹病毒上的研究表明,病毒编码的miRNA在病毒逃避免疫清除方面起到重要作用[15]。前人研究发现,PRV Ea株感染PK-15细胞后,PRV长潜伏相关转录本(large latency transcript,LLT)基因能够转录产生包括prv-miR-LLT11a在内的11个成熟miRNA[16]。目前,对于这11种miRNA的表达时相及其生物学功能还未进行深入的研究。鉴于病毒编码miRNA在病毒与宿主互作过程中起到的重要作用,对miRNA的表达时相及基因调控机制进行深入研究显得尤为重要。为此,以prv-miR-LLT11a为研究对象,以从河南某猪场分离到的PRV野生毒株QBA为感染毒株,采用茎环引物实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)检测其感染PK-15细胞后prv-miR-LLT11a的表达时相变化,旨在为研究PRV的致病机制奠定基础。
1 材料和方法
1.1 病毒与细胞
PRV QBA株为从河南某猪场分离并保存的野生毒株;PK-15细胞系购自中国典型培养物保藏中心(CCTCC)。
1.2 试剂与仪器
DMEM培养基购自GIBCO公司;胎牛血清购自杭州四季青生物工程材料有限公司;第一链cDNA合成试剂盒(SK2445)、SG Fast qPCR Master Mix(High Rox)(BBI)荧光定量试剂盒 (B639273)以及microRNA抽提试剂盒(B518811)均购自生工生物工程(上海)股份有限公司。
PCR反应扩增仪购自BIO公司;StepOne型荧光定量PCR仪购自ABI公司。
1.3 PRV感染PK-15细胞样品的制备
按6.0×105个细胞/孔的量将PK-15细胞铺入六孔板,37 ℃条件下于5% CO2细胞培养箱内培养,待细胞长满单层时按0.5个感染复数(MOI)的量接种PRV QBA毒株,吸附1 h后换含有2%胎牛血清的维持液,此时记为0 h。分别在感染后0、1、2、4、6、8、12、24 h收取细胞,冻存于-80 ℃备用。
1.4 miRNA提取与反转录
参照柱式miRNA抽提试剂盒(B518811_ZH_P)操作手册,进行miRNA的提取,甲醛变性琼脂糖凝胶电泳检测RNA的完整性,分光光度计分别测定miRNA提取物的OD260/280和OD260/230值。使用特异性茎环引物,参照第一链cDNA合成试剂盒(SK2445)操作说明书,取1 μg总RNA进行反转录,得到cDNA,-20 ℃保存备用。
1.5 RT-qPCR引物设计
根据miRBase提交的prv-miR-LLT11a(登录号:MI0022083)成熟序列设计特异性茎环反转录引物prv-miR-LLT11a RT。应用Primer Premier 5.0软件分别设计目的基因prv-miR-LLT11a和内参基因U6(GenBank:EU520423.1)RT-qPCR引物prv-miR-LTT11a-F/prv-miR-LTT11a-R和U6-F/U6-R,内参基因U6下游引物U6-R同时作为其反转录引物。通过Blast检测引物的特异性,引物由生工生物工程(上海)股份有限公司合成,序列见表1。
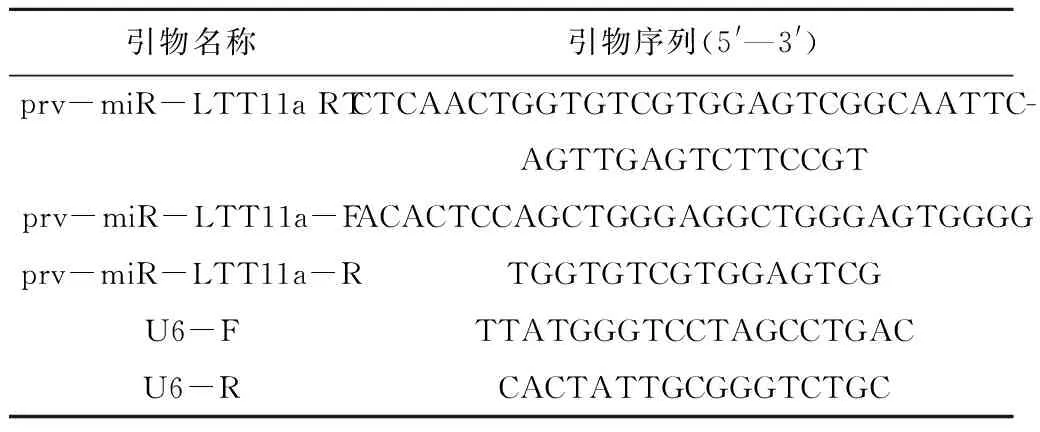
表1 目的基因和内参基因引物序列
1.6 RT-qPCR检测prv-miR-LLT11a的相对表达量
RT-qPCR总体系20 μL:2× SYBR Green qPCR Master Mix(High Rox)10 μL,上、下游引物各0.4 μL,模板cDNA 2 μL,加7.2 μL的ddH2O补至20 μL。每个样本设置3个重复。RT-qPCR循环参数:95 ℃ 3 min预变性;95 ℃ 7 s,57 ℃ 10 s,72 ℃ 15 s,共45个循环。以U6基因为内参,采用2-△△Ct计算prv-miR-LLT11a的相对表达量,所得数据用SPSS软件进行统计分析。
2 结果与分析
2.1 miRNA样品的质量检测
从图1可以看出,miRNA样品在琼脂糖凝胶电泳中条带单一,无弥散,表明miRNA完整性较好。使用分光光度计测定的miRNA样本OD260/280值介于1.9~2.0,表明所提miRNA样品中含蛋白质、DNA等杂质较少,纯度较高且质量良好,可以用于后续反转录试验(表2)。
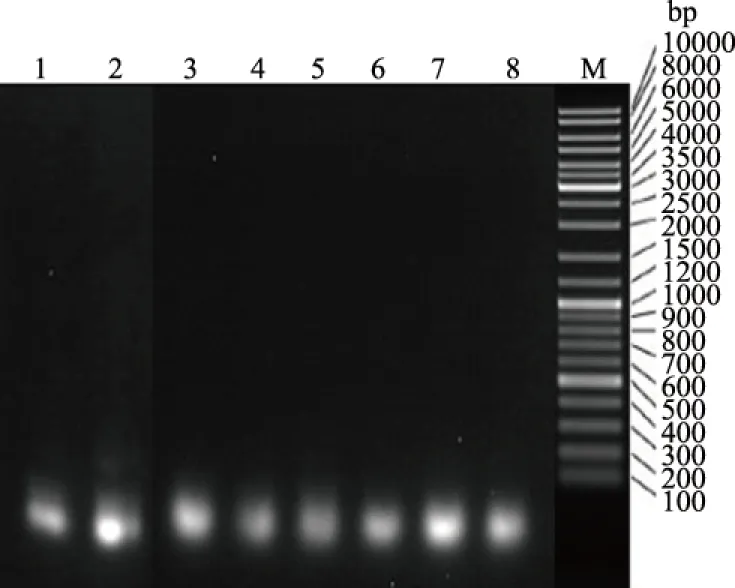
M为DNA Marker;1—8分别为感染0、1、2、4、6、8、12、24 h的样品
2.2 RT-qPCR引物特异性检测
从图2和图3可以看出,RT-qPCR扩增曲线
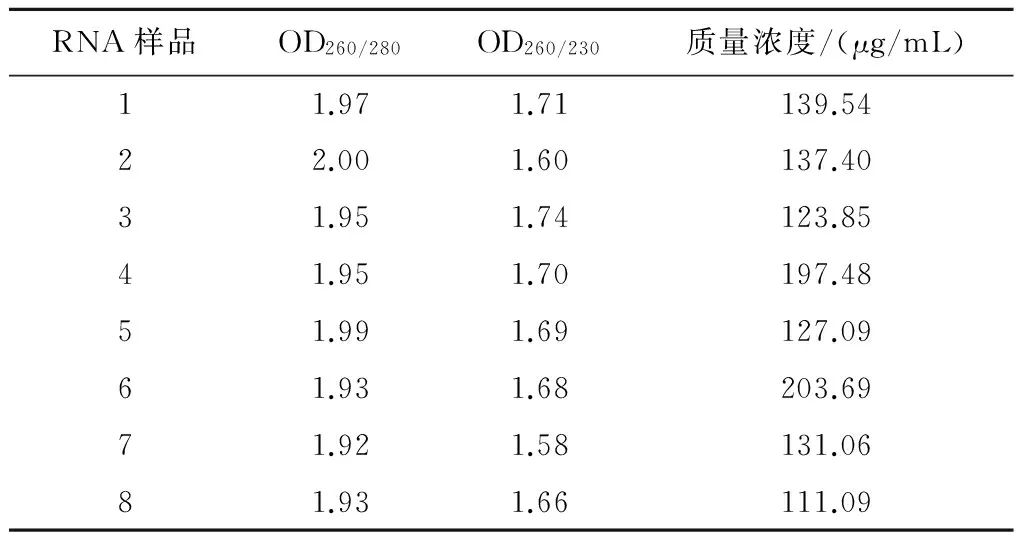
表2 miRNA样品的质量检测
拐点清晰,熔解曲线峰值单一,表明prv-miR-LLT11a及内参基因U6引物特异性好,扩增过程中没有产生引物二聚体或非特异性扩增,定量结果准确可靠,数据可以用于下一步分析。
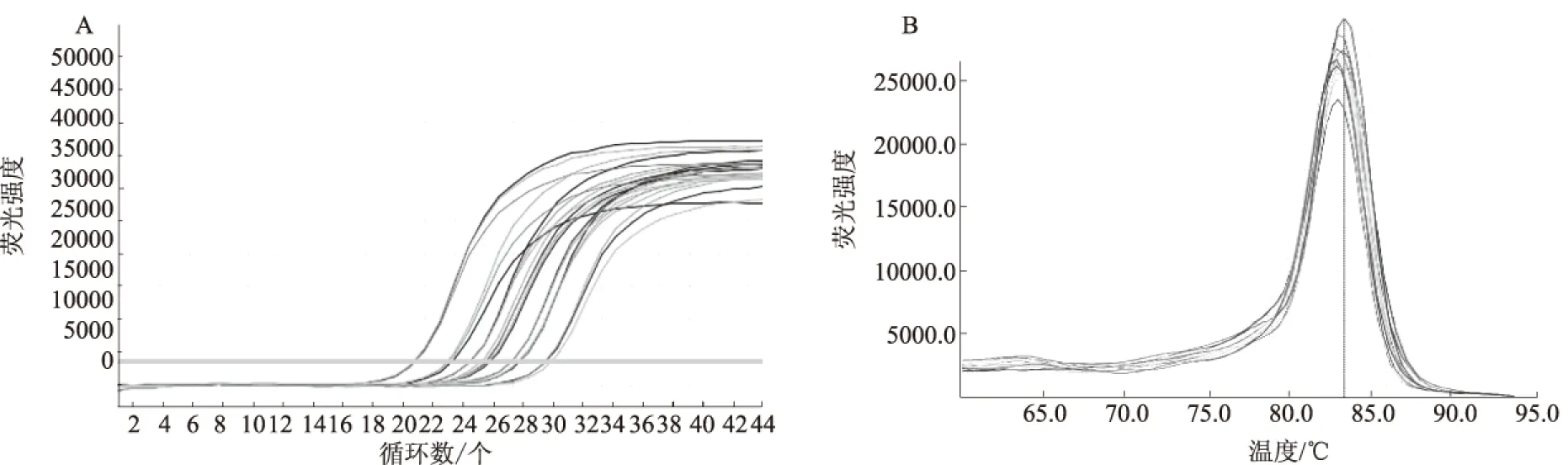
图2 prv-miR-LLT11a 扩增曲线(A)和熔解曲线(B)
图3 内参基因U6扩增曲线(A)和熔解曲线(B)
2.3 茎环引物RT-qPCR检测prv-miR-LLT11a的表达时相
RT-qPCR结果显示,PRV QBA株感染PK-15细胞1 h后,prv-miR-LLT11a的表达量极显著升高;感染后2 h的表达量较1 h时开始显著下降,感染后6 h表达量降至最低,从感染后8 h开始表达量持续急剧升高(图4)。prv-miR-LLT11a在PRV QBA株感染PK-15细胞后呈现极显著的差异性表达,提示其在PRV感染宿主过程中可能起到基因调控作用。
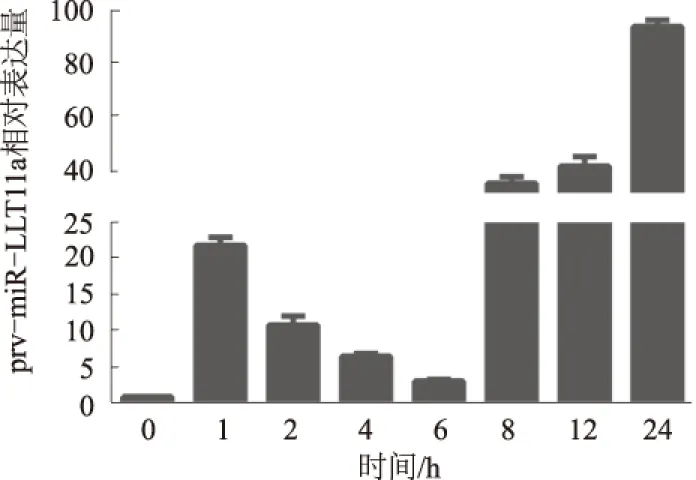
图4 PRV感染PK-15细胞期间prv-miR-LLT11a不同时间点的相对表达量
3 结论与讨论
miRNA是近年生命科学领域研究的热点之一,几乎所有的高等动物、植物和多种DNA病毒都可以编码产生miRNA,miRNA广泛参与细胞的增殖分化、凋亡代谢、免疫应答等过程[17-19]。新生成的双链miRNA的一条链可进入RNA诱导的沉默复合体中(RNA-induced silencing complex,RISC)中发挥成熟miRNA的功能,指导RISC作用于靶mRNA[20],其互补链则会被降解。前人研究发现,PRV Ea株感染PK-15细胞后其LLT基因能够转录出11个成熟的miRNA,除LLT之外的基因组还能够转录出25个新的miRNA[21]。目前,关于这些miRNA在病毒感染期间的表达时相及其功能尚不清楚。茎环RT-qPCR是检测miRNA比较常用的方法,需要针对每一条miRNA进行茎环引物设计,特异性强、灵敏度高。本研究采用茎环引物RT-qPCR检测PRV QBA株感染PK-15细胞后prv-miR-LLT11a的表达时相变化,结果表明,病毒感染1 h后,prv-miR-LLT11a的表达量显著升高;随后逐渐下降,至6 h达到最低;8 h后开始持续急剧升高。1型疱疹病毒(HSV-1)编码的miR-H2和miR-H4-3p可以分别作用于早期基因ICP0和晚期基因ICP34.5,有利于HSV-1调控病毒生命周期和建立潜伏感染状态[22-23]。prv-miR-LLT11a是否起到与miR-H2和miR-H4-3p相类似的功能还需要进一步研究。
PRV具有潜伏感染的特性,病毒在体内建立潜伏感染的前提是逃避宿主免疫清除,但是PRV逃避免疫清除以及潜伏的机制还不清楚。目前,研究miRNA功能较成熟的疱疹病毒如HCMV、KSHV、 EBV等,在促进病毒逃避免疫清除方面都有比较深入的发现,对研究PRV编码的miRNA的功能有一定的借鉴意义。研究发现,HCMV、KSHV、EBV 三种疱疹病毒分别编码的miR-UL112-1、miR-K12 cluster、pri-miR-BART2都能靶向作用于主要组织相容性复合体Ⅰ类分子相关链B(major histocompatibility complex class Ⅰ-related chain B,MICB)基因,并抑制其表达,而MICB作为NK细胞激活受体NKG2D的配体,在促进NK细胞杀伤受感染的靶细胞过程中起关键作用,进而帮助病毒逃逸免疫清除[15,20,24]。对KSHV进一步研究发现,其编码的miR-K12-1,3,4-3p能够同时靶向并上调作为细胞凋亡重要调控因子的半胱天冬酶3的表达,间接促进细胞凋亡,有利于病毒逃逸[25]。同为疱疹病毒的PRV在感染PK-15细胞后不同时间,其编码的prv-miR-LLT11a呈极显著差异性表达,提示其可能参与了病毒与宿主的互作过程。
目前,对miRNA的研究主要集中在基因调控方面,对其在病毒感染期间的表达时相研究还比较少。而对于miRNA表达时相的研究有助于发掘差异性表达显著的miRNA,此类miRNA极有可能参与基因调控影响病毒与宿主的相互作用,研究miRNA的表达时相可以进一步筛选出病毒感染期间表达差异性显著的miRNA,对后续研究其基因调控功能以及揭示调控机制都是必要的。本研究采用茎环引物RT-qPCR检测发现,prv-miR-LLT11a在PRV QBA株感染PK-15细胞后呈极显著的差异性表达,这可能与病毒的免疫逃逸与潜伏有关,为下一步研究prv-miR-LLT11a的基因调控功能奠定了基础。
[1] Pomeranz L E,Reynolds A E,Hengartner C J.Molecular biology of pseudorabies virus:Impact on neurovirology and veterinary medicine[J].Microbiology and Molecular Biology Reviews,2005,69(3):462-500.
[2] Roizman B,Zhou G,Du T.Checkpoints in productive and latent infections with herpes simplex virus 1:Conceptualization of the issues[J].Journal of Neurovirology,2011,17(6):512-517.
[3] 刘芳,张冲,王寅彪,等.猪伪狂犬病毒gD蛋白抗原表位的克隆及表达[J].河南农业科学,2016,45(4):122-125.
[4] 顾阳,高晓云,程琨,等.鉴别猪伪狂犬病病毒强毒与疫苗毒双重PCR检测方法的建立[J].华北农学报,2014,29(2):94-97.
[5] Klupp B G,Hengartner C J,Mettenleiter T C,etal.Complete,annotated sequence of the pseudorabies virus genome[J].Journal of Virology,2004,78(1):424-440.
[6] 杨庆芳,宁官保,李俊达.猪伪狂犬病病毒的分离鉴定[J].山西农业科学,2011,39(8):886-889.
[7] 高晓云,顾阳,潘鑫龙,等.猪伪狂犬病病毒河南分离株gE全基因的克隆与序列分析[J].华北农学报,2015,30(1):137-141.
[8] 韩伟,丁伯良,王英珍,等.猪伪狂犬病病毒的分离鉴定[J].天津农业科学,2009,15(3):4-6.
[9] 解伟涛,梁跃,乔松林,等.2014—2016年河南省猪伪狂犬野毒感染和免疫情况血清学调查[J]. 河南农业科学,2016,45(12):153-156.
[10] 徐引弟,张青娴,李建林,等.猪伪狂犬病毒、副猪嗜血杆菌和猪链球菌混合感染的病原分离与鉴定[J].河南农业科学,2015,44(9):100-104.
[11] 杨雯慧,闫文朝,吴志明,等.河南省猪伪狂犬病血清学调查与分析[J].河南农业科学,2015,44(9):108-111.
[12] Bartel D P.MicroRNAs:Genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[13] Hatziapostolou M,Polytarchou C,Aggelidou E,etal.An HNF4α-miRNA inflammatory feedback circuit regulates hepatocellular oncogenesis[J].Cell,2011,147(6):1233-1247.
[14] Zhu H,Shyh-Chang N,Segrè A V,etal.The Lin28/let-7 axis regulates glucose metabolism[J].Cell,2011,147(1):81-94.
[15] Nachmani D,Stern-Ginossar N,Sarid R,etal.Diverse herpesvirus microRNAs target the stress-induced immune ligand MICB to escape recognition by natural killer cells[J].Cell Host & Microbe,2009,5(4):376-385.
[16] Wu Y Q,Chen D J,He H B,etal.Pseudorabies virus infected porcine epithelial cell line generates a diverse set of host microRNAs and a special cluster of viral microRNAs[J].PLoS One,2012,7(1):e30988.
[17] Ambros V.The functions of animal microRNAs[J].Nature,2004,431(7006):350-355.
[18] Xu P,Vernooy S Y,Guo M,etal.The drosophila microRNA mir-14 suppresses cell death and is required for normal fat metabolism[J].Current Biology,2003,13(9):790-795.
[19] Chen C Z,Li L,Lodish H F,etal.MicroRNAs modulate hematopoietic lineage differentiation[J].Science,2004,303(5654):83-86.
[20] Tomari Y,Du T,Zamore P D.Sorting of drosophila small silencing RNAs[J].Cell,2007,130(2):299-308.
[21] Liu F,Zheng H,Tong W,etal.Identification and analysis of novel viral and host dysregulated microRNAs in variant pseudorabies virus-infected PK15 cells[J].PLoS One,2016,11(3):e0151546.
[22] Du T,Zhou G,Roizman B.Induction of apoptosis accelerates reactivation of latent HSV-1 in ganglionic organ cultures and replication in cell cultures[J].Proceedings of the National Academy of Sciences,2012,109(36):14616-14621.
[23] Jurak I,Hackenberg M,Kim J Y,etal.Expression of herpes simplex virus 1 microRNAs in cell culture models of quiescent and latent infection[J].Journal of Virology,2014,88(4):2337-2339.
[24] Stern-Ginossar N,Elefant N,Zimmermann A,etal.Host immune system gene targeting by a viral miRNA[J].Science,2007,317:376-381.
[25] Suffert G,Malterer G,Hausser J,etal.Kaposi’s sarcoma herpesvirus microRNAs target caspase 3 and regulate apoptosis[J].PLoS Pathog,2011,7(12):e1002405.
Effects on Temporal Expression of prv-miR-LLT11a in PK-15 Cells Infected by Pseudorabies Virus
YANG Li,SHI Ang,LI Xinguo,LI Shuangshuang,SHI Qinghe,ZHENG Guanmin,WANG Yuguo,CHEN Lu*,WANG Chuanqing
(College of Animal Husbandry and Veterinary,Henan Agricultural University,Zhengzhou 450002,China)
In order to study the pathogenic mechanism of pseudorabies virus(PRV),PK-15 cells were infected with PRV QBA strain at 0.5 MOI,and cells were harvested and microRNA(miRNA) were extracted at 0,1,2,4,6,8,12,24 hours post infection(hpi).Then the temporal expression of prv-miR-LLT11a was detected by stem-loop real-time quantitative PCR(RT-qPCR).The amplification results of RT-qPCR showed that the melting curve had a single peak and a clear inflection point.RT-qPCR data showed that the expression of prv-miR-LLT11a remarkably significant increased in PK-15 cells after 1 hour infection with PRV QBA strain,then decreased.Its expression level decreased to the lowest level at 6 hpi,and increased significantly after 8 hpi.
PRV; prv-miR-LLT11a; stem-loop RT-qPCR; temporal expression
2016-12-22
国家自然科学基金项目(31272567);河南省高校科技创新人才支持计划项目(14HASTIT022);河南省高校科技创新团队支持计划项目(14IRTSTHN015)
杨 利(1989-),男,河南汝南人,在读硕士研究生,研究方向:病毒分子生物学。E-mail:yangli8189@163.com
*通讯作者:陈 陆(1971-),男,河南罗山人,教授,博士,主要从事动物传染病发病机理与防控研究。 E-mail:chenluhau@126.com
S855.3
A
1004-3268(2017)06-0120-05
