生防外生菌根真菌的筛选及其生长和发酵条件优化
2017-07-05杜颐林张旭辉
杜颐林,张旭辉,李 勇
(西南大学 资源环境学院,重庆 400715)
生防外生菌根真菌的筛选及其生长和发酵条件优化
杜颐林,张旭辉,李 勇*
(西南大学 资源环境学院,重庆 400715)
为了筛选具有广谱拮抗活性的外生菌根真菌,采用平板对峙法(初筛)和生长速率法(复筛)测定了6种外生菌根真菌对5种常见植物病原真菌的抑制活性,通过单因素试验对抑制效果较好的生防菌进行生长及发酵条件优化。结果表明,彩色豆马勃Pt01在初筛试验中对植物病原真菌的抑菌率为40.1%~49.7%,在复筛试验中抑菌率为78.5%~91.8%,抑菌作用整体高于其他外生菌根真菌。条件优化后发现,Pt01在28 ℃、pH值为7.0、碳源为乳糖、氮源为硝酸钾时生长最好;其最佳发酵条件:温度为30 ℃,初始pH值为6.0,碳源为乳糖,氮源为酵母膏,时间为5 d,转速对不同病原真菌抑菌率各有不同影响,需要单独考虑最佳转速。彩色豆马勃菌株Pt01对5种受试病原真菌均有明显的抑制作用,优化其生长和发酵条件为其在植物病害防治上的应用提供了理论依据。
外生菌根真菌; 筛选; 植物病原真菌; 抑制作用; 条件优化
外生菌根真菌是一种十分丰富的资源,不仅能增大宿主根系的吸收面积[1-3],改善植物营养[4-6],调节植物代谢,提高植物产品品质[7-9],而且可以通过重寄生作用,或产生多种酶类物质、抗生素和挥发性物质,抑制病原菌,增强植物抗病能力[10-11]。此外,利用外生菌根真菌研发生物农药,不仅毒性小、残留低,而且不易使病原菌产生抗药性[12],外生菌根真菌在生物防治、生态稳定和环境安全等方面所表现出的巨大研究潜力和应用价值愈发引起人们的关注。
外生菌根真菌在防治植物病害、提高植物抗病能力方面的研究日益丰富。栾庆书等[10]研究表明,彩色豆马勃(Pisolithustinctorius)能够抑制立枯丝核菌(Rhizoctoniasolani)生长。吴小芹等[13]研究发现,彩色豆马勃对松枯梢病菌(Sphaeropsissapinea)有明显抑制作用。赵志鹏等[14]发现,灰褐牛肝菌(Boletusgriseus)对立枯丝核菌有明显的拮抗作用。但是,目前国内发现的生防菌株基本上均是对单一病原真菌具有防治效果,具有广谱抑菌活性的生防外生菌根真菌研究较少,尤其是对核盘菌、拟盘多毛孢菌、柑橘炭疽病菌等均有抑制作用的生防真菌尚未见报道。为此,从保存的生防外生菌根真菌中筛选对柑橘炭疽病菌等5种病原真菌均有显著拮抗效果的生防菌株,并对其生长和发酵条件进行优化,旨在为补充广谱抑菌的生防菌资源及其实际生产应用提供科学依据。
1 材料和方法
1.1 材料
1.1.1 供试菌株 外生菌根真菌:采自四川西昌的彩色豆马勃Pt715、采自云南普洱的彩色豆马勃Pt01、采自云南普洱的松乳菇(Lactariusdeliciosus)Srg01、采自重庆缙云山的松乳菇LD2、采自重庆金佛山的褐环乳牛肝菌(Suillusluteus)N7、采自内蒙古大青山的网纹灰包(Lycoperdonperlatum)LP。以上菌株均保存于西南大学资源环境学院微生物学实验室。
植物病原真菌:柑橘炭疽病菌(Colletotrichumgloeosprioides)、油菜核盘菌(Sclerotiniasclerotiorum),松立枯丝核菌(Rhizoctoniasolani)、西瓜蔓枯病菌(Didymellabryoniae)、拟盘多毛孢菌(Pestalotiopsisversicolor)。以上菌株均由西南大学植物生态病理研究所惠赠。
1.1.2 培养基 外生菌根真菌生长培养基:KH2PO41.0 g、MgSO4·7H2O 0.5 g、葡萄糖20 g、酒石酸铵0.5 g、维生素B10.1 g、琼脂15~20 g、微量元素混合液[8.45 mg/L H3BO3、5 mg/L MnSO4、6 mg/L FeSO4、0.625 mg/L CuSO4、2.77 mg/L ZnCl2、0.27 mg/L (NH4)2MoO4,pH值5.5] 1.0 mL,蒸馏水定容至1 000 mL。
外生菌根真菌液体发酵培养基:KH2PO41.0 g、MgSO4·7H2O 0.5 g、葡萄糖20 g、酒石酸铵0.5 g、维生素B10.1 g、微量元素混合液1.0 mL,蒸馏水定容至1 000 mL。
PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂15~20 g,蒸馏水定容至1 000 mL。
PDA改良培养基:马铃薯200 g、葡萄糖20 g、琼脂15~20 g、KH2PO41.0 g、MgSO4·7H2O 0.5 g、酒石酸铵0.5 g、维生素B10.1 g、微量元素混合液1.0 mL,蒸馏水定容至1 000 mL。1.2 生防外生菌根真菌的筛选
为了逐步规范院区的各项收费和结算工作,财务部门会同相关部门和单位共同完成了院区 “一卡通”结算中心的搭建工作,并委托物业公司负责系统前台的运行和管理,软件负责后台数据的运维和上传。为全院职工办理园区卡,实现餐卡的充值和消费。并设计将院区的各项收费业务逐步纳入结算系统进行管理,统一纳入财务信息系统集中管理,加强对收费和结算工作的核实和监督,不断提高服务全院的水平。
1.2.1 初筛 采用平板对峙法[15],将活化的外生菌根真菌和病原真菌打成直径5 mm的菌饼,分别接种在相距3 cm处的PDA改良培养基上,构成两点对峙,以只接病原真菌菌饼的培养基为空白对照,28 ℃恒温培养5 d后观察,通过十字交叉法测量病原真菌的菌落直径,并计算抑菌率[16]。每个处理重复3次,根据抑菌率的大小,筛选出拮抗效果良好的菌株。抑菌率=(对照菌落直径-处理菌落直径)/对照菌落直径×100%。
1.2.2 复筛 选取初筛试验中对病原真菌拮抗能力较强的外生菌根真菌,采用生长速率法[17]测定其无菌发酵液的抑菌活性。将5块直径5 mm的生防菌菌饼接种到外生菌根真菌发酵培养基中,25 ℃、180 r/min摇床培养3 d后,8 500 r/min离心15 min,上清液用0.22 μm的无菌滤膜过滤,得到无菌滤液。然后按体积1∶5的比例加入冷却至50 ℃的外生菌根真菌生长培养基中,制备成混合培养基,冷却彻底后,将直径为5 mm的病原真菌菌饼接到平板中央,以未接种外生菌根真菌的无菌发酵液为对照组,于28 ℃恒温培养3 d后,按照1.2.1的方法计算抑菌率。每个处理重复3次,根据抑菌率的大小,筛选出抑菌活性较强的生防菌株。
1.3 生防菌株培养条件的优化
研究不同温度、pH值、碳源、氮源对生防菌株生长的影响:在其他培养条件不变的情况下,将筛选得到的拮抗效果良好的菌株分别置于20 ℃、25 ℃、28 ℃、30 ℃和35 ℃下培养;分别调整培养基pH值为5.0、6.0、7.0和8.0;以20 g/L的添加量,分别用蔗糖、葡萄糖、麦芽糖和乳糖为菌株生长提供碳源;以0.5 g/L的添加量,分别用硝酸钾、硝酸铵、酵母膏和蛋白胨替代生长培养基中的酒石酸铵,为菌株生长提供氮源。每个处理重复3次,采用十字交叉法于培养3 d后测量菌落直径,以菌落大小表征生长优劣。
1.4 生防菌株发酵条件优化
采用单因素试验对生防菌株的发酵条件包括发酵温度、初始pH值、碳源、氮源、转速和发酵时间进行优化研究。设置不同发酵温度(25、28、30、35 ℃)、不同初始pH值(5.0、6.0、7.0、8.0)、不同碳源(蔗糖、葡萄糖、麦芽糖、乳糖)、不同氮源(硝酸钾、硝酸铵、酵母膏、蛋白胨)、不同转速(100、140、180、220 r/min)、不同发酵时间(3、5、7、9 d)进行发酵,以考察发酵条件对生防菌株抑菌活性的影响。按照1.2.2的方法得到生防菌株无菌滤液,然后移取3 mL无菌滤液至24 mL的外生菌根真菌生长培养基中,制备成混合培养基,冷却后将直径为5 mm的病原真菌菌饼接到平板中央,以未接种外生菌根真菌的无菌发酵液为对照组,每组处理均设3次重复,参照1.2.1的方法计算得到不同发酵条件下的抑菌率。
1.5 数据处理与分析
试验数据均采用SPSS 21.0统计软件进行统计分析,采用单因素方差分析进行均值差异显著性检验,Duncan’s法进行多重比较;应用Excel 2007进行图表制作。
2 结果与分析
2.1.1 初筛 由表1可知,通过平板对峙初筛,得到3株拮抗效果较好的生防菌株N7、Pt01和Srg01。其中,菌株N7对柑橘炭疽病菌和西瓜蔓枯病菌的抑菌率最高,分别为42.6%、52.9%;菌株Pt01对油菜核盘菌、松立枯丝核菌和拟盘多毛孢菌的抑菌率最高,分别为44.4%、45.3%、49.7%;菌株Srg01对5种植物病原真菌也均有较高的抑菌率,为30.0%~49.7%。因此,可以初步确定Srg01、Pt01和N7为目标生防菌株。

表1 外生菌根真菌对病原真菌的抑菌率 %
注:在同一列中不同字母表示处理间差异显著(P<0.05),下同。
2.1.2 复筛 表2结果显示,在复筛试验中菌株Pt01对5种病原真菌均有较强的抑制作用,其中,对油菜核盘菌的抑菌率最高,达到91.8%,对其他病原真菌的抑菌率为78.5%~88.1%,均高于另2株生防真菌。综合分析,确定菌株Pt01为最有效的生防外生菌根真菌。
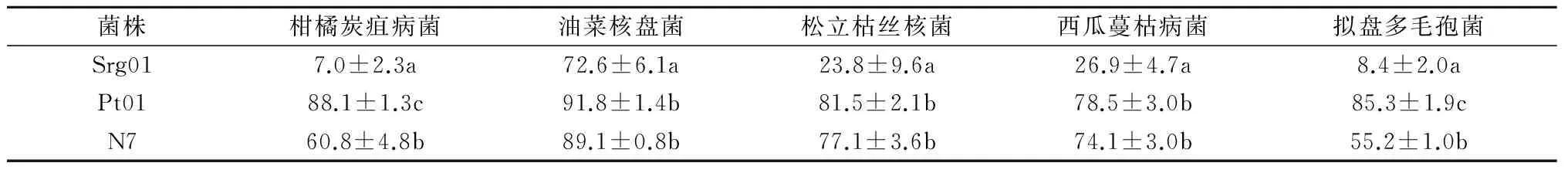
表2 优良菌株无菌发酵滤液对病原真菌的抑菌率 %
2.2 生防菌株Pt01培养条件的优化结果
2.2.1 温度对生防菌株生长的影响 如图1所示,外生菌根真菌Pt01的菌落直径随着温度的升高,呈现出先增加后降低的趋势,在28 ℃条件下达到最大,说明其最适生长温度为28 ℃,属于典型的中温菌。Pt01在35 ℃下几乎不能正常生长,可能是温度过高对菌株体内的代谢酶产生负面影响,抑制了其生长。
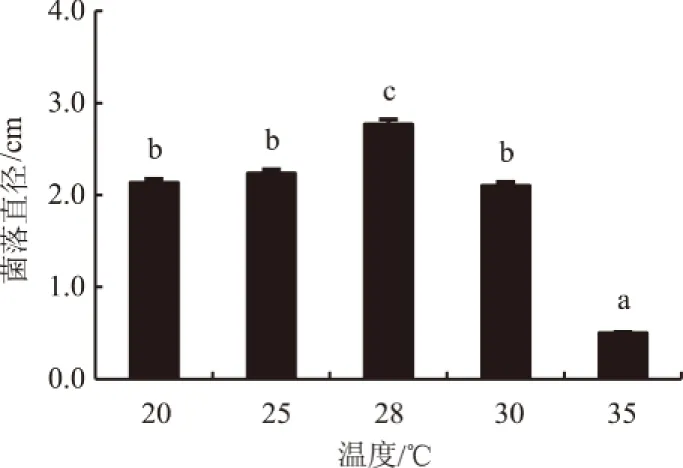
不同字母表示处理间差异显著(P<0.05),下同
2.2.2 pH值对生防菌株生长的影响 由图2可知,在pH值5.0~8.0范围内,菌株Pt01均能生长,但其在pH值为5.0和6.0时菌落较小,分别为1.8 cm和1.9 cm,并且与另外2个处理间均差异显著(P<0.05);pH值为7.0时,菌株Pt01的菌落直径最大,达到3.2 cm,与pH值8.0处理达到显著差异水平。因此,菌株Pt01最适生长pH值为7.0。
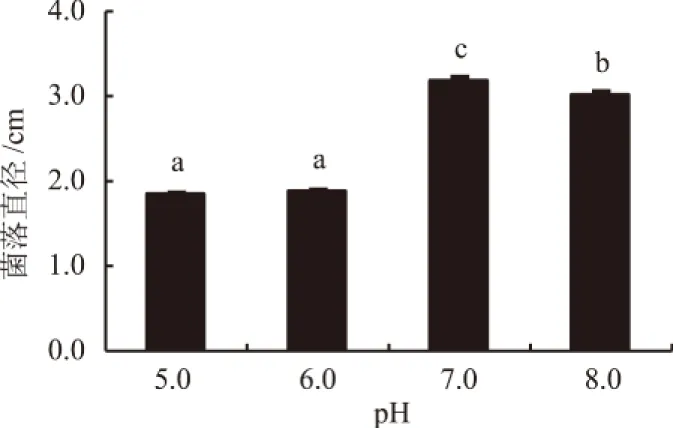
图2 pH值对生防菌株Pt01生长的影响
2.2.3 碳源对生防菌株生长的影响 图3显示,菌株Pt01能利用所有供试碳源,但其最适碳源为乳糖,此时菌落直径为3.3 cm,分别是蔗糖、葡萄糖和麦芽糖的1.27倍、1.50倍和1.32倍。
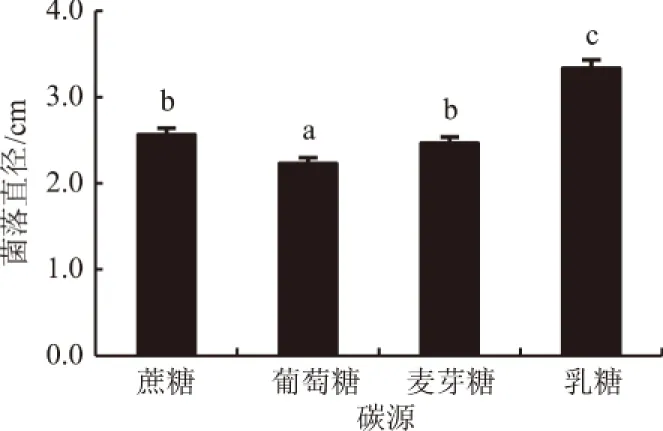
图3 碳源对生防菌株Pt01生长的影响
2.2.4 氮源对生防菌株生长的影响 图4结果表明,菌株Pt01能利用所有供试氮源,但其最适氮源为硝酸钾,此时菌落直径为3.5 cm,分别是硝酸铵、酵母膏和蛋白胨的1.21倍、1.10倍和1.17倍。
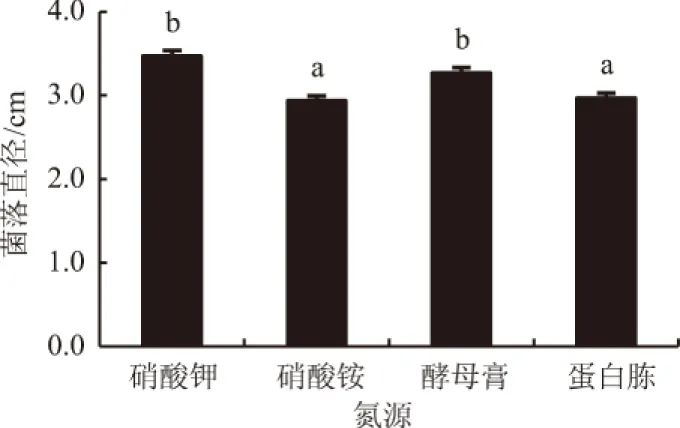
图4 氮源对生防菌株Pt01生长的影响
2.3 生防菌株Pt01发酵条件的优化结果
2.3.1 发酵温度对生防菌株无菌发酵液抑菌活性的影响 如图5所示,随着温度的升高,菌株Pt01发酵液对供试病原真菌的抑菌率先升高后降低,在30 ℃时抑菌率均达到最大,在此温度下,菌株Pt01发酵滤液对油菜核盘菌、松立枯丝核菌、西瓜蔓枯病菌的抑菌率分别为42%、49%、57%,对柑橘炭疽病菌和拟盘多毛孢菌的抑菌率分别为37%、17%。30 ℃处理的抑菌率与其他温度处理间均达到显著差异水平(P<0.05),表明菌株Pt01的最佳发酵温度为30 ℃。

图5 发酵温度对菌株Pt01无菌发酵液抑菌活性的影响
2.3.2 初始pH值对生防菌株无菌发酵液抑菌活性的影响 在一定范围内,菌株Pt01发酵液对供试病原真菌的抑菌率随着pH值的升高表现出先升高后降低的趋势(图6),当pH值为6.0时抑菌率均达到最高,其对松立枯丝核菌、西瓜蔓枯病菌、柑橘炭疽病菌和拟盘多毛孢菌的抑菌率分别达到了69%、51%、50%、45%,与其他pH值处理间均达到显著差异水平(P<0.05),表明菌株Pt01发酵的最适初始pH值为6.0。
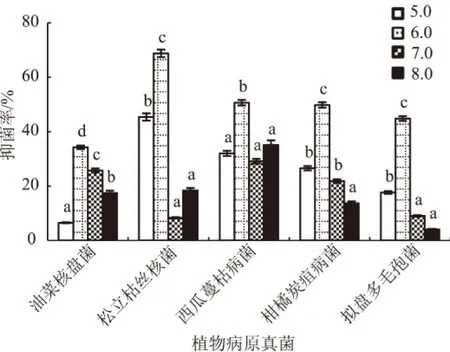
图6 初始pH值对菌株Pt01无菌发酵液抑菌活性的影响
2.3.3 不同碳源对生防菌株无菌发酵液抑菌活性的影响 图7结果显示,在4种供试碳源中,以乳糖作为碳源时菌株Pt01发酵液的抑菌效果最好,此时,其对西瓜蔓枯病菌、拟盘多毛孢菌和柑橘炭疽病菌的抑菌率分别是68%、43%、40%。因此,选用乳糖作为菌株Pt01的发酵碳源。

图7 不同碳源对菌株Pt01无菌发酵液抑菌活性的影响
2.3.4 不同氮源对生防菌株无菌发酵液抑菌活性的影响 如图8所示,以酵母膏作为氮源时,菌株Pt01发酵液对5种病原真菌的抑菌活性均达到最大值,其中对西瓜蔓枯病菌的抑菌率可以达到69%,显著高于其他处理的抑菌率(P<0.05)。因此,选择酵母膏作为生防菌株Pt01的最佳发酵氮源。

图8 不同氮源对菌株Pt01无菌发酵液抑菌活性的影响
2.3.5 转速对生防菌株无菌发酵液抑菌活性的影响 由图9可知,菌株Pt01发酵液对不同病原真菌产生最高抑菌率时转速各不相同。转速为100 r/min时,Pt01对油菜核盘菌和拟盘多毛孢菌的抑菌率最高;转速为140 r/min时,对松立枯丝核菌和柑橘炭疽病菌的抑菌率最高;而当转速为220 r/min时,其对西瓜蔓枯病菌的抑菌率最高,达到73%。但不同真菌最高抑菌率所对应的转速处理与其他处理间均达到显著差异水平(P<0.05)。不同转速对不同病原真菌具有不同的影响,因此,需要分别考虑转速以达到理想的效果。
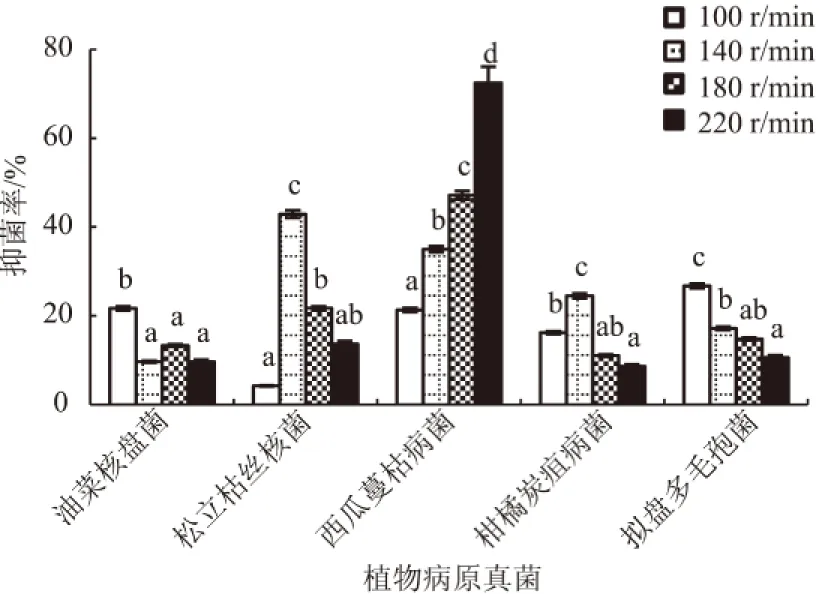
图9 转速对菌株Pt01无菌发酵液抑菌活性的影响
2.3.6 发酵时间对生防菌株无菌发酵液抑菌活性的影响 在一定范围内,菌株Pt01发酵液的抑菌率随着发酵时间的延长表现出先升高后降低的趋势(图10),其对拟盘多毛孢菌的抑菌率在发酶7 d时最大,达到43.2%,与其他时间处理间达到显著差异水平(P<0.05),而对另外4种病原真菌的抑菌率均在发酶5 d时达到最大,随后开始逐渐降低,其原因可能是超过5 d后,菌株的生长进入衰退阶段,使得抑菌活性大大降低。综合考虑,确定最适发酵时间为5 d,但若仅针对拟盘多毛孢菌,菌株Pt01的最适发酵时间为7 d。

图10 发酵时间对菌株Pt01无菌发酵液抑菌活性的影响
3 结论与讨论
利用外生菌根真菌防治植物病害已有较多研究,但关于其生长和发酵条件的研究相对较少,这是因为外生菌根真菌受外界众多的环境因子(如pH值、温度、重金属、盐浓度以及营养元素的供给等)影响较大[18],不能具体确定其最适条件,只能比较某一时期或相对条件下的生防效果。外生菌根真菌的生长和代谢是保证其发挥高效生防作用的基础,其抑菌活性的高低与培养条件密切相关。栾竹青等[19]采用单因素试验对乳牛肝菌发酵条件进行优化后,其生长状况显著改善。张扬等[20]对红绒盖牛肝菌发酵条件进行优化,发现其发酵液对杨树溃疡病的防治效果有所提高。
本研究通过平板对峙法和生长速率法筛选得到一株对5种常见病原真菌拮抗效果明显的外生菌根真菌Pt01,其发酵液对油菜核盘菌的抑菌率高达91.8%,对柑橘炭疽病菌、松立枯丝核菌、拟盘多毛孢菌的抑菌率也均在80%以上。为了实现生防菌株Pt01的应用,对其生长和发酵条件进行优化,确定了最适生长条件:温度为28 ℃,pH值为7.0,碳源为乳糖,氮源为硝酸钾;最佳发酵条件:发酵温度为30 ℃,初始pH值为6.0,碳源为乳糖,氮源为酵母膏,发酵时间为5 d,转速对不同病原真菌具有不同的影响,需要分别考虑最适转速。
生防菌从试验阶段到田间应用是一个复杂的过程,试验条件下获得的拮抗效果较为理想的生防菌株,能否在田间发挥高效生防作用,并保持稳定增殖,甚至形成优势种群,这是生防菌大规模商品化应用需要考虑的关键因子[21-23]。因此,对于本研究筛选到的生防外生菌根真菌,需要进一步研究定殖特性、田间防效及生物安全性等。
[1] 李月蛟,朱利英,尹华军,等.连续三年夜间增温和施氮对云杉外生菌根及菌根真菌多样性的影响[J].生态学报,2015,35(9):2967-2977.
[2] 王琴.外生菌根及其在现代林业中的应用[J].辽宁林业科技,2014(1):32-35.
[3] 宋微,吴小芹,叶建仁.6种外生菌根真菌对895杨矿质营养吸收的影响[J].南京林业大学学报(自然科学版),2011,35(2):35-38.
[4] 刘润进,陈应龙.菌根学[M].北京:科学出版社,2007.
[5] 王艺,丁贵杰.外生菌根对马尾松幼苗生长、生理特征和养分的影响[J].南京林业大学学报(自然科学版),2013,37(2):97-102.
[6] 崔磊,穆立蔷.黑龙江省紫椴典型分布区外生菌根形态与解剖特征[J].生态学杂志,2014,33(9):2490-2500.
[7] Zhang Y,Xu Y Z,Zheng Z X,etal.Analyses of diversity and distribution characteristics of macrofungi in Huafo Mountain Nature Reserve of Yunnan province[J].Journal of Plant Resources and Environment,2012,21(1):111-117.
[8] 樊永军,闫伟,王黎元.贺兰山地区青海云杉外生菌根的形态[J].林业科学,2011,47(6):108-113.
[9] Liang Y,Guo L D,Ma K P.Spatial pattern of the most common late stage ectomycorrhizal fungi in a subtropical forest in Dujiangyan,Southwest of China [J].Acta Botanica Sinica,2004,46(1):29-34.
[10] 栾庆书,吴元华,白慧敏.外生菌根真菌对病原菌拮抗作用机理研究进展[J].辽宁林业科技,2009(5):52-54.
[11] Sen R.Multitrophic interactions between aRhizoctoniasp.and mycorrhizal fungi affect Scots pine seedling performance in nursery soil [J].New Phytologist,2001,152(3):543-553.
[12] 宋秀杰,郝国防.生物农药及生物防治[J].环境保护,2002(6):28-30.
[13] 吴小芹,孙民琴,高悦,等.几种外生菌根菌对松苗抗非根部病害的影响[J].林业科学,2007,43(6):88-93.
[14] 赵志鹏,郭秀珍.外生菌根真菌纯培养中生理活性物质代谢的研究[J].林业科学,1990,26(5):465-469.
[15] 方中达.植病研究方法[M].北京:农业出版社,1998:376-377.
[16] 曹明慧,冉炜,杨兴明,等.烟草黑胫病拮抗菌的筛选及其生物效应[J].土壤学报,2011,48(1):151-159.
[17] 廖庭,秦健,袁高庆,等.巨大芽孢杆菌B196菌株抑菌物质的分离纯化[J].植物保护,2014,40(2):16-21.
[18] 温祝桂,陈亚华.中国外生菌根真菌研究进展[J].生物技术通报,2013(2):22-30.
[19] 栾竹青,由翠荣,梁丽琨,等.乳牛肝菌发酵条件的优化[J].河南大学学报(自然科学版),2016,46(4):430-437.
[20] 张扬,叶建仁,赵阳,等.红绒盖牛肝菌发酵条件及对杨树溃疡病的防治效果[J].森林与环境学报,2016,36(4):397-403.
[21] 张华,赵辉,王鹏涛,等.解淀粉芽孢杆菌B10-26抑菌物质的稳定性研究与初步分离纯化[J].河南农业科学,2014,43(5):93-96.
[22] Benizri E,Baudoin E,Guckert A.Root colonization by inoculated plant growth-promoting rhizobacteria[J].Biocontrol Science and Technology,2001,11(5):557-574.
[23] Bloemberg G V,Lugtenberg B J.Molecular basis of plant growth promotion and biocontrol by rhizobacteria[J].Current Opinion in Plant Biology,2001,4(4):343-350.
Screening of Antagonistic Ectomycorrhizal Fungi and Optimization of Growth and Fermentation Conditions
DU Yilin,ZHANG Xuhui,LI Yong*
(College of Resources and Environment,Southwest University,Chongqing 400715,China)
In order to screen ectomycorrhizal fungi with a broad spectrum of antagonistic activity,the dual culture assay and growth rate method were performed for determining the inhibitory efficacy of six ectomycorrhizal fungi against five kinds of common plant pathogenic fungi.Subsequently,the growth and fermentation conditions of the strain with a higher inhibitory rate to pathogenic fungi were optimized through the single factor experiment.The results showed thatPisolithustinctoriusPt01 had a better inhibitory efficacy against all the plant pathogenic fungi.In confrontation culture,the inhibitory rates of Pt01 against five kinds of plant pathogenic fungi were from 40.1% to 49.7%,while the inhibitory rates were from 78.5% to 91.8% with growth rate method.After optimized,the growth conditions of Pt01 were temperature of 28 ℃,initial pH of 7.0,lactose as carbon source,and potassium nitrate as nitrogen source.Additionally,the optimum fermentation conditions of Pt01 were temperature of 30 ℃,initial pH of 6.0,lactose as carbon source,yeast extract as nitrogen source,fermentation time of 5 d.The highest inhibitory rates of Pt01 to different pathogenic fungi were obtained at different rotational speed,so rotational speed was necessary to be considered separately for achieving the best inhibitory effect.These results demonstrated that Pt01 had obvious inhibition against five kinds of pathogenic fungi,and the optimization of its growth and fermentation conditions could provide theoretical basis for its application in the prevention and control of plant diseases.
ectomycorrhizal fungi; screening; plant pathogenic fungi; inhibitory efficacy; condition optimization
2016-11-23
西南大学本科生科技创新基金项目(20152402007)
杜颐林(1997-),男,山西忻州人,在读本科生,研究方向:环境微生物。E-mail:441846373@qq.com
*通讯作者:李 勇(1973-),男,四川西昌人,副教授,博士,主要从事环境微生物研究。E-mail:Liyongwf@swu.edu.cn
S476.1
A
1004-3268(2017)06-0074-06
