猪囊尾蚴半胱氨酸蛋白酶TsCL-1动态结构柔性分析研究
2017-07-03杨琳朱月勋杨艳超赵琴平杨力权
杨琳,朱月勋,杨艳超,赵琴平,杨力权*
(1.武汉大学基础医学院,武汉430071;2.云南省大理白族自治州血吸虫病防治研究所,云南大理671000;3.大理大学农学与生物科学学院,云南大理671003)
猪囊尾蚴半胱氨酸蛋白酶TsCL-1动态结构柔性分析研究
杨琳1,2,朱月勋3,杨艳超3,赵琴平1,杨力权3*
(1.武汉大学基础医学院,武汉430071;2.云南省大理白族自治州血吸虫病防治研究所,云南大理671000;3.大理大学农学与生物科学学院,云南大理671003)
通过对猪囊尾蚴半胱氨酸蛋白酶TsCL-1的结构模型进行分子动力学模拟,并对其进行模拟过程中的结构稳定性和动态结构柔性分析。结果表明,模拟过程中TsCL-1总体结构相对稳定;分子的结构骨架具有较小的波动,而分子的表面环区和底物结合区域则具有较大的波动和较强的构象柔性。研究结果将为进一步深入研究TsCL-1的动力学行为和功能关系奠定基础。
半胱氨酸蛋白酶TsCL-1;分子动力学模拟;动态结构柔性;结构功能研究
猪带绦虫(Taenia solium),是一种以猪、人和其他杂食或草食动物为中间宿主,以人为唯一终末宿主的带科绦虫寄生虫〔1〕。猪囊尾蚴病(Cysticercosis cellulosae)是由猪带绦虫的幼虫猪囊尾蚴(Cysticercus cellulose)在中间宿主体内肌肉或组织内寄生,而引起的一种疾病〔1-2〕。猪囊尾蚴幼虫寄生于人体的位置和数量不同,会导致不同的临床症状。该病是一种危害严重、分布广泛的人兽共患寄生虫病〔1〕,给人类健康带来严重危害〔3〕。
研究表明,由寄生虫分泌的半胱氨酸蛋白酶(Cysteine Protease,CP)不仅是寄生虫入侵宿主的因子之一〔4〕,也可能在寄生虫免疫逃避机制及寄生虫治疗中有着重要作用〔4-6〕。半胱氨酸蛋白酶TsCL-1是由猪囊尾蚴分泌的一种半胱氨酸蛋白酶,属于半胱氨酸蛋白酶CA蛋白酶中的C1族蛋白酶。由于其晶体结构未被测定,因此对其与宿主相互作用机制还未进行广泛深入的研究。本课题组之前通过同源模建技术构建了猪囊尾蚴半胱氨酸蛋白酶TsCL-1的三维结构模型并对其进行了结构分析〔7〕。通过对TsCL-1三维结构模型的构建及分析,得以对TsCL-1的空间结构及与功能的关系进行初步研究。但是,由于蛋白质生物学功能的行使是一个动态的过程,其功能的发挥根植于蛋白质的动力学行为〔8〕。因此,仅仅研究蛋白质的静态空间结构并不能全面地反映蛋白质结构与功能的关系,还需要进一步分析其动力学行为才能深入理解结构-功能间的关系。分子动力学模拟(Molecular dynamics simulations),是目前一种在分子水平通过动力学模拟手段研究生物大分子结构和动力学关系的有效手段〔9-10〕。通过分子动力学模拟可以得到体系内任意时刻各原子的位置和速度,当分子结构稳定且模拟时间足够长时,便可得到较好的随时间变化的分子结构动力学轨迹〔11〕。
本文通过对猪囊尾蚴半胱氨酸蛋白酶TsCL-1的结构模型进行分子动力学模拟,并对其动力学模拟轨迹及动态结构特征进行分析,研究其模拟过程中的总体和局部动力学特征和构象柔性,以及这些结构动力学性质对功能发挥的可能影响。本文结果将进一步为在分子水平上揭示猪囊尾蚴虫半胱氨酸蛋白酶与宿主的相互作用机制和致病机理奠定基础。
1 材料和方法
1.1 材料本文采用课题组之前通过同源模建技术构建的猪囊尾蚴半胱氨酸蛋白酶TsCL-1的三维结构模型进行动力学模拟〔7〕。TsCL-1的结构模型具备半胱氨酸蛋白酶CA族典型的α∕β折叠模式,结构骨架主要由两个不同的结构域所组成,一个以α-螺旋为主要结构的L区(L domain),另一个以反平行β片层为主要结构的R区(R domain),催化三聚体(Cys25-His163-Asn183)位于两个结构域的表面〔12-13〕,结构模型中存在3对二硫键,分别由Cys22和Cys65、Cys56和Cys97、Cys156和Cys205构成。见封三图4。
1.2 动力学模拟方法及步骤本文对半胱氨酸蛋白酶TsCL-1的分子动力学模拟研究由Gromacs 4.6软件包〔14-15〕完成。具体步骤为:首先将同源模建得到的半胱氨酸蛋白酶TsCL-1结构模型加入一个四面体的溶剂框,接着向溶剂框中加入SPC水分子和抗衡离子,随后进行能量最小化处理(最陡下降和共轭梯度能量优化方法)以消除蛋白质与水分子间的立体化学冲突,两次能量最小化所使用的力场为GROMOS96 43a1力场,长程静电相互作用采用PME算法,非键项范德华相互作用的截断半径(cut-off)设定为1.4 nm,最陡下降能量优化的收敛力设定为1 000.0 kJ∕(mol·nm),共轭梯度能量优化的收敛力设定为100.0 kJ∕(mol·nm),体系分别在264步和484步达到收敛。然后,对系统进行400 ps的位置抑制性分子动力学模拟,长程静电相互作用采用PME算法,非键项范德华相互作用的截断半径设定为1.0 nm,压力保持在1标准大气压。最后,对体系进行生产分子动力学模拟。在生产分子动力学模拟中,长程静电相互作用采用PME算法,非键项范德华相互作用的截断半径为0.9 nm,压力保持在1标准大气压,温度设置为300 K,消除质量中心平移和转动的频率为10步,记录模拟轨迹的频率为10 ps。生产分子动力学模拟时间为50 ns,模拟所得的轨迹将用于对半胱氨酸蛋白酶TsCL-1结构的动力学行为和结构柔性分析。
2 结果
2.1 模拟过程中TsCL-1的结构稳定性分析本文在分子动力学模拟轨迹的基础上,通过分析蛋白质的动态结构特征或几何性质来研究蛋白质的动力学行为和结构柔性特点。在动态结构几何属性的分析中,RMSD(root-mean-square deviation)是采样结构与初始结构所有原子位置平均距离的均方根偏差,该值的大小反应了比较结构间构象差异程度的大小。RMSF(rootmean square fluctuation)是指原子的均方根波动,某个残基或原子的RMSF值越高,表明该原子具有更强的构象柔性。本文所得到的RMSD和RMSF值分别通过Gromacs软件包的g_rms和g_rmsf程序计算得到。见图1。
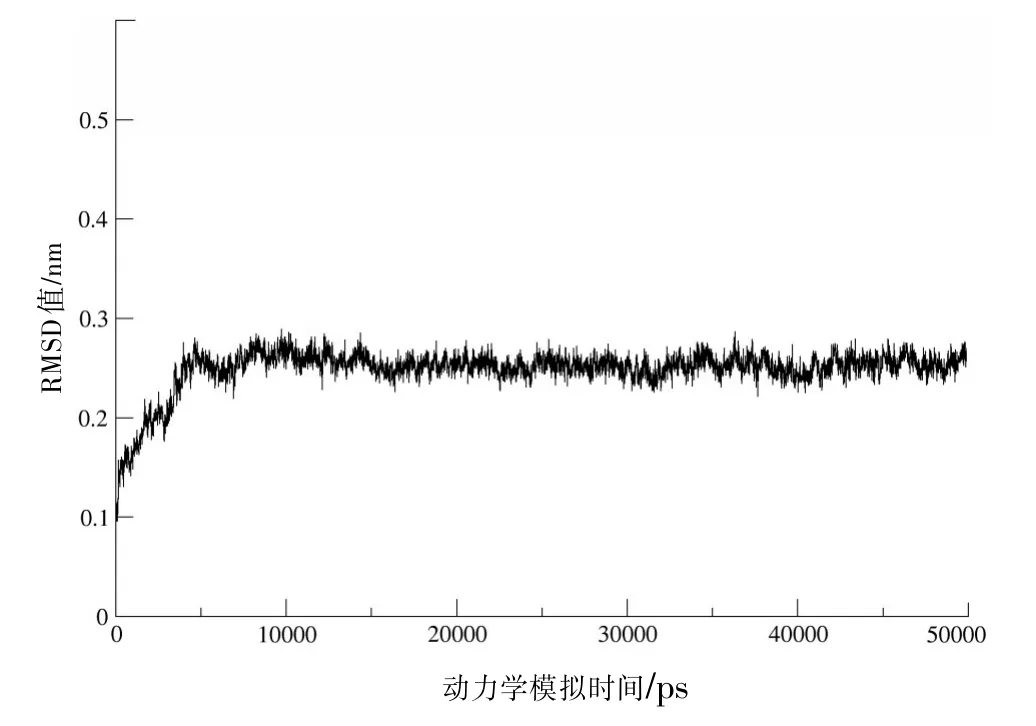
图1 TsCL-1分子模拟过程中相对于初始结构的RMSD值
图1中显示了以模拟时间为函数的TsCL-1蛋白酶模拟过程中骨架原子相对于初始结构的RMSD值变化情况。从图1中可以看出,RMSD值在前5 ns有一个明显的上升过程,在10 ns以后RMSD值较为稳定。因此我们选取10~50 ns的模拟轨迹为平衡轨迹,用于之后的动力学特征和结构柔性分析。平衡轨迹较小的波动说明模拟过程中TsCL-1的结构与初始结构没有较大的差异,模拟过程中TsCL-1的总体结构相对稳定。同时,经过计算,模拟过程中模拟结构的全原子(Allatom)、全骨架(Allbb)和二级结构骨架(SS bb)的RMSD平均值分别为3.32、2.49和1.94Å,这一结果说明模拟过程中二级结构最为稳定,而结构的波动主要是由连接二级结构的环区运动引起的。
2.2 模拟过程中TsCL-1的局部构象柔性分析在对TsCL-1模拟过程中的总体结构性质进行分析的基础上,我们通过分析计算TsCL-1在模拟过程中各氨基酸残基Cα原子的RMSF值来研究局部构象的柔性。见图2。从图2中可以看出,具有最大构象柔性的区域(RMSF>0.15)有:残基41-45,63-67,99-105,158-159和173-176。其中,残基63-67是底物结合区域S1和S3的主要组成部分,残基41-45是位于底物结合区域背面的环区,而残基99-105,158-159,173-176均为暴露于蛋白质分子表面的环区。具有较大构象柔性的区域(0.10<RMSF<0.15)为:残基1-3,10-12,19-22,91-98,109-111,138-147和215-216。残基1-3和215-216主要是N-端和C-末端,残基19-22是底物结合区域S1的主要组成部分,残基138-147包含底物结合区域S1’及其附近的区域,残基19-22,91-98和109-111是位于蛋白分子表面的环区。值得注意的是,在模拟过程中构成TsCL-1结构核心的主要二级结构元件具有相对较低的RMSF值(RMSF<0.10),也就是说在模拟过程中表现出了较高的结构刚性。
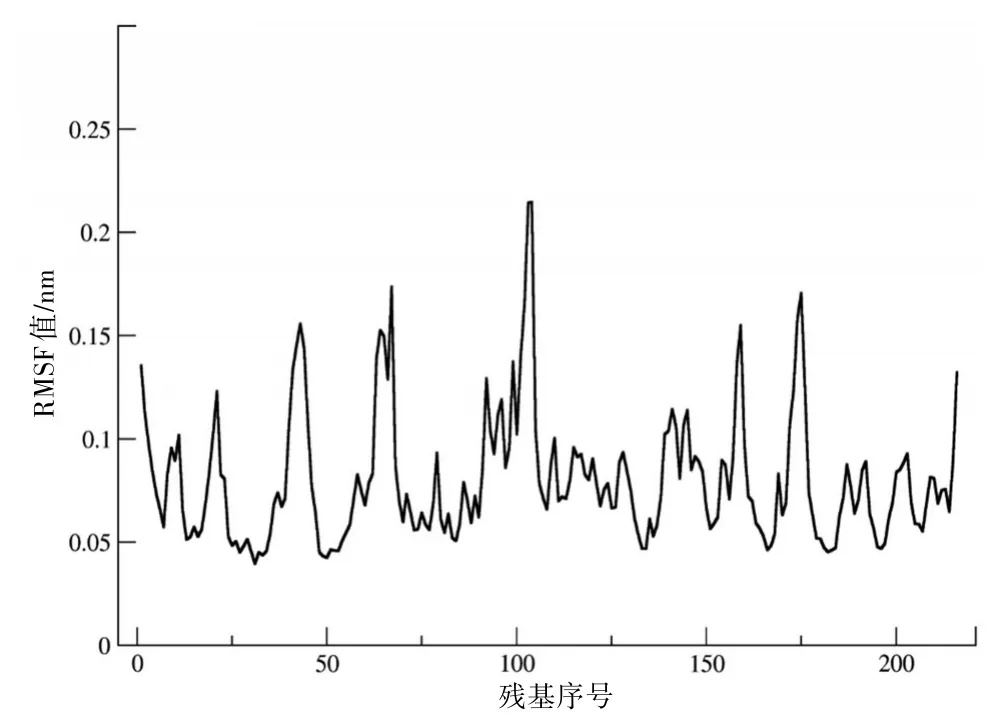
图2 TsCL-1模拟过程中氨基酸残基Cα原子的RMSF值
为了能更直观地观察出TsCL-1在模拟过程中,蛋白质分子不同结构部位波动的强弱,我们把模拟过程中各氨基酸残基的CαRMSF值投射到TsCL-1的三维结构上,得到了TsCL-1在模拟过程中不同结构部位的波动差异图〔16〕。见封三图5。从封三图5中可以直观的看出,模拟过程TsCL-1构象柔性较强(波动较大)的部位主要是表面环区、N-端和C-末端、底物结合部位及与底物结合部位附近的环区。
3 讨论
通过对同源模建构建的TsCL-1结构模型进行分析研究发现,TsCL-1为刚性相对较强的球状蛋白,与其他半胱氨酸蛋白酶CA家族的成员一样,TsCL-1具备半胱氨酸蛋白酶CA族典型的α∕β折叠模式,保持了家族保守的包含以α-螺旋为主要结构的L区结构域和以反平行β片层为主要结构的R区结构域的结构骨架。我们认为其具备的保守家族骨架折叠模式,保证了它具有坚固的球状折叠构型。同时,对模拟过程中动力学轨迹的几何性质计算和分析表明,在模拟过程中TsCL-1呈现出总体上相对稳定的结构状态。RMSF分析结果表明,模拟过程中组成TsCL-1蛋白酶分子核心结构的二级结构元件具有较小的波动和较强的结构刚性,而暴露于表面的环区和底物结合区域则具有较大的波动的较强的构象柔性。因此,我们认为,在模拟过程中TsCL-1具备的整体结构刚性,特别是其构成折叠骨架核心结构的稳定性保证了它不易被自身或其他蛋白酶水解。同时,目前研究表明,蛋白酶底物结合区构象柔性越大,将可能越有利于底物对酶的构象选择〔17〕或诱导契合过程〔18〕的发生,同时也有利于已结合底物的调节和定位,以便催化反应能顺利进行。因此,我们认为模拟过程中TsCL-1底物结合区域的高构象柔性将有利于其生物学功能的发挥。本文的研究结果将有利于进一步在分子水平上研究和揭示猪囊尾蚴半胱氨酸蛋白酶结构和功能的关系。
〔1〕GARCÍA H H,GONZALEZ A E,EVANS C A,et al.Taenia solium cysticercosis〔J〕.The Lancet,2003,362(9383):547-556.
〔2〕PRASAD K N,PRASAD A,VERMA A,etal.Human cysticercosis and Indian scenario:a review〔J〕.J Biosci,2008,33(4):571-582.
〔3〕WILLINGHAM A L,ENGELS D.Control of Taenia solium cysticercosis∕taeniosis〔J〕.Adv Parasitol,2006,61:509-566.
〔4〕BERASAÍN P,GOÑI F,MCGONIGLE S,etal.Proteinases secreted by Fasciola hepatica degrade extracellular matrix and basementmembrane components〔J〕.J Parasitol,1997,83(1):1-5.
〔5〕HOTEZ P,HAGGERTY J,HAWDON J,etal.Metalloproteases of infective Ancylostoma hookworm larvae and their possible functions in tissue invasion and ecdysis〔J〕.Infect Immun,1990,58(12):3883-3892.
〔6〕LI A H,MOON S U,PARK Y K,et al.Identification and characterization of a cathepsin L-like cysteine protease from Taenia solium metacestode〔J〕.Veterinary Parasitology,2006,141(3):251-259.
〔7〕杨琳,赵琴平,杨力权.猪囊尾蚴半胱氨酸蛋白酶TsCL-1结构的同源模建〔J〕.楚雄师范学院学报,2016,31(3):37-40.
〔8〕HENZLER-WILDMAN K,KERN D.Dynamic personalities ofproteins〔J〕.Nature,2007,450(7172):964-972.
〔9〕KARPLUS M,MCCAMMON J A.Molecular dynamics simulations of biomolecules〔J〕.Nat Struct Biol,2002,9(9):646-652.
〔10〕HANSSON T,OOSTENBRINK C,VAN GUNSTEREN W. Molecular dynamics simulations〔J〕.Curr Opin Struct Biol,2002,12(2):190-196.
〔11〕陈敏伯.计算化学:从理论化学到分子模拟〔M〕.北京:科学出版社,2009.
〔12〕DRENTH J,JANSONIUS J N,KOEKOEK R,et al.The structure of papain〔J〕.Adv Protein Chem,1971,25:79-115.
〔13〕LIGHT A,FRATER R,KIMMEL J R,etal.CurrentStatus of the Structure of Papain:The Linear Sequence,Active Sulfhydryl Group,and the Disulfide Bridges〔J〕.Proc Natl Acad SciUSA,1964,52:1276-1283.
〔14〕VAN DER SPOEL D,LINDAHL E,HESS B,et al.GROMACS:Fast,Flexible,and Free〔J〕.J Comput Chem,2005,26(16):1701-1718.
〔15〕LINDAHL E,HESS B,VAN DER SPOEL D.GROMACS 3.0:a package for molecular simulation and trajectory analysis〔J〕.Journalof Molecular Modeling,2001,7(8):306-317.
〔16〕PETTERSEN E F,GODDARD T D,HUANG C C,et al. UCSF Chimera:a visualization system for exploratory research and analysis〔J〕.J Comput Chem,2004,25(13):1605-1612.
〔17〕TOBID,BAHAR I.Structuralchanges involved in protein binding correlate with intrinsic motions of proteins in the unbound state〔J〕.Proc Natl Acad Sci USA,2005,102(52):18908-18913.
〔18〕KOSHLAND D E.Application of a Theory of Enzyme Specificity to Protein Synthesis〔J〕.Proc Natl Acad Sci USA,1958,44(2):98-104.
Study on the StructuralFlexibility of Cysteine Protease TsCL-1 from Cysticercus Cellulose
Yang Lin1,2,Zhu Yuexun3,Yang Yanchao3,Zhao Qinping1,Yang Liquan3*
(1.Schoolof Basic MedicalSciences,Wuhan University,Wuhan 430071,China;2.DaliInstitute of Schistosomiasis Prevention and Control,Dali,Yunnan 671000,China;3.College of Agriculture and Biological Science,Dali University,Dali,Yunnan 671003,China)
Using the Molecular Dynamics Simulation method,the dynamic structural stability and conformational flexibility of cysteine protease TsCL-1 from Cysticercus cellulose have been investigated.The results indicate that TsCL-1 contains an overall structural stability during the simulation.The results also indicate that the structural core of TsCL-1 shows a small fluctuation amplitude,whereas most of the surface-exposed loops and the substrate binding sites experience significant conformational fluctuations and exhibit a highly structural flexibility.The results of this article will provide a solid basis for further studying the relationship between dynamic structuralfeatures and functions ofTsCL-1.
Cysteine protease TsCL-1;molecular dynamics simu¬lations;dynamic structural flexibility;structure and function relationship
Q6
A
2096-2266(2017)06-0055-04
10.3969∕j.issn.2096-2266.2017.06.013
(责任编辑李杨)
大学生科研基金资助项目(KYSX201615)
2016-12-07
2017-03-30
杨琳,主治医师,主要从事寄生虫诊治研究.
*通信作者:杨力权,副教授,博士.
