天花粉多糖的除蛋白工艺优化研究*
2017-07-03于丹陈楠张颖孟凡佳都晓伟
于丹,陈楠,张颖,孟凡佳,都晓伟
(黑龙江中医药大学,黑龙江哈尔滨150040)
工程师园地
天花粉多糖的除蛋白工艺优化研究*
于丹,陈楠,张颖,孟凡佳,都晓伟*
(黑龙江中医药大学,黑龙江哈尔滨150040)
目的:优化天花粉多糖的除蛋白工艺。方法:以除蛋白率、多糖收率和天花粉多糖中的中性糖、糖醛酸和蛋白质含量为指标,筛选并优化了天花粉多糖的除蛋白工艺。结果:天花粉多糖的最佳除蛋白工艺为提取液以50%乙醇浓度除杂,上清液调节乙醇浓度达80%醇沉;沉淀加水溶解,TCA浓度15%,体积1∶1,振荡30min;取上清液,再加入氯仿-正丁醇溶液体积比10∶1,剧烈振摇20min,萃取两次。除蛋白率为88.18%,多糖收率为75.07%,总糖含量可达77.74%,蛋白质含量仅为0.23%。结论:乙醇分级醇沉、TCA法和Sevage法的联合除蛋白质方法简便,成本较低,可大量除去天花粉多糖中的蛋白质和淀粉杂质,提高天花粉多糖纯度。
天花粉;多糖;除蛋白质工艺
天花粉(Trichosanthis Radix)来源于葫芦科植物栝楼Trichosanthes kirilowii Maxim.或双边栝楼Trichosanthes rosthornii Harms的干燥块根,始载于《神农本草经》,在我国有着悠久的药用历史。现代研究发现天花粉主要含有蛋白质、凝集素、多糖和黄酮等化学成分[1],其中天花粉多糖为一类主要活性化学成分,具有降血糖、抗肿瘤和免疫增强等多种药理作用[2]。但在天花粉多糖的制备过程中,由于天花粉含有大量的蛋白质和凝集素,常与多糖形成缀合物,且天花粉蛋白属于水溶性的高分子化合物,在提取多糖时被一起提取出来,成为了影响天花粉多糖纯度的主要杂质。同时,天花粉蛋白和天花粉凝集素属于核糖体灭活蛋白,二者是与天花粉临床应用不良反应相关的主要成分[1]。另外,天花粉中淀粉含量丰富,且其也属于多糖类成分,但却没有与天花粉多糖相一致的药理活性,也是影响天花粉多糖纯度的一类杂质。因此,尽可能去除蛋白质和淀粉类杂质是提高天花粉多糖纯度的重要环节,但目前尚未见此部分研究工作的详细报道。
在多糖的纯化工艺研究中,常见的除蛋白质方法主要为Sevage法、三氟三氯乙烷法、三氯乙酸法(TCA法)与酶法,各种除蛋白方法均有利弊,如效率低、多糖易降解、多糖损失大、除蛋白质不完全等[3]。为了尽量除去天花粉多糖中的蛋白质杂质,并且降低多糖损失率,本实验采用联合乙醇分级醇沉、TCA法和Sevage法的除蛋白质方法优化了天花粉多糖的纯化工艺,得到了较为满意的效果。此结果可为天花粉多糖的进一步开发研究和生产应用提供参考。
1 实验部分
1.1 仪器与试药
722E型可见分光光度计(上海光谱仪器有限公司);UV-2700型紫外分光光度计(日本岛津); N-1100型旋转蒸发仪(日本东京理化科技有限公司);H1850型离心机(湖南湘仪实验仪器开发有限公司),PHS-25型精密数显酸度计(杭州雷磁分析仪器厂)。
D-葡萄糖(供含量测定用,批号110833-201004,中国药品生物制品检定所);D-半乳糖醛酸(供含量测定用,批号111646-200301,中国药品生物制品检定所);牛血清白蛋白(生化级别,批号:735094,Roche),考马斯亮兰G-250(国药集团化学试剂有限公司);95%乙醇(AR天津广成精细化学品有限公司);NaOH(AR国药集团化学试剂有限公司);三氯乙酸(AR天津广成精细化学品有限公司);正丁醇(AR天津市富宇精细化工有限公司);氯仿(AR天津市富宇精细化工有限公司);其它化学试剂均为分析纯。
天花粉药材购于安阳天尊生物工程股份有限公司,粉碎后过60目筛备用。
1.2 实验方法
1.2.1 中性糖、糖醛酸和蛋白质含量测定
(1)中性糖含量测定精密吸取浓度为0.044,0.055,0.066,0.077,0.088,0.099,0.11mg·mL-1的葡萄糖对照品溶液1mL置具塞试管中,以水为空白对照,分别加入1mL蒸馏水与1mL 5%苯酚溶液,迅速加入浓H2SO45mL,沸水浴15min,冷却至室温。于490 nm处测定吸光度(A),以A为横坐标,质量为纵坐标,得回归方程为:Y=197.8X-4.252,r= 0.9985,线性范围为44~110μg。
(2)糖醛酸含量测定精密量取浓度为0.01,0.02,0.03,0.04,0.05和0.06mg·mL-1的D-半乳糖醛酸对照品溶液1mL置于具塞试管中,于冰水浴中缓慢加入四硼酸钠-浓H2SO4溶液5mL,摇匀,沸水浴中加热8min,取出冰浴中冷却后加入0.15%间羟联苯溶液80μL,混匀,静置30min。于525nm处测定吸光度(A),以A为横坐标,质量为纵坐标,得回归方程为:Y=87.807X+3.4042,r=0.9991,线性范围为10~60μg。
(3)蛋白质含量测定精密吸取浓度分别为0.01,0.02,0.04,0.06,0.08和0.10mgomL-1的牛血清白蛋白标准溶液1mL至试管中,以水为空白对照,分别加入0.01%考马斯亮蓝G-250溶液5mL,再加入0.9%NaCl溶液4ml,混匀。于638nm处测定吸光度(A),以A为横坐标,质量为纵坐标,得回归方程为:Y=193.4X-2.9043,r=0.9994,线性范围为10~100μg。
1.2.2 天花粉多糖的提取精密称取天花粉药材500g,加入25倍量体积水,于45℃浸泡提取3次,每次4h,过滤,合并滤液,减压回收至500mL,-20℃冷冻备用。
1.2.3 天花粉多糖的分级醇沉条件考察取1.2.1项下提取液80mL,缓慢加入95%乙醇使含醇量达50%,4℃静置12h,过滤,滤液平均分成4份。分别缓慢加入95%乙醇使含醇量达60%、70%、80%和90%,4℃静置12h,离心,沉淀分别用无水乙醇、丙酮、乙醚反复洗涤3次,干燥,称重,计算收率,并测定多糖得量,计算多糖含量。
1.2.4 除蛋白质方法的考察
(1)Sevage法除蛋白质取天花粉多糖醇沉样品1.50g,溶于10mL水中,加入氯仿-正丁醇溶液(5:1)2mL,剧烈振摇20min,蛋白质变性成胶状存在于水相与溶剂相的交界面上,分去水层与溶剂层交界处的变性蛋白。此操作重复多次,直至水相与溶剂相的交界面上无变性蛋白质出现为止。取水相分别测定蛋白质与多糖含量。
(2)TCA法除蛋白质取天花粉多糖醇沉样品1.50g,溶于10mL水中,加入15%TCA10mL,强烈振摇30min,离心,取上清液加入NaOH溶液,调节pH值为7,过滤,回收至5 mL,分别测定蛋白质与多糖含量。
1.2.5 TCA-Sevage法除蛋白质的条件优化
(1)TCA法除蛋白质的浓度考察取天花粉多糖醇沉样品5份,每份1.50g,溶于10mL水中,分别加入5%,10%,15%、20%、和30%的TCA 10mL,强烈振摇30min,离心,取上清液加NaOH溶液,调节pH值为7,过滤,回收至5mL,分别测定蛋白质与多糖含量。
1.2.5.2 TCA法除蛋白质的体积考察取天花粉多糖醇沉样品5份,每份1.50g,溶于10mL水中,分别加入15%TCA 4、6、8、10和12mL,强烈振摇30min,离心,取上清液加NaOH溶液,调节pH值为7,过滤,回收至5 mL,分别测定蛋白质与多糖含量。
(3)TCA法除蛋白质的时间考察取天花粉多糖醇沉样品5份,每份1.50g,溶于10mL水中,分别加入15%TCA 10 mL,强烈振摇20、30、40、50和60min,离心,取上清液加NaOH溶液,调节pH值为7,过滤,回收至5 mL,分别测定蛋白质与多糖含量。
(4)Sevage法除蛋白质的次数考察取经TCA法除蛋白质后的上清液3份,每份20mL,加入氯仿-正丁醇溶液(5∶1)2mL,剧烈振摇20min,分别萃取1、2和3次,分去水层与溶剂层交界处的变性蛋白质。取水层加氢氧化钠溶液,调节pH值为7,过滤,回收至5 mL,分别测定蛋白质与多糖含量。
1.2.6 天花粉多糖的纯度测定取天花粉多糖配制成10mg·mL-1的样品溶液,分别测定中性糖、糖醛酸和蛋白质含量。取天花粉多糖配制成2mg·mL-1的溶液,离心,取上清液在200~400nm范围内利用紫外分光光度计进行紫外全波长扫描,以确定天花粉多糖中是否含有核酸和蛋白质缀合物。
2 结果与讨论
2.1 天花粉多糖的分级醇沉条件考察
乙醇分级醇沉考察结果表明(表1),当乙醇浓度为60%,沉淀量、收率、多糖得量、多糖含量均较低。经70%,80%与90%乙醇浓度醇沉后,多糖含量相近;但在多糖得量、沉淀量与收率方面,90%醇沉浓度最高,80%醇沉浓度其次,二者均显著高于70%醇沉浓度;90%与80%醇沉浓度相比较,无统计学差异(P>0.05)。从经济方面考虑,本实验确定的最佳乙醇醇沉条件为:天花粉多糖提取液(药液浓度相当于含生药材1gomL-1)先加95%乙醇调节乙醇浓度达50%,4℃静置12h,过滤,除杂,上清液继续加入95%乙醇调节乙醇浓度达80%醇沉。
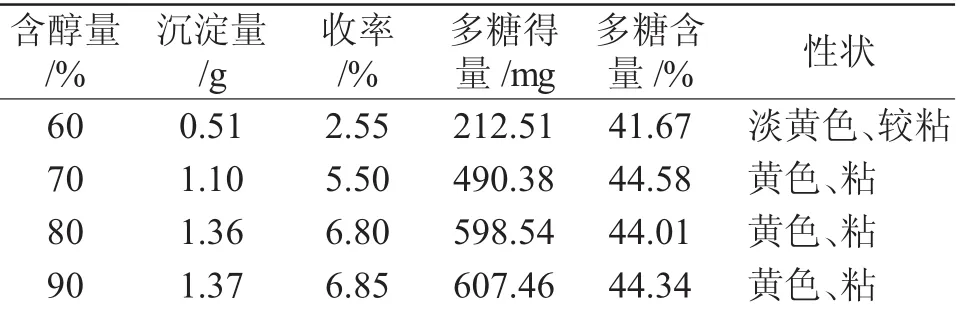
表1 不同乙醇浓度考察结果(n=3)Tab.1Results of precipitation with different amount of alcohol(n=3)
2.2 除蛋白质方法比较
实验结果表明(表2),TCA法的除蛋白率与多糖收率均显著性高于Sevage法(P<0.05),但TCA法的除蛋白率虽可达80.18%,但仍有少量蛋白质杂质未除尽。

表2 不同除蛋白方法比较结果(n=3)Tab.2Results of deprotein with different methods(n=3)
2.3 TCA-Sevage法除蛋白质优化结果
TCA-Sevage法除蛋白质优化结果见图1和表3。

图1TCA除蛋白质考察结果Fig.1Results of deprotein with TCA
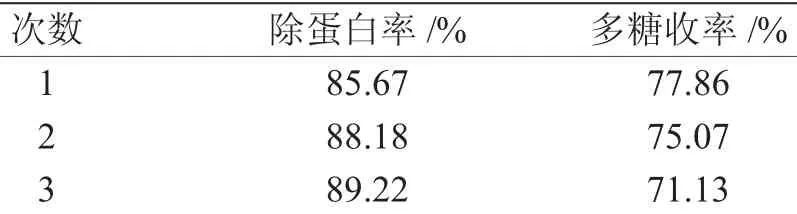
表3 Sevage法除蛋白的次数考察结果(n=3)Tab.3Result of different times with sevage method(n=3)
实验结果表明,随着TCA浓度和体积的增加,除蛋白率增强,但多糖回收率下降,最终确定TCA的浓度为15%,体积为10mL;随着TCA除蛋白时间的延长,30min后除蛋白率增长缓慢,但多糖回收率基本保持不变,最终确定除蛋白时间的为30min。随着Sevage法除蛋白次数的增加,除蛋白率升高,但不存在显著性差异(P>0.05);多糖收率下降,以除蛋白3次的多糖收率下降最为显著(P<0.05)。综合除蛋白率与多糖收率实验结果,确定Sevage法除蛋白次数为2次。故最终确定的除蛋白质方法为:取天花粉多糖的醇沉沉淀加一定量的水溶解,溶液(mL)∶15%三氯乙酸(mL)体积比1∶1,振荡30min,离心,取上清液(mL):体积氯仿-正丁醇溶液(5∶1,mL)体积比10∶1,剧烈振摇20min,萃取两次,分去水层与溶剂层交界处的变性蛋白。取水层加氢氧化钠,调节PH值为7,过滤,即得。
2.4 天花粉多糖的纯度测定
实验结果表明(表4和图2),天花粉多糖具有较高的纯度,其总糖含量可达77.74%,蛋白质含量仅为0.23%。且紫外光谱中,在260和280nm处无明显吸收峰,表明无核酸和蛋白质。

表4 天花粉多糖中的中性糖、糖醛酸和蛋白质的含量测定(n=3)Tab.4Content of neutral sugar,uronic acid and protein of polysaccharides from Trichosanthis Radix(n=3)
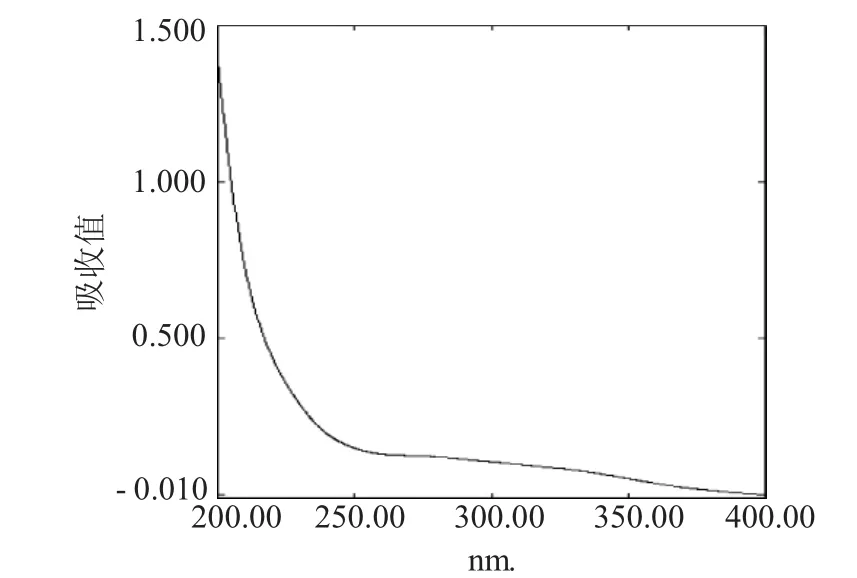
图2天花粉多糖紫外光谱图Fig.2UV spectra of polysaccharides from Trichosanthis Radix
3 讨论
3.1 提取方法的确定
由于天花粉中含有大量的淀粉,当提取温度高于45℃时溶液成糊状,使提取液与残渣难以分离。碘试液检测提取液呈明显蓝色,表明有大量的淀粉溶出。淀粉的溶出给多糖的分离造成困难,同时使多糖的含量测定结果偏高。为了避免上述现象的发生,故本实验确定采用提取温度≤45℃、水浸泡的方法提取天花粉总多糖。此结果与黄晓兰等的研究报道结果相一致[4]。
3.2 乙醇分级醇沉条件的确定
乙醇醇沉法是经典的多糖纯化方法,当向天花粉多糖提取液中加入95%乙醇调节含醇量达50%时,出现少量淡黄色沉淀,采用苯酚-硫酸法未检测到多糖成分,采用考马斯亮蓝法检测到蛋白质类成分。故为了提高多糖纯度,本实验样品先调节含醇达50%,4℃静置12h,过滤除杂,然后上清液继续加95%乙醇调节含醇量考察最佳的分级醇沉条件。
3.3 除蛋白质方法的确定
Sevage法和TCA法是常用的除蛋白质方法,尤其是TCA法,除蛋白质效率较高,常用于植物多糖的蛋白质去除。本实验研究结果发现,由于天花粉多糖中蛋白质含量较高,采用Sevage法需重复操作11次才能使两相交界面上无变性蛋白质出现,且多糖损失率较高(49.55%)。TCA法较Sevage法除蛋白率高,多糖损失率低,操作简便,可除去大量蛋白质,但仍有少部分蛋白质残留,若增加TCA除蛋白质次数,多糖损失量增高。故本实验先采用TCA法除去样品中的大量蛋白,再用Sevage法除去残留的少量蛋白质,以尽可能多的除去蛋白质杂质。
4 结论
本实验所确定的天花粉多糖除蛋白工艺,操作方法简便,成本较低,可大量除去天花粉多糖中的蛋白质和淀粉杂质,提高天花粉多糖纯度。此纯化工艺可为天花粉多糖在分离、结构鉴定和药理作用等方面的进一步开发研究与生产应用提供相应的技术支持。
[1]李振红,陆阳,刘晶星.天花粉化学成分与药理活性[J].国外医药.(植物药分册),2003,18(1):1-4.
[2]洪缨,顾海鸥.天花粉药理研究进展[J].北京医药,1994,(3):32-35.
[3]王珊,黄胜阳.植物多糖提取液脱蛋白方法的研究进展[J].食品科技,2012,37(9):188-191.
[4]黄晓兰,吴惠勤,王蔚,等.,天花粉多糖的提取、分离与纯化研究[J].中草药,2008,39(11):1662-1665.
Optimization study of deproteinization process for polysaccharides from Trichosanthis Radix*
YU Dan,CHEN Nan,ZHANG Ying,MENG Fan-jia,DU Xiao-wei*
(Heilongjiang University of Chinese Medicine,Harbin 150040,China)
Objective:To optimize deproteinization process of polysaccharides from Trichosanthis Radix. Method:With retention rate of polysaccharides,deproteinized rate and the content of neutral sugar,uronic acid and protein as indexes,the optimized deproteinization process of polysaccharides from Trichosanthis Radix were studied. Result:The concentrated solution was precipitated sequentially by final concentration of 50%(v/v)ethanol and 80%(v/v)ethanol,then the precipitate was removed protein by adding the equal volume of 15%TCA to deprotein 30min,and the last step is that the supernate was mixed with chloroform and n-butanol as volume ratio of 10:1 to severe vibrate 20 min and repeat two times.Retention rate of polysaccharides,deproteinized rate,the content of total sugar and protein were 75.07%,88.18%,77.74%and 0.23%,respectively.Conclusion:The deproteinized method united grade alcohol sink,TCA and Sevage method could improve the purity of polysaccharide from trichosanthis radix by removing the large amounts of protein and starch impurity,meanwhile the method is simple and low costing.
Trichosanthis Radix;polysaccharides;deproteinization process
R93
A
10.16247/j.cnki.23-1171/tq.20170663
2017-04-11
黑龙江省教育厅面上项目(12511523)
于丹(1980-),女,博士,副教授,研究方向:中药的药效物质基础研究。
都晓伟,女,教授,博士生导师,研究方向:中药及天然药物的质量评价与开发。
