双波长法测定山药中直链和支链淀粉含量
2017-07-01崔晋李建军马艳弘李亚辉魏建明郝林
崔晋,李建军,马艳弘,李亚辉,魏建明,郝林
(1.山西农业大学食品科学与工程学院,山西晋中030801;2.江苏省农业科学院农产品加工研究所,江苏南京210014;3.江苏博达生物科技有限公司,江苏徐州221723)
双波长法测定山药中直链和支链淀粉含量
崔晋1,2,李建军2,马艳弘2,李亚辉2,魏建明3,郝林1,*
(1.山西农业大学食品科学与工程学院,山西晋中030801;2.江苏省农业科学院农产品加工研究所,江苏南京210014;3.江苏博达生物科技有限公司,江苏徐州221723)
使用双波长分光光度法测定不同品种山药中直链淀粉和支链淀粉的含量,根据双波长法的测定原理,确定山药直链及支链淀粉的测定波长和参比波长,直链淀粉分别为624 nm和410 nm,支链淀粉分别为538 nm和758 nm。试验结果表明,该测定方法标准曲线良好。直链淀粉在0~50 μg/mL质量浓度范围内其碘复合物与吸光度呈线性关系(R2=0.999 7),支链淀粉在0~250 μg/mL质量浓度范围内其碘复合物与吸光度呈线性关系(R2=0.998 4)。山药中直链淀粉含量为0.026 mg/mL,回收率在96.72%~98.73%之间;支链淀粉的含量为0.072 mg/mL,回收率在95.74%~97.87%之间,RSD均小于1.5%。
山药;双波长分光光度法;直链淀粉;支链淀粉
山药为薯蓣科植物薯蓣(Dioscorea opposita Thunb.),属草本蔓生性植物,块茎呈长纺锤至柱形。目前已有品种600多种,其肉质柔滑,富含维生素、微量元素、蛋白质、多糖、薯蓣皂甙、尿囊素、尿囊酸等保健功能较强的生物活性物质,尤其是其紫山药品种,还含有抗氧化活性较强的花青素[1-2]、具有很高的食用价值和开发前景。山药中含有大量淀粉,是重要的优质淀粉来源,然而当前对植物淀粉的研究大多集中在玉米淀粉和马铃薯淀粉上,对山药淀粉的开发利用却鲜有报道。极大的限制了山药淀粉的开发应用和山药深加工技术的发展。
淀粉是由脱水葡萄糖通过α-D-(1-4)糖苷键链接形成的高分子碳水化合物,其测定方法主要有传统的旋光法[3]、水解总糖测定法[4]、蒽酮比色法[5]、三波长比色法和酶法淀粉测定法,以及近几年发展起来的双波长检测法。传统的测定方法操作繁琐,测定结果易受样品中糖分、脂类等物质的干扰,且无法区分直链、支链淀粉。而双波长法作为近年来兴起的一种能同时测定直链和支链淀粉的方法,具有准确性高、重复性好、效率高,具有三波长比色法、酶法淀粉测定法不可比拟的优点[6-10],目前已被广泛应用于小麦、银杏、板栗、高粱[11-13]等淀粉的分析测定。
通常植物中淀粉的含量和比例对其营养品质与加工特性有较大影响[14],而栽培品种和种植地区的差异均会造成山药直链淀粉和支链淀粉的含量变化,因此本文采用双波长分光光度法建立了快速检测山药淀粉的检测方法,并且分析了不同品种山药淀粉的含量与组分差异,为进一步开展山药品质分析、保健食品开发以及资源的综合利用等提供参考。
1 材料与方法
1.1 材料与试剂
供试山药资源:采自江苏省农科院试验基地;直链淀粉与支链淀粉标准品:美国sigma公司;其余常规试剂石油醚、氢氧化钾、盐酸、碘、碘化钾均为国产分析纯试剂。
碘试剂的配制:准确称取18.5 g碘化钾,用少量蒸馏水溶解,再加入6.5 g碘,搅拌溶解后用蒸馏水定容至100 mL,贮于棕色瓶中备用。
1.2 仪器与设备
D-8紫外可见分光光度计:南京菲勒仪器有限公司;ML204万分之一天平、FE20-K pH计:梅特勒仪器有限公司;DHG-9076A电热鼓风干燥箱、DK-8D数显恒温水浴锅:上海精宏实验设备有限公司;FW100万能粉碎机:天津市泰斯特仪器有限公司;SZF-06A粗脂肪测定仪:上海新嘉电子有限公司。
1.3 方法
1.3.1 淀粉标准工作液的制备[15]
准确称取直链淀粉标准品和支链淀粉标准品各0.100 0 g,分别放入100 mL烧杯中,加1 mol/L氢氧化钾溶液10 mL,置于85℃水浴中充分搅拌溶解,然后用蒸馏水定容至50 mL,混合均匀,即为2.0 mg/mL的直链淀粉标准工作液和2.0 mg/mL的支链淀粉标准工作液。
1.3.2 直链淀粉与支链淀粉检测波长的确定
吸取1.0 mL直链淀粉标准工作液和5 mL支链淀粉标准工作液,分别放入100 mL烧杯中,加蒸馏水25 mL,用0.1 mol/L的盐酸溶液调pH值至3.0,再加入0.02 mL碘试剂,并用蒸馏水定容至50 mL。室温下静置25 min后以蒸馏水为空白对照,分别在紫外-可见光分光光度计上进行400 nm~800 nm波段光谱扫描,分别获得二者的吸收光谱图,根据等吸收点作图法确定直链淀粉的测定波长(λ1)和参比波长(λ3),以及支链淀粉的测定波长(λ2)和参比波长(λ4)。
1.3.3 直链淀粉与支链淀粉标准曲线的绘制
分别取直链淀粉标准工作液 0.1、0.3、0.5、0.7、0.9、1.1 mL于烧杯中,加蒸馏水25 mL,以盐酸溶液调pH值至3.0,加0.02 mL碘试剂,用蒸馏水定容至50 mL。室温下静置25 min,在λ1和λ2波长下分别测定吸光度 ODλ1、ODλ2,以二者的差值△OD 值为纵坐标,直链淀粉浓度为横坐标,即可绘制出双波长直链淀粉标准曲线;分别取支链淀粉标准工作液0.5、1.0、1.5、2.0、2.5、3.0 mL于烧杯中,其他操作同直链淀粉,根据结果即可绘制支链淀粉标准线。
1.3.4 山药的处理与淀粉含量的测定
山药进行切片处理,置于60℃鼓风干燥箱中烘干至恒重,然后用万能粉碎机将样品打成粉末,称重,测得水分含量W1;称取1.000 g烘干样品(M),利用粗脂肪测定仪,加入80 mL石油醚,加热回流脱脂4 h,然后放入干燥箱中烘干至恒重,测出粗脂肪含量W2。再称取脱脂样品0.100 g,加入1 mol/L的氢氧化钾10 mL,于85℃水浴中充分搅拌溶解后,用蒸馏水定容至50 mL,静置20 min后过滤。各品种均取滤液3mL,加入25 mL蒸馏水,以盐酸溶液调节pH值至3.0,样品测定液中加碘试剂0.02 mL,测定液和空白液均用蒸馏水定容至50 mL。室温静置25 min后,以蒸馏水为空白对照,测定各样品吸光值。再根据直、支链淀粉的双波长标准曲线算出样品的直、支链淀粉含量,二者相加即得烘干样品总淀粉含量。直链淀粉和支链淀粉含量计算公式分别如下:

1.3.5 双波长法的测定稳定性、测定精度与加标回收率试验
分别取直链淀粉和支链淀粉标准液,每隔5分钟测定一次吸光值,计算平均值和相对标准偏差RSD值,评价双波长检测的稳定性;对同一紫山药样品同时测定直链淀粉和支链淀粉的含量,进行4次重复测定,计算结果的平均值与RSD值,评价其测定精度;在已测得直链淀粉和支链淀粉含量的紫山药样品中,分别添加准确称量的不同质量的直链淀粉和支链淀粉标准品,测定支链淀粉与直链淀粉含量,按照下列公式计算加标回收率及RSD值,以此检验双波长法测定紫山药淀粉含量的准确度。

式中:m1为加标准品后样品测定的总质量,mg;m2为样品中原有直链或支链淀粉的质量,mg;m3为添加的直链或支链淀粉标准品的质量,mg。
2 结果与分析
2.1 直链淀粉测定波长及参比波长的选择
根据双波长分光光度法测定原理[16],采用作图法选定参比波长和测定波长。用D-8紫外可见分光光度计分别对直链淀粉、支链淀粉标准溶液进行扫描得到吸收光谱。选择波长需要具备两个基本条件,一是同存组分在这两个波长应具有相同的吸收值,使其浓度变化不影响到测定值,二是待定组分在这两个波长的差值应足够大[17]。直链淀粉、支链淀粉测定波长与参比波长分析见图1。
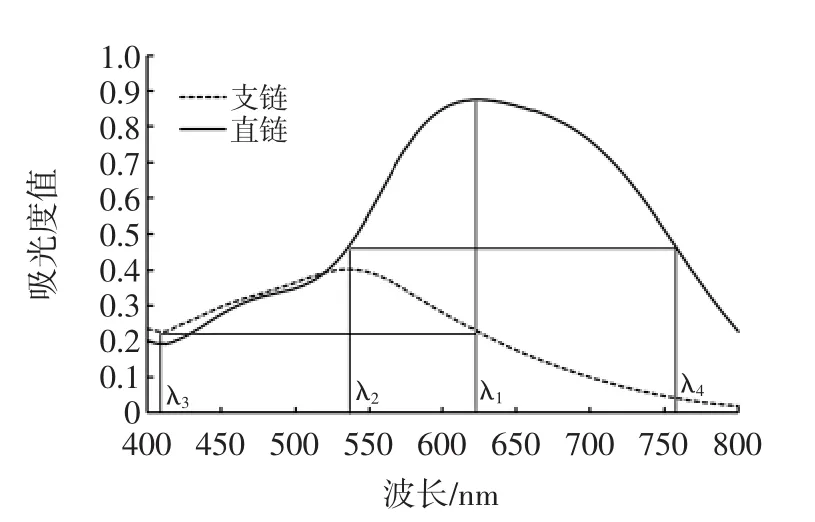
图1 直链淀粉、支链淀粉测定波长与参比波长分析Fig.1 The analysis of determination wavelength and reference wavelength of amylose and amylopectin
根据扫描图谱和等吸收点作图法的原理,确定直链淀粉和支链淀粉最大吸收波长分别为624 nm和538nm,确定直链淀粉测定双波长为624nm和410nm,支链淀粉测定双波长为538 nm和758 nm。
2.2 直链淀粉及支链淀粉标准曲线的绘制
以蒸馏水为空白,采用双波长分光光度法在测定波长624 nm,参比波长410 nm下分别测定吸光度。以直链淀粉含量为横坐标,以ΔA直=Aλ1-Aλ3为纵坐标绘制标准曲线(见图2)。直链淀粉回归方程为y=20.15x-0.121 2,相关系数 R2=0.999 7。
以蒸馏水为空白,采用双波长分光光度法在测定波长624 nm,参比波长410 nm下分别测定吸光度。以支链淀粉含量为横坐标,以ΔA支=Aλ2-Aλ4为纵坐标绘制标准曲线(见图3)。支链淀粉回归方程为y=2.105 7x-0.023 5,相关系数 R2=0.998 4。
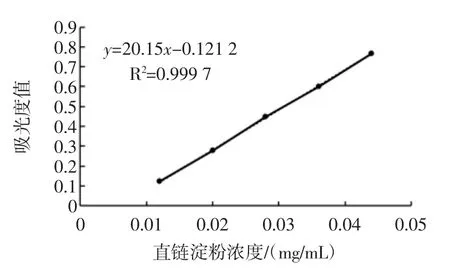
图2 直链淀粉标准曲线Fig.2 Calibration curve of amylose determination
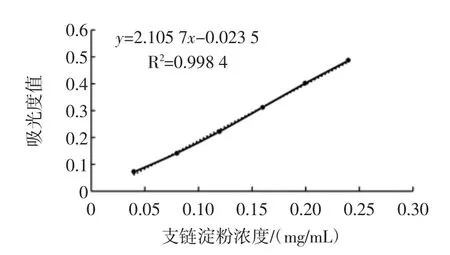
图3 支链淀粉标准曲线Fig.3 Calibration curve of amylopectin determination
2.3 双波长测定方法的稳定性试验
取直链淀粉和支链淀粉标准液,每隔5分钟测吸光值见表1。

表1 直链淀粉和支链淀粉在不同测定时间的吸光值Table 1 The absorbance value of amylase and amylopectin in different reaction time
由表1可知,在15min~40min区间内,直链淀粉和支链淀粉溶液的吸光值的相对偏差RSD<1%,15 min~40 min范围内检测结果基本稳定,表明试验的重复性好,说明双波长的检测结果相对稳定。
2.4 双波长法测定精密度评价
取其中的4种山药进行精密度试验,经过相同处理的紫山药进行重复测定4次,结果见表2。
可以看出,双波长法进行淀粉的测定的试验方法重复性良好,具有较高的精密度。
2.5 样品加标回收率测定结果
为了检测山药淀粉含量测定结果的准确性,在已测得直链淀粉和支链淀粉含量的样品中,在处理好的山药样品中添加直链淀粉和支链淀粉标准品,求得其回收率见表3。由表3可见,直链淀粉和支链淀粉其回收率在95.74%~98.73%之间,RSD均小于1.5%,满足检测要求,说明该分析检测方法具有较高的准确度,适用于同时测定山药样品中的直链淀粉和支链淀粉含量。
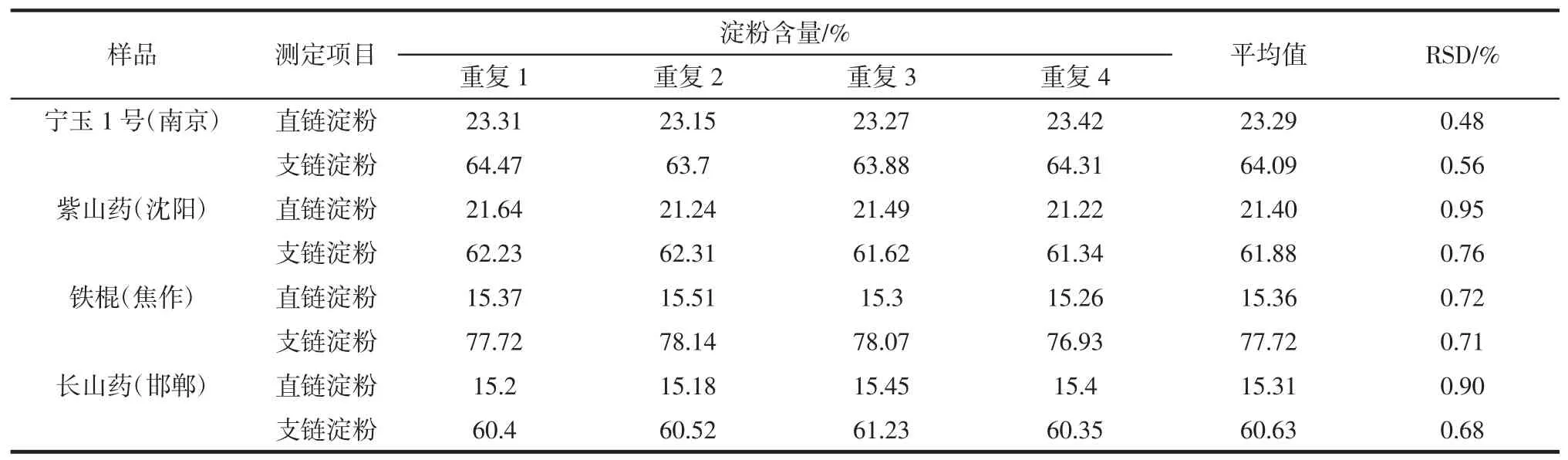
表2 样品测定重复性试验结果Table 2 Results of repeated determinations of amylose and amylopectin in cassava starch

表3 直链淀粉和支链淀粉回收率Table 3 Spike recovery rates of amylose and amylopectin
2.6 不同山药的淀粉含量变化
测定不同山药的水分、脂肪及淀粉含量见表4。由表4可见,供试样品水分含量在1.12%~8.82%,脂肪含量在1.1%~2.8%之间;烘干样品中直链淀粉含量在15.2%~27.3%之间,支链淀粉含量在43.8%~77.72%之间,总淀粉含量在67.7%~93.09%之间。

表4 山药样品中直链和支链淀粉含量的测定结果Table 4 Determination results of amylase and amylopectin in purple yam
3 结论
双波长法作为近年来发展的一种能同时测定直链和支链淀粉的方法,具有准确性高、重复性好、效率高等优点,被广泛应用于植物淀粉含量的快速检测中。本文采用双波长分光光度法,研究了碘试剂与直链淀粉和支链淀粉的显色反应,测定了山药的淀粉含量、直链淀粉含量和支链淀粉含量。根据其光谱扫描结果,确定直链淀粉的测定波长为624 nm,参比波长为410 nm,支链淀粉的测定波长为538 nm,参比波长为758 nm。直链淀粉在浓度为0~50 μg/mL范围内与吸光值呈线性关系,回归方程为:y=20.15x-0.121 2,R2=0.999 7,支链淀粉在浓度为 0~250 μg/mL 范围内与吸光值呈线性关系,回归方程为:y=2.105 7x-0.023 5,R2=0.998 4。采用双波长法测定紫山药中的直链淀粉和支链淀粉含量,二者的平均回收率分别为97.67%和96.69%,精密度高,RSD均小于1.5%,此方法可用于测定山药中直链淀粉和支链淀粉含量准确检测试验中。
[1] 毛德富,周昌南.紫山药在山区高产栽培技术初探[J].江西农业学报,2006,18(5):135
[2] 赵冬兰,唐君,刘靖,等.紫山药的引种与标准化栽培技术初探[J].江西农业学报,2009,21(2):78-79
[3] 陶锦鸿,郑铁松.旋光法测定莲子淀粉含量的研究[J].食品工业科技,2009,30(1):306-308
[4] 彭湘莲,李忠海,钟海雁,等.食品分析实验教学改革综述[J].安徽农业科学,2007,35(34):11326-11327
[5] 郭冬生,彭小兰.蒽酮比色法和酶水解法两种淀粉测定方法的比较研究[J].湖南文理学院学报,2007,19(3):34-36
[6] Ma J,Jiang Q T,Zhang X W,et al.Effect of lipids on starch determination through various methods[J].Pakistan Journal of Agricultural Sciences,2014,51(3):749-755
[11]Mestres C,Matencio F,Pons B,et al.A Rapid Method for the Determination of Amylose Content by Using Differential-Scanning Calorimetry[J].Starch-Starke,2006,48(1):2-6
[7] Zhu T,Jackson D S,Wehling R L.Comparison of amylase determination methods and the development of a dual wavelength iodine binding technique[J].Cereal Chem,2008,85:51-58
[8] Wang J,Li Y,Tian Y.et al.A novel triple-wavelength colorimetric method for measuring amylase and amylopectin contents[J].Starch/St rke 2010,62:508-516
[9] Jarvis C E,Walker J R L.Simultaneous,rapid,spectrophotometric determination of total starch,amylose and amylopectin[J].J Sci Food Agri,1993,63:89-92
[10]Shi H X,Hao Y Y,Fang H Y,et al.Separation and Purification of Amylose and Amylopectin from Cassava Starch and Content Determination by Dual-wavelength Spectrophotometry[J].Food Science,2011,46(2):115-125
[11]金玉红,张开利,张兴春.双波长法测定小麦及小麦芽中直链、支链淀粉含量[J].中国粮油学报,2009,24(1):137-140
[12]刘襄河,郑丽璇,郑丽勉,等.双波长法测定常用淀粉原料中直链淀粉、支链淀粉及总粉含量[J].广东农业科学,2013,40(18):97-100
[13]王广鹏,刘庆香,孔德军.板栗支链淀粉含量的双波长测定方法[J].河北农业科技,2008,12(1):35-37
[14]金丽晨,耿志明,李金州,等.稻米淀粉组成及分子结构与食味品质的关系[J].江苏农业学报,2011,27(1):13-18
[15]马艳弘,钟小仙,乔月芳,等.双波长法测定珍珠粟淀粉中直链和支链淀粉的含量[J].江苏农业科学,2016,44(12):331-334
[16]徐发华,朱凯,荆永锋.不同时期施用苹果酸对烟叶中非挥发性有机酸的影响[J].西南农业学报,2008,21(1):66-70
[17]王文超,贺帆,宋朝鹏,等.双波长分光光度法测定烟草中的直链淀粉和支链淀粉[J].烟草化学,2013,6(311):50-52
Dual-wavelength Spectrophotometry Method for Measuring Amylase and Amylopectin Contents of Yam
CUI Jin1,2,LI Jian-jun2,MA Yan-hong2,LI Ya-hui2,WEI Jian-ming3,HAO Lin1,*
(1.College of Food Science and Nutrition Engineering,Shanxi Agricultural University,Jinzhong 030801,Shanxi,China;2.Institute of Agricultural Products Processing,Jiangsu Academy of Agricultural Sciences,Nanjing 210014,Jiangsu,China;3.Jiangsu Boda Biotechnology Ltd.,Xuzhou 221723,Jiangsu,China)
Dual-wavelength spectrophotometry was applied to the determination of amylase and amylopectin content in yam.According to the principle of dual-wavelength method determination,determine the purple yam starch measure wavelength and reference wave length.Absorbencies at 624 nm and 410 nm were used for amylose content measurement,absorbencies at 538 nm and 758 nm were used for amylopectin content measurement.An excellent linear relationship between starch-iodine complex and absorbance was achieved in the range of 0-50 μg/mL(R2=0.999 7)for amylose and 0-250 μg/mL(R2=0.998 4)for amylopectin.The content of amylase was 0.026 mg/mL and the average recovery was between 96.72%and 98.73%.The content of amylopectin was 0.072 mg/mL and the average recovery was between 95.74%and 97.87%,and the RSD were both less than 1.5%.
yam;dual-wavelength spectrophotometry;amylase;amylopectin
2017-03-30
江苏省农业自主创新基金项目(CX(16)1019)
崔晋(1992—),男(汉),硕士研究生,研究方向:食品生物技术。
*通信作者:郝林(1957—),男(汉),教授,博士,研究方向:食品生物技术。
10.3969/j.issn.1005-6521.2017.13.031
