17p染色体遗传学不稳定与乳腺癌发生的关系
2017-07-01赵娜冯玲杨宇石徐澍方艺
赵娜,冯玲,杨宇石,徐澍,方艺
(贵州医科大学,贵阳 550000)
17p染色体遗传学不稳定与乳腺癌发生的关系
赵娜,冯玲,杨宇石,徐澍,方艺
(贵州医科大学,贵阳 550000)
目的 检测乳腺病变组织标本17p染色体区间6个微卫星位点微卫星不稳定(MSI)和杂合性缺失(LOH)情况,进一步探讨乳腺癌发生的分子机制。方法 采用聚合酶链式反应-单链构象多态性(PCR-SSCP)分析方法检测106例份乳腺病变标本[其中乳腺导管上皮普通型增生(UDH)31例、非典型增生(ADH)10例、乳腺导管原位癌(DCIS)32例、乳腺浸润性导管癌(IDC)33例]17p染色体上6个微卫星位点(D17S695、D17S261、D17S786、D17S796、D17S831、D17S654)MSI及LOH发生情况。结果 106例标本中6个微卫星位点均有一定频率的LOH/MSI发生。D17S261、D17S796位点LOH/MSI发生总频率分别为32.1%、24.5%(P<0.05)。D17S261位点LOH/MSI发生率UDH低于DCIS,DCIS低于IDC(P均<0.01);D17S796位点LOH/MSI发生率UDH低于DCIS(P<0.01)。结论 乳腺病变组织标本17p染色体区间6个微卫星位点微卫星均有一定频率的LOH/MSI发生,17p染色体的遗传学不稳定是乳腺癌发生的前奏,D17S261、D17S796位点在UDH向IDC演变过程中可能起到关键作用。
乳腺癌;乳腺疾病;17p染色体;微卫星不稳定;杂合性缺失
近年来乳腺癌的发病率迅速上升,且呈年轻化趋势[1]。研究发现,微卫星不稳定(MSI)和杂合性缺失(LOH)是肿瘤发生途径的早期步骤,且是参与癌变的重要机制[2]。目前已有假设提出,乳腺癌有可能与结肠癌类似,是从增生性病变向浸润性癌演进的一个连续的组织学进程,其过程中通常伴有遗传学不稳定[3]。目前国内外文献报道17p染色体在多种肿瘤(如肺癌、肝癌、胃癌、前列腺癌等)LOH及MSI发生频率较高,但在乳腺增生性病变中LOH及MSI发生情况的相关报道较少。本研究在17p染色体上选择了6个微卫星位点,检测了106例份乳腺病变组织的MSI及LOH情况,旨在为乳腺癌的早期诊断提供分子生物学依据。
1 材料与方法
1.1 材料 收集贵州医科大学附属医院病理科2009~2014年经病理确诊的106例份乳腺组织库存蜡块,其中乳腺导管上皮普通型增生(UDH)31例、不典型增生(ADH)10例、乳腺导管原位癌(DCIS)32例、乳腺浸润性癌(IDC)33例。所有病例为女性,年龄(57±21)岁,无家族史,且均为原发肿瘤。标本均已由病理医师做回顾性诊断。
1.2 MSI及 LOH检测
1.2.1 DNA提取 石蜡组织切片取8~10片,二甲苯脱蜡完全后加入无水乙醇洗脱,蛋白酶K消化,石蜡组织DNA试剂盒美国Omega提取DNA,测定浓度(A260/A280在1.8~2.0的样本作为实验的模板DNA);-20 ℃保存。
1.2.2 引物合成 选取17p染色体上6个微卫星位点,引物序列见表1。引物序列均来自GenBank数据库,由上海生工生物工程技术服务有限公司合成。
1.2.3 聚合酶链式反应-单链构象多态性(PCR-SSCP)分析 PCR反应体系总体积为50 μL。其中DNA模版2 μL,Taq mix 25 μL(TaKaRa公司产品,内含1.25 U Taq、0.4 mmol/L dNTP、4 mmol/L Mg2+及Buffer),上、下游引物各1 μL,剩余量用灭菌双蒸水补齐。反应条件:94 ℃预变性10 min,94 ℃变性30 s,56~60 ℃退火30 s,72 ℃延伸1 min,循环35次;72 ℃最后延伸7 min。反应结束后,取5 μL进行1.0%琼脂糖凝胶电泳以观察扩增效果;再取PCR产物5 μL,加变性上样缓冲液5 μL混匀,进行94 ℃变性10 min,冰浴骤冷,80 V电压下进行8%尿素变性聚丙烯酰胺凝胶电泳60 min, 电泳液为1×TBE。电泳结束后, 取下凝胶, 经10%冰醋酸固固定、0.1% AgNO3溶液染色。显色至条带清晰,最后观察结果并记录。

表1 6个微卫星位点的引物序列及退火温度
判定标准:与正常组织比较,若被测组织等位基因出现条带数目的改变或位置迁移记为MSI;若某一条等位基因条带消失或相对密度减少50%以上记为LOH。阳性结果均重复2次,以排除假阳性。见图1。

注:T为病变组织,N为正常组织;A箭头所指为等位条带消失;B箭头所指为等位条带密度减少50%;C箭头所指为条带数目增加(本实验结果MSI以条带增加为主)。
1.3 统计学方法 采用SPSS22.0统计软件。多组间率的比较采用两样本构成比的χ2检验,若组间差异有统计学意义,进一步比较采用χ2分割法。P<0.05为差异有统计学意义。
2 结果
106例份乳腺病例标本中,D17S695、D17S654、D17S786、D17S796、D17S831、D17S261位点在UDH、ADH、DCIS、IDC中均有不同程度的LOH/MSI发生,见图2、表2。D17S261、D17S796位点UDH、ADH、DCIS、IDC的LOH/MSI总发生频率分别为32.1%、24.5%,二者比较P<0.05;D17S695、D17S786、D17S654、D17S831位点UDH、ADH、DCIS、IDC中LOH/MSI发生频率分别为19.8%、22.6%、34.0%、14.2%,P>0.05。D17S261位点UDH的LOH/MSI发生频率低于DCIS,DCIS低于IDC(P均<0.01);D17S796位点UDH的LOH/MSI发生频率低于DCIS(P<0.01)。

注:T1、N1为DCIS;T2、N2为IDC;T3、N3,T5、N5为UDH;N4、T4为ADH;其中T2箭头所指为MSI(+),其余均为LOH(+)。
3 讨论
肿瘤的形成主要是由于正常细胞的生长受控、分化受阻所致[4]。大多数研究认为,肿瘤细胞表型的形成关系到两条独立的途径:一种是以DNA错配修复基因缺陷为主,以基因组MSI为特征;另一种则以肿瘤抑制基因失活为主,以LOH为特征。两条途径分别代表了两种不同基因组不稳定性的机制[5]。
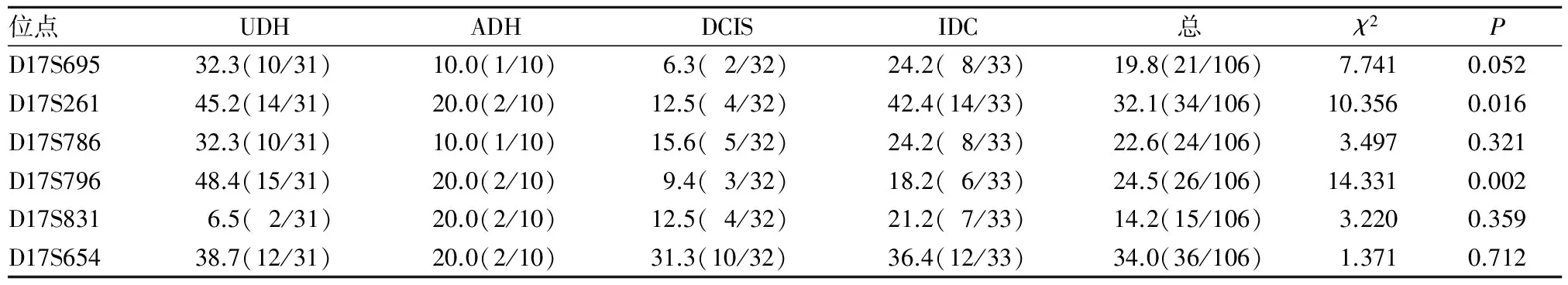
表2 106份标本所在各位点UDH、ADH、DCIS、IDC的LOH/MSI发生频率(%)
MSI又称复制错误,首先在遗传性非息肉性结直肠癌中被发现,随后在胃癌、子宫内膜癌、肝癌、前列腺癌等肿瘤中得以证实,被认为与肿瘤的发生发展有关[6]。微卫星是一种散布于人全基因组中的简单串列重复序列,多存在于非编码区内,通常为1~6个碱基对的15~30个重复单位,大约每100 000 bp中出现一个[7]。MSI是指经遗传异常状态,这种状态下,与正常细胞相比,微卫星的等位基因在基因组的增加或缺失的重复单元频率更高[8]。MSI状态是通过肿瘤与正常组织DNA进行比较确定的,其结果根据改变的微卫星序列的数目进行分类。如果改变是存在于两个或两个以上的五个微卫星序列中,该肿瘤被归类为高MSI(MSI-H);如果只有一个标记被突破,则被划分为低MSI(MSI-L);没有变化的五个微卫星之间存在的肿瘤则被认为是微卫星稳定(MSS)[9]。MSI作为最早应用于实验室筛查遗传性非息肉病性大肠癌的分子标记,其敏感性为100%,特异性在90%以上[10]。
LOH是基因组中很常见的一种基因组改变,其发生是由于一个等位基因的杂合性缺失,或母系或父系的染色体或染色体区与其他等位基因同时缺失的重叠。根据不同的拷贝数状态,杂合性缺失包括复制中立的、复制丢失的和复制增加的[11]。目前已经证实,LOH是多种肿瘤的重要遗传事件,且在正常细胞中由于节段性异倍性已经显示出纯合性的纯合子等位基因或其他机制[12]。
已有研究表明,大多数肿瘤癌旁正常组织中的基因组存在不稳定性,是提高IDC风险的潜在标志物[13]。目前DCIS、IDC有关LOH的多是通过比较病变组织与配对的邻近或远处正常组织的LOH进行[14],并提出假设,组织学上正常的组织基因也正常。然而这种假设并不成立,因为一些证据已证实LOH发生在形态学和组织学均正常的早期乳腺癌患者的正常乳腺组织中[15~17]。本研究结果显示,位于17p12区的D17S261以及位于17p13区的D17S796在乳腺普通型增生发展为乳腺癌的过程中出现了明显的LOH与MSI改变。提示在乳腺癌中17p染色体上LOH/MSI出现了高频改变。而在乳腺普通型增生发生时,提前关注17p染色体部分位点的突变可预测其发展为乳腺癌的可能性。
本研究结果提示,17p染色体的遗传学不稳定是乳腺癌发生的前奏,D17S261、D17S796位点突变在UDH向IDC演变过程中可能起到关键作用。提示临床可通过检测正常乳腺组织或良性病变乳腺组织D17S261、D17S796位点突变情况预测乳腺癌发生的可能性并进行预防。但该位点突变是作为独立因素还是与其他位点协同作用参与乳腺癌的发生,以及是否可作为评估乳腺癌发生风险的独立因素,还有待大量的研究证实。
[1] 周兴,钱立庭.人乳头瘤病毒感染与乳腺癌的关系研究进展[J].山东医药,2015,55(7):100-102.
[2] Migdalska-Sęk M, Karowicz-Bilińska A, Pastuszak-Lewandoska D, et al. Assessment of the frequency of genetic alterations (LOH/MSI) in patients with intraepithelial cervical lesions with HPV infection: a pilot study[J]. Med Oncol, 2016,33(5):51-52.
[3] 冯玲,徐澍,赵娜,等.乳腺癌和导管增生病变与1p染色体不稳定的关系[J].临床与实验病理学,2016,32(5):501-504.
[4] Zhou R, Curry JM, Roy LD, et al. A novel association of neuropilin-1 and MUC1 in pancreatic ductal adenocarcinoma: role in induction of VEGF signaling and angiogenesis[J]. Oncogene, 2016,35(43):5608-5618.
[5] 从文铭,张树辉,冼志红,等.肝细胞癌肿瘤抑制基因的杂合性缺失和微卫星不稳定性研究[J].中华病理学杂志,2005,34(2):71-74.
[6] Geiersbach KB, Samowitz WS. Microsatellite instability and colorectal cancer[J]. Arch Pathol Lab Med, 2011,135(10):1269-1277.
[7] Shao J, Washington MK, Saxena R, et al. Heterozygous disruption ofthe PTEN promotes intestinal neoplasia in APCmin/+mouse: roles of osteopontin[J]. Carcinogenesis, 2007,28(12):2476-2483.
[8] Lu Y, Soong TD, Elemento O. A novel approach for characterizing microsatellite instability in cancer cells[J]. PLoS One, 2013,8(5):e63056.
[9] Srdjan M, Jadranka A, Ivan D, et al. Microsatellite instability & survival in patients with stage Ⅱ/Ⅲ colorectal carcinoma[J]. Indian J Med Res, 2016,143(7):104-111.
[10] Bonis PA, Trikalinos TA, Chung M, et al. Hereditary nonpolyposis colorectal cancer: diagnostic strategies and their implications[J]. Evid Rep Technol Assess (Full Rep), 2007(150):1-180.
[11] Forghanifard MM, Vahid EE, Dadkhah E, et al. Loss of heterozygosity and microsatellite instability as predictive markers among Iranian esophageal cancer patients[J]. Iran J Basic Med Sci, 2016,19(7):726-733.
[12] Gavin H, Roth A, Daniel L, et al. Integrative analysis of genome-wide loss of heterozygosity and monoallelic expression at nucleotide resolution reveals disrupted pathways in triple-negative breast cancer[J]. Genome Res, 2012,22(10):1995-2007.
[13] Fang C, Wang FB, Li Y, et al. Down-regulation of miR-199b-5p is correlated with poor prognosis for breast cancer patients[J]. Biomed Pharmacother, 2016(84):1189-1193.
[14] Zikan M, Bohm J, Pavlista D, et al. Comparative analysis of loss of heterozygosity and expression profile in normal tissue, DCIS and invasive breast cancer[J]. Clin Transl Oncol, 2011,13(9):652-655.
[15] Rennstam K, Ringberg A, Cunliffe HE, et al. Genomic alterations in histopathologically normal breast tissue from BRCA1 mutation carriers may be caused by BRCA1 haploinsufficiency[J]. Genes Chromosomes Cancer, 2010,49(1):78-90.
[16] Reis-Filho JS, Lakhani SR. The diagnosis and management of pre-invasive breast disease: Genetic alterations in pre-invasive lesions[J]. Breast Cancer Res, 2003,5(6):313-319.
[17] Ruan X, Liu H, Boardman L, et al. Genome-wide analysis of loss of heterozygosity in breast infiltrating ductal carcinoma distantnormal tissue highlights arm specific enrichment and expansion across tumor stages[J]. PLoS One,2014,9(4):e95783.
贵州省科学技术基金资助项目(黔科合J字2278);贵州省社会发展攻关项目(黔科合SY字3016)。
徐澍(E-mail: xushu@gmc.edu.cn)
10.3969/j.issn.1002-266X.2017.20.013
R737.9
A
1002-266X(2017)24-0043-03
2016-06-03)
