PhaP介导EGFR靶向多肽修饰的肿瘤靶向PHBHHx纳米药物递送载体的构建
2017-07-01樊帆马建岗卢晓云牛腾吴志民
樊帆,马建岗,卢晓云,牛腾,吴志民
PhaP介导EGFR靶向多肽修饰的肿瘤靶向PHBHHx纳米药物递送载体的构建
樊帆,马建岗,卢晓云,牛腾,吴志民
西安交通大学生命科学与技术学院生物医学信息工程教育部重点实验室,陕西西安 710049

樊帆, 马建岗, 卢晓云, 等. PhaP介导EGFR靶向多肽修饰的肿瘤靶向PHBHHx纳米药物递送载体的构建. 生物工程学报, 2017, 33(6): 1028–1036.Fan F, Ma JG, Lu XY, et al. Development of tumor targeting PHBHHx nanoparticles by PhaP mediated immobilization of EGFR-targeting peptide. Chin J Biotech, 2017, 33(6): 1028–1036.
聚羟基脂肪酸 (PHA) 颗粒表面结合蛋白PhaP具有与疏水性高分子材料表面紧密结合的能力,本研究将EGFR靶向多肽 (ETP) 与PhaP进行融合表达,构建了ETP-PhaP融合蛋白表达的重组工程菌BL21(DE3)(pPI-ETP-P)。经对工程菌株的诱导表达及ETP-PhaP融合蛋白的纯化后,通过PhaP蛋白介导能够有效地将ETP-PhaP融合蛋白修饰于3-羟基丁酸-3-羟基己酸共聚酯 (PHBHHx) 纳米微球表面,构建成为具有EGFR靶向作用的药物递送载体。分别检测宫颈癌细胞系SiHa(EGFR高表达) 和CaSKi(EGFR低表达) 对ETP-PhaP修饰的PHBHHx纳米药物载体和未经修饰的纳米药物载体的吞噬情况。结果显示,纯化的ETP-PhaP融合蛋白能够很好地吸附于PHBHHx颗粒的表面,经ETP-PhaP融合蛋白修饰的PHBHHx纳米药物载体对EGFR高表达的宫颈癌SiHa细胞的靶向效果强于EGFR低表达的CaSKi细胞系。这一结果表明了PhaP介导的PHBHHx纳米微球表面EGFR靶向多肽修饰具有简便、高效的优势,为疏水性纳米药物载体表面功能多肽修饰提供了一种新策略。
PHA颗粒表面结合蛋白,3-羟基丁酸-3-羟基己酸共聚酯,表皮生长因子受体,肿瘤靶向,药物递送载体
纳米技术的快速发展及其在抗肿瘤药物递送领域的应用已经显示出其在延长药物作用时间、增加疗效、降低毒副作用、缓控释给药等方面的优势[1-3]。通过在纳米药物载体表面修饰特定的肿瘤靶向分子,可以进一步提高纳米药物在肿瘤局部的聚集,并可以通过配体受体介导的细胞内吞作用,实现肿瘤细胞内释药,减少肿瘤药物耐药性的产生等[4-5]。生物可降解高分子材料肿瘤靶向纳米药物开发中常用的载体材料,因其良好的生物相容性、控释能力以及生物可降解性而被广泛用于纳米药物[6-8],但其表面功能性靶向分子的修饰方法仍然较为局限。
聚羟基脂肪酸酯 (Polyhydroxyalkanoate,PHA) 是一类由多种微生物胞内合成的生物可降解聚酯材料[9],基于其脂肪族生物聚酯的化学性质,其在作为疏水性药物的包封及缓释载体方面具有很好的优势[10-13]。3-羟基丁酸-3-羟基己酸共聚酯 (PHBHHx) 是PHA家族中可加工性能较好的一种。PHBHHx具有良好的生物可降解性和生物相容性[14]。天然PHA颗粒表面结合的PHA颗粒表面结合蛋白 (PhaP) 是一种低分子量的两亲性蛋白[15],除了可与PHA材料结合之外,还可以在菌体中结合在胞内形成的三酰甘油包涵体上[16],或通过疏水作用与疏水性高分子如聚乳酸或聚苯乙烯等材料表面很好地结合[17]。PhaP蛋白能够与其他蛋白或多肽分子融合表达,从而通过PhaP介导将功能多肽或蛋白质固定化呈递于疏水材料表面[18-19]。有学者先后将麦芽糖结合蛋白 (MBP)、β-半乳糖苷酶 (LacZ)、氯霉素乙酰基转移酶 (CAT)[18]、小鼠白细胞介素-2 (IL-2)、髓磷脂寡树突胶质细胞糖蛋白 (MOG)[19]等多种蛋白通过此方法与PhaP融合表达后合成了表面负载相关蛋白的PHA微球。Yao等还通过将人类酸性糖蛋白 (hAGP) 及人类表皮生长因子 (hEGF) 与PhaP融合表达,构建了hAGP-PhaP和hEGF-PhaP修饰的PHA纳米颗粒,分别实现了其对肝癌细胞和巨噬细胞的靶向聚集作用[20]。本课题组前期也通过将人类免疫共刺激分子B7-2与PhaP蛋白融合表达后呈递于PHBHHx纳米颗粒表面,使功能化的纳米微球具有活化淋巴细胞的生物活性作用[21]。本研究中,我们将表皮生长因子受体靶向多肽 (ETP) 与PhaP蛋白融合表达,经过重组大肠杆菌的诱导表达和ETP-PhaP融合蛋白的分离纯化后,通过PhaP蛋白与PHBHHx纳米微球表面的相互作用,构建了具有EGFR靶向性的PHBHHx纳米药物递送载体。采用ETP多肽而非天然的EGF对PHBHHx纳米微球表面进行修饰,在实现微球对EGFR的靶向作用的同时,能够减少采用天然EGF靶向EGFR时可能造成的对受体功能的激活作用及由于受体激活引起的下游的细胞效应。研究中通过体外细胞学实验证明了ETP-PhaP修饰的PHBHHx纳米微球靶向肿瘤细胞表面EGFR的有效性,使得PhaP介导的纳米微球表面多肽修饰技术为包括PHA在内的多种疏水性高分子微球表面的功能化修饰提供了简便高效的策略。
1 材料与方法
1.1 ETP-PhaP融合蛋白表达质粒的构建及诱导表达
编码ETP-PhaP融合蛋白的DNA序列片段由上海捷瑞生物技术有限公司合成,在ETP-PhaP融合蛋白编码序列3′端设计合成有一个组氨酸标签,且DNA片段5′和3′端分别合成有Ⅰ和HⅠ的酶切位点序列。合成的DNA片段经双酶切后亚克隆至表达载体pTwin2中,获得的ETP-PhaP融合蛋白表达质粒pPI-ETP-P转化入.BL21(DE3)菌株中构建得到用于该融合蛋白表达的重组.BL21(DE3)(pPI-ETP-P) 工程菌。采用添加100 mg/mL氨苄青霉素的LB培养基进行重组大肠杆菌BL21(DE3)(pPI-ETP-P) 菌株的培养,在200 r/min、37 ℃下培养至600达到0.6–0.7时,添加0.5 mmol/L的IPTG并在23 ℃下继续培养6 h进行ETP-PhaP融合蛋白的诱导表达。
1.2 ETP-PhaP融合蛋白的分离纯化
培养结束后收集菌体,超声裂解后于4 ℃、12 000 r/min离心30 min,上清中的ETP-PhaP融合蛋白进一步通过镍亲和柱(GE Healthcare, USA) 进行纯化,洗脱的纯化蛋白进行脱盐处理后进行12%的SDS-PAGE分离,并通过抗组氨酸标签抗体为一抗,HRP偶联的小鼠IgG抗体为二抗进行ETP-PhaP融合蛋白的免疫印迹鉴定。
1.3 载荧光素PHBHHx纳米微球的制备
称取20 mg PHBHHx材料 (用于制备游离PHBHHx纳米颗粒) 或20 mg PHBHHx材料和 2 mg罗丹明B (用于制备PHBHHx纳米荧光颗粒)溶于1 mL氯仿中。将溶解有荧光素和材料的氯仿溶液用注射器缓慢加入5 mL的1% PVA (/) 溶液中并超声分散10 min形成乳液。将乳化液转移至磁力搅拌器上,充分搅拌6 h使PHBHHx纳米颗粒固化,室温下减压蒸馏除去体系中残留的氯仿。制备的纳米颗粒悬液在12 000 r/min离心20 min,用双蒸水清洗沉淀部分后将其重悬于5 mL的PBS缓冲液中,采用颗粒粒度分析仪 (马尔文公司,英国) 测定PHBHHx纳米颗粒粒径及分布。通过气相色谱法测定得到的PHBHHx纳米微球的质量,分别计算制备游离PHBHHx纳米微球和载罗丹明B的PHBHHx纳米微球的产率。
1.4 PHBHHx纳米颗粒表面ETP-PhaP蛋白的修饰及表征
将200 μL浓度为250 μg/mL的ETP-PhaP融合蛋白与1 mL的PHBHHx纳米颗粒悬液 (1 mg/mL) 混合后在4 ℃条件下孵育3 h。进一步在4 ℃、14 000 r/min条件下离心30 min收集修饰后的PHBHHx纳米颗粒。收集获得的修饰后颗粒经PBS缓冲液洗涤2次后,其表面结合的蛋白组分用200 mL的1×Laemmli SDS-PAGE缓冲液(Tris-HCl 63 mmol/L,甘油10%,SDS 2%,溴酚蓝0.002 5%,pH 6.8) 变性洗脱,用10%的SDS-PAGE分离后,转印至PVDF膜进行Western blotting鉴定 (一抗:组氨酸标签抗体,CW0286;二抗:抗小鼠IgG抗体,CW0102,Beijing CoWin Bioscience Co. Ltd.)。上清组分通过BCA法进行蛋白浓度测定,并与颗粒表面洗脱的蛋白一起进行SDS-PAGE及Western blotting检测。
1.5 人宫颈癌SiHa和CaSki细胞的体外培养及其EGFR表达水平鉴定
采用添加100 mL/L胎牛血清的RPMI-1640培养基,体外培养人宫颈癌SiHa和CaSki细胞。Western blotting检测两种细胞中EGFR的表达水平。EGFR特异性抗体 (#d38b1,Cell Signaling Technology) 为一抗 (1∶1 000),辣根过氧化氢酶标记的山羊抗兔抗体 (北京中杉金桥生物公司) 为二抗 (1∶5 000),DAP化学发光底物购自Thermo Scientific (34079)。
1.6 ETP-PhaP修饰的PHBHHx纳米颗粒的吞噬检测
为检测ETP-PhaP修饰的PHBHHx纳米颗粒对EGFR高表达肿瘤细胞的体外靶向效果, 0.5 mg/mL的ETP-PhaP修饰及未经修饰的PHBHHx荧光纳米颗粒分别与SiHa和CaSki细胞共同孵育1 h。孵育结束后,用PBS将细胞清洗3次,荧光显微镜观察细胞,并用酶标仪测定每孔细胞的荧光强度。
1.7 数据处理与统计学分析
所有实验设至少3个平行样品,实验数据表示为3次独立实验结果的平均数±标准差;应用软件SPSS 13.0进行检验,<0.05时认为差异具有统计学意义。
2 结果与分析
2.1 ETP-PhaP融合蛋白表达载体的构建及表达宿主的验证
ETP-PhaP融合蛋白的编码序列经Ⅰ和HⅠ酶切后插入表达载体pTwin2质粒中,获得ETP-PhaP融合蛋白的表达质粒pPI-ETP-P (图1A),将其转化入.BL21(DE3) 并再次进行质粒酶切验证(图1B),获得重组ETP-PhaP融合蛋白表达宿主菌.BL21(DE3)(pPI-ETP-P)。
2.2 ETP-PhaP融合蛋白的诱导表达及纯化
重组.BL21 (DE3) (pPI-ETP-P)经IPTG诱导表达ETP-PhaP融合蛋白,培养结束后裂解菌体,以镍亲和柱纯化ETP-PhaP融合蛋白,纯化过程各组分的SDS-PAGE图如图2A所示,图中在重组菌全菌裂解液 (泳道2) 及纯化出的目标蛋白样品 (泳道4) 中在ETP-PhaP融合蛋白15.5 kDa理论分子量大小的位置上均有一条明显的蛋白条带。Western blotting结果显示 (图2B),这两条蛋白条带均可被抗组氨酸标签抗体特异识别,判断为诱导表达出的ETP-PhaP融合蛋白。
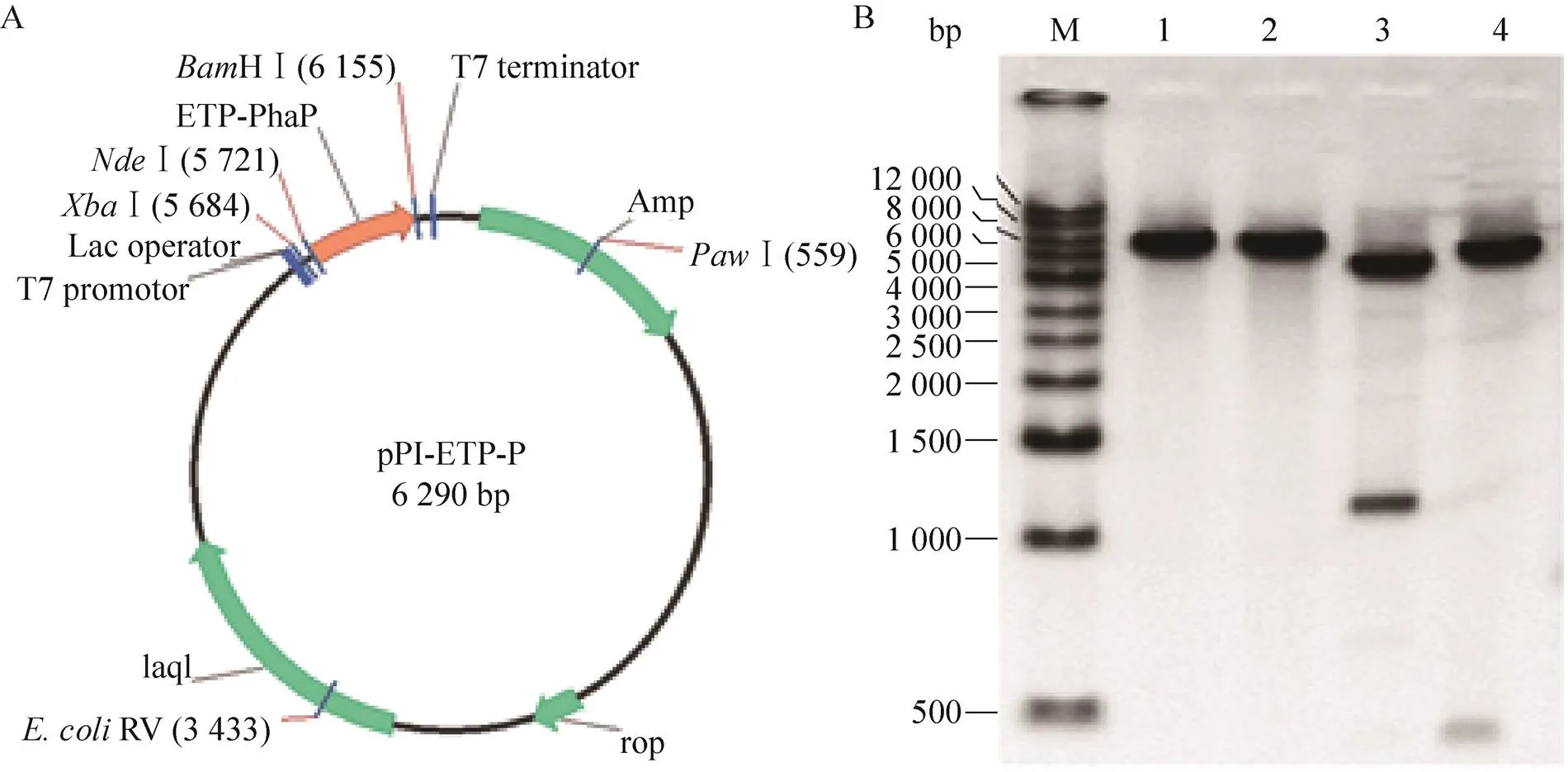
图1 pPI-ETP-P质粒 (A) 及其酶切验证图 (B)
2.3 PHBHHx荧光纳米微球的制备及表征
采用乳化/溶剂挥发方法制备得到了空白及包裹荧光素罗丹明B的PHBHHx纳米颗粒。空白PHBHHx纳米颗粒的平均粒径 ((155.7±17.2) nm) 略小于载荧光素的PHBHHx纳米颗粒 ((187.6±11.1) nm),但两者的粒径分布都较为均一,多分散系数 (PDI) 分别为0.153与0.037。两种颗粒表面Zeta电位均为–30 mV左右,其中空白PHBHHx纳米颗粒为(–29.2±1.5) mV,载荧光素的PHBHHx纳米颗粒为(–30.1±1.3) mV。包裹荧光素罗丹明B的PHBHHx纳米颗粒的产率 (45.9%±3.1%) 略低于空白PHBHHx纳米颗粒的产率 (61.7%±2.3%)。
2.4 ETP-PhaP融合蛋白在PHBHHx纳米微球表面的修饰
将500 μL浓度为1 mg/mL的ETP-PhaP融合蛋白 (500 μg) 与2 mL的PHBHHx纳米颗粒悬液(0.5 mg/mL) 在4 ℃条件下混合孵育3 h后,离心分别收集颗粒及上清,颗粒经缓冲液洗涤后,其表面结合蛋白经100 μL的1×Laemmli SDS-PAGE缓冲液洗脱。BCA法对孵育结束后上清中的蛋白定量检测结果显示,上清中残留蛋白浓度为 (138.8±4.6) μg/mL,计算可知PHBHHx纳米颗粒表面对ETP-PhaP融合蛋白的吸附量约为 (153±11.5) μg/mg。分别将上清和颗粒表面洗脱的融合蛋白进行SDS-PAGE和Western blotting检测,结果如图3所示。上清及颗粒表面ETP-PhaP融合蛋白比值的计算值与Western blotting结果灰度比值分析相符。
2.5 ETP-PhaP蛋白修饰的PHBHHx荧光纳米微球体对宫颈癌细胞的体外靶向能力
研究中首先验证了人宫颈癌SiHa细胞和CaSki细胞 (图4A) 的EGFR表达水平,其Western blotting检测结果见图4B。
在此基础上进一步开展了ETP-PhaP融合蛋白修饰的PHBHHx荧光纳米颗粒体外靶向EGFR的效果研究。体外培养的细胞分别用荧光强度相等的罗丹明B溶液、未经修饰PHBHHx荧光纳米颗粒和ETP-PhaP修饰的PHBHHx荧光纳米颗粒处理1 h后,荧光显微镜观察结果如图5A所示,各样品经蛋白定量均一化后检测细胞内荧光强度,结果见图5B。
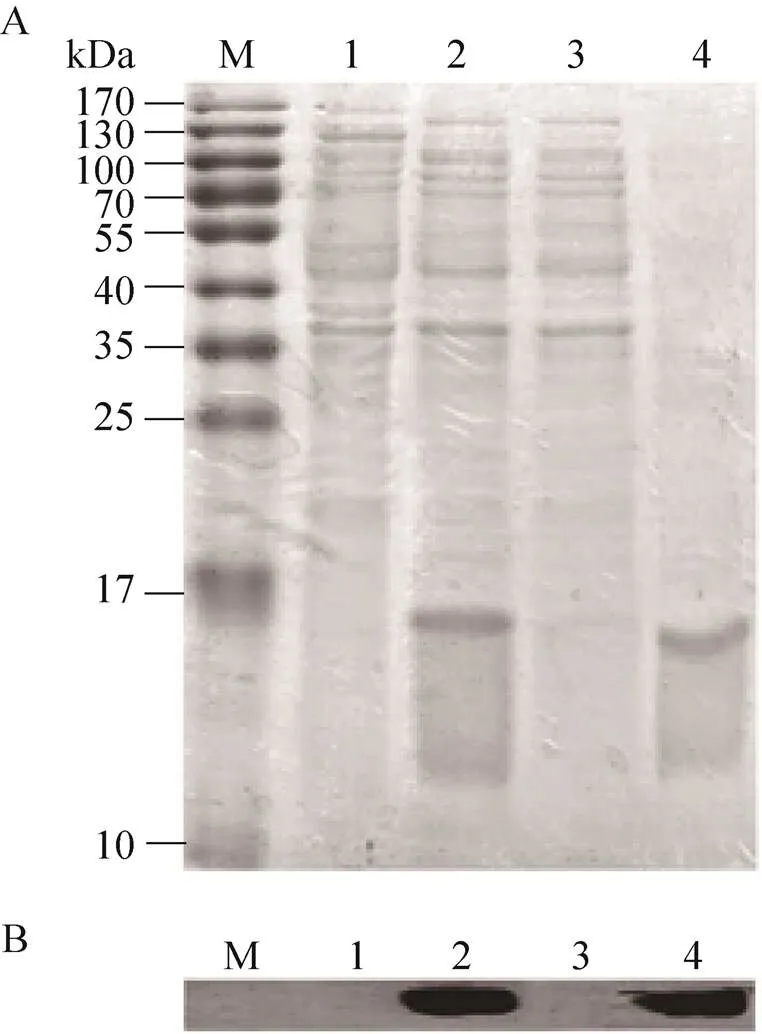
图2 重组工程菌表达ETP-PhaP融合蛋白的SDS-PAGE图 (A)及免疫印迹检测结果 (B)
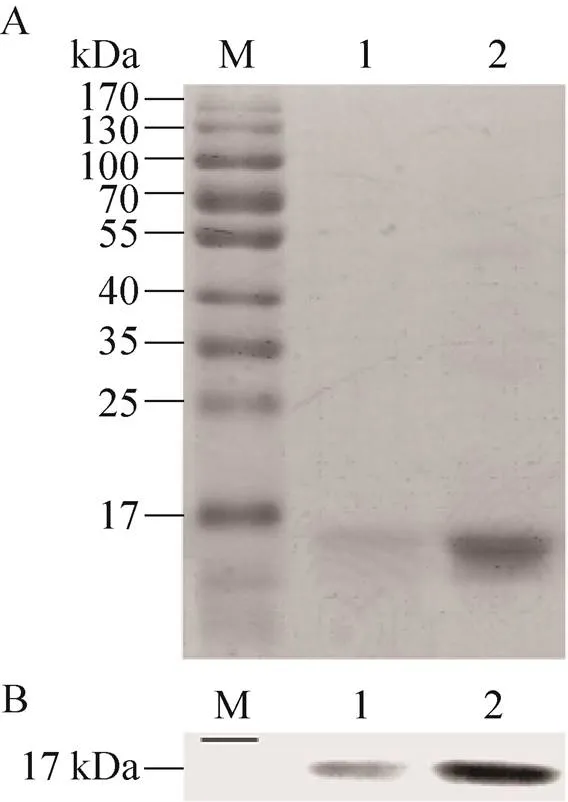
图3 PHBHHx颗粒表面及孵育上清中ETP-PhaP融合蛋白的SDS-PAGE图 (A) 及免疫印迹检测结果(B)
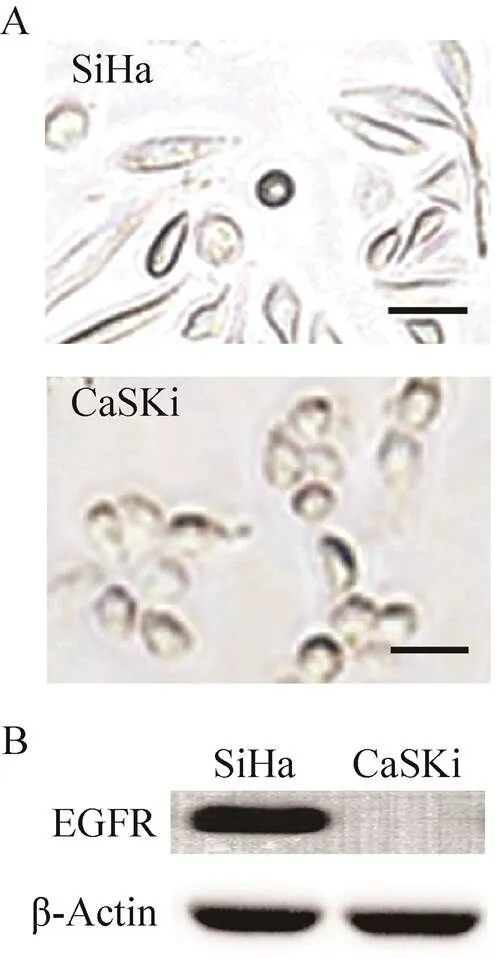
图4 SiHa及CaSKi细胞光镜照片 (A) 及其EGFR表达水平的Western blotting鉴定图 (B)
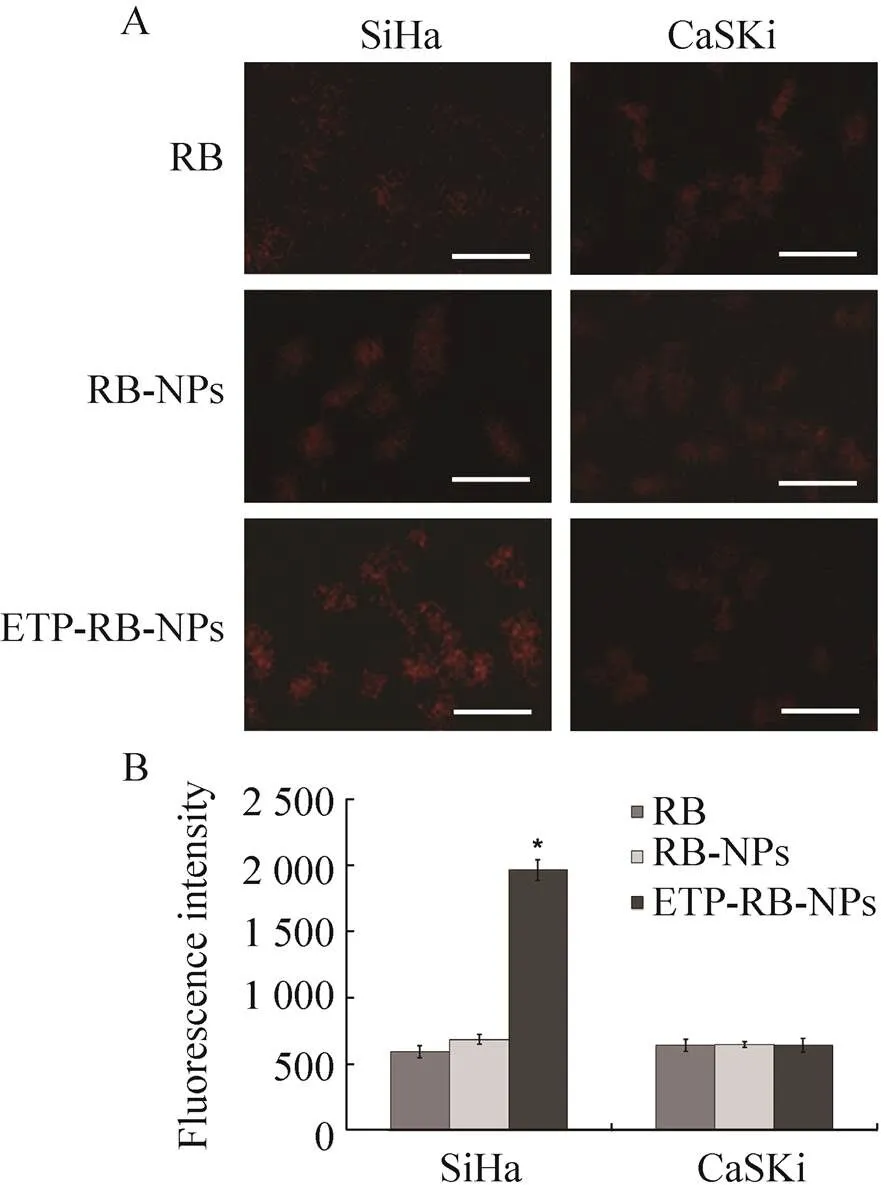
图5 SiHa及CaSKi细胞对游离罗丹明B、未经修饰和经ETP-PhaP修饰的PHBHHx荧光纳米颗粒的吞噬
由图中可以看出,用罗丹明B和未经ETP-PhaP融合蛋白修饰的载罗丹明B的纳米颗粒处理细胞后,SiHa和CaSKi细胞在显微镜下均呈现微弱的橙红色荧光着色。而用ETP-PhaP修饰的荧光纳米颗粒处理两种细胞后,表面EGFR低表达的CaSKi细胞着色未见增强,而在SiHa细胞内可以明显观察到橙红色荧光信号增强,荧光定量检测结果也显示ETP-PhaP修饰的荧光纳米颗粒处理的SiHa细胞内荧光强度增加约2.3倍,说明ETP-PhaP修饰的荧光纳米颗粒可以经由SiHa细胞表面的EGFR与ETP多肽的识别,更好地被EGFR高表达的SiHa细胞摄取内吞入胞。
3 讨论
PHA是一种天然的生物可降解聚酯材料,在体内具有良好的生物相容性和生物可降解性,其降解产物3-羟基丁酸是人体内正常代谢的中间产物酮体的一种,对细胞安全无毒。PHA在组织工程领域的应用已得到广泛的研究[22-23],大量实验证明PHA材料对细胞的生物相容性优于其他生物降解高分子材料 (如PLA、PLGA、壳聚糖等)。近年来,其作为药物递送载体的研究也崭露头角[10-13]。PHA纳米颗粒避免了很多纳米微球 (如脂质体等) 在大剂量使用时的毒性问题[24],其在体内可完全降解并被彻底代谢掉,不存在体内蓄积的潜在隐患。基于PHA材料的聚酯特性、良好的生物相容性和生物安全性,其在疏水性药物的控释方面有着独特的优势[25]。PHA作为药物载体的另一优势在于其表面可通过疏水作用吸附大量PHA颗粒结合蛋白 (PhaP)。而PhaP易与其他蛋白或多肽分子融合表达,从而可以方便地将多种靶向多肽分子通过与PhaP蛋白融合表达而高效地结合在PHA颗粒表面。
本研究中,我们将具有EGFR靶向作用的短肽ETP融合于PHA颗粒结合蛋白PhaP的氨基端,获得的ETP-PhaP融合蛋白经纯化后由PhaP介导吸附于制备好的PHBHHx纳米颗粒表面。经测定及计算可以得到,PHBHHx纳米颗粒表面对ETP-PhaP融合蛋白的吸附量约为 (153±11.5) μg/mg,即每毫克PHBHHx纳米颗粒约吸附10 nmol的融合蛋白。考虑PHBHHx的密度约为1.25 g/cm3,则每毫克材料制备的颗粒数约为4.0×1011个,由此可粗略计算出平均每个PHBHHx纳米微球上能够结合1.5×104个融合蛋白分子。这一估算值提示PHBHHx纳米颗粒表面结合的ETP-PhaP融合蛋白较为丰富,进一步可以通过定量质谱等技术对颗粒表面的蛋白结合量进行更为精确的测定。
在进行PHBHHx颗粒表面蛋白修饰的研究中,为了保证ETP-PhaP融合蛋白能够充分与颗粒结合,本实验中设定了孵育时间为3 h,且使用了过量的ETP-PhaP融合蛋白。而在实验过程中我们也发现,PhaP介导的PHBHHx颗粒表面融合蛋白的修饰在孵育1 h左右即可达到饱和。对于包封有药物的高分子纳米载体而言,在药物装载后进行的修饰、分离等后续处理步骤都有可能造成包封药物的泄露或损失,因此,后续加工步骤越少,工艺越简单,造成的药物损失越少。经PhaP介导的PHBHHx颗粒表面多肽修饰的过程非常简单,不需添加任何额外的反应物或催化剂,只需将制备好的颗粒与融合蛋白溶液共混。通过控制投放的PHBHHx颗粒量与融合蛋白的量,能够实现全部融合蛋白均被吸附至颗粒表面。与采用化学交联法对高分子纳米颗粒表面修饰的工艺相比,通过PhaP介导进行PHBHHx微球表面多肽的修饰极大地降低了颗粒修饰后繁琐的反应、分离及纯化等步骤,也不存在反应物或催化剂残留等潜在问题,是一种非常方便高效的方法。
与未经ETP-PhaP修饰的纳米颗粒相比,ETP-PhaP修饰后的PHBHHx荧光纳米颗粒能够更好地被EGFR高表达的SiHa细胞所摄取。而对EGFR低表达的CaSKi细胞而言,修饰与否并未对PHBHHx纳米颗粒的被动摄取造成明显影响。这一体外结果显示ETP-PhaP修饰后的PHBHHx纳米颗粒具有针对EGFR选择性的肿瘤细胞靶向能力。
4 结论
通过PhaP介导进行PHBHHx微球表面多肽修饰的技术化工艺简单,成本低廉,能够有效实现EGFR靶向多肽在PHBHHx纳米药物载体表面的功能化修饰,使其具有明显的体外EGFR高表达肿瘤细胞的靶向作用。这一方法未来可进一步用于多种不同靶向分子修饰的抗肿瘤药物递送载体的构建与开发。
[1] Seigneuric R, Markey L, Nuyten DS, et al. From nanotechnology to nanomedicine: applications to cancer research. Cur Mol Med, 2010, 10(7): 640–652.
[2] Farokhzad OC, Langer R. Impact of nanotechnology on drug delivery. ACS Nano, 2009, 3(1): 16–20.
[3] Shi J, Votruba AR, Farokhzad OC, et al. Nanotechnology in drug delivery and tissue engineering: from discovery to applications. Nano Lett, 2010, 10(9): 3223–3230.
[4] Jain RK, Stylianopoulos T. Delivering nanomedicine to solid tumors. Nat Rev Clin Oncol, 2010, 7(11): 653–664.
[5] Dong XW, Mumper RJ. Nanomedicinal strategies to treat multidrug-resistant tumors: current progress. Nanomedicine, 2010, 5(4): 597–615.
[6] Masood F. Polymeric nanoparticles for targeted drug delivery system for cancer therapy. Mater Sci Eng C, 2016, 60: 569–578.
[7] Kamaly N, Yameen B, Wu J, et al. Degradable controlled-release polymers and polymeric nanoparticles: Mechanisms of controlling drug release. Chem Rev, 2016, 116(4): 2602–2603.
[8] Mora-Huertas CE, Fessi H, Elaissari A. Polymer-based nanocapsules for drug delivery. Int J Pharm, 2010, 385(1): 113–142.
[9] Yin J, Chen XM, Chen GQ. Progress on polyhydroxyalkanoates (PHA). Chin J Biotech, 2016, 32(6): 726–737 (in Chinese).尹进, 车雪梅, 陈国强. 聚羟基脂肪酸酯的研究进展. 生物工程学报, 2016, 32(6): 726–737.
[10] Lu XY, Ciraolo E, Stefenia R, et al. Sustained release of PI3K inhibitor from PHA nanoparticles andgrowth inhibition of cancer cell lines. Appl Microbiol Biotechnol, 2011, 89(5): 1423–1433.
[11] Xiong YC, Yao YC, Zhan XY, et al. Application of polyhydroxyalkanoates nanoparticles as intracellular sustained drug-release vectors. J Biom Sci Polymer Ed, 2010, 21(1): 127–140.
[12] Lu XY, Li MC, Zhu XL, et al. Microbial synthesized biodegradable PHBHHxPEG hybrid copolymer as an efficient intracellular delivery nanocarrier for kinase inhibitor. BMC Biotechnol, 2014, 14: 4.
[13] Shrivastav A, Kim HY, Kim YR. Advances in the applications of polyhydroxyalkanoate nanoparticles for novel drug delivery system. Biomed Rea Int, 2013, 2013: 581684.
[14] Chen GQ, Wu Q. The application of polyhydroxyalkanoates as tissue engineering materials. Biomaterials, 2005, 26(33): 6565–6578.
[15] Pieper-Fürst U, Madkour MH, Mayer F, et al. Identification of the region of a 14-kilodalton protein of Rhodococcus ruber that is responsible for the binding of this phasin to polyhydroxyalkanoic acid granules. J Bacteriol, 1995, 177(9): 2513–2523.
[16] Hänisch J, Wältermann M, Robenek H, et al. TheH16 phasin PhaP1 is targeted to intracellular triacylglycerol inclusions inPD630 andmc2155, and provides an anchor to target other proteins. Microbiology, 2006, 152(11): 3271–3280.
[17] Wang ZH, Wu HN, Chen J, Zhang J, et al. A novel self-cleaving phasin tag for purification of recombinant proteins based on hydrophobic polyhydroxyalkanoate nanoparticles. Lab Chip, 2008, 8(11): 1957–1962.
[18] Banki MR, Gerngross TU, Wood DW. Novel and economical purification of recombinant proteins: intein-mediated protein purification usingpolyhydroxybutyrate (PHB) matrix association. Protein Sci, 2005, 14(6): 1387–1395.
[19] Backstrom BT, Brockelbank JA, Rehm BH. Recombinantproduces tailor-made biopolyester granules for applications in fluorescence activated cell sorting: functional display of the mouse interleukin-2 and myelin oligodendrocyte glycoprotein. BMC Biotechnol, 2007, 7: 3.
[20] Yao YC, Zhan XY, Zhang J, et al. A specific drug targeting system based on polyhydroxyalkanoate granule binding protein PhaP fused with targeted cell ligands. Biomaterials, 2008, 29(36): 4823–4830.
[21] Li MC, Liu QQ, Lu XY, et al. Heterologous expression of human costimulatory molecule B7-2 and construction of B7-2 immobilized polyhydroxyalkanoate nanoparticles for use as an immune activation agent. BMC Biotechnol, 2012, 12: 43.
[22] Li Z, Loh XJ. Water soluble polyhydroxyalkanoates: future materials for therapeutic applications. Chem Soc Rev, 2015, 44(10): 2865–2879.
[23] You M, Peng G, Li J, et al. Chondrogenic differentiation of human bone marrow mesenchymal stem cells on polyhydroxyalkanoate (PHA) scaffolds coated with PHA granule binding protein PhaP fused with RGD peptide. Biomaterials, 2011, 32(9): 2305–2313.
[24] Yah CS, Simate GS, Iyuke SE. Nanoparticles toxicity and their routes of exposures. Pak J Pharm Sci, 2012, 25(2): 477–491.
[25] Fan F, Lu XY, Ren K, et al. Entrapment and sustained release of hydrophobic drugs with different molecular weights from PHBHHx-PEG nanoparticles. Chin J Biomed Eng, 2014, 23(2): 66–73.
(本文责编 郝丽芳)
Development of tumor targeting PHBHHx nanoparticles by PhaP mediated immobilization of EGFR-targeting peptide
Fan Fan, Jiangang Ma, Xiaoyun Lu, Teng Niu, and Zhimin Wu
Key Laboratory of Biomedical Information Engineering of Ministry of Education, School of Life Science and Technology, Xi’an Jiaotong University, Xi’an 710049, Shaanxi, China
PHA granule binding protein phasin (PhaP) has a high affinity for hydrophobic materials and can bind to hydrophobic polymers via strong hydrophobic interaction. In this study, an EGFR-targeting peptide (ETP) was fused with PhaP and the fusion protein ETP-PhaP was produced in recombinantBL21 (DE3) (pPI-ETP-P) and then purified by Ni affinity purification. The tumor targeting PHBHHx nanoparticles were developed based on PhaP mediated ETP immobilization and the cellular uptake of the ETP-PhaP modified PHBHHx NPs and none modified PHBHHx NPs by cervical cancer cell lines SiHa (EGFR over expressed) and CaSKi (EGFR low expressed) were analyzed. The purified ETP-PhaP could be adsorbed onto the hydrophobic surface of PHBHHx NPs. The ETP-PhaP modified PHBHHx NPs could target to EGFR over expressed cervical cancer cells SiHa more efficiently than to the EGFR low expressed CaSKi cells. These results demonstrated the advantage in effectiveness and convenience of PhaP mediated ETP adsorption on PHBHHx nanoparticles, providing a novel strategy for hydrophobic nanocarrier surface modification.
PhaP, PHBHHx, EGFR, tumor targeting, drug delivery carrier
10.13345/j.cjb.160454
November 18, 2016; Accepted:February 6, 2017
Xiaoyun Lu. Tel/Fax: +86-29-82668463; E-mail: luxy05@mail.xjtu.edu.cn
Supported by:National Natural Science Foundation of China (Nos. 81172170, 81371288).
国家自然科学基金(Nos. 81172170,81371288)资助。
网络出版时间:2017-04-11
http://kns.cnki.net/kcms/detail/11.1998.Q.20170411.1704.002.html
