射频消融治疗符合米兰标准的早期肝癌疗效分析
2017-07-01崔芒芒朱晓琳张倜武强崔云龙李慧锴李强房锋张伟宋天强
崔芒芒 朱晓琳 张倜 武强 崔云龙 李慧锴 李强 房锋 张伟 宋天强
射频消融治疗符合米兰标准的早期肝癌疗效分析
崔芒芒 朱晓琳 张倜 武强 崔云龙 李慧锴 李强 房锋 张伟 宋天强
目的:探讨射频消融治疗符合米兰标准的早期肝癌的疗效及预后危险因素。方法:回顾性分析天津医科大学肿瘤医院72例行射频消融治疗的符合米兰标准的早期肝癌患者病例,评估其术后恢复情况,分析复发率、生存率及预后危险因素。结果:72例患者术后并发症轻微且恢复迅速,术后1、2、3年累积复发率分别为12.50%、20.83%和33.33%;1、2、3年累积生存率分别为93.06%、87.50%、79.17%。多因素分析提示肿瘤大小与复发密切相关,肿瘤大小与术前白蛋白水平是影响总生存的独立危险因素。结论:射频消融术治疗符合米兰标准的早期肝癌,近远期效果良好。肿瘤大小是复发的独立危险因素,肿瘤大小与术前白蛋白水平是影响总生存的重要因素。
射频消融 米兰标准 肝癌 预后 危险因素
肝癌是常见的恶性肿瘤之一,占癌症相关死因第3位[1]。肝癌早期,肿瘤数目较少、直径较小,手术切除为首选治疗手段[2]。随着微创技术的兴起和发展,射频消融越来越多地用于早期肝癌的治疗。本研究回顾性分析天津医科大学肿瘤医院肝胆肿瘤科2010年1月至2013年12月72例射频消融治疗的符合米兰标准的早期肝癌病例,评估射频消融术后疗效并探讨影响预后的危险因素,为早期肝癌尤其是符合米兰标准的早期肝癌的治疗提供临床指导。
1 材料与方法
1.1 病例资料
收集2010年1月至2013年12月首诊治疗为射频消融的符合米兰标准的早期肝癌患者72例。入选标准为单个肿瘤直径≤5 cm或多个肿瘤数目≤3个且最大直径≤3 cm,影像学检查无大血管侵犯或淋巴结或肝外转移,Child-Pugh分级A或B,且无顽固性腹水。所有患者均经临床、影像学检查(CT或MRI)以及甲胎蛋白检测确诊为原发性肝癌。肝硬化诊断依据为:1)慢性肝病史如乙肝或丙肝病毒感染;2)肝表面结节状、欠光滑、尾叶肥大等影像学表现;3)门静脉高压的临床证据,如食管胃静脉曲张、脾肿大、血小板计数<100×109/L以及腹水。患者术前均常规行超声检查,3例行超声引导下穿刺活检确诊病理类型为4.17%(3/72)。72例共80处病灶(表1)。

表1 患者临床特征Table 1 Clinical characteristics of patients
1.2 方法
术前常规检查评估患者全身状况。采用日本ALOKA α7探术及穿刺引导系统,美国cool-tip冷循环射频治疗仪。全身麻醉后5例开腹射频,67例经超声引导射频。B超引导下选择肋间进针,将射频治疗针刺入肿瘤深面,开启仪器后针尖温度迅速升高,达到靶温度90~100℃后持续6~12 min(具体时间依肿瘤大小而定),最后进行针道消融。直径≤3 cm的肿瘤单次消融,>3 cm者多点重叠消融,治疗结束前B超确认消融范围覆盖整个肿瘤,消融安全范围距离瘤灶边缘为0.5~1.0 cm。
1.3 统计学分析
采用SPSS 20.0软件进行统计学分析,应用Ka⁃plan-Meier及Log-Rank检验进行单因素分析,Cox比例风险模型进行多因素分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 近期疗效
术后有30例患者出现不同程度的肝功能异常,主要表现为谷丙转氨酶与谷草转氨酶升高,经护肝等对症治疗后各指标恢复正常;5例低热;3例有轻微恶心呕吐症状;未见严重并发症如腹水、出血、肝衰竭等。所有患者于术后1~16 d后恢复出院,中位术后住院时间为4 d。
2.2 远期疗效
72例术后进行了定期的复查和随访。随访频率为术后前3个月,每月复查1次,3个月到半年每3个月复查1次,之后每半年复查1次。复查的项目包括彩超、CT或MRI、肿瘤标志物甲胎蛋白检测以及肝功能检测。
截至2016年12月,72例患者中位随访时间为40(9~77)个月。随访期间复发27例,具体分类为:原病灶及其邻近部位的新发病灶为肝内局部复发,其他肝段或同一肝段距原病灶>2 cm的新发病灶为肝内远处复发,肿瘤门静脉侵犯或转移为BCLC分期C期复发[3]。其中肝内局部复发11例,肝内远处复发13例,肝外远处转移3例;术后1、2、3年累积复发率分别为12.50%、20.83%和33.33%。死亡17例且均为肝癌相关,中位生存时间为43(5~80)个月,术后1、2、3年累积生存率分别为93.06%、87.50%、79.17%。
在分析预后影响因素时,本研究筛选11项可能的危险因素,如年龄、性别、术前白蛋白水平等进行单因素分析,结果发现复发与肿瘤大小和年龄有关(图1、2)。将单因素分析中有意义的因素进一步纳入多因素分析,结果显示肿瘤大小为复发的独立危险因素(表2)。单因素分析表明肿瘤大小和术前白蛋白水平与患者总生存时间密切相关(图3、4),多因素分析显示上述两项指标均为影响总生存时间的独立危险因素(表3)。

图1 不同肿瘤大小患者复发曲线Figure 1 Recurrence curves of patients with different tumor sizes

图2 不同年龄患者复发曲线Figure 2 Recurrence curves of patients in different ages

表2 复发相关因素的单因素及多因素分析Table 2 Univariate and multivariate analyses of factors associated with tumor recurrence
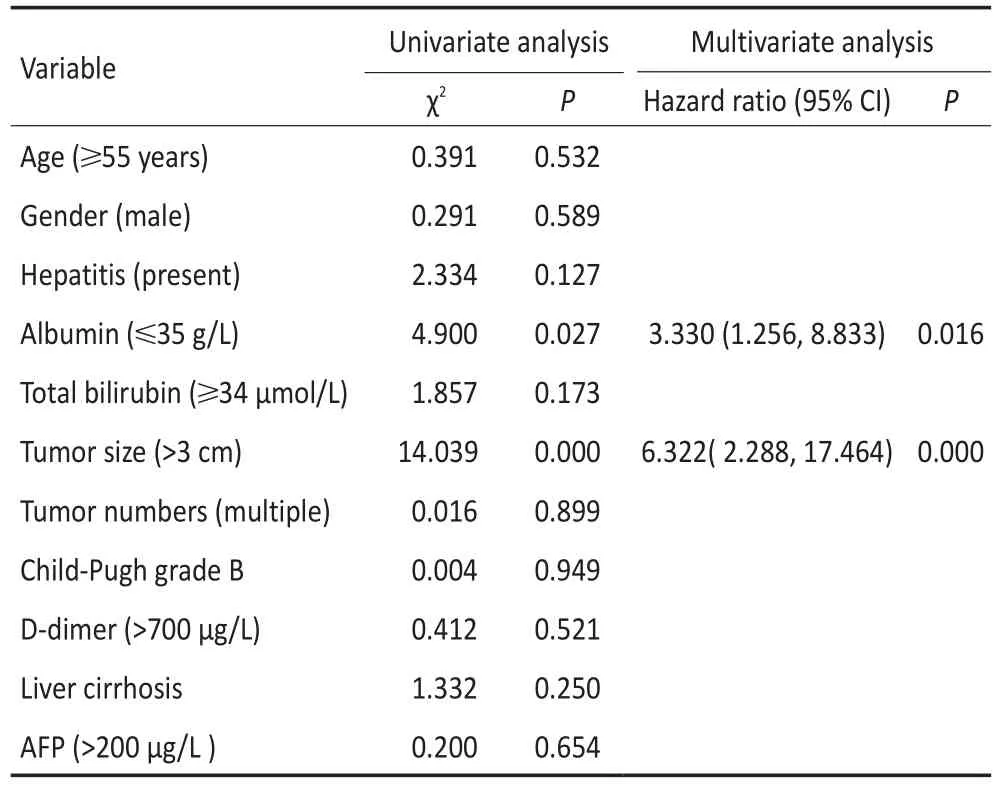
表3 总体生存相关因素的单因素及多因素分析Table 3 Univariate and multivariate analyses of factors associated with overall survival

图3 不同肿瘤大小患者生存曲线Figure 3 Survival curves of patients with different tumor sizes

图4 不同白蛋白水平患者生存曲线Figure 4 Survival curves of patients with different albumin levels
3 讨论
肝癌是我国最常见的恶性肿瘤之一,发病率、死亡率居高不下。早期肝癌可选择手术治疗,但由于我国肝癌患者往往合并肝硬化病史[4],限制了手术在早期肝癌中的应用。射频消融利用其热效应原理局部损毁瘤灶[5],为早期肝癌提供了一种新的治疗方案。
射频消融的进行需要影像技术的引导,超声定位即是其中一项技术方法[6]。肿瘤组织内部持续升温使细胞发生凝固性坏死继而发生不可逆性损伤[7],利用这一特性,在超声引导下,将射频电极针插入肿瘤内部,射频电流的组织热效应(90~110℃)可以直接杀灭肿瘤细胞[8],从而达到损毁瘤体、治愈肝癌的目的。
射频消融是一种微创技术,其手术时间短,术后并发症少[9],常见有低热、疼痛、恶心呕吐、肝功能异常等[10]。本研究中出现术后转氨酶升高的30例患者中,21例存在肝硬化,提示术前肝硬化较重、肝功能储备较差发生肝功能异常并发症的可能性较大。此类患者术前应积极改善肝功能,术后加强护肝治疗,尽量避免并发症的发生。除肝功能异常外,本研究患者其他并发症仅为术后低热或恶心呕吐,症状轻微,恢复迅速,住院时间短。在短期效果方面,射频消融相比手术切除具有明显的优势[11]。
射频消融术后的复发问题一直广受关注。本研究中,肝内局部复发11例,局部复发率为15.28%。中位复发时间为22个月,1、2、3年累积复发率分别为12.50%、20.83%和33.33%,而周铁等[12]研究显示此类患者的中位复发时间为18个月,1、2、3年的累积复发率分别为41.2%、58.7%和71.9%。射频术后的局部复发率从2%至60%不等[13],肿瘤大小不仅是局部复发的独立危险因素[14],本研究显示与复发同样密切相关。本研究患者肿瘤偏小,直径均值仅为(2.36±0.80)cm,直径≤3 cm者62例(86.11%),这可能是本研究局部复发率和累积复发率均偏低的原因。射频消融对于早期肝内复发的病灶具有很强的可重复操作性[15],这使得射频消融在早期复发性肝癌的治疗方面具有广阔的应用价值。
据报道,射频消融与手术切除治疗符合米兰标准的肝癌生存疗效相当[16-20]。Chen等[17]与Feng等[19]的研究显示,手术治疗的1、2、3年累积生存率分别为93.3%、82.3%、73.4%和93.1%、83.1%、67.2%,本研究的相应生存率分别为93.06%、87.50%、79.17%,疗效与之相近。
多因素分析表明,肿瘤大小是预后的独立危险因素,与相关报道结论一致[21-23]。肿瘤直径较大时往往需要反复多点热凝,在各个损毁区域之间可能残留无法重叠的盲区,使得消融不彻底[24]。而且肿瘤增大后出现卫星病灶及微转移灶的风险也相应增加,导致无法彻底消融。对于直径3~5 cm的肝癌而言,消融范围>1 cm可以有效改善患者预后[25]。另外,术前白蛋白水平对总体生存影响显著。Nishika⁃wa等[26]在研究射频消融治疗肝癌时发现,白蛋白水平是影响患者总生存时间的重要因素。Toshikuni等[27]的研究同样表明白蛋白值≤35 g/L严重影响患者长期生存时间。白蛋白由肝脏合成,其水平偏低表明肝功能状况较差。此类患者易发生蛋白质-能量营养不良,进而影响预后[26]。
射频消融用于治疗符合米兰标准的早期肝癌,安全微创,疗效确切,尤其适用于肿瘤直径≤3 cm的患者。对于肿瘤直径>3 cm的肿瘤,应在严格选择适应证基础上慎重行射频消融并达到安全消融范围。另外,积极纠正低白蛋白血症、改善患者肝功能,对于提高远期生存率、改善预后,具有十分重要的临床意义。然而,本研究属于回顾性分析且样本量较少,亟需更大样本量的临床研究的验证。
[1] Jordi B,Tadatoshi T,Vincenzo M,et al.Adjuvant sorafenib for hepatocellular carcinoma after resection orablation(STORM):a phase 3,randomised,double-blind,placebo-controlled trial[J].Lancet Oncol,2015,16(13):1344-1354.
[2] Gao J,Wang SH,Ding XM,et al.Radiofrequency ablation for single hepatocellular carcninoma 3 cm or less as first-line treatment[J].World J Gastroenterol,2015,21(17):5287-5294.
[3] Facciorusso A,Del Prete V,Antonino M,et al.Post-recurrence survival in hepatocellular carcinoma after percutaneous radiofrequency ablation[J].Dig Liver Dis,2014,46(11):1014-1019.
[4]Liao MH,Huang JW,Wu H,et al.Shall we take a second thought before applying radiofrequency ablation for resectable HCC≤2cm[J]?Hepatobiliary Surg Nutr,2014,3(3):109-111.
[5] Hou WJ,Zhu XL,Zhang XJ,et al.Imaging characteristics of hepatocellular carcinoma after radiofrequency ablation[J].Chin J Clin Oncol,2012,39(14):1000-1002.[侯文静,朱晓琳,张雪君.肝癌射频治疗后影像学特征研究进展[J].中国肿瘤临床,2012,39(14):1000-1002.]
[6] Ye GH,Yang H.Application value of contrast-enhanced ultrasound before and after radiofrequency ablation of hepatic carcionoma[J].Chinese General Practice,2015,18(9):1090-1093.[叶桂宏,杨红.超声造影在肝癌射频消融前后的应用价值研究[J].中国全科医学,2015,18(9):1090-1093.]
[7] Li JY,Luo YK.Application of radiofrequency ablation technology in treatment of thyroid nodules[J].Acad J Chin PLA Med Sch,2016,37(7):807-809.[李建如,罗渝昆.射频消融技术在甲状腺结节治疗中的应用[J].解放军医学院军报,2016,37(7):807-809.]
[8] Mou SD,Chen JH.The advancement of radiofrequency ablation in the treatment of hepatocellular carcinoma[J].Chin J Clin Oncol Rehabil,2014,21(3):379-381.[牟尚东,陈俊辉.肝癌射频消融治疗技术进展[J].中国肿瘤临床与康复,2014,21(3):379-381.]
[9] Feng K,Ma KS.Value of radiofrequency ablation in the treatment of hepatocellular carcionoma[J].World J Gastroenterol,2014,20(20):5987-5998.
[10]Ding Q,Yin SW,Xiang TM.Complications of multipolar radiofrequency ablation in the treatment of advanced liver cancer:clinical analysis and prevention[J].J Intervent Radiol,2014,23(4):343-345.[丁强,殷世武,项廷淼.多极射频消融治疗肝癌并发症的临床分析及防治[J].介入放射学杂志,2014,23(4):343-345.]
[11]Duan CY,Liu MY,Zhang ZH,et al.Radiofrequency ablation versus hepatic resection for the treatment of early-stage hepatocellular carcinoma meeting Milan criteria:a systematic review and meta-analysis[J].World J Surg Oncol,2013,11(1):190.
[12]Zhou T,Kong WT,Qiu YD,et al.Factors influencing the survival rates and intrahepatic recurrence after radiofrequency ablation for small hepatocellular carcinoma[J].Chin J Min Inv Surg,2010,10(5):387-390.[周铁,孔文韬,仇毓东,等.小肝癌射频消融治疗后患者生存及肝内肿瘤复发的有关因素分析[J].中国微创外科杂志,2010,10(5):387-390.]
[13]Mulier S,Ni YC,Jamart J,et al.Local recurrence after hepatic radiofrequency coagulation:multivariate meta-analysis and review of contributing factors[J].Ann Surg,2005,242(2):158-171.
[14]Peng ZW,Zhang YJ,Chen MS,et al.Radiofrequency ablation as firstline treatment for small solitary hepatocellular carcinoma:longterm results[J].Eur J Surg Oncol,2010,36(11):1054-1060.
[15]Zeng P,Zhou LD,Wang D,et al.Radiofrequency ablation for small hepatocellular carcinoma:efficacy and prognostic factors[J].Chinese Journal of General Surgery,2014,23(7):904-909.[曾鹏,周乐杜,王栋,等.射频消融治疗小肝癌疗效及预后因素分析[J].中国普通外科杂志,2014,23(7):904-909.]
[16]Wang YQ,Luo QQ,Li YP,et al.Radiofrequency ablation versus hepatic resection for small hepatocellular carcinomas:a meta-analysis of randomized and nonrandomized controlled trials[J].PLoS One,2014,9(1):e84484.
[17]Chen MS,Li JQ,Zheng Y,et al.A prospective randomized trial comparing percutaneous local ablative therapy and partial hepatectomy for small hepatocellular carcinoma[J].Ann Surg,2006,243(3):321-328.
[18]Amaud H,Pierre B,Christophe L,et al.Radiofrequency ablation versus surgical resection for hepatocellular carcinoma within the Milan criteria:a study of 281 Western patients[J].Int J Hyperthemia,2015,35(7):749-757.
[19]Feng K,Yan J,Li XW,et al.A randomized controlled trial of radiofrequency ablation and surgical resection in the treatment of small hepatocellular carcinoma[J].J Hepatol,2012,57(4):794-802.
[20]Pompili M,Saviano A,de Matthaeis N,et al.Long-term effectiveness of resection and radiofrequency ablation for single hepatocellular carcinoma≤3 cm,results of a multicenter Italian surgery[J].J Hepatol,2013,59(1):89-97.
[21]Li RL,Wan J.Prognostic factors of primary liver RFA analysis[J].J Mod Oncol,2015,23(20):2970-2972.[李蕊利,万娟.原发性肝癌射频消融预后的影响因素分析[J].现代肿瘤医学,2015,23(20):2970-2972.]
[22]Shou JW,Fang Y,Chai F,et al.Clinical prognostic factors analysis of radiofrequency ablation on 194 cases of primary hepatocellular carcinoma[J].Clin Edu Gener Prac,2014,12(2):155-158.[寿佳威,方勇,柴枫,等.原发性肝癌194例患者射频消融术后临床预后因素分析[J].全科医学临床与教育,2014,12(2):155-158.]
[23]El-Fattah MA,Aboelmagd M,Elhamouly M.Prognostic factors of hepatocellular carcinoma survival after radiofrequency ablation:a US population-based study[J].United European Gastroenterol J,2017,5(2):227-235.
[24]Wang Y,Ren ZG.Correlation factors for recurrence of liver cancer after raidofrequency ablation[J].Chin J Clin Oncol,2008,35(7):411-414.[王妍,任正刚.射频治疗肝癌术后复发的相关因素[J].中国肿瘤临床,2008,35(7):411-414.]
[25]Ke S,Ding XM,Qian XJ,et al.Radiofrequency ablation of hepatocellular carcinoma sized>3 and≤5 cm:Is ablative margin of more than 1 cm justified[J]?World J Gastroenterol,2013,19(42):7389-7398.
[26]Nishikawa H,Osaki Y,Iguchi E,et al.Percutaneous radiofrequency ablation therapy for recurrent hepatocellular carcinoma[J].Anticancer Res,2012,32(11):5059-5065.
[27]Toshikuni N,Takuma Y,Goto T,et al.Prognostic factors in hepatitis C patients with a single small hepatocellular carcinoma after radiofrequencyablation[J].Hepatogastroenterology,2012,59(120):2361-2366.
(2017-03-07收稿)
(2017-04-23修回)
(编辑:郑莉 校对:孙喜佳)
Efficacy analysis of radiofrequency ablation in the treatment of early-stage hepatocellular carcinoma within the Milan criteria
Mangmang CUI,Xiaolin ZHU,Ti ZHANG,Qiang WU,Yunlong CUI,Huikai LI,Qiang LI,Feng FANG,Wei ZHANG,Tianqiang SONG
Tianqiang SONG;E-mail:tjchi@hotmail.com
Department of Hepatobiliary Cancer,Tianjin Medical University Cancer Institute and Hospital;National Clinical Research Center for Cancer;Key Laboratory of Cancer Prevention and Therapy,Tianjin;Tianjin's Clinical Research Center for Cancer,Tianjin 300060,China
Objective:To assess efficiency of radiofrequency ablation(RFA)in the treatment of early-stage hepatocellular carcinoma within the Milan criteria and analyze prognostic factors.Methods:Reviews were conducted on clinical data of 72 patients with earlystage hepatocellular carcinoma meeting the Milan criteria who underwent RFA in Tianjin Medical University Cancer Institute and Hospital.Recovery status after RFA was assessed,as well as recurrence rate,survival rate,and risk factors associated with prognosis were analyzed.Results:Slight post-RFA complications were observed,and all 72 patients recovered rapidly.For 1-,2-,and 3-year cumulative recurrence rates,computed values reached 12.50%,20.83%,and 33.33%,respectively.For 1-,2-,and 3-year cumulative survival rates,computed values totaled 93.06%,87.50%,and 79.17%,respectively.Multivariate analysis showed that tumor size was closely associated with recurrence and that tumor size and serum albumin levels before RFA were predictive factors for overall survival.Conclusion:RFA is an effective method in treatment of early-stage hepatocellular carcinoma within the Milan criteria.Tumor size is an independent risk factor of recurrence and along with preoperative serum albumin levels,it is a significant factor affecting overall survival of patients.
radiofrequency ablation,Milan criteria,hepatocellular carcinoma,prognosis,risk factors

10.3969/j.issn.1000-8179.2017.11.256
天津医科大学肿瘤医院肝胆肿瘤科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心(天津市300060)
宋天强 tjchi@hotmail.com
崔芒芒 专业方向为肝胆肿瘤的临床及基础研究。
E-mail:cuixiaoqianyou@163.com
