MicroRNA-21及其靶基因程序性细胞死亡因子4在动脉粥样硬化中的作用
2017-07-01朱晓彤张圣洁梁雪李广平
朱晓彤 张圣洁 梁雪 李广平
300211 天津医科大学第二医院心脏科 天津市心血管病离子与分子机能重点实验室 天津心脏病学研究所
·基础研究·
MicroRNA-21及其靶基因程序性细胞死亡因子4在动脉粥样硬化中的作用
朱晓彤 张圣洁 梁雪 李广平
300211 天津医科大学第二医院心脏科 天津市心血管病离子与分子机能重点实验室 天津心脏病学研究所
目的 探讨microRNA(miR)-21及其靶基因程序性细胞死亡因子4(PDCD4)在动脉粥样硬化(AS)发生发展中的作用。方法 收集38例急性ST段抬高型心肌梗死(STEMI)患者及34例非冠心病患者的血浆,实时定量PCR检测miR-21的表达水平。在Lipo3 000的介导下,将miR-21类似物、抑制剂及沉默PDCD4(siPDCD4)分别转染鼠巨噬细胞系RAW 264.7细胞,并用氧化修饰低密度脂蛋白(ox-LDL)与细胞共同孵育,设立空白对照组(未转染且未加ox-LDL)及ox-LDL组(仅加ox-LDL)。采用油红O染色检测细胞泡沫化程度,实时定量PCR及Western blot分别检测泡沫细胞中miR-21及PDCD4蛋白水平。此外,建立ApoE-/-小鼠AS模型20只,按随机数字表法分为3组:单纯高脂喂养组6只、过表达miR-21组7只及阴性对照组(NC,7只),鼠尾静脉注射胆固醇包裹的miR-21激动剂(agomiR-21)及阴性对照agomiR-NC分别建立过表达miR-21组及NC组。选用正常饲料喂养的C57BL/6小鼠作为正常对照组。实时定量PCR检测miR-21在AS斑块及正常动脉组织中的表达;Western blot及免疫组化分别检测PDCD4蛋白水平。结果 与相应的对照组比较,miR-21在STEMI患者血浆、泡沫细胞及单纯高脂喂养ApoE-/-小鼠斑块组织中的表达水平均明显升高(P<0.001;P<0.01;P<0.01);泡沫细胞及单纯高脂喂养ApoE-/-小鼠斑块内PDCD4蛋白水平明显增多;与ox-LDL组比较,ox-LDL+miR-21类似物组及ox-LDL+siPDCD4组巨噬细胞泡沫化程度明显下降,ox-LDL+miR-21抑制剂组细胞泡沫化程度明显增加。过表达miR-21组AS斑块内PDCD4蛋白水平较NC组明显减少,且斑块较NC组明显减小。结论 miR-21在急性STEMI患者血浆中、泡沫细胞及AS斑块内的水平明显升高。过表达miR-21及沉默PDCD4可抑制巨噬细胞向泡沫细胞的转化,这与动物组织实验结果一致,表明miR-21或可靶向调控PDCD4的表达,从而发挥抗AS的作用。
microRNA-21; 程序性细胞死亡因子4; 动脉粥样硬化; 急性ST段抬高型心肌梗死; 泡沫细胞
MicroRNAs(miRs)是一类长22个核苷酸左右的非编码RNA小分子,参与多种生理和病理机制发生,包括炎症和心血管疾病[1]。其中,miR-21在血管平滑肌细胞的增殖、凋亡,心肌细胞的生长、死亡以及心肌成纤维细胞的功能中均发挥重要作用。研究表明,miR-21在缺血性细胞死亡及心肌梗死中的保护性作用是通过其靶基因程序性细胞死亡因子4(programmed cell death 4,PDCD4)及其下游激活蛋白1(activating protein 1,AP-1)实现的[2]。PDCD4是新确定的一种抑癌基因,目前认为PDCD4的缺失可促进小鼠巨噬细胞自噬介导的脂质降解,阻止巨噬细胞转变为泡沫细胞,并可减少ApoE-/-小鼠动脉粥样硬化(atherosclerosis,AS)斑块中的脂质沉积,进而减缓AS斑块的形成[3]。然而,miR-21及其靶基因PDCD4在AS的发生发展过程中的作用尚存在争论。本研究通过分析急性ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)患者血浆中的含量,初步阐明miR-21水平与STEMI的关系,并通过体外细胞及动物组织模型,证实miR-21与PDCD4及二者之间的关系在AS中的作用。
1 材料与方法
1.1 患者入选及样本采集
收集于天津医科大学第二医院住院的STEMI患者38例,并收集同期住院的非冠心病患者34例作为对照组,所有患者均行冠状动脉造影检查。排除恶性肿瘤、血栓栓塞、进展中的肝脏疾病、肾功能衰竭、瓣膜性心脏病、扩张型心肌病及其他炎性疾病等。收集所有入选对象的临床病例资料,血浆样本于-80 ℃保存备用。
1.2 细胞转染及泡沫细胞诱导
将小鼠巨噬细胞系RAW 264.7细胞(ATCC,美国)于转染前1 d铺至6孔板中,加入完全培养基,按Lipo3000(Invitrogen,美国)说明书进行miR-21类似物/抑制剂及siPDCD4的转染。培养6 h后,加入终浓度为50 μg/ml的氧化低密度脂蛋白(ox-LDL)培养48 h。收集细胞提取RNA及蛋白,并采用油红O染色液试剂盒(北京雷根)按说明书对细胞进行染色。
1.3 AS小鼠模型建立及取材
4~6周龄的雄性ApoE-/-小鼠共20只,给予高脂饲料喂养20周,建立AS模型,按随机数字表法分为3组:单纯高脂喂养组6只、过表达miR-21组7只及阴性对照组(negative control,NC)7只,胆固醇包裹的miR-21激动剂(miR-21 agonist,agomiR-21)及阴性对照agomiR-NC冻干粉(广州锐博)溶入PBS配成混悬液,单次注射剂量为10 nmol,于单纯高脂喂养组、过表达miR-21组及NC组小鼠尾静脉内分别注入等体积PBS、agomiR-21及agomiR-NC,1次/3 d共4周。选用正常饲料喂养的C57BL/6小鼠作为正常对照组(controls)7只。
小鼠断颈处死,将四肢固定于鼠板,75%乙醇消毒并剪开胸部皮肤,剪去小鼠的胸骨和肋骨,去除肺组织,由近端剪断食管和气管,剥离完整的主动脉,将主动脉浸泡于4%多聚甲醛过夜,制备HE染色及免疫组化切片。未经4%多聚甲醛灌流的主动脉用DEPC·H2O处理过的研磨棒将血管研磨溶解后,分成两部分,一部分待提取RNA;另一部分加RAPI裂解液,-80 ℃保存,留待提取蛋白。
1.4 实时定量PCR检测miR-21及U6基因表达
采用miRNA提取试剂盒(北京天根)按说明书从血浆中提取总RNA,Trizol法提取细胞总RNA,按动物组织RNA提取试剂盒(北京天根)说明书提取主动脉内总RNA,并反转录获得cDNA。定量PCR以U6为内参,反应条件:95 ℃预变性10 min热启动后,进行40个如下循环:95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s。miR-21的相对表达量以2-ΔΔCt方法计算。
1.5 HE染色
石蜡包埋,间断均匀切片,厚度为5 μm,进行HE染色,光镜下观察血管形态学改变。
1.6 免疫组织化学及Western blot检测PDCD4的表达
免疫组化:采用SP法。石蜡切片脱蜡,3%H2O2避光孵育20 min,蒸馏水、PBS各洗5 min。用柠檬酸钠缓冲液微波抗原修复15 min,取出迅速冷却,PBS洗2次各5 min。滴加封闭液,37 ℃孵育30 min,倾去不洗。加入PBS按1:100稀释的Rabbit-antiPDCD4(ab79405)一抗,37 ℃孵育30 min,4 ℃过夜。PBS洗2次各5 min,加生物素标记山羊抗兔IgG,37 ℃孵育30 min。PBS洗2次各5 min,加辣根过氧化物酶标记的链霉卵白素工作液,37 ℃孵育30 min。PBS洗2次各5 min,DAB显色。用苏木精复染,脱水、透明,中性树胶封片。
Western blot:细胞裂解液裂解细胞及动脉组织
研磨裂解后,加蛋白上样缓冲液后煮5 min,经10% SDS-PAGE电泳,转移到醋酸纤维素膜上,5% TBSTM封闭过夜,次日用一抗孵育2 h,TBST洗3次,5 min/次,再加二抗孵育1 h,TBST洗6次,5 min/次,ECL显色,暗室曝光显影。内参选用辣根过氧化物酶标记鼠抗β-actin 抗体,图像分析软件对条带进行灰度分析。
1.7 统计学方法
2 结果
2.1 miR-21在STEMI患者血浆中的表达
实时定量PCR结果显示,与对照组比较,miR-21在急性STEMI患者血浆中的水平明显升高(9.477±1.500比1.000±0.3795,P<0.001)。
2.2 miR-21、PDCD4在小鼠泡沫细胞中的表达
实时定量PCR及Western blot结果显示,小鼠巨噬细胞源性泡沫细胞中miR-21及PDCD4的表达水平明显升高(图1)。
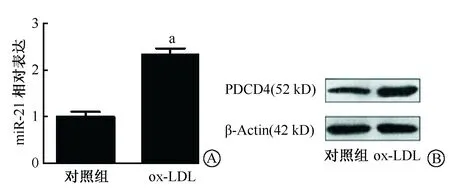
A:miR-21在小鼠泡沫细胞中的表达(aP<0.01);B:PDCD4在小鼠泡沫细胞中的表达图1 miR-21和PDCD4在小鼠泡沫细胞中的表达
2.3 miR-21和PDCD4对细胞泡沫化的影响
油红O染色显示,与ox-LDL组比较,ox-LDL+miR-21类似物组及ox-LDL+siPDCD4组巨噬细胞泡沫化程度明显下降,ox-LDL+miR-21抑制剂组细胞泡沫化程度明显增加(图2)。

图2 miR-21和PDCD4对巨噬细胞泡沫化的影响(油红O染色,×40)

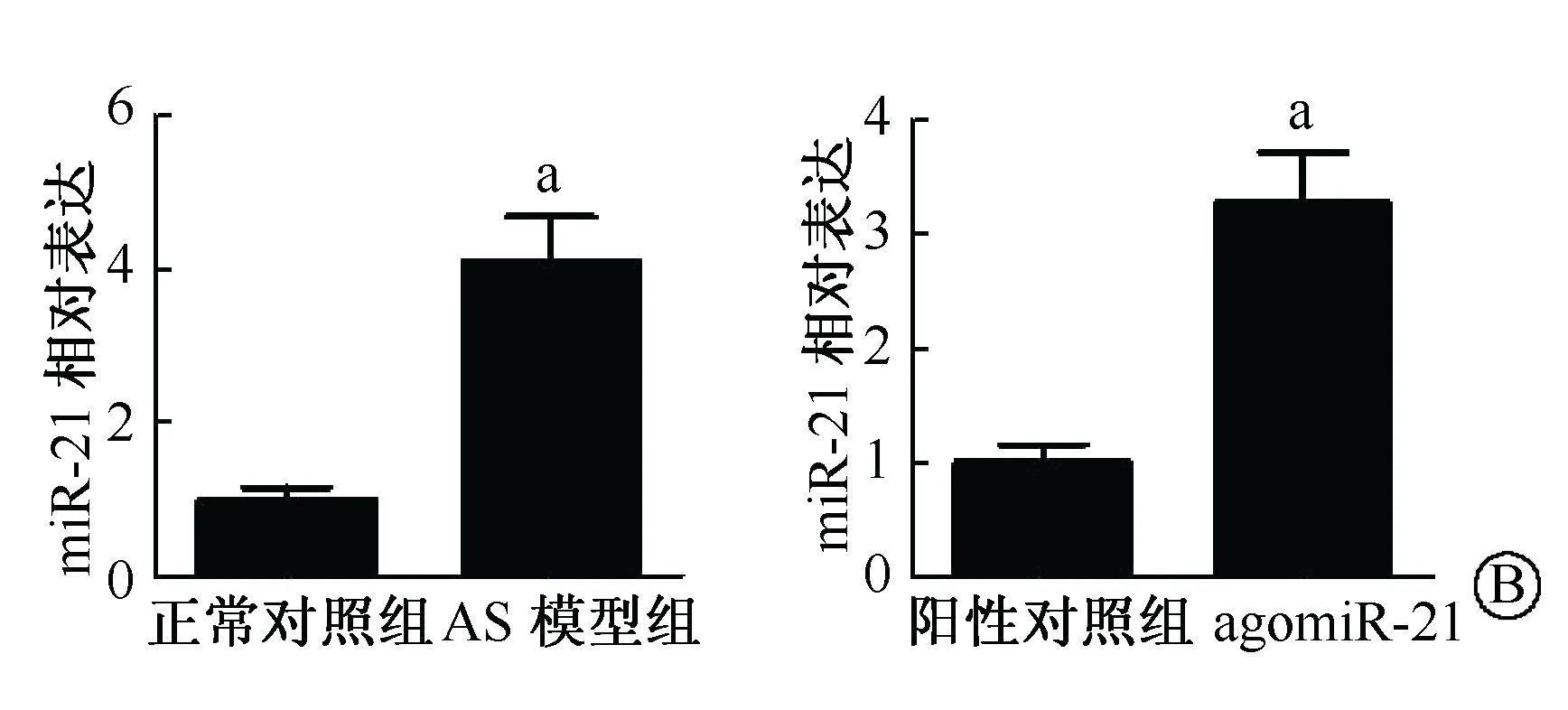


A:AS模型、agomiR-21及阴性对照组模型的建立(油红O染色×10);B:miR-21在各组小鼠的主动脉中的表达;C、D:小鼠主动脉PDCD4蛋白免疫组化染色及Western blot (aP<0.01),(油红O染色,×40)图3 miR-21含量与PDCD4蛋白水平在AS病变动脉中的表达
2.4 miR-21和PDCD4对AS斑块的影响
动物模型建立(图3A)。实时定量PCR结果显示,与正常对照组(C57BL/6小鼠)比较,单纯高脂喂养小鼠AS斑块中miR-21的表达水平明显升高(P<0.01,图3B)。免疫组化及Western blot结果显示,单纯高脂喂养小鼠斑块内PDCD4蛋白水平较正常对照组明显增多(图3C);过表达miR-21组AS斑块内PDCD4蛋白水平较NC组明显减少,且斑块明显减小(图3D)。
3 讨论
AS是动脉硬化性疾病中最常见的一种。其特点是病变从动脉内膜开始,先后有脂质和复合糖类积聚、出血和血栓形成、纤维组织增生和钙质沉着,并有动脉中层的逐渐蜕变和钙化。近年来,AS导致的冠状动脉粥样硬化性心脏病(coronary artery disease,CAD)成为我国人群的主要死亡原因之一,而急性心肌梗死(acute myocardial infarction,AMI)是导致冠心病患者发生不良预后及猝死的主要原因。2016年5月10日发布的《中国心血管病报告2015》显示,2014年中国AMI死亡率城市为55.32/10万,农村为68.60/10万,AMI死亡率均随年龄的增加而增加,其递增趋势近似于指数关系[4]。研究发现,炎症氧化反应贯穿AS斑块的起始形成,炎症介质和脂类相互作用决定斑块进展破裂,在AMI的病变中起着核心作用[5]。
miR-21是一种广泛表达于多种组织并且参与多种疾病发生发展的miR。多项研究表明,miR-21在AS患者血浆中的表达升高[6]。然而,miR-21在AS发生发展过程中的作用尚存在争论。有研究表明,AMI模型及患者心肌缺血边缘区及非缺血部位中miR-21的表达升高,转染miR-21可以缩小缺血面积,提示miR-21或可改善冠心病的预后[7]。另有学者发现,miR-21在球囊拉伤、剪切力损伤或H2O2损伤的血管平滑肌细胞中显著升高,并可促进血管平滑肌增殖及迁移[8],提示miR-21升高可促进AS的形成。
PDCD4是近年发现的一种重要的抑癌基因,通过抑制蛋白转录和翻译抑制肿瘤的发生、发展从而发挥抑癌基因的功能[9]。miR作为生物体内重要的小分子非编码RNA在转录后水平上调控靶基因起到了广泛作用。多项研究表明miR-21直接靶向调节PDCD4基因在人多数肿瘤组织如口咽癌、前列腺癌、胰腺癌、乳腺癌等中发挥重要作用[10-13]。另外,对巨噬细胞自噬及其相关功能的影响证实PDCD4能够抑制多种刺激诱导的巨噬细胞自噬,发现通过抑制巨噬细胞自噬促进巨噬细胞泡沫化形成,并且在AS发生发展过程中也发挥至关重要作用[3]。有研究表明,miR-21可以靶定并抑制PDCD4的表达以减轻H2O2导致的心肌细胞损伤[14],提示miR-21或可改变AS斑块稳定性,可能成为早期识别AS的循环标志物,成为CAD的新的治疗靶点。
本实验在临床患者外周血中检测到miR-21的表达。有研究表明细胞可通过分泌含有miRs的微泡进入到外周血循环,miRs可以在细胞和组织器官中建立信号通路,并携带细胞内的生理及病理信息,可作为疾病诊断、预测及疾病监控的新的生物标志物[15]。Deddens等[16]在小鼠缺血再灌注损伤模型中发现损伤的心肌可释放含有心脏和肌肉特异性miRs的微泡到血液循环中,并可在血浆中快速检测到。本实验结果显示miR-21水平在急性STEMI患者血浆中显著升高,但循环miR-21能否取代传统的心血管病标记物,如肌钙蛋白、肌酸激酶等,我们需进一步证实miR-21与急性冠状动脉综合征相对应的动态变化,并寻找一种快速的检测方法。本实验在入选人群中,并未纳入非ST段抬高型心肌梗死及心绞痛患者,未能涵盖所有冠心病人群,有待进一步完善。
在转染miR-21类似物/抑制剂及siPDCD4并用ox-LDL处理RAW264.7细胞成泡沫细胞的体外模型中发现,过表达miR-21及沉默PDCD4可抑制巨噬细胞向泡沫细胞的转化。提示miR-21可发挥抗AS的作用。建立ApoE-/-小鼠AS模型,并采用鼠尾静脉注射法建立过表达miR-21 AS模型,结果显示,单纯高脂喂养小鼠AS斑块中miR-21的表达水平明显升高,且过表达miR-21组AS斑块内PDCD4蛋白水平较NC组明显减少,且斑块明显减小。提示miR-21抑制PDCD4的表达,并可减缓AS斑块的发展。同时,单纯高脂喂养小鼠斑块内PDCD4蛋白水平较正常小鼠动脉组织中明显增多,提示PDCD4蛋白很可能具有促AS的作用,进一步证实miR-21在AS发生发展中起保护性作用。本研究在细胞及动物实验中,有待进一步明确miR-21与PDCD4之间的关系及深入探索发生机制。
综上可见,miR-21在急性STEMI患者、泡沫细胞及AS斑块中的水平明显升高,有望成为临床诊断急性STEMI和预测AS形成的新的指标。miR-21或可靶向调控PDCD4的表达,从而发挥抗AS作用,为延缓AS从而治疗CAD提供了新的治疗方向,对于早期预防、诊断及治疗CAD将具有重要意义。
利益冲突:无
[1] Schober A,Weber C.Mechanisms of MicroRNAs in Atherosclerosis[J].Annu Rev Pathol,2016,11:583-616.DOI:10.1146/annurev-pathol-012615-044135.
[2] Cheng Y,Zhang C.MicroRNA-21 in Cardiovascular Disease[J].J Cardiovasc Transl Res,2010,3(3):251-255.DOI:10.1007/s12265-010-9169-7.
[3] Wang L,Jiang Y,Song X,et al.Pdcd4 deficiency enhances macrophage lipoautophagy and attenuates foam cell formation and atherosclerosis in mice[J].Cell Death Dis,2016,7:e2055.DOI:10.1038/cddis.2015.416.
[4] 隋辉,陈伟伟,王文.《中国心血管病报告2015》要点解读[J].中国心血管杂志,2016,21(4):259-261.DOI:10.3969j.issn.1007-5410.2016.04.001.
Sui H,Chen WW,Wang W.Interpretation of report on cardiovascular diseases in China (2015) [J].Chin J Cardiovasc Med,2016,21(4):259-261.DOI:10.3969j.issn.1007-5410.2016.04.001.
[5] Conti P,Shaik-Dasthagirisaeb Y.Atherosclerosis:a chronic inflammatory disease mediated by mast cells[J].Cent Eur J Immunol,2015,40(3):380-386.DOI:10.5114/ceji.2015.54603.
[6] Darabi F,Aghaei M,Movahedian A,et al.The role of serum levels of microRNA-21 and matrix metalloproteinase-9 in patients with acute coronary syndrome[J].Mol Cell Biochem,2016,422(1-2):51-60.DOI:10.1007/s 11010-016- 2805-z.
[7] Dong S,Cheng Y,Yang J,et al.MicroRNA expression signature and the role of microRNA-21 in the early phase of acute myocardial infarction[J].J Biol Chem,2009,284(43):29514-29525.DOI:10.1074/jbc.M109.027896.
[8] Ji R,Cheng Y,Yue J,et al.MicroRNA expression signature and antisense-mediated depletion reveal an essential role of MicroRNA in vascular neointimal lesion formation[J].Circ Res,2007,100(11):1579-1588.DOI:10.1161/CIRCRESAHA.106.141986.
[9] Li JZ,Gao W,Ho WK,et al.The clinical association of programmed cell death protein 4 (PDCD4) with solid tumors and its prognostic significance:a meta-analysis[J].Chin J Cancer,2016,35(1):95.DOI:10.1186/s40880- 016-0158-3.
[10] Wei X,Wang W,Wang L,et al.MicroRNA-21 induces 5-fluorouracil resistance in human pancreatic cancer cells by regulating PTEN and PDCD4[J].Cancer Med,2016,5(4):693-702.DOI:10.1002/cam4.626.
[11] Zhang X,Gee H,Rose B,et al.Regulation of the tumour suppressor PDCD4 by miR-499 and miR-21 in oropharyngeal cancers[J].BMC Cancer,2015,16:86.DOI:10.1186/s12885-016-2109-4.
[12] Venturutti L,Romero LV,Urtreger AJ,et al.Stat3 regulates ErbB-2 expression and co-opts ErbB-2 nuclear function to induce miR-21 expression,PDCD4 downregulation and breast cancer metastasis[J].Oncogene,2016,35(17):2208-2222.DOI:10.1038/onc.2015.281.
[13] Dong B,Shi Z,Wang J,et al.IL-6 Inhibits the Targeted Modulation of PDCD4 by miR-21 in Prostate Cancer[J].PLoS One,2015,10(8):e134366.DOI:10.1371/journal.pone.0134366.
[14] Cheng Y,Liu X,Zhang S,et al.MicroRNA-21 protects against the H(2)O(2)-induced injury on cardiac myocytes via its target gene PDCD4[J].J Mol Cell Cardiol,2009,47(1):5-14.DOI:10.1016/j.yjmcc.2009.01.008.
[15] Bollati V,Angelici L,Rizzo G,et al.Microvesicle-associated micr-oRNA expression is altered upon particulate matter exposure in healthy workers and in A549 cells[J].J Appl Toxicol,2015,35(1):59-67.DOI:10.1002/jat.2987.
[16] Deddens JC,Vrijsen KR,Colijn JM,et al.Circulating Extracellular Vesicles Contain miRNAs and are Released as Early Biomarkers for Cardiac Injury[J].J Cardiovasc Transl Res,2016,9(4):291-301.DOI:10.1007/s12265-016- 9705-1.
(本文编辑:谭潇)
Roles of microRNA-21 and its target gene programmed cell death 4 in atherosclerosis
ZhuXiaotong,ZhangShengjie,LiangXue,LiGuangping
DepartmentofCardiology,TianjinInstituteofCardiology,SecondHospitalofTianjinMedicalUniversity,TianjinKeyLaboratoryofIonic-MolecularFunctionofCardiovasculardisease,TianjinInstituteofCardiology,Tianjin300211,China
Correspondingauthor:LiGuangping,Email:tjcardiol@126.com
Objective To investigate the roles of microRNA (miR)-21 and its target gene, programmed cell death 4 (PDCD4) in the development of atherosclerosis (AS). Methods The plasma of 38 patients with acute ST elevation myocardial infarction (STEMI) and 34 non-coronary heart disease patients were collected and used for detecting the levels of miR-21 by real-time quantitative PCR. Rat macrophage line RAW 264.7 cells were transfected with the miR-21 analogue, inhibitor and silencing PDCD4 (siPDCD4) in mediation of Lipo3000, then co-incubated with ox-LDL and cultured for 48 h,blank control group (untransfected with no ox-LDL) and ox-LDL group (ox-LDL only) were also set up meanwhile. The effect of miR-21 and PDCD4 on foam RAW 264.7 cells was analyzed by oil red staining. High fat feeding was given to 20 ApoE-/-male mice (4-6 weeks) to establish AS animal models, and the mice were randomly divided into 3 groups: 6 in AS group, 7 in miR-21 mimics treated group and 7 in NC group. Every 3 days, mice in the miR-21 mimics treated group and NC group
tail vein injection of cholesterol conjugated miR-21 agonist (agomiR-21) and agomiR-NC, respectively. C57BL/6 mice fed with standard diet were arranged in the normal control group. qRT-PCR was performed to detect the expression levels of miR-21 in atherosclerotic plaque and normal artery. Immunohistochemistry and Western blot were used to measure the expression of PDCD4 protein. Results The expression levels of miR-21 in plasma of patients with STEMI, foam cells and plaque tissue from simple high fat fed ApoE-/-mouse were significantly higher than those in the control group (P<0.001,P<0.01,P<0.01, respectively). As compared with those in ox-LDL group, the bubbling levels in ox-LDL+miR-21 mimics group and ox-LDL+siPDCD4 group decreased significantly while those in ox-LDL+miR-21 inhibitor group increased significantly. Compared with the C57BL/6 mice, the high fat diet-fed ApoE-/-mice exhibited a greater accumulation of PDCD4 protein in the aorta. Nevertheless, tail vein injection of miR-21 mimics markedly inhibited the protein expression of PDCD4, and significantly decreased the sizes of AS areas. Conclusions Overexpression of miR-21 may inhibit the transformation of macrophages to foam cells and decrease AS area by regulating the expressions of PDCD4 thus plays a critical and protective role in anti-AS.
microRNA-21; Programmed cell death 4; Atherosclerosis; Acute ST-segment elevation myocardial infarction; Foam cells
李广平,电子信箱:tjcardiol@126.com
10.3969/j.issn.1007-5410.2017.03.009
2016-10-21)
