肺表面活性蛋白B的构效关系研究进展
2017-06-29顾仕苓唐晓莲王万能周继红
刘 钦,顾仕苓,唐晓莲,王万能,周继红
(1.重庆理工大学 药学与生物工程学院,重庆 400054;2.第三军医大学大坪医院野战外科研究所 第四研究室,重庆 400042)
肺表面活性蛋白B的构效关系研究进展
刘 钦1,顾仕苓1,唐晓莲1,王万能1,周继红2
(1.重庆理工大学 药学与生物工程学院,重庆 400054;2.第三军医大学大坪医院野战外科研究所 第四研究室,重庆 400042)

肺表面活性蛋白B;结构;构效关系;脂质-蛋白相互作用
肺表面活性蛋白(surfactant protein,SP)是肺表面活性物质发挥功能作用不可缺少的重要组成成分,约占总量的10%[1-2]。 SP按其被认为的先后顺序分别命名为SP-A、SP-B、SP-C和SP-D 4种, 其中SP-B为小分子疏水性蛋白,其主要功能是降低肺表面张力,维持正常肺呼吸功能[3-5]。SP-B作为维持肺正常呼吸作用的关键物质,它的异常会引起肺部疾病,如急性呼吸窘迫综合征(ARDS),是目前临床上肺部疾病中较为常见的呼吸病,一直困扰着国内外医学界[6]。对于这类疾病的治疗主要是外源性SP-B替代疗法,而目前用于治疗的SP-B主要来自于动物肺部提取物和基于其结构设计的类似物,但外来的异源性蛋白会被机体的免疫系统识别,治疗性外源性SP-B的开发和改进已成为目前医学界研究的热点,只有开发新的制剂才能更好地用于疾病的治疗。
虽然当前SP-B的研究是个热点,但大多数都集中在对其功能和生产的研究,而对于SP-B发挥其活性的结构特征及结构与功能关系的研究报道还比较缺乏,而其结构决定了SP-B的一些作用机制。
1 肺表面活性蛋白SP-B的合成分泌
SP-B的合成、分泌与表达具有较为严格的组织细胞特异性,主要在肺泡Ⅱ型上皮细胞中经转录、翻译后形成前体蛋白原,再在内质网中加工形成含有381个氨基酸的SP-B前体蛋白(precursor surfactant protein B,proSP-B),然后进入高尔基复合体经糖基化、酶切作用加工处理,最终形成只有79个氨基酸的成熟SP-B单体。SP-B单体以多囊体的形式存在于细胞内,最后包装形成板层体,从而作为主要的贮存形式。当其需分泌到细胞外时,在多囊体中以囊泡出胞的方式进入分泌途径,从而在肺泡气液界面形成具有降低表面张力的磷脂单分子层膜。另外Clara(终末细支气管上皮细胞)细胞也能转录、翻译形成成熟的SP-B蛋白,但由于其缺乏多囊体,因此不能分泌蛋白进入肺泡间隙,发挥降低气液界面表面张力的作用。proSP-B的相对分子质量约为42 kDa,具有一个典型的疏水性氨基酸起始序列NproSP-B,使之能顺利通过内质网孔并进入高尔基复合体进行加工处理。成熟的SP-B单体的相对分子质量约为8.7 kDa,两个成熟的SP-B分子通过Cys48链间二硫键形成同源二聚体,这有利于维持SP-B的稳定性,且具有抗酸和抗蛋白降解的作用。SP-B在肺泡II上皮细胞中的合成、分泌路径见图1[7]。
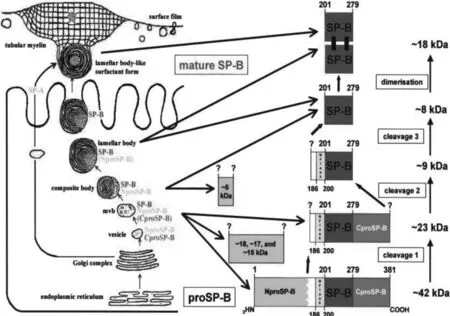
图1 SP-B在肺泡II上皮细胞中的合成、分泌路径
2 SP-B独特的结构特征
SP-B蛋白序列中疏水性氨基酸,如亮氨酸、半胱氨酸等,约占50%以上,且呈现周期性排列。在SP-B的疏水性区域中含有8个带正电的和1个带负电的保守性氨基酸残基。SP-B中存在的7个半胱氨酸是其形成独特结构的基础,其中的6个通过分子内二硫键连接C8-C77、C11-C71和C35-C46,参与稳定其二级结构,第7个半胱氨酸残基(C48)通过分子间二硫键的形式参与蛋白的共价二聚体形成,如图2所示[8-9],而其独特的二硫键存在形式促使SP-B形成发卡结构,增强其空间结构的热稳定性。
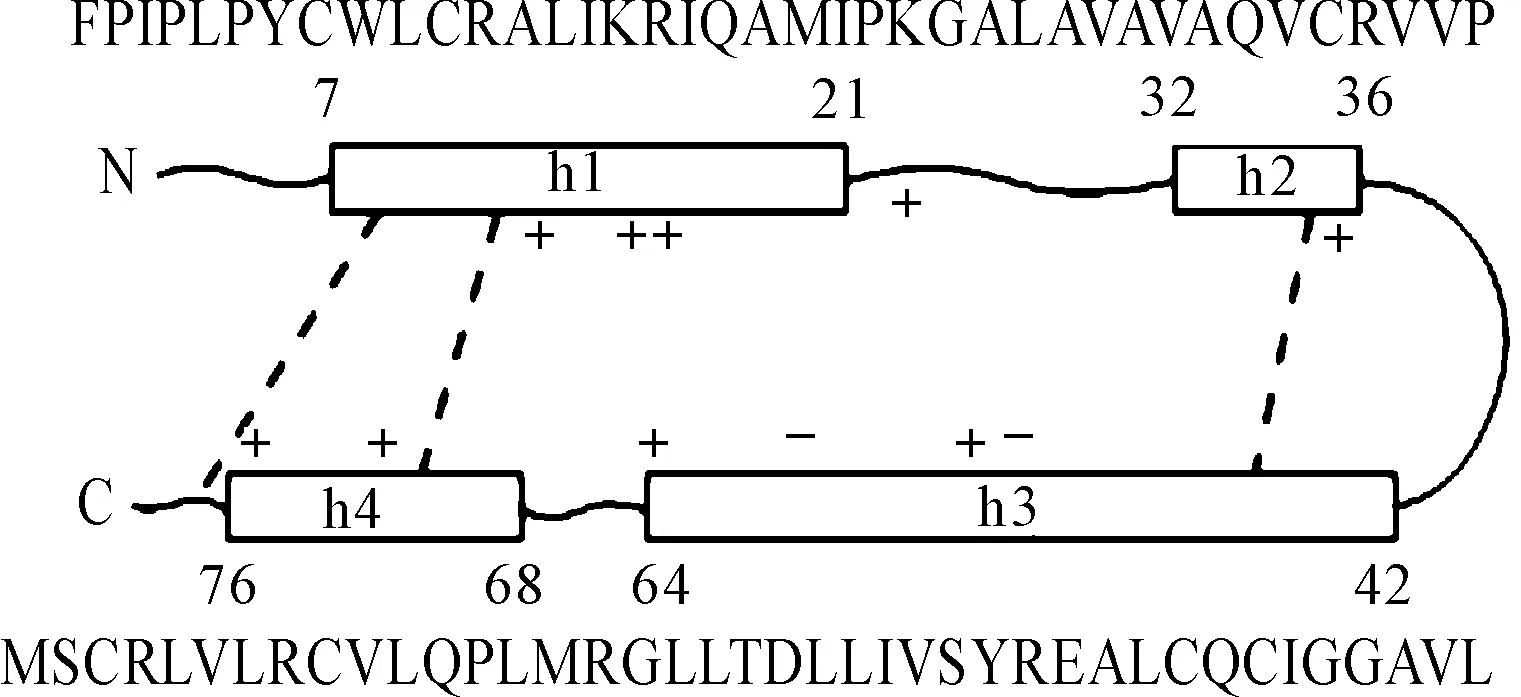
图2 SP-B蛋白二级空间结构
由于SP-B的疏水性强且难以通过基因重组技术生产,故其三维结构仍是不清楚的,而SP-B与鞘脂激活蛋白样蛋白超家族蛋白(Saposin-like proteins,SAPLIPs)具有类似的结构,因此基于SAPLIPs结构,理论上可以模拟出SP-B的结构模型[10-11]。Zaltash等[12]基于NK-lysin核磁共振结构模拟了SP-B同源二聚体的结构模型,如图3所示,两个单体通过Cys48-Cys48’之间二硫键共价连接,且呈对应排列,使Glu51-Arg52’和Arg52-Glu51’之间连接形成互补离子对,这个模型使带电残基处在同一平面,促进了SP-B单体之间和SP-B与磷脂双分子层的交叉效应,增强了SP-B的生理功能。

图3 疏水性SP-B天然蛋白模拟结构
Parra等[13]研究认为SP-B能通过低聚化的方式参与SP-B与脂质的结合,稳定SP-B与脂质的相互作用,故SP-B能与磷脂膜牢固地结合而发挥表面活性功能。基于NK-lysin的序列特点,SP-B的螺旋结构较多,是第1个被认为具有4个两亲性α-螺旋结构的物质,其中螺旋结构1和4被二硫键连接在蛋白结构的第1域中,而螺旋结构2和3在蛋白结构的第2域中,4个螺旋结构通过二硫键形成类似发卡结构,其中结构1和4起到疏水域的开关作用,决定着蛋白的功能[14-15]。根据序列比对分析可知,SP-B的多种结构形态中的一种结构模型类似于球形闭合环状的鞘脂结合蛋白B(saposin B),而其中存在的4个螺旋结构是SP-B发挥功能作用必不可少的结构基础,螺旋结构能影响SP-B与膜上的蛋白相互作用,促进膜表面活性物质的分布[16-17]。此结构模型也被mini-B(MB,由起始SP-B序列和SP-B折叠的8-25和63-78残基共同构成)合成肽结构的分析所证实,且根据红外光谱IR和分子建模及NMR的结构数据的分析证实了之前的推测[18-19]。此外模拟设计的SP-B结构模型具有紧密折叠区域,形成了类似于口袋状的封闭结构,疏水性磷脂质进入其内部并稳定存在,从而发挥蛋白的脂质重排功能,进一步引起表面张力的改变[12,20]。因此,SP-B构象的可变性可能是其表面活性功能的一个重要结构基础。
Zaltash等认为SP-B二聚体不仅能通过二硫键形成螺旋结构,且参与形成反离子对形式,其结构基础是SP-B序列残基所决定的[12]。无论体内还是体外实验,通过断裂SP-B分子C48分子间二硫键均会影响其表面活性,从而进一步证实了SP-B的表面活性功能与其二聚体的状态具有明显的相关性[21]。但Zaltash等[22]后来的研究认为C48的存在与否并不是SP-B发挥其表面活性功能的必要成分,且SP-B蛋白的大部分功能依赖于其浓度,可能SP-B间还存在其他的作用方式,例如非共价键结合或离子相互作用力。
3 SP-B与膜脂质的相互作用
通过荧光标记的ESR和NMR实验可知SP-B与膜脂质的相互作用是其表面活性功能的主要体现[23-24]。SP-B与膜脂质的相互作用是由SP-B中的螺旋结构折叠区域与磷脂酰基通过疏水性相互作用连接为基础的。然而,SP-B与膜脂质不同程度的相互作用似乎取决于分子重排及脂蛋白的比例,脂蛋白的脂质部分交联进入SP-B二聚体的核心域,而大量的SP-B二聚体又相互聚集形成一个类似球状的低聚体,当膜上存在较多的脂蛋白时,SP-B与脂质形成脂蛋白复合物,使得SP-B与脂蛋白重排形成脂蛋白复合物有机体[25-26]。另外,通过对Zaltash提出的结构模型的分析,发现极性残基很可能聚集在SP-B二聚体的外围,而不是分子疏水性的核心部分,或作为一个跨膜蛋白存在于液状DPPC膜上[27]。
Ryan 等[28-29]基于SP-B序列设计的短肽的生理活性及其与膜的相互作用的研究表明:SP-B中的几个主要片段对SP-B的结构具有明显的影响,参与膜上蛋白的定向排列。由于SP-B的N-端位于膜的表面,因此SP-B的N-端被认为是降低其表面张力作用的主要区域,而其中的芳香族残基更为重要,因为芳香族残基的侧链能自发地与膜的磷脂头部和酰基链区域形成牢固的结合,因此SP-B上的2、4、6位脯氨酸,9位色氨酸的存在对于SP-B的表面活性作用是必不可少的[30-31]。 另外,SP-B上10~22位残基带有正电荷,能通过静电相互作用与磷脂阴离子头部相结合,从而使得SP-B结合在磷脂膜的表面而发挥其表面活性功能[32-33]。蛋白的结构及蛋白-脂质的相互作用关系,决定了SP-B的表面活性功能,且SP-B的螺旋结构对于膜的融合和重排均有一定的促进作用,SP-B中26-37氨基酸残基是SP-B融合功能的最主要区段,其可能是通过膜交联的介导作用促进蛋白-蛋白的相互作用[29]。此外,SP-B单体间通过半胱氨酸形成的二硫键连接形成二聚体,从而进一步形成低聚体,发挥其功能作用[34-35]。另外,SP-B的C-端主要是43-79残基,似乎也是蛋白参与膜融合和重排的重要组成部分,也可以降低表面张力,只是其活性并没有SP-B的N-端高[28,36]。
SP-B的C-和N-端具有明显的两亲性。在SP-B 的4个α螺旋结构域中,两亲性中的亲水性部分镶嵌在膜的表面,疏水性部分通过二硫键稳定在核心域,SP-B序列与鞘脂结合蛋白序列高度同源,且其二硫键结合方式是高保真区域。SD和IR实验表明:SP-B模拟肽和鞘脂结合蛋白同样具有高含量的α-螺旋结构[37-38]。此外,SP-B能影响鞘脂结合蛋白与膜脂质双分子层的关联,在其开环状态下,SP-B螺旋结构的疏水性部分与磷脂的侧链结合,插入磷脂分子层的内部,带正电的和电中性的残基与极性脂质头部相结合[39-40]。IR结果表明:SP-B的螺旋结构部分与膜相互平行,SP-B疏水性部分则插入磷脂双分子层内部,此结构对SP-B发挥功能作用具有重要意义[26,41]。SP-B通过疏水性区域形成一个凹行中心腔域,并与极性带电残基形成的凸形域相适配,N端作用于特异性的结合脂质分子层[42-43]。
4 SP-B的表面活性功能作用机制
SP-B的结构特点是其发挥功能作用的关键,SP-B与膜脂质的相互作用及其肺表面活性作用均依赖SP-B的独特结构,且其作用模式具有一定的规律性。对于疏水性SP-B蛋白,其表面活性功能的规律即其作用机制如图4[44-45]所示。SP-B单体通过分子间的相互作用聚集形成二聚体,大量的二聚体聚合一起形成寡聚体,多个寡聚体聚集形成一个疏水性部分在里,亲水性部分在外的开放低聚体结构域,再与膜脂质通过疏水性互相作用形成一个整体,形成膜嵌和结构,膜脂质分子隐藏在其疏水性部分中,使得SP-B与膜磷脂上的酰基链相互作用形成有机整体[46-49]。由于磷脂膜的流动性,一部分低聚体携带磷脂从磷脂膜上独立出来,游离于水环境下,由于气液界面的表面张力作用,在液体环境下游离的脂质通过表面吸附作用从低聚体中分离出来分布于气液界面上从而降低表面张力,而二聚体则继续参与下一次的转运工作。至此,SP-B完成了1个循环,从而发挥了其降低气液界面表面张力的作用。SP-B分子中的碱性氨基酸残基与磷脂负离子相互作用,促进磷脂形成单分子层膜,增强磷脂膜的表面活性,且使磷脂单分子层稳定存在于肺泡表面,从而维持肺泡的正常生理功能。

图4 SP-B的作用机制
SP-B与膜脂质相互作用的形式是依靠疏水相互作用使得SP-B的N-和C-端的螺旋疏水性结构与蛋白中的氨基酸残基侧链相互作用,SP-B再与脂质囊泡融合,促进与膜的结合。SP-B的N-端带有正电性,能与带负电的脂质结合,维持表面张力,支撑表面界面的延展[50]。由SP-B的C-和N-直接相连组成的MB具有比SP-B更强的功能,其能直接形成二聚体形式,而SP-B的C-和N-是SP-B与脂质作用的主要作用位点,且MB能折叠形成螺旋发卡结构,并通过二硫键的连接稳定存在[51-52]。此外,MB模拟肽在体外活性研究认为:其降低表面张力的作用极强,表面张力几乎为零;而体内研究表明:MB还能抵抗磷脂酶A的降解作用[19]。Frans等[53]认为,MB的立体结构中含有α螺旋和β折叠,并有大量环状结构,而MB的N端是其发挥功能作用的主要部分,此外,N端还维持其二聚体状态,N端形成的β折叠能促进二聚体的自连,通过疏水性侧链的非特异性作用力聚合。
5 结束语
SP-B属于SAPLIPs家族成员,具有其独特的结构特点,特别是其周期性的疏水性氨基酸排列和两亲性螺旋结构可形成高稳定性的α螺旋结构,这些都是其发挥功能作用必不可少的基础。而且,SP-B与膜脂质形成一个有机整体,参与膜脂质层重排,影响磷脂双分子层的细胞膜结构功能活性。因此,可基于SP-B的结构特点和其膜相容性,设计出基于类似物的结构,为SP-B的进一步开发利用和肺损伤的治疗提供理论基础。
虽然目前的研究认为肺损伤的机制是多种多样的,与呼吸系统发育和其他疾病导致的继发性病理等有关,而并不只与肺表面活性蛋白相关,但肺表面活性蛋白无疑是其中一个十分重要的因素,SP-B作为肺表面活性蛋白中最为重要的一种,对其的研究是十分必要的。目前对SP-B的结构功能研究均基于正常生理状态下,但在病理状态下(如急性呼吸窘迫症),SP-B的结构变化及构效关系目前仍是不清楚的,SP-B的作用机制受病理状态的影响也不清楚,且SP-B的治疗作用是如何发挥作用及相应的构象变化都是不清楚的,因此弄清这些问题将能更好地设计和开发利用SP-B。
[1] 王静.肺表面活性物质相关蛋白C和A原核表达载体的构建、表达及纯化[D].广州:南方医科大学,2012.
[2] SCHURCH D,OSPINA O L,CRUZ A,et al.Combined and independent action of proteins SP-B and SP-C in the surface behavior and mechanical stability of pulmonary surfactant films.[J].Biophysical Journal,2010,99(10):3290-3299.
[3] PEREZGIL J,WEAVER T E.Pulmonary surfactant pathophysiology:current models and open questions.[J].Physiology,2010,25(3):132-141.
[4] 孟庆雪,刘玉芬,刘静,等.肺表面活性蛋白研究进展[J].中国畜牧兽医,2014,41(3):178-181.
[5] HALLIDAY H L.Surfactants:past,present and future[J].Journal of Perinatology,2008,28 Suppl 1(5):S47-S56.
[6] WILLSON D F,NOTTER R H.The future of exogenous surfactant therapy.[J].Respiratory Care,2011,56(9).
[7] BRASCH F,JOHNEN G,WINN-BRASCH A,et al.Surfactant Protein B in Type II Pneumocytes and Intra-Alveolar Surfactant Forms of Human Lungs[J].American Journal of Respiratory Cell and Molecular Biology,2004,30(4):449-458.
[8] 王鹏,王万能,吕婧,等.疏水性肺表面活性蛋白SP-B结构类似物的研究进展[J].华西药学杂志,2013,28(6):636-639.
[9] 张潇骏,王万能,周继红,等.大鼠成熟的肺表面活性蛋白 B 的原核表达及纯化[J].动物医学进展,2016,37(4):18-23.
[10]KONDEJ D,SOSNOWSKI T R.Alteration of biophysical activity of pulmonary surfactant by aluminosilicate nanoparticles[J].Inhalation Toxicology,2013,25(2):77-83.
[11]BOUZAS V,HALLER T,HOBI N,et al.Nontoxic impact of PEG-coated gold nanospheres on functional pulmonary surfactant-secreting alveolar type II cells[J].Nanotoxicology,2013,8(8):813-823.
[12]ZALTASH S,PALMBLAD M,CURSTEDT T,et al.Pulmonary surfactant protein B:a structural model and a functional analogue[J].Biochimica Et Biophysica Acta,2000,1466(1/2):179-186.
[13]PARRA,ALCARAZ,ANTONIO,et al.Hydrophobic Pulmonary Surfactant Proteins SP-B and SP-C Induce Pore Formation in Planar Lipid Membranes:Evidence for Proteolipid Pores[J].Biophysical Journal,2013,104(1):146-155.
[14]WANG W N,ZHOU J H,WANG P,et al.The localization of SP-B and influences of lipopolysaccharide on it[J].European Review for Medical & Pharmacological Sciences,2016,20(11):117-126.
[15]GOSS V,HUNT A N,POSTLE A D.Regulation of lung surfactant phospholipid synthesis and metabolism[J].Biochimica Et Biophysica Acta,2014,1831(2):448-458.
[16]LONEY R,CHAVARHA M,RANANAVARE S B,et al.An Anionic Phospholipid Enables the Hydrophobic Surfactant Proteins to Alter Spontaneous Curvature[J].Biophysical Journal,2013,104(3):594-603.
[17]RUPPERT C,LOPEZ-RODRIGUEZ E,KORFEI M,et al.Napsin A knockout Mice show Surfactant Processing Disorders and Induction of ER-Stress but no fibrotic Lung-Phenotype[J].Der Internist,2013,54(6):748.
[18]WARING A J,WALTHER F J,GORDON L M,et al.The role of charged amphipathic helices in the structure and function of surfactant protein B[J].The Journal of Peptide Research,2005,66(6):364-374.
[19]SARKER M,WARING A J,WALTHER F J,et al.Structure of mini-B,a functional fragment of surfactant protein B,in detergent micelles[J].Biochemistry,2007,46(39):11047-11056.
[20]OLMEDA B,GARCIAALVAREZ B,PEREZGIL J.Structure-function correlations of pulmonary surfactant protein SP-B and the saposin-like family of proteins.[J].Biophysics of Structure & Mechanism,2014,42(2/3):209-222.
[21]IKEGAMI M,TAKABATAKE N,WEAVER T E.Intersubunit disulfide bridge is not required for the protective role of SP-B against lung inflammation[J].Journal of Applied Physiology,2002,93(2):505-511.
[22]ZALTASH S,GRIFFITHS W J,BECK D,et al.Membrane activity of (Cys48Ser) lung surfactant protein B increases with dimerisation[J].Biological Chemistry,2001,382(6):933-939.
[23]BAATZ J E,ELLEDGE B,WHITSETT J A.Surfactant protein SP-B induces ordering at the surface of model membrane bilayers[J].Biochemistry,1990,29(28):6714-6720.
[24]CRUZ A,WORTHMAN L A,SERRANO A G,et al.Microstructure and dynamic surface properties of surfactant protein SP-B/dipalmitoylphosphatidylcholine interfacial films spread from lipid-protein bilayers[J].European Biophysics Journal,2000,29(3):204-213.
[25]BALA P,KUMAR J.ANTIMICROBIAL PEPTIDES:A REVIEW[J].Peptides,2014,32(1):188-201.
[26]OLMEDA B,GARCIA-ALVAREZ B,GOMEZ M J,et al.A model for the structure and mechanism of action of pulmonary surfactant protein B[J].Faseb Journal Official Publication of the Federation of American Societies for Experimental Biology,2015,29(10):1210-1221.
[27]SHENG W,JIAN P,MA J,et al.Protein Secondary Structure Prediction Using Deep Convolutional Neural Fields[J].Scientific Reports,2016(6):636-641.
[28]RYAN M A,QI X,SERRANO A G,et al.Mapping and analysis of the lytic and fusogenic domains of surfactant protein B[J].Biochemistry,2005,44(3):861-872.
[29]SERRANO A G,CRUZ A,RODRIGUEZ-CAPOTE K,et al.Intrinsic structural and functional determinants within the amino acid sequence of mature pulmonary surfactant protein SP-B[J].Biochemistry,2005,44(1):417-430.
[30]KOSZTIN I.Quantum Effects in Biology:Structure,function,and quantum dynamics of pigment-protein complexes[J].2014(2):369-374.
[31]TOUW W G,BAAKMAN C,BLACK J,et al.A series of PDB-related databanks for everyday needs[J].Nucleic Acids Research,2014,43(D1):364-368.
[32]WANG Y,RAO K M,DEMCHUK E.Topographical organization of the N-terminal segment of lung pulmonary surfactant protein B (SP-B(1-25)) in phospholipid bilayers[J].Biochemistry,2003,42(14):4015-4027.
[33]AND J W K,LEE K Y C.NMR Structure of Lung Surfactant Peptide SP-B11-25[J].Biochemistry,2002,41(30):9627-9636.
[34]SHARIFAHMADIAN M,SARKER M,PALLEBOINA D,et al.Role of the N-Terminal Seven Residues of Surfactant Protein B (SP-B)[J].Plos One,2013,8(9):e72821.
[35]PARRA,ALCARAZ,ANTONIO,et al.Hydrophobic Pulmonary Surfactant Proteins SP-B and SP-C Induce Pore Formation in Planar Lipid Membranes:Evidence for Proteolipid Pores[J].Biophysical Journal,2013,104(1):146-155.
[36]SERRANO A G,RYAN M,WEAVER T E,et al.Critical structure-function determinants within the N-terminal region of pulmonary surfactant protein SP-B[J].Biophysical Journal,2006,90(1):238-249.
[37]PARRA E,PEREZ-GIL J.Composition,structure and mechanical properties define performance of pulmonary surfactant membranes and films[J].Chemistry & Physics of Lipids,2015,185:153-175.
[38]OLMEDA B,GARCIAALVAREZ B,PEREZGIL J.Structure-function correlations of pulmonary surfactant protein SP-B and the saposin-like family of proteins.[J].Biophysics of Structure & Mechanism,2013,42(2/3):209-222.
[39]BANARES-HIDALGO A,PEREZ -GIL J,ESTRADA P.Acidic pH triggers conformational changes at the NH 2 -terminal propeptide of the precursor of pulmonary surfactant protein B to form a coiled coil structure[J].Biochimica Et Biophysica Acta,2014,1838(7):1738-1751.
[40]BERNARDINO D L S J,VARGAS R,PICARDI V,et al.Segregated ordered lipid phases and protein-promoted membrane cohesivity are required for pulmonary surfactant films to stabilize and protect the respiratory surface[J].Faraday Discussions,2013,161(1):535-548.
[41]SEURYNCKSERVOSS S L,DOHM M T,BARRON A E.Effects of including an N-terminal insertion region and arginine-mimetic side chains in helical peptoid analogues of lung surfactant protein B[J].Biochemistry,2006,45(39):11809-11818.
[42]BERNARDINO D L S J,VARGAS R,PICARDI V,et al.Segregated ordered lipid phases and protein-promoted membrane cohesivity are required for pulmonary surfactant films to stabilize and protect the respiratory surface[J].Faraday Discussions,2013,161(1):535-548.
[43]CURSTEDT T,CALKOVSKA A,JOHANSSON J.New generation synthetic surfactants[J].Neonatology,2013,103(4):327-330.
[44]OLMEDA B,GARCIA-ALVAREZ B,PEREZérez-GIL J.Structure-function correlations of pulmonary surfactant protein SP-B and the saposin-like family of proteins[J].European Biophysics Journal,2013,42(2/3):209-222.
[45]OLMEDA B,GARCIA-ALVAREZ B,GOMEZ M J,et al.A model for the structure and mechanism of action of pulmonary surfactant protein B[J].Faseb Journal Official Publication of the Federation of American Societies for Experimental Biology,2015,29(10):572-580.
[46]WALTHER F J,HERNANDEZJUVIEL J M,GORDON L M,et al.Synthetic surfactant containing SP-B and SP-C mimics is superior to single-peptide formulations in rabbits with chemical acute lung injury[J].Peerj,2014,2(1):88-96.
[47]ZHOU A,ZHANG J,CAI W,et al.Comparison of chemosynthetic and biological surfactants on accelerating hydrogen production from waste activated sludge in a short-cut fermentation-bioelectrochemical system[Z].International Journal of Hydrogen Energy,2016.
[48]FINOT E,MARKEY L,HANE F,et al.Combined atomic force microscopy and spectroscopic ellipsometry applied to the analysis of lipid-protein thin films[J].Colloids & Surfaces B Biointerfaces,2013,104(4):289-293.
[49]KALANTARIAN A,SAAD S M,NEUMANN A W.Accuracy of surface tension measurement from drop shapes:the role of image analysis[J].Advances in Colloid & Interface Science,2013,200(6):15-22.
[50]BAOUKINA S,TIELEMAN D P.Direct Simulation of Protein-Mediated Vesicle Fusion:Lung Surfactant Protein B[J].Biophysical Journal,2010,99(7):2134-2142.
[51]KIM K,CHOI S Q,ZELL Z A,et al.Effect of cholesterol nanodomains on monolayer morphology and dynamics[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(33):3054-3060.
[52]SURI L N,CRUZ A,VELDHUIZEN R A,et al.Adaptations to hibernation in lung surfactant composition of 13-lined ground squirrels influence surfactant lipid phase segregation properties[J].Biochimica Et Biophysica Acta,2014,1828(8):1707-1714.
[53]WALTHER F J,WARING A J,HERNANDEZJUVIEL J M,et al.Critical Structural and Functional Roles for the N-Terminal Insertion Sequence in Surfactant Protein B Analogs[J].Plos One,2010,5(1):425-435.
(责任编辑 何杰玲)
Research Progress in Structural-Function Relationship of Pulmonary Surfactant Protein B
LIU Qin1,GU Shi-ling1,TANG Xiao-lian1,WANG Wan-neng1,ZHOU Ji-hong2
(1.College of Pharmacy and Bioengineering, Chongqing University of Technology, Chongqing 400054, China; 2.Department Four, Institute of Surgery Research, Daping Hospital, Third Military Medical University, Chongqing 400042, China)
Pulmonary surfactant is a type of phospholipoprotein complex distributed in the alveolar lining. Because of its amphiphilic, phospholipids can interact with specific proteins in the pulmonary surfactant and form monolayer of phospholipids in the alveoli, and exerting the effect of decreasing the surface tension of the gas-liquid interface. Surfactant protein B (SP-B) is the most important specific protein of pulmonary surfactant protein, and its abnormalities often cause lung diseases, so it plays an irreplaceable role in the maintenance and repair of lung function. The structure of SP-B is similar to that of amoebapore protein superfamily, and belongs to superfamily protein of saposin-like protein (SAPLIPs). In this paper, the lipid-protein interaction and the structural-function relationship of SP-B were analyzed to provide theoretical support for analogue-based drug development.
pulmonary surfactant B; structure; structural-function relationship; lipid-protein interactions
2017-02-18 基金项目:国家自然科学基金资助项目 (81471865)
刘钦(1990—),男,硕士研究生,主要从事基因工程药物研究,E-mail:1950028911@qq.com。
刘钦,顾仕苓,唐晓莲,等.肺表面活性蛋白B的构效关系研究进展[J].重庆理工大学学报(自然科学),2017(5):91-98.
format:LIU Qin,GU Shi-ling,TANG Xiao-lian,et al.Research Progress in Structural-Function Relationship of Pulmonary Surfactant Protein B[J].Journal of Chongqing University of Technology(Natural Science),2017(5):91-98.
10.3969/j.issn.1674-8425(z).2017.05.016
R914
A
1674-8425(2017)05-0091-08
