HBsAg(-)HBcAb(+)肿瘤患者化疗后HBV再激活3例报道并文献复习
2017-06-29罗皓周澄亚李力杨学刚杨溪霖吴立春
罗皓, 周澄亚, 李力, 杨学刚, 杨溪霖, 吴立春
(四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院,成都 610041)
HBsAg(-)HBcAb(+)肿瘤患者化疗后HBV再激活3例报道并文献复习
罗皓, 周澄亚, 李力, 杨学刚, 杨溪霖, 吴立春
(四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院,成都 610041)
目的: 探讨乙肝表面抗原(HBsAg)(-)核心抗体(HBcAb)(+)肿瘤患者化疗后引起乙型肝炎病毒(HBV)再激活的治疗与监控。方法:报道3例HBsAg(-)HBcAb(+)的肿瘤患者化疗过程中出现HBV再激活的病例,针对可行的治疗监控措施进行文献复习。结果:1例最初乙肝表面抗体(HBsAb)(+)、HBcAb(+)的非霍奇金淋巴瘤(NHL)患者经过多次化疗后转变为HBsAg(+)、e抗原(HBeAg)(+)、HBcAb(+);1例乙肝e抗体(HBeAb)(+)、HBcAb(+)的霍奇金淋巴瘤(HL)患者化疗后乙肝模式未改变,乙肝病毒载量(HBV-DNA)定量结果增高;1例HBsAb(+)、HBeAb(+)、HBcAb(+)的肝癌患者行肝动脉化疗栓塞术(TACE)后出现HBV-DNA定量结果增高。3例HBsAg(-)患者化疗后均出现HBV再激活,经抗病毒治疗后获得良好转归。结论:不仅对于HBsAg(+)的患者,对于即使处于康复期的既往有急性或慢性乙肝病史的HBsAg(-)、HBcAb(+)患者,在应用化疗或免疫抑制剂治疗时均需严密监测血清HBsAg、肝功能及HBV-DNA定量的动态变化,必要时实施预防性抗病毒治疗,以免中止原有治疗计划延误病情。
乙型肝炎病毒;再激活;肿瘤;化疗
乙型肝炎病毒(HBV)感染呈世界性流行,我国为高发地区,而随着肿瘤发病率的增高,肿瘤合并乙肝患者也逐渐增多,此类肿瘤患者在化疗期间容易诱发HBV再激活,从而导致肝细胞炎症,甚至出现重症肝炎乃至肝衰竭危及生命[1-2]。大多数文献讨论了乙肝表面抗原(HBsAg)(+)的肿瘤患者在化疗或使用免疫抑制剂时容易造成乙肝病毒再激活,而对HBsAg(-)、核心抗体(HBcAb)(+)病例报道较少[2]。本文旨在结合相关文献报道讨论肿瘤合并HBV感染患者在进行化疗或免疫抑制剂治疗时HBV再激活的现状,重视既往感染过乙肝的HBsAg(-)、HBcAb(+)患者,强调监测血清HBsAg、肝功能及HBV-DNA定量以及预防性抗病毒治疗的重要性。
1 临床资料
病例1,男性,64岁,2014年5月22日入院,完善相关检查临床诊断为非霍奇金淋巴瘤(NHL)。患者既往有乙型肝炎病史10余年,治疗前血清HBV五项模式为HBsAg(-)乙肝表面抗体(HBsAb)(+)e抗原(HBeAg)(-)e抗体(HBeAb)(-)HBcAb(+),基线HBV-DNA阴性<500IU/mL(最低检测值<500IU/mL),肝功能正常。排除化疗禁忌后予以R-CHOP(利妥昔单抗600mg d1,环磷酰胺1.0g d2,表柔比星100mg d2,长春新碱 4mg d2,泼尼松 100mg d2~d6)方案化疗,在2014年6月~2015年1月的第1~7周期化疗过程中复查血清HBsAg、肝功能及HBV-DNA定量未见异常,但出现骨髓抑制,肺部感染,予升白细胞、抗感染及营养支持治疗。于第8周期化疗后复查血清HBsAg转为阳性即HBsAg(+)HBsAb(+)HBeAg(-)HBeAb(-)HBcAb(+),HBV-DNA定量未查,肝功能未见异常,未进行相应治疗。8周期化疗结束后两月发现肿瘤转移再入院时复查HBV-DNA定量升至3.13×108IU/mL,血清HBV五项模式转为HBsAg (+)HBeAg(+)HBcAb(+),即大三阳,肝功能结果:ALT 152IU/L,AST 296IU/L,总胆红素61μmol/L。立即给予恩替卡韦抑制HBV复制,同时辅以保肝、降酶和增强免疫力等对症支持治疗。两周后复查异常生化指标逐渐下降,5周后HBV-DNA定量降至<500IU/mL,但从扩增曲线发现仍有少量病毒复制,只是病毒量小于500 IU/mL的检测下限,结果119 IU/mL仅供参考(见图1)。而后患者继续行相应放化疗,随访HBV-DNA定量结果<500IU/mL,且扩增曲线未发现病毒复制,肝功能未见异常,完成治疗后出院,嘱患者持续使用恩替卡韦抗病毒治疗至少12个月。
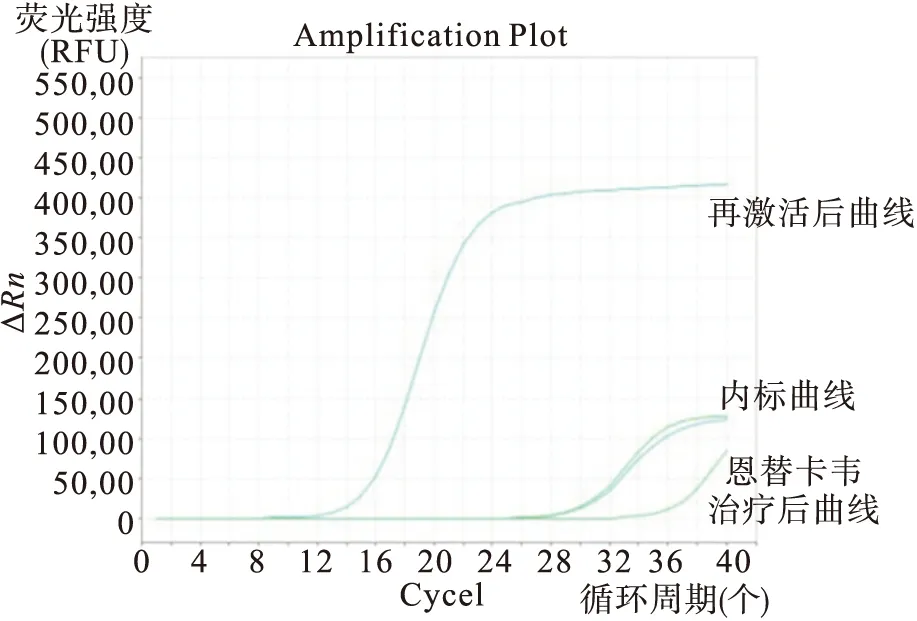
图1 例1患者恩替卡韦治疗前后HBV-DNA扩增曲线图
病例2,女性,69岁,2015年9月23日入院,完善相关检查临床诊断为霍奇金淋巴瘤(HL)。患者既往有乙型肝炎病史10余年,治疗前血清HBV五项模式为HBsAg(-)HBsAb(-)HBeAg(-)HBeAb(+)HBcAb(+),基线HBV-DNA阴性<500IU/mL,肝功能正常。排除化疗禁忌后于2015年9月28日予以ABVD(表柔比星 50mg d1、15,博莱霉素 15mg d1、15,长春新碱 4mg d1、15,氮烯咪胺 500mg d1、15)方案化疗,一周期化疗后复查发现HBV-DNA定量升高至3.17×103IU/mL,血清HBsAg、肝功能未见异常。予恩替卡韦抑制病毒复制,同时辅以保肝、增强免疫治疗,两周后复查HBV-DNA定量<500IU/mL,从扩增曲线未发现病毒复制(见图2)。患者化疗计划未变,完成治疗出院,嘱患者持续使用恩替卡韦抗病毒治疗至少6个月。
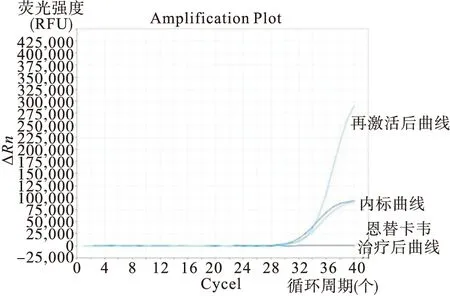
图2 例2患者恩替卡韦治疗前后HBV-DNA扩增曲线
病例3,男性,63岁,2013年11月5日在外院行肝脏肿瘤切除术,后于2014年1月6日入我院,诊断为原发性肝癌术后,患者既往有乙型肝炎病史20余年,血清HBV五项模式为HBsAg(-)HBsAb(+)HBeAg(-)HBeAb(+)HBcAb(+),基线HBV-DNA阴性<500IU/mL,肝功能正常。于2016年1月18日行第3次肝动脉化疗栓塞术(TACE)(方案:奥沙利铂100mg,替加氟1.0g动脉灌注)后HBV-DNA定量升高至1.25x103IU/mL,血清HBsAg无变化,AST 104IU/L。予恩替卡韦抗病毒治疗,两周后复查HBV-DNA定量<500IU/mL,从扩增曲线也未发现病毒复制,肝功能恢复正常(见图3)。患者按计划完成治疗出院,嘱患者持续使用恩替卡韦抗病毒治疗至少6个月。
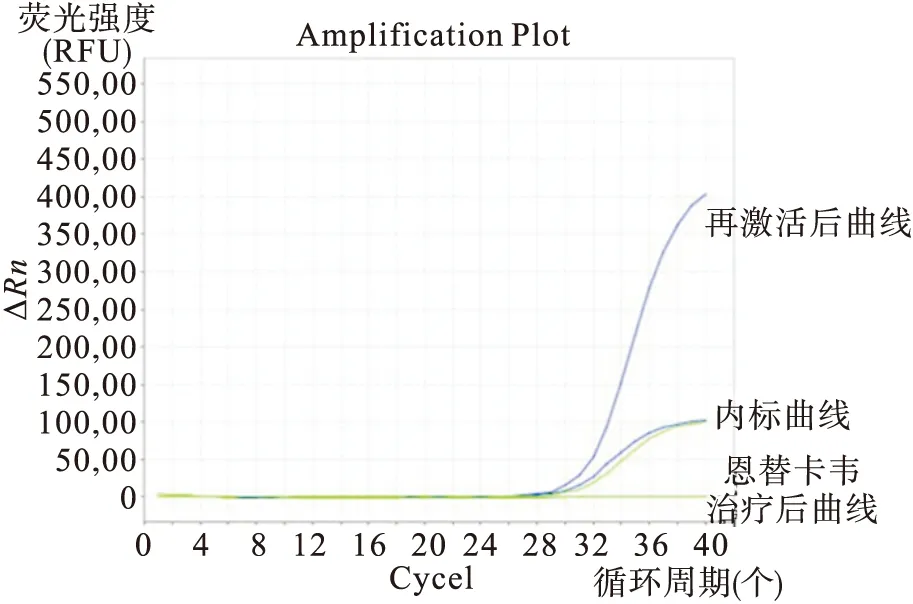
图3 例3患者恩替卡韦治疗前后HBV-DNA扩增曲线
2 检测方法及仪器
肝功能项目采用深圳迈瑞BS820全自动生化分析仪检测,HBV五项采用苏州新波Anytest时间分辨荧光免疫分析仪检测,HBV-DNA定量采用美国ABI7500型实时荧光定量PCR仪检测,所有结果均在本院检测。
3 讨 论
若患者既往有乙肝病史,HBcAb常为阳性,其体内可能长期持续存在HBV-DNA, Sugauchi等[3]研究发现,HBV感染者恢复期肝细胞及外周血单核细胞中,HBV可持续存在数十年并保持低水平复制,Kang等[4]报道4.7%(27/571)的HBsAg(-)、HBcAb(+)患者血清能检测到低水平HBV-DNA复制。当患者免疫力下降时,即可能再次激活HBV。中华医学会肝病学分会和感染病学分会于2015年发布的《慢性乙型肝炎防治指南》中,对乙肝再激活的定义为:发生于非活动性HBsAg携带者或乙型肝炎康复者中,特别是在接受免疫抑制治疗或化疗时。在HBV-DNA持续稳定的患者中,HBV-DNA升高大于10倍,或者基线HBV-DNA阴性者由阴性转为阳性且≥100IU/mL,或者缺乏基线HBV-DNA者HBV-DNA≥20 000 IU/mL。往往伴有肝脏炎症坏死再次出现,ALT升高[1]。本研究3例患者均有乙肝病史,化疗前HBsAg(-)、HBcAb(+),处于乙肝康复期,在接受化疗后,3例患者均出现基线HBV-DNA由阴性转为阳性且≥100IU/mL,2例患者出现转氨酶升高,表明3例患者均提示HBV再激活。
研究发现乙肝病毒再激活经过两个阶段[5-7]:第一阶段在化疗或免疫抑制治疗后,由于免疫系统受到抑制,病毒复制增加,主要表现为HBV-DNA定量结果升高。第二阶段在化疗或免疫抑制治疗停止后,免疫抑制减弱,免疫功能恢复产生免疫介导作用直接破坏感染病毒的肝细胞,导致肝炎、肝衰竭甚至死亡。而后通过抗病毒治疗或自身免疫应答好转,转氨酶、HBV-DNA定量下降至正常。病例1患者化疗后,HBV-DNA复制升至3.13×108IU/mL,化疗停止后免疫功能恢复,破坏感染病毒的肝细胞,导致肝功能结果异常,机体免疫平衡被打破,导致肝炎复发。病例2及病例3患者在HBV-DNA定量结果升高后及时予以抗病毒治疗阻止了病情的发展,未造成肝功能的进一步损害。由此可见,化疗或免疫抑制治疗期间应积极监测乙肝病毒再激活的情况,并及时治疗可以降低肝功能的受损程度[7-10]。
淋巴瘤患者大多存在免疫功能抑制,加上化疗对免疫功能的损伤作用,容易再次激活HBV[8]。任苑蓉等[11]统计发现24.3%的NHL患者有HBV病史,显著高于其他恶性肿瘤组。而B细胞来源的NHL化疗过程中联合利妥昔单抗已成为一线治疗方案,能显著提高患者疗效和生存期,同时更应注意HBV再激活的问题[12]。利妥昔单抗是一种单克隆抗B淋巴细胞抗体,可与B淋巴细胞上的CD20抗原结合,导致B淋巴细胞溶解、凋亡,继而产生的抗体减少,对病毒的抑制作用减弱,由此为化疗后病毒的再激活创造了有利条件[9-10]。Targhetta等[13]报道,HBsAg(-)患者在接受联合和未联合利妥昔单抗化疗方案治疗时,乙肝再激活率分别为2.7%(2/74)和0.8%(2/245),P<0.05。Dong等[14]研究发现,利妥昔单抗联合化疗明显增加了HBsAg(-)患者乙肝再激活的风险(OR=2.14,95%置信区间:1.42~3.22,P=0.0003)。而在80例HBsAg(-)HBcAb(+)淋巴瘤患者给予利妥昔单抗治疗的过程中,再激活率可达23.8%[15]。
表柔比星等蒽环类药物被认为是HBV再激活的重要危险因素[9],有研究[16]报道,蒽环类化疗药治疗后HBV再激活高达88.9%(16/18),且蒽环类药物可直接损伤肝细胞[17],为HBV再激活创造条件。
另外,化疗使全身免疫力降低,导致抵抗病毒复制的能力减弱,可能是HBV再激活的重要原因[18]。
恶性淋巴瘤患者治疗方案中,利妥昔单抗和表柔比星均为一线药物,且均为HBV再激活的危险因素[9,12],故使用时应对乙肝再激活引起足够重视。
研究证明患者血清中高水平HBV-DNA与肝癌发生密切相关,约90%的肝癌患者均有HBV感染[19],当肝癌患者接受化疗或免疫抑制治疗时,HBV与宿主免疫平衡被打破,致使肝细胞内共价闭合环状DNA(cccDNA)复制加快,感染细胞增多,达到一定程度时引起HBV再激活[20]。多因素分析显示未抗病毒治疗是TACE术后HBV再激活的可能独立危险因素,而抗病毒治疗是HBV 再激活的保护因素[21]。杨阳等[22]研究发现,HBV-DNA阴性肝癌患者TACE术前未抗病毒组和抗病毒组2年生存率分别为43.3%和70.0%,差异有统计学意义(Χ2=4.857,P=0.037)。Jang等[23]研究发现,11.0%(12/109)的HBsAg(-)肝癌患者行TACE术后HBV可再激活,其中4例发展为肝炎。
关于化疗后HBV再激活在乳腺癌[24-25],肾癌[26],胃癌[27],肺癌[28]等实体瘤也均有报道,本研究主要选取淋巴瘤和肝癌进行讨论,一是因为淋巴瘤所用化疗药物较多高/中风险免疫抑制剂,容易引起HBV再激活,而肝癌相对于其它肿瘤,HBV感染率更高,HBV激活问题也更受临床研究者的关注。二是因为两种病种所在病区医师重视HBV再激活,积极检测患者HBV-DNA,以此提醒其他病区医师提高对肿瘤合并HBV再激活的重视,积极按照专家共识和肝炎防治指南进行治疗,尤其对本文所述HBsAg(-)、HBcAb(+)肿瘤患者不能掉以轻心,以免中止治疗计划。
2013年发布的《淋巴瘤免疫化疗HBV再激活预防和治疗中国专家共识》指出:HBsAg(-)、HBcAb(+)淋巴瘤患者在接受含糖皮质激素和(或)利妥昔单抗以及蒽环类再激活高风险的化疗药物时,需要预防抗病毒治疗,并持续监测乙肝血清免疫学标志物、HBV-DNA和肝功能。化疗和(或)激素治疗期间每个月行HBV-DNA定量检测,治疗结束后还需密切随访,每3个月复查HBV-DNA了解复制情况[7]。2015年发布的《慢性乙型肝炎防治指南》中同样提出:对于接受化疗、免疫抑制剂治疗的患者,在起始治疗前都应常规筛查HBsAg、HBcAb和HBV-DNA,并评估接受免疫抑制剂的风险程度。若HBsAg(+)或HBsAg(-)、HBcAb(+)患者使用高/中风险免疫抑制剂,应给予核苷(酸)类似物预防性抗病毒治疗,治疗时间至少维持至结束免疫抑制剂治疗后6个月(对使用B淋巴细胞活性抑制剂患者至少为12个月)。对于HBsAb和HBcAb双阳性者在接受一些高、中危类免疫抑制剂尤其是高危类药物时仍有部分患者出现HBV再激活导致肝炎复发,因此仍建议对于这些患者除了应密切监测HBV血清学标志物和HBV-DNA外,还应兼顾使用的免疫抑制剂药物的特性和HBV感染后的肝脏疾病状态等,综合评估给予患者制定安全有效的治疗措施[1]。病例1患者正是HBsAg阴性、HBsAb和HBcAb双阳性情况下,使用高风险免疫抑制剂利妥昔单抗而未预防性抗病毒治疗,在HBsAg转阳时,未及时引起重视,最终导致病毒大量复制,最后转变为大三阳。病例2和病例3患者均为HBsAg(-)、HBcAb(+)且化疗药物为高/中风险免疫抑制剂,在HBV再激活时积极给予抗病毒治疗,病情得到很好的控制。本文所报道的3例患者均符合共识及指南所列要求,应按其建议预防性抗病毒治疗,但目前较多临床医师并未对有乙肝病史的恶性肿瘤患者化疗可能激活HBV引起重视。部分患者在化疗前并未筛查HBsAg、HBcAb和HBV-DNA,或者只检查HBsAg、HBcAb,未监测HBV-DNA定量结果;部分患者第1周期化疗监测HBV-DNA定量结果为阴性后未继续监测,杨小舟等[29]发现,恶性肿瘤化疗后ALT升高及HBV再激活多发生在化疗第3周期至化疗完成,本文例1及例3患者发生HBV再激活也并非在化疗周期开始时,所以化疗全程均应密切监测HBsAg和HBV-DNA及肝功能,为临床治疗提供依据;部分患者虽然监测了HBV-DNA定量结果,但未及时综合评估,调整治疗策略,可能导致治疗难以进一步实施,耽误后续治疗。
综上,既往有乙肝病史的恶性肿瘤患者在化疗或免疫抑制治疗时,应警惕HBV再激活,对于HBsAg(+)的患者需预防性抗病毒治疗,而对于HBsAg(-)HBcAb(+)患者,在使用高/中风险药物时同样需要预防性抗病毒治疗,以避免HBV再激活后可能导致的肝炎、肝衰竭;治疗期间应严密监测血清HBsAg、肝功能及HBV-DNA定量的动态变化,以便及时发现乙肝病毒是否再激活。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
[1] 中华医学会肝病学分会中华医学会感染病学分会.慢性乙型肝炎防治指南(2015年版)[J].中华实验和临床感染病杂志:电子版,2015,9(3):1-18.
[2] Masafumi I.Reactivation of hepatitis B virus in patients receiving chemotherapy[J].Jpn J Clin Oncol,2013,43(1):8-16.
[3] Sugauchi F,Tanaka Y,Kusumoto S.Virological and clinical characteristics on reactivation of occult hepatitis B in patients with hematological malignancy[J].J Med Virol,2011,83(3):412-418.
[4] Kang SY,Kim MH,Lee WI.Occult hepatitis B virus infection in Korean patients with isolated anti-HBc[J].Arch Virol,2014,159(2):227-233.
[5] Hui CK,Cheung WW,Au WY,et al.Hepatitis B reactivation after withdrawal of pre-emptive lamivudine in patients with haematological malignancy on completion of cytotoxic chemotherapy[J].Gut,2005,54(11):1597-1603.
[6] 梁雪松,万谟彬,陈姬秀,等.拉米夫定对免疫受损HBsAg携带者HBV再激活预防和治疗[J].中华现代内科学杂志,2005,2(7):594-596.
[7] 中国临床肿瘤学会,中华医学会血液学分会,中国医师协会肿瘤医师考核委员会.淋巴瘤免疫化疗HBV再激活预防和治疗中国专家共识[J].临床肿瘤学杂志,2013,18(10):935-942.
[8] 李卓,李子坚,席亚明.淋巴瘤治疗相关乙型肝炎病毒再激活研究进展[J].中国实验血液学杂志,2016,24(1):266-270.
[9] 陆莹婷,黄洪晖.非霍奇金淋巴瘤合并乙型肝炎病毒感染经化疗后肝炎病毒再激活研究进展[J].肿瘤,2009,29(2):191-194.
[10]Kusumoto S,Tanaka Y,Ueda R,et al.Reactivation of hepatitis B virus following rituximab-plus-steroid combination chemotherapy[J].J Gastroenterol,2011,46(1):9-16.
[11]任苑蓉,熊竹娟,敬小梅,等.非霍奇金淋巴瘤与乙型肝炎病毒感染关系的临床研究[J].肿瘤预防与治疗,2013,22(2):72-74.
[12]高冲,吴雪,陈宝安,等.利妥昔单抗治疗乙肝病毒感染的恶性淋巴瘤患者安全性观察[J].江苏医药,2014,40(3):349-350.
[13]Targhetta C, Cabras MG,Mamusa AM,et al. Hepatitis B virus-related liver disease in isolated anti-hepatitis B-core positive lymphoma patients receiving chemo- or chemo-immune therapy[J]. Haematologica,2008,93(6):951-952.
[14]Dong HJ,Ni LN,Sheng GF,et al.Risk of hepatitis B virus (HBV) reactivation in non-Hodgkin lymphoma patients receiving rituximab-chemotherapy: A meta-analysis[J].J Clin Virol,2013,57(3):209-214.
[15]Yeo W,Chan TC,Leung NW,et al. Hepatitis B virus reactivation in lymphoma patients with prior resolved hepatitis B undergoing anticancer therapy with or without rituximab[J].J Clin Oncol,2009,27:605-611.
[16]吴大英,李霞,杨楚钦,等.化疗引起肿瘤患者乙肝病毒再活化的病例对照研究[J].国际病毒学杂志,2013,20(4):174,192-193.
[17]龚建忠,陈彦帆,韦燕,等.乳腺癌蒽环类药物辅助化疗后肝功能损害与HBV激活的临床研究[J].海南医学,2012,23(12):4-6.
[18]杨洪亮,张翼鷟.淋巴瘤合并乙肝化疗后乙肝病毒再激活研究进展[J].山东医药,2014,54(13):90-92.
[19]Yu SJ,Lee JH,Jang ES,et al.Hepatocellular carcinoma:high hepatitis B viral load and mortality in patients treated with transarterial chemoembolization[J].Radiology,2013,267(2):638-647.
[20]倪全法,王晓光,俞鹏飞,等.原发性肝癌肝动脉化疗栓塞治疗后乙肝病毒再活化及其相关因素研究[J].肿瘤学杂志,2011,17(5):360-362.
[21]Lao XM ,Wang D ,Shi M,et al,Changes in hepatitis B virus DNA levels and liver function after transcatheter arterial chemoembolization of hepatocellular carcinoma[J].Hepatol Res, 2011,41(6):553-563.
[22]杨阳,杨龙,魏燕,等.抗病毒治疗对HBV-DNA阴性的乙肝相关肝癌行TACE术后HBV再激活的预防及对预后影响[J].武警医学,2016,27(4):329-333.
[23]Jang JW,Kim YW,Lee SW,et al. Reactivation of hepatitis B virus in HBsAg-negative patients with hepatocellular carcinoma[J].PLoS one,2015,10(4):1-12.
[24]张崇建,王璐,王丽娜,等.乳腺癌患者化疗后肝功能损伤与乙型肝炎病毒感染的关系分析[J].中华医院感染学杂志,2016,26(4):902-904.
[25]Lee HJ, Kim DY, Keam B,et al.Lamivudine prophylaxis for hepatitis B virus carrier patients with breast cancer during adjuvant chemotherapy[J].Breast Cancer,2014,21(4):387-393.
[26]Daniello C,Maruzzo M,Basso U.Prevention of hepatitis B virus reactivation with lamivudine in a patient with advanced renal cell carcinoma treated with everolimus[J].Am J Ther,2016,23:e300-303.
[27]Eren OO,Artac M,Boruban MC,et al.Chemotherapy-induced Hepatitis B virus reactivation in HbsAg positive cancer patients: a single center experience[J].Med Oncol,2009,26:386-392.
[28]严岳,张剑威,赵洪云,等.乙肝病毒感染与肺癌患者化疗后肝功能损害的相关性研究[J].中国肿瘤临床,2012,39(8):465-468.
[29]杨小舟,崔铁军,解莹,等.核苷类药物对恶性肿瘤患者化疗后乙型肝炎病毒再激活的研究[J].中华医院感染学杂志,2016,26(2):289-291,297.
Reactivation of Hepatitis B Virus Infection after Chemotherapy in Cancer Patients with HBsAg(-)HBcAb(+) :Three Cases Reports and Literatures Review
Luo Hao,Zhou Chengya,Li Li,Yang Xuegang,Yang Xilin,Wu Lichun
(SichuanCancerHospital&Institute,SichuanCancerCenter,SchoolofMedicine,UniversityofElectronicScienceandTechnologyofChina,Chengdu610041,Sichuan,China)
Objective: To study the treatment and management for hepatitis B virus(HBV) reactivation after chemotherapy in cancer patients with HBsAg(-)HBcAb(+) . Methods: This study presented three different cases of HBV reactivation after chemotherapy, and made a literatures review about possible prophylactic and therapeutic methods. Results:One non-Hodgkin lymphoma(NHL)patient with HBsAb(+)HBcAb(+) changed into HBsAg(+)HBeAg(+)HBcAb(+) after several cycles of chemotherapy. In another Hodgkin’s lymphoma(HL) patient with HBeAb(+)、HBcAb(+), the HBV-DNA level was elevated after chemotherapy. The last HBsAb(+), HBeAb(+), HBcAb(+) hepatocellular carcinoma patient’s HBV-DNA level was also elevated after the transarterial chemoembolization(TACE).The three patients of HBsAg(-)suffered from HBV reactivation during the chemotherapy, but all of them obtained good outcome following the antiviral therapy. Conclusion: The HBsAg, liver function and HBV-DNA level should be closely monitored during the procedure of chemotherapy or immunosuppressive therapy not only in the patients of HBsAg (+),but also in the HBsAg(-)HBcAb(+) patients who once suffered from acute hepatitis or chronic hepatitis infection. If necessary, the prophylactic use of antiviral therapy should be carried out in case the unexpected stop of the treatment regimen.
Hepatitis B Virus; Reactivation;Cancer; Chemotherapy
罗皓(1987-),男,四川成都人,本科,初级检验技师,主要研究方向:生化检验及分子生物检验。
2016- 04- 08
2016- 10- 17
R730.53;R730.6
A
10.3969/j.issn.1674- 0904.2017.02.008
