白及粉末饮片质量评价方法初步研究
2017-06-28王涛王晓辉陈衍男杨帆张冲王晓
王涛 ,王晓辉 ,陈衍男,杨帆,张冲,王晓
(1 .山东省分析测试中心,山东省中药质量控制技术重点实验室,山东 济南 250014;2. 山东农业大学食品科学与工程学院,山东 泰安 271018)
【中药与天然活性产物】
白及粉末饮片质量评价方法初步研究
王涛1,王晓辉1,陈衍男2,杨帆1,张冲1,王晓1
(1 .山东省分析测试中心,山东省中药质量控制技术重点实验室,山东 济南 250014;2. 山东农业大学食品科学与工程学院,山东 泰安 271018)
为建立白及粉末饮片的质量评价方法,以不同产地的10批次白及粉末饮片为研究对象,建立并改进了其薄层色谱鉴别方法,并采用蒽酮-硫酸法测定白及粉末饮片中的白及多糖质量分数,同时对其显微鉴别以及水分、总灰分和酸不溶性灰分质量分数的测定进行了研究和归纳。本实验建立的方法简单快速、重复性好,能够对白及粉末饮片质量进行有效、科学的评价。
白及;粉末饮片;质量评价;多糖
中药材白及为兰科珍稀植物白及Bletillastriata(Thunb. ) Reiehb. f. 的干燥块茎,广泛分布于我国中南和西南地区,贵州产量最大[1]。现代药理研究表明,白及不但具有生肌与止血等传统功效[2-4],而且在抗菌、抗癌和抗氧化等方面显示出新的活性[5-8]。白及不只是药用植物资源,近年来也逐渐成为生物医学和天然食品增稠剂的重要原材料,其经济价值和市场前景不容忽视[9-10]。常规中药饮片或中药材经粉碎制成粉末型饮片(新型中药饮片),提高了生物利用度以及有效成分溶出度,减小了用药剂量,克服了传统饮片煎煮、服用不便等缺点,在临床上得到了广泛应用[11]。
近十年来,白及的需求量增加,价格呈上升趋势,白及中药材以次充好、以假乱真的现象尤为严重。目前相关质量监管标准的缺乏,导致白及粉末饮片的安全性与有效性达不到要求。为使白及粉末饮片更好地在临床使用和推广,建立具有针对性、可行性的质量评价体系势在必行。2015年版《中国药典》[3]对白及的质量控制仅有性状、检查和薄层鉴别,没有对白及中具有药理活性的白及多糖进行质量控制,相关报道也较少。本研究考察了中药白及粉末饮片的性状、显微特征、薄层色谱(TLC)鉴别以及水分、灰分和多糖的质量分数测定,为其地方质量评价方法的建立以及质量的系统评价提供科学依据。
1 仪器与试药
XDS-1B倒置生物显微镜(重庆光电有限公司);GENESYS 10S UV-Vis紫外/可见分光光度计(赛默飞世尔科技公司);GZX-9140MBE数显鼓风干燥箱(上海博迅实业有限公司医疗设备厂);电子炉(北京市永光明医疗仪器有限公司);SX2-4-13马弗炉(山东省龙口市先科仪器公司);BSA124S型万分之一分析天平(赛多利斯科学仪器有限公司);GF254型硅胶板(青岛海浪硅胶干燥剂有限公司、青岛海洋化工有限公司、烟台江友生产有限公司)。
白及药材样品来自贵州、湖南、四川、安徽4个产地,共10批次,经山东中医药大学李佳教授鉴定为兰科珍稀植物白及Bletillastriata(Thunb. ) Reiehb. f.的块茎,见表1。根据《湖南省中药饮片炮制规范(2010版)》[12],所有样品经粉碎后过120目标准药筛得到白及粉末饮片备用。
试剂:香草醛为化学纯;蒽酮、D-无水葡萄糖、硫酸、三氯甲烷、乙酸乙酯、甲醇、石油醚、甲酸乙酯、环己烷等试剂为分析纯;水为蒸馏水。

表1 白及药材样品编号及产地
2 方法与结果
2.1 显微特征鉴别
本品粉末为淡黄白色;气微,味苦,湿润显黏性。取少量白及粉末于载玻片上,滴加水合氯醛(取水合氯醛5.0 g,加水15.0 mL、甘油10.0 mL,溶解即得),均匀后置酒精灯上加热透化,盖上盖玻片,置显微镜下观察,显微特征如图1。从图1可以看出表皮细胞形状不规则,垂周壁微波状弯曲。草酸钙针晶束随处散在或成束存在于椭圆形黏液细胞中。导管多为螺纹,视野中清晰可见。纤维成束,硅质块细胞位于纤维周围。梯纹导管明显,多见。糊化淀粉粒团块无色[13]。

1表皮细胞;2 草酸钙针晶束;3 糊化淀粉粒团块;4~5 纤维及含硅质块细胞;6 导管。图1 白及粉末的显微特征Fig.1 Microscopic characteristics of Bletilla striata powder
2.2 水分检测
参照《中国药典》[3]水分含量的检测方法,制订了白及粉末饮片水分的检测方法和限量。称取本品粉末约2.0 g,于105 ℃下干燥至恒重。根据减失的质量,计算白及粉末饮片样品中的含水量。本文对10批次白及粉末饮片水分进行了检测,结果见表2。由表2可见,10批次白及粉末饮片中的水分质量分数在7.7%~9.1%,平均值为8.4%,因此,以平均数上浮20%为限度,建议暂定白及粉末饮片水分质量分数不得超过10.0%。
2.3 灰分和酸不溶性灰分检测
参照《中国药典》[3]灰分和酸不溶性灰分的检测方法,制订了白及粉末饮片总灰分与酸不溶性灰分的检测方法和限量。由表2可见,10批次白及粉末饮片的总灰分质量分数为1.8%~6.5%,平均值为3.7%,因此,以平均数上浮20%为限度,建议暂定白及粉末饮片总灰分质量分数不得超过5.0%。酸不溶性灰分质量分数为0.1%~1.6%,平均值为0.6%,因此,以平均数上浮20%为限度,建议暂定白及粉末饮片酸不溶性灰分质量分数不得超过1.0%。

表2 白及粉末饮片中水分、灰分和酸不溶性灰分质量分数控制指标
2.4 薄层色谱(TLC)鉴别
2.4.1 薄层色谱条件
选用硅胶GF254型薄层板,以环己烷-乙酸乙酯-甲醇(6∶3∶1,V/V)为展开剂,喷以质量分数1%香草醛硫酸乙醇溶液,110oC下加热至斑点显色清晰[14-15]。
2.4.2 样品制备
取样品粉末1.0 g,加20 mL甲醇超声30 min,放冷,抽滤,续滤液至蒸发皿中蒸干,残渣加甲醇溶解,离心,取上层液体作为样品溶液。
2.4.2 鉴别与结果
吸取样品溶液各5 μL,分别点于同一硅胶GF254薄层板上,以环己烷-乙酸乙酯-甲醇(6∶3∶1,V/V)为展开剂,预饱和15 min,展开,取出,晾干,喷以质量分数1%香草醛硫酸乙醇溶液,在110oC下加热至斑点显色清晰。结果样品色谱中,除4号样品外,其他产地和批次的样品在相应的位置显相同的斑点,斑点的大小和颜色有所差异,鉴别结果如图2所示。
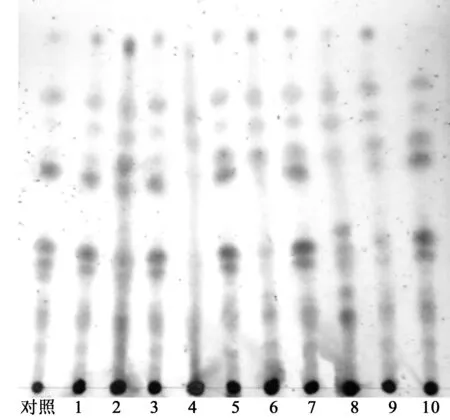
质量分数1%香草醛硫酸乙醇溶液显色图2 白及粉末TLC图Fig.2 TLC of Bletilla striata powder
图2中,1~10表示10批次样品,批号分别为140912、141115、130801、150303235、131010、160101、150215、150301、150823、130901。
3 白及粉末饮片中多糖含量测定
采用蒽酮-硫酸紫外显色法对白及粉末饮片中的粗多糖进行含量测定[16-19]。
3.1 对照品溶液的制备
精密称取干燥至恒重的无水葡萄糖对照品12.2 mg,置于100 mL容量瓶中,加水溶解并定容,摇匀,即得对照品溶液。
3.2 供试品溶液的制备
精密称取白及粉末饮片0.5 g,置圆底烧瓶中,加水150 mL,加热回流1 h,趁热滤过,残渣及烧瓶热水洗涤4次,每次10 mL,合并滤液和洗液,转移至250 mL容量瓶中,加水定容,摇匀,取溶液0.5 mL,置10 mL容量瓶中,加水至刻度,摇匀,备用。
3.3 标准曲线的制备
精密量取对照品溶液0.2、0.4、0.6、1.0、1.2 mL于试管中,加水至2 mL,分别加入质量分数0.2%蒽酮-乙酸乙酯溶液0.5 mL,冰水浴中加入5 mL硫酸,混匀,沸水浴中加热10 min,取出置冰水浴中冷却10 min,在625 nm处测量其吸收值。以吸光度为纵坐标,多糖含量为横坐标,绘制标准曲线,线性回归方程为y=0.007 62x+0.006 64,R2= 0.999。多糖浓度在12.2~73.2 μg/mL之间呈良好的线性关系,见图3。

图3 葡萄糖标准曲线Fig.3 Standard curve of glucose
3.4 多糖的含量测定
分别取白及粉末饮片,精密称定,按3.2项下方法制备供试品溶液。取供试品溶液2 mL置试管中,按3.3项下条件测定多糖质量分数,结果见表3。

表3 白及粉末饮片中多糖质量分数测定结果 ( n = 3)
4 讨论
4.1 显微特征鉴别
白及粉末饮片显微特征明显,表皮细胞、草酸钙针晶、纤维及含硅质块细胞、导管和糊化淀粉粒块清晰可见,与白及药材的显微特征相符合,鉴别结果为建立地方标准提供了可靠的依据。
4.2 水分、灰分和酸不溶性灰分检测
由表2可知,10批白及粉末饮片的水分质量分数在7.7%~9.1%,平均值为8.4%,产地差异和药材存放时间并未引起白及粉末饮片含水量的巨大变化,因此,拟定白及粉末饮片水分质量分数不得超过10.0%。10批白及粉末饮片的总灰分质量分数为1.8%~6.5%,平均值为3.7%。药典规定白及药材总灰分质量分数为5.0%,第10批白及粉末饮片的总灰分为6.5%,这可能与药材的净制有关。因此,拟定白及粉末饮片总灰分质量分数不得超过5.0%。10批白及粉末饮片的酸不溶性灰分质量分数为0.1%~1.6%,平均值为0.6%。药典并未规定白及药材酸不溶性灰分的含量,因此,作为质控标准,本研究初步拟定白及粉末饮片酸不溶性灰分质量分数不得超过1.0%。
4.3 TLC鉴别
首先,对不同的展开系统分别进行比较:(1)三氯甲烷-甲醇-水(6∶0.5∶0.05,V/V); (2)石油醚-甲酸乙酯-甲酸(15∶5∶1,V/V);(3)环己烷-乙酸乙酯-甲醇(6∶5∶1,V/V);(4)乙酸乙酯-甲醇-水(6∶0.5∶0.05,V/V)等。在此基础上进行溶剂比例筛选,由图2可知,环己烷-乙酸乙酯-甲醇(6∶3∶1,V/V)作为展开剂斑点相对位置和重现性好,不会出现脱混的现象。其次,考察了不同温度、湿度以及3种不同品牌硅胶预制板下薄层鉴别的影响。结果表明,在室温(20~25oC)及低温(4~10oC)展开,显示温度影响相对较小,斑点清晰,湿度在31%和76%时也均能获得较好的分离效果。3种不同品牌薄层板中,烟台江友GF254型硅胶板效果最佳。从结果中可以看出,溶剂前沿以下两个粉红色斑点清晰可见,分离度好,可以作为白及粉末质量评价指标性评定。样品测定中,样品150303235的TLC鉴别未见其对应指标性斑点,但溶剂前沿以下三个青色斑点与其他样品、标准药材相对应,并且此样品的多糖含量丰富。由此推测,该样品可能为白及属的其他品种。样品160101的TLC图中对应斑点颜色减弱,其他批号样品则无明显差异,斑点分离效果好。
4.4 多糖含量测定
白及块茎中含有萜类、菲类、联苄类等化合物,但含量较低不适合作为质量评价指标。2015年版《中国药典》并未收录其含量测定标准。白及含有含量较高的多糖物质并且具有显著的生物活性,因此以多糖含量作为白及粉末质量评价的依据之一。白及药材多糖含量测定通常是蒽酮-硫酸和苯酚-硫酸两种方法,苯酚易氧化并对某些多糖可能诱导发生副反应,因此,本研究采用较为经典有效和常用的蒽酮-硫酸法。从测定结果得出,10批白及粉末饮片多糖质量分数为24.4%~31.5%,样品131010和130901中多糖的质量分数最高,160101样品中多糖的质量分数最低,平均为28.4%,以平均质量分数下浮20%为依据,故拟定白及粉末饮片多糖质量分数不低于22.7%。不同产地和批次白及粉末饮片多糖质量分数存在一定差异,来自产地贵州的样品中,白及的多糖质量分数相对最高且较为稳定,表明地域差异与生长环境、采收期等因素影响其内在质量[20]。此方法为今后白及粉末饮片的质量评价提供了科学依据。
5 小结
白及粉末饮片的质量标准体系是由每一环节的质量标准共同组成的,通过系统的研究,上述结果各限量控制指标较2015年版《中国药典》白及药材的标准有所提高,同时增加了酸不溶性灰分、多糖含量测定等检测指标,为白及粉末饮片的质量评价提供了较为全面的实践方法和理论支持,弥补了白及粉末饮片质量标准研究的不足,为白及药材质量标准的进一步提高奠定了基础。总之,中药质量标准是一个复杂、艰巨的体系[21],但其重要性激励着科研工作者不断的探索、完善和创新。
[1]MABBERLEY D J. The Plant-Book: A Portable Dictionary of the Vascular Plants [M].London: Cambridge University Press, 1997.
[2]张龙霏,胡晶红,张永清. 白及药理研究进展 [J].中国现代中药,2014, 16(1):83-86.
[3]国家药典委员会. 中华人民共和国药典2015年版四部 [M].北京: 中国医药科技出版社,2015.
[4]赵菲菲,杨馨,徐丹,等.白及非多糖组分的止血作用及其机制的初步研究[J].中国药理学通报,2016, 32(8): 1121-1126.
[5]汤逸飞,阮川芬,应晨,等.白及属植物化学成分与药理作用研究进展[J].中草药,2014, 45(19): 2864-2872.
[6]孙爱静,庞素秋,王国权.中药白及化学成分与药理活性研究进展[J].环球中医药,2016, 9(4): 507-511.
[7]孙爱静,庞素秋,王国权.白及化学成分的分离及其抗肿瘤活性[J].中国医药工业杂志,2016, 47(1): 35-38.
[8]孙爱静,庞素秋,王国权.白及化学成分与抗肿瘤活性研究[J].中国药学杂志,2016, 51(2):101-104.
[9]王晓敏,吴明开,罗晓青.珍稀药用兰科植物白芨的研究现状与展望[J].贵州农业科学,2011, 39(3):42-45.
[10]李伟平,何良艳,丁志山.白及的应用及资源现状[J].中华中医药学刊,2012, 30(1):158-160.
[11]刘芳,傅超美,李小红,等.中药粉末饮片的研究与应用进展分析[J].中国实验方剂学杂志,2016, 22(2):222-225.
[12]湖南省食品药品监督管理局.湖南省中药饮片炮制规范(2010年版)[M].长沙:湖南科学技术出版社,2010.
[13]国家药典委员会. 中华人民共和国药典中药材显微鉴别彩色图鉴 [M].北京: 人民卫生出版社,2009.[14]杨毅,艾萍,杨丽萍,等.白及薄层色谱条件的改进和主要色谱斑点化学成分的鉴定[J].亚太传统医药,2009, 5(9):23-25.
[15]杨顺丽,杨枝中,李龙,等.白及薄层色谱鉴别方法的改进和高效液相指纹图谱研究[J].云南中医学院学报,2015, 38(5):41-45.
[16]王爱民,王永林,郑林,等.白及药材中多糖的含量测定[J].中国中药杂志,2009, 34(22):2963-2965.
[17]陶平德,常明泉,李德福,等.蒽酮-硫酸法测定复方白及乳膏中白及多糖的含量[J].儿科药学杂志,2012, 18(9):40-43.
[18]秦亚东,汪荣斌,周宙.不同产地白及多糖含量测定[J].安徽科技学院学报,2014, 28(3):41-44.
[19]朱海涛,楚亚琴,陈黎.正交试验优选蒽酮-硫酸法测定白芨多糖含量条件[J].中国医院药学杂志,2014, 34(20):1714-1718.
[20]吴凤云,邱丽莎,崔秀明,等.白及品质特征影响因素研究[J].中国医院药学杂志,2016, 36(21):1838-1844.
[21]石上梅,钱忠直.逐步建立和完善提高符合中医药特点的中药质量标准——解读《中国药典》2010年版(一部)[J].中国现代中药,2010, 12 (9):3-6.
Preliminary study on the quality evaluation ofBletillastriatapowder
WANG Tao1, WANG Xiao-hui1, CHEN Yan-nan2, YANG Fan1, ZHANG Chong1, WANG Xiao1
(1.Key Laboratory of Traditional Chinese Medicine Quality Control Technology, Shandong Analysis and Test Center, Jinan 250014,China; 2.College of Food Science and Engineering,Shandong Agricultural University,Taian 271018,China)
∶To establish the quality evaluation method ofBletillastriatapowder, ten batches of samples from different areas were adapted to analysis. The identification method based on thin layer chromatogram (TLC) was improved, while the method with anthrone-sulfuric acid coloration was established to determine the polysaccharide inBletillastriatapowder. Meanwhile, the contents of microscopic, moisture, total ash, and acid insoluble ash inBletillastriatapowder had been studied and summarized. This method is convenient and stable so that it can be effectively and scientifically used for the quality evaluation ofBletillastriatapowder.
∶Bletillastriata; powder; quality evaluation; polysaccharide
10.3976/j.issn.1002-4026.2017.03.006
2016-10-08
山东省分析测试中心科技发展基金(山分基合字2015第6号);山东省科学院先导项目
王涛(1987—),男,博士,助理研究员,研究方向为中药质量控制及评价体系。E-mail: taowang_xmu@163.com
R284. 1
A
1002-4026(2017)03-0026-07
