HPLC-MS同时测定泽泻中两种泽泻醇的含量
2017-06-28池雨锋王小明张玲林莎莎蒋海强周洪雷
池雨锋 ,王小明 ,张玲 ,林莎莎 ,蒋海强,周洪雷*
(1.山东中医药大学药学院,山东 济南 250355;2山东中医药大学实验中心,山东 济南 250355)
【中药与天然活性产物】
HPLC-MS同时测定泽泻中两种泽泻醇的含量
池雨锋1,王小明1,张玲1,林莎莎1,蒋海强2*,周洪雷1*
(1.山东中医药大学药学院,山东 济南 250355;2山东中医药大学实验中心,山东 济南 250355)
为提高泽泻药材的质量控制水平,建立了泽泻中23-乙酰泽泻醇B和24-乙酰泽泻醇A的高效液相-质谱联用含量测定方法。色谱条件为Halo C18色谱柱(2.1 mm×100 mm, 2.7 μm),体积分数0.1%甲酸水-0.1%甲酸乙腈为流动相,梯度洗脱,流速0.3 mL·min-1,柱温30 ℃;质谱条件为ESI离子源, 正离子检测方式,MRM模式,干燥气温度350 ℃,干燥气流速9 L·min-1,雾化器压力241.3 kPa,毛细管电压4 000 V。 测得药材中23-乙酰泽泻醇B和24-乙酰泽泻醇A含量分别为11.459 5 μg·g-1,321.823 9 μg·g-1。该方法结果准确,重现性好,可用于测定泽泻中两种成分的含量。
泽泻;泽泻醇;高效液相-质谱法;含量测定
泽泻为泽泻科植物泽泻Alismaorientalis(Sam.)Juzap 的干燥块茎。泽泻为常用中药,始载于《神农本草经》,并将其列为上品。泽泻为临床常用利水渗湿药,味甘、淡,性寒,归肾、膀胱经,能够泄热,利水渗湿、化浊降脂,临床上用于小便不利、水肿、高脂血症、热淋涩痛[1]。
泽泻所含有的化学成分主要是萜类,包括倍半萜、二萜、三萜,还有谷甾醇、硬脂酸、大黄素等[2]。现代药理研究表明,泽泻具有利尿、降血糖、降血脂、抗结石、抗肾炎、抗动脉粥样硬化等多种药理作用[3]。王立新等[4]发现泽泻的利尿有效成分主要是24-乙酰泽泻醇A,且泽泻中含有的23-乙酰泽泻醇B能够明显地降低血清中甘油三酯和总胆固醇含量[5-6]。许文等[7]对泽泻具有降糖活性部位化学成分进行研究,得到了多种三萜类成分,其中9种成分能够促进细胞对葡萄糖的摄取,推测三萜类物质是泽泻降糖作用的物质基础。尹仁杰等[8]认为23-乙酰泽泻醇B和24-乙酰泽泻醇A是泽泻利尿的有效成分,因此,这两种成分含量的高低在一定程度上决定了药材质量。本实验以这两种成分为指标,建立了泽泻的HPLC-MS测定方法,为科学评价泽泻质量提供依据。
1 实验部分
1.1 药材及试剂
泽泻药材(泽泻科植物泽泻Alismaorientalis(Sam.)Juzep. 的干燥块茎,原产地福建;批号:120906),24-乙酰泽泻醇A(批号18674-16-3)及23-乙酰泽泻醇B(批号26575-95-1)购自北京宝赛希望生物科技有限公司,乙腈 (色谱纯,Fisher公司);水为Milli-Q超纯水,其它试剂均为分析纯。
1.2 仪器及色谱-质谱条件
仪器:Agilent 1260高效液相色谱系统,检测器:6420 QQQ质谱检测器。色谱柱:Halo C18(2.1 mm×100 mm, 2.7 μm);流动相: 0.1%甲酸水- 0.1%甲酸乙腈体系(均为体积分数),流速0.3 mL·min-1,柱温:30 °C。梯度洗脱条件:0 min,90∶10(0.1%甲酸水溶液∶0.1%甲酸乙腈溶液,下同);12 min,70∶30;45~55 min,48∶52;75 min,28∶72。质谱条件:ESI离子源, 正离子检测方式,MRM模式,干燥气温度350 °C,干燥气流速 9 L·min-1,雾化器压力 241.3 kPa(35 Psi),毛细管电压 4 000 V。MRM参数见表1。
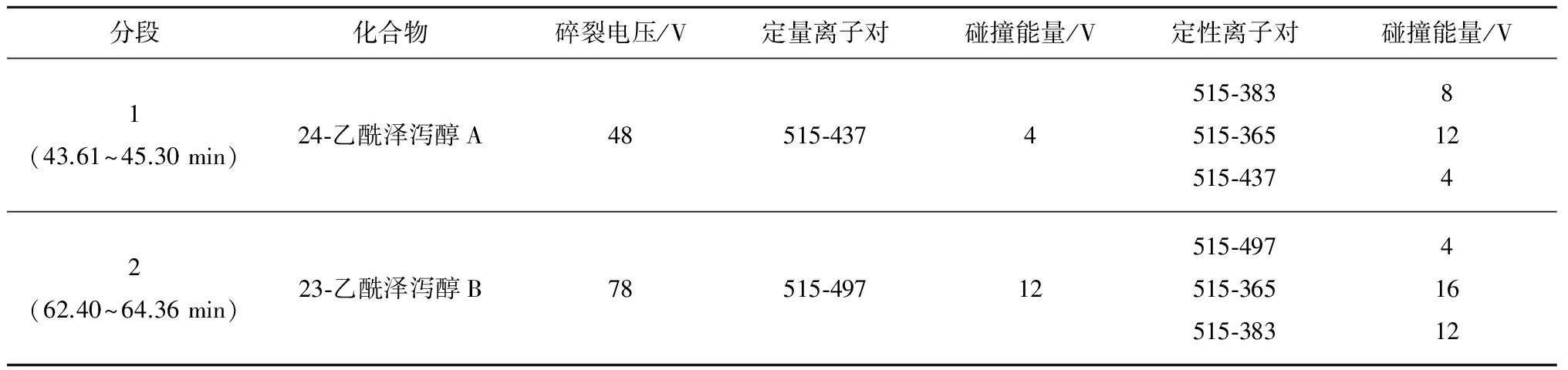
表1 各离子对多反应监测(MRM)参数
1.3 对照品溶液的制备
分别精密称取24-乙酰泽泻醇A、23-乙酰泽泻醇B对照品粉末适量,乙腈超声溶解、定容使制成1.693 4 mg·mL-1的24-乙酰泽泻醇A储备液,0.426 6 mg·mL-1的23-乙酰泽泻醇B储备液,置于冰箱4 °C保存。测定时每种储备液分别取适量,制成混合对照品,混合对照品中24-乙酰泽泻醇A和23-乙酰泽泻醇B含量分别为0.423 3 mg·mL-1和0.106 6 mg·mL-1。
1.4 供试品溶液的制备
泽泻药材粉碎,精密称取10 g,10倍量95%乙醇回流提取3次,每次1 h,药渣再以10倍量水回流提取3次,每次1 h,过滤。醇提液60 ℃悬蒸回收乙醇,水提液60 ℃水浴蒸干,用甲醇转移并合并水提物和醇提物,定容至10 mL。甲醇液加适量甲醇稀释,超声30 min,经0.45 μm微孔滤膜过滤至进样瓶中,即得相当于原药材浓度为50 mg·mL-1的泽泻供试液。
2 结果
2.1 线性关系考察
采用逐步稀释法,至信噪比等于3时,浓度定为各成分检测限,24-乙酰泽泻醇A检测限为4.233 2 ng·mL-1,23-乙酰泽泻醇B检测限为42.660 0 ng·mL-1,信噪比等于10时的浓度定为定量限,二者定量限分别为14.110 7 ng·mL-1和142.200 0 ng·mL-1。精密吸取一定量的混合对照品溶液,用乙腈分别稀释至0、5、10、20、50、100倍。混合对照品浓度由低到高依次连续进样,以对照品溶液浓度(X,μg·mL-1)对峰面积(Y)进行线性回归,得回归方程:24-乙酰泽泻醇A,Y=8.460 1X+11 529.766 7,R=0.999 2,线性范围4.233 0~423.300 0 μg·mL-1;23-乙酰泽泻醇B,Y=2.194 7X+0.464 1,R=0.999 9,线性范围2.133 0~213.300 0 μg·mL-1。
2.2 方法学考察
精密度:以稀释20倍混合标准品溶液为样品,连续进样6次,根据峰面积考察精密度,24-乙酰泽泻醇A和23-乙酰泽泻醇B的相对标准偏差分别为1.56%和1.31%。
重复性:按照前述步骤,重复制备6份泽泻供试品溶液,根据两种成分含量考察重现性,24-乙酰泽泻醇A和23-乙酰泽泻醇B的相对标准偏差分别为1.59%和1.35%。
稳定性:按照前述方法制备一份供试品溶液,分别在 0、2、4、8、12、16、24 h 进样,以峰面积为指标,24-乙酰泽泻醇A和23-乙酰泽泻醇B的相对标准偏差分别为2.51%和1.89%,表明供试液在24 h之内稳定。
加样回收率:在已知成分含量的6份供试品溶液中分别定量加入两种对照品,每份测定2次,24-乙酰泽泻醇A和23-乙酰泽泻醇B的回收率分别为97.1%和98.6%。
2.3 样品测定结果
按照前述步骤,平行制备3份供试品溶液,按前述色谱质谱条件进行测定,色谱图见图1,结果见表2,1、2号色谱峰分别为24-乙酰泽泻醇A和23-乙酰泽泻醇B。
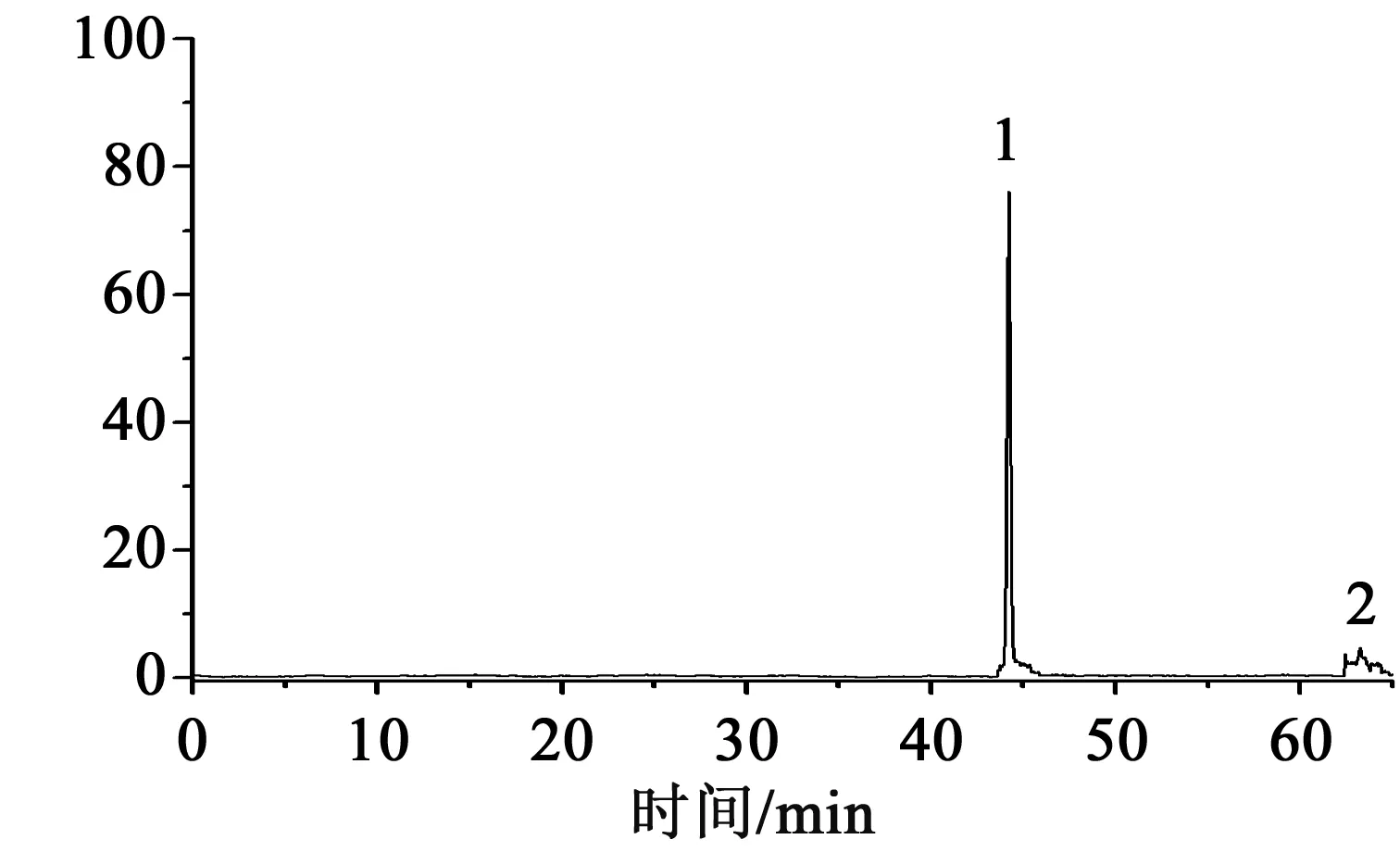
图1 泽泻样品MRM色谱图Fig.1 MRM chromatogram of Rhizoma Alismatis samples
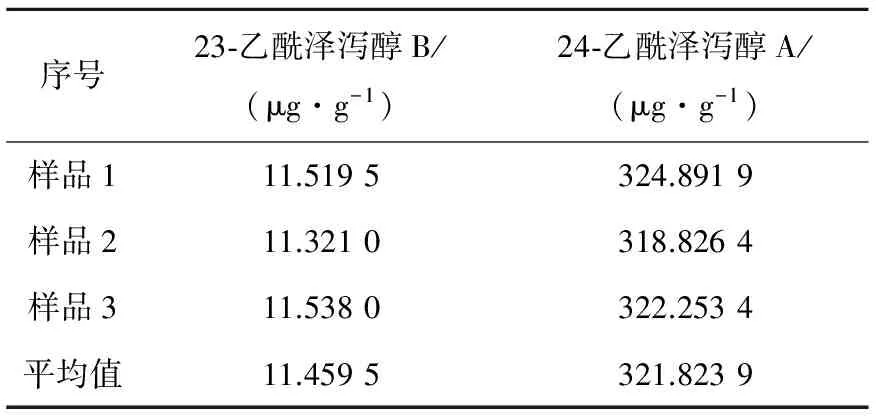
序号23⁃乙酰泽泻醇B/(μg·g-1)24⁃乙酰泽泻醇A/(μg·g-1)样品111.5195324.8919样品211.3210318.8264样品311.5380322.2534平均值11.4595321.8239
3 讨论
泽泻作为中药在我国具有悠久的用药历史,历代本草均有收录,现今临床常用于治疗小便不利、水肿、高血脂症。泽泻中的三萜类成分不稳定,容易发生转化,文献报道,在贮存和炮制过程中,23-乙酰泽泻醇B会发生部分转化,转变成24-乙酰泽泻醇A和泽泻醇B,23-乙酰泽泻醇B含量有所降低,24-乙酰泽泻醇A含量明显增加,泽泻中的24-乙酰泽泻醇A和23-乙酰泽泻醇B是泽泻的主要活性成分[8-11]。因此,24-乙酰泽泻醇A和23-乙酰泽泻醇B的含量,在一定程度上决定了药材质量的高低,所以,仅以23-乙酰泽泻醇B作为指标评价泽泻药材质量是否合理,还需要进一步论证。
MRM参数的优化,通过全扫描获得母离子丰度,根据其丰度优化碎裂电压。然后,通过子离子扫描施加不同的碰撞能量使母离子发生裂解,对碰撞能量进行优化,以丰度最高的子离子为定量离子,丰度次之的子离子为定性离子,根据定量离子和定性离子的丰度优化碰撞电压,最终确定MRM参数。
目前,泽泻中萜类有效成分的含量测定方法,主要有紫外可见分光光度法和高效液相色谱法[12-14],用高效液相-质谱联用方法测定有效成分含量的文章鲜有报道。紫外可见分光光度法能在一定程度上反映药材的质量,但是测定结果准确性偏低。高效液相色谱法多用紫外检测器,而泽泻中的有效成分紫外吸收较弱,只能利用波长较短的末端吸收进行测定,干扰因素多,误差相对较大。而高效液相-质谱联用方法具有测定结果准确重现性好的优点。本实验建立的HPLC-MS方法,用以测定泽泻中的24-乙酰泽泻醇A和23-乙酰泽泻醇B,为深入研究泽泻的质量标准提供了实验依据。
[1]国家药典委员会.中华人民共和国药典2015年版一部[S].北京:中国医药科技出版社,2015:229.
[2]肖飞艳,冯育林,杨世林,等. 泽泻化学成分的研究进展[J]. 中药新药与临床药理,2009,20(5):491-495.
[3] 禹建春,叶红梅,林西西. 泽泻的药理研究概况[J]. 海峡药学,2011,23(2):92-93.
[4] 王立新,吴启南,张桥,等. 泽泻中利尿活性物质的研究[J]. 华西药学杂志,2008,23(6):670-672.
[5]黄珍,刘咏松. 泽泻降血脂药理作用及物质基础研究进展[J]. 山西中医学院学报,2008,9(5):55-56.
[6]吴永平,王梦,卢定强.乙酰泽泻醇B与洛伐他汀对大鼠降血脂作用的比较[J]. 华西药学杂志,2011,26(3):243-244.
[7] 许文,罗奋熔,赵万里,等. 泽泻降糖活性提取物化学成分研究[J]. 中草药,2014,45(22):3238-3245.
[8]尹仁杰,吴继洲. 泽泻的研究进展[J]. 医药导报,2003,22(5):295-296.
[9]彭贤,黄舒,郦皆秀,等. 泽泻属植物化学成分与药理活性[J]. 国外医药(植物药分册),2000(06):245-247.
[10] 朱玉岚,彭国平. 泽泻的萜类化学成分研究进展[J]. 天然产物研究与开发,2006,18(2):348-351.
[11]郑云枫,朱玉岚,彭国平. 泽泻炮制过程中23-乙酰泽泻醇B的转化[J]. 中草药,2006,37(10):1479-1482.
[12]王巧娥,邱招钗,靳保辉,等. 泽泻中三萜醇酮类化合物总量的快速测定方法研究[J]. 厦门大学学报(自然科学版),2003,42(6):751-755.
[13]罗张炎,周爱存,张朝凤,等. HPLC同时测定泽泻中4种泽泻醇成分的含量[J]. 中国中药杂志,2010,35(24):3306-3309.
[14]吴秋云,陈艳红,谢友良. 不同产地泽泻有效成分的含量测定[J]. 临床医学工程,2010,17(10):60-61.
Simultaneous determination of two alisols in Rhizoma Alismatis by HPLC-MS
CHI Yu-feng1,WANG Xiao-ming1,ZHANG Ling1,LIN Sha-sha1,JIANG Hai-qiang2*,ZHOU Hong-lei1*
(1.College of Pharmacy, Shandong University of Traditional Chinese Medicine, Jinan 250355,China;2.Experience Center of Shandong University of Traditional Chinese Medicine, Jinan 250355,China)
∶To improve the quality control of the Rhizoma Alismatis, a HPLC-MS method for determination of the contents of two alisols in Rhizoma Alismatis was established in this paper. Chromatographic conditions were as follows:Halo C18column(2.1 mm×100 mm, 2.7 μm), the mobile phase was a mixture of 0.1% formic acid solution-0.1% formic acid in acetonitrile, gradient elution, the flow rate was 0.3 mL·min-1, the column temperature was 30 ℃. The conditions of MS included: ESI ion source, detection method with positive ions, mode by MRM, drying temperature was 350 ℃, the flow rate of drying gas was 9 L·min-1, pressure of nebulizer was 241.3 kPa, and the voltage of capillary was 4 000 V. The content of alisol B 23-acetate and alisol A 24-acetate in the samples was 11.459 5 μg·g-1and 321.823 9 μg·g-1, respectively. The method is accurate and reproducible to the determination of two alisols in Rhizoma Alismatis.
∶Rhizoma Alismatis; alisols; HPLC-MS; content determination
10.3976/j.issn.1002-4026.2017.03.004
2016-08-12
山东省自然科学基金(ZR2015HM080);山东省博士后创新项目专项资金(201403006);山东省科技计划(2013GSF11903);山东省高校中医药抗病毒协同创新课题(XTCX2014C01-03)
池雨锋(1989—),男,硕士研究生,研究方向为天然药物化学成分。E-mail:chongming0539@126.com
*通信作者,蒋海强(1982—),男,博士,副教授,研究方向为天然药物化学成分。E-mail: jhq12723@163.com; 周洪雷(1967—),男,教授,研究方向为中药及复方活性成分与质量控制。E-mail:zhouhongleitcm@163.com
R284.1
A
1002-4026(2017)03-0017-04
