RNA干扰抑制KLF10基因对MG-63细胞成骨分化的影响
2017-06-28付峰勃
付峰勃,殷 霄
西安市中心医院口腔科(西安 710003)
△通讯作者
RNA干扰抑制KLF10基因对MG-63细胞成骨分化的影响
付峰勃,殷 霄△
西安市中心医院口腔科(西安 710003)
目的:研究Kruppel样因子10(KLF10)在MG-63细胞向成骨细胞分化过程中的作用。方法:采用RNA干扰的方法抑制MG-63细胞中KLF10的表达,并使用成骨分化培养液诱导细胞分化,实时定量PCR检测成骨分化标志性基因ALP、OC、BSP 及转录因子Runx2的mRNA的表达量变化,蛋白质印迹检测Runx2的蛋白表达。结果:诱导分化后,KLF10表达抑制细胞的ALP、OC的mRNA表达量低于正常细胞(P<0.05);KLF10表达抑制会直接导致Runx2的mRNA及蛋白表达量降低。结论:KLF10在MG-63细胞成骨分化过程中发挥重要作用。
骨组织的重建与损伤修复是正畸和种植治疗的基础。在此过程中,机体依靠成骨细胞与破骨细胞的分化调节着骨组织的动态平衡。当间充质细胞诱导分化为成骨细胞后,开始持续分泌细胞外基质并矿化形成新的骨组织,以达到骨修复与改建的效果。成骨细胞的分化受到多种转录因子及信号通路调节,其中TGF-β信号通路是研究最多也是最明确的调节成骨细胞分化的信号之一[1],其众多下游信号分子也被证实参与了成骨细胞分化调节。Kruppel样因子10(Kruppel-like factor 10,KLF10)是Kruppel样家族转录因中的一员。它编码的480-氨基酸蛋白在NH2末端区域有若干Src同源结构域,并在COOH末端区域有3个C2H2类锌指结构DNA结合序列。KLF10最早是Subramaniam等在人成骨细胞中发现的,此研究发现TGF-β处理人成骨细胞后可以通过PCR检测到KLF10的表达[2]。之后的研究表明KLF10在很多细胞核中都有表达,TGF-β直接调控其表达。通过对KLF10基因敲除的小鼠研究发现,小鼠呈现性别特异性的骨质疏松:母鼠出现骨密度及矿化成分减少,骨强度丧失。进一步细胞层面的研究发现,KLF10敲除导致母鼠成骨细胞数量减少、显微结构改变。体外细胞研究也显示KLF10能够调节与成骨分化密切相关的转录因子Runx2的表达与活性[3]。因此,以上众多的研究都表明,KLF10与成骨细胞的分化有密切关系。然而关于KLF10在成骨细胞分化中作用的体外研究并不透彻,KLF10是否参与了MG-63细胞的成骨向分化,目前仍没有确切的研究结论。本实验采用RNA干扰的方式,抑制MG-63细胞中KLF10的表达,观察KLF10缺失条件下MG-63在受到成骨分化诱导时特性的改变,以探讨KLF10对MG-63细胞分化命运的调控,为骨组织损伤修复与重建提供新的研究思路。
材料与方法
1 材 料 MG-63细胞系(购于ATCC,美国);α-MEM培养基、胎牛血清(Gibco BRL,美国);L-抗坏血酸、β-磷酸甘油、细胞培养用地塞米松(Sigma-Aldrich,美国);Lipofectamine 2000脂质体转染试剂、Trizol(Invitrogen,美国);RevertAid First Strand cDNA SynthesisKit反转录试剂盒(Thermo,美国);SYBR Premix EX Taq(Takara,日本);全蛋白提取试剂盒、BCA蛋白浓度测定试剂盒(凯基生物科技发展有限公司,南京);Anti-KLF10 抗体、Anti-β-actin抗体(Abcam,英国);Anti-Runx2抗体(Santa Cruz,美国);PVDF膜(Roche,瑞士);二氧化碳恒温孵箱(Thermo,美国);荧光定量PCR仪、酶联免疫检测仪(Bio-Rad,美国);Image Quant 350 快速化学光成像系统(GE,美国)。
2 实验方法 ①转染抑制KLF10的shRNA表达载体:MG-63细胞系培养采用含10%胎牛血清的α-MEM培养液,培养于饱和湿度37 ℃、5% CO2细胞培养箱中。根据文献[4]中已验证的针对KLF10基因的siRNA干扰序列(5’-GAA CCC TCT CAA GTG TCA AAT-3’),经过BLAST验证确定干扰靶点唯一后交由上海吉玛技术有限公司利用pGPH1/GFP/Neo载体构建相应的shRNA表达质粒。取生长状态良好的MG-63细胞均匀接种至6孔细胞培养板中,待细胞生长至80%融合后使用Lipofectamine 2000将shRNA表达质粒转染至细胞内,命名为si-KLF10常规培养24 h后提取细胞RNA及蛋白进行后续实验。②KLF10 mRNA的检测:取转染shRNA及正常的MG-63细胞,弃培养液后PBS清洗,加入Trizol提取细胞总RNA,定量后取1 μg RNA,使用RevertAid First Strand cDNA SynthesisKit试剂盒反转录为cDNA,保存于-80℃冰箱备用。设计KLF10及GAPDH引物,序列如下。KLF10:正向5’- ACT GCC AAA CCT CAC ATT GC -3’, 反向 5’-ACG AAT CAC ACT TGT TGC CTG-3’。GAPDH:正向5’-GAC CCC TTC ATT GAC CTC A-3’ 反向5’-GCT CCT GGA AGA TGG TGA-3’。 PCR反应体系如下:SYBR Premix EX Taq 12.5 μl,上游引物1 μl,下游引物1 μl,cDNA模板2 μl,ddH2O 8.5 μl。实时定量反应条件如下:95 ℃预变性30 s;95 ℃变性10 s,55 ℃退火10 s,72 ℃延展10 s,读取荧光,45个循环;65~95 ℃每次递增0.5℃加热5 s并读取荧光绘制溶解曲线以验证扩增的特异性,后冷却至4 ℃。将GAPDH作为内参,采用2-ΔΔCt法计算KLF10 mRNA的相对表达量。实验重复3次,统计分析各组细胞间差异。③蛋白质印迹(Western blot)检测KLF10的蛋白表达:取转染shRNA及正常的MG-63细胞,弃培养液并用预冷PBS清洗后,胰蛋白酶消化收集细胞,按照试剂盒说明步骤提取细胞蛋白。BCA法测定各组蛋白浓度后按比例加入5×Loading Buffer,开水煮沸5 min。取等量蛋白样本进行SDS-聚丙烯酰氨凝胶电泳(SDS-PAGE),根据KLF10蛋白及β-actin蛋白分子量大小截取凝胶并转至PVDF膜上,用5%脱脂奶粉的TBST封闭1 h。分别用Anti-KLF10 抗体,Anti-β-actin抗体室温孵育1 h,4 ℃过夜,TBST洗膜,加入二抗室温孵育1 h,TBST洗膜后加化学发光试剂浸润,ImageQuant 350成像。④成骨分化诱导:实验分为两组,对照组为正常MG-36细胞,实验组为转染shRNA表达载体的KLF10表达抑制的MG-63细胞。成骨分化诱导前取生长良好的MG-63细胞接种至6孔培养板,实验组按上述方案转染后培养24 h,对照组常规培养。之后两组均更换为含有50 ng/ml L-抗坏血酸、10 mmol/L β-磷酸甘油钠及1×10-8mmol/L地塞米松并添加10%胎牛血清的α-MEM培养液诱导分化。培养72 h后收集细胞提取RNA,实时定量PCR检测成骨标志性基因碱性磷酸酶(ALP)、骨钙蛋白(OC)、骨唾液酸蛋白(BSP)以及成骨调节转录因子Runx2的mRNA表达量,引物序列如下。ALP:5’- ACT GGT ACT CAG ACA ACG AGA T -3’, 反向 5’- ACG TCA ATG TCC CTG ATG TTA TG -3’。OC:5’- CAC TCC TCG CCC TAT TGG C -3’, 反向 5’- CCC TCC TGC TTG GAC ACA AAG-3’。BSP:5’- CAC TGG AGC CAA TGC AGA AGA -3’, 反向 5’- TGG TGG GGT TGT AGG TTC AAA -3’。Runx2:正向5’- TGG TTA CTG TCA TGG CGG GTA -3’, 反向 5’- TCT CAG ATC GTT GAA CCT TGC TA-3’。同时提取细胞蛋白Western blot检测Runx2蛋白表达。
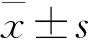
结 果
1 KLF10干扰效率的验证 将干扰KLF10的shRNA表达质粒转染入MG-63细胞系后,由于载体带有GFP绿色荧光蛋白,可见绝大多数细胞均成功转染,呈现绿色荧光(图1 A),说明本实验达到较高的转染效率。之后,我们检测了转染后细胞KLF10 mRNA的相对表达量,结果显示经过shRNA干扰后细胞的KLF10 mRNA表达水平降低到之前的40%左右(图1 B)。进一步Western blot同样验证了siRNA干扰后的MG-63细胞KLF10蛋白表达显著降低(图1C)。

A:shRNA表达质粒转染效率;B:实时定量PCR检测KLF10 mRNA相对表达量;C:Western blot检测KLF10蛋白
2 KLF10表达抑制对MG-63细胞成骨分化诱导后成骨标志性基因mRNA表达的影响 MG-63细胞经过siRNA干扰KLF10后ALP mRNA表达并无明显变化(P>0.05)(图2 A)。经过成骨诱导分化72 h后,正常MG-63细胞及KLF10抑制的si-KLF10细胞的ALP mRNA水平都显著提升(P<0.05),分别提升了6倍及4倍左右;同时,无论是否经过成骨分化诱导,KLF10抑制却可导致MG-63细胞中OC mRNA表达量的持续降低(图2B)。然而,无论是否经过成骨分化诱导,KLF10抑制都对MG-63细胞中BSP mRNA表达量无显著影响(图2 C)。
3 KLF10表达抑制对MG-63细胞中成骨调节转录因子Runx2的影响 成骨分化诱导能够显著提升Runx2的表达。然而siRNA干扰KLF10表达下降后,无论是否进行成骨分化诱导,MG-63细胞中的Runx2 mRNA及蛋白的表达量都要显著低于正常MG-63细胞(图3)。
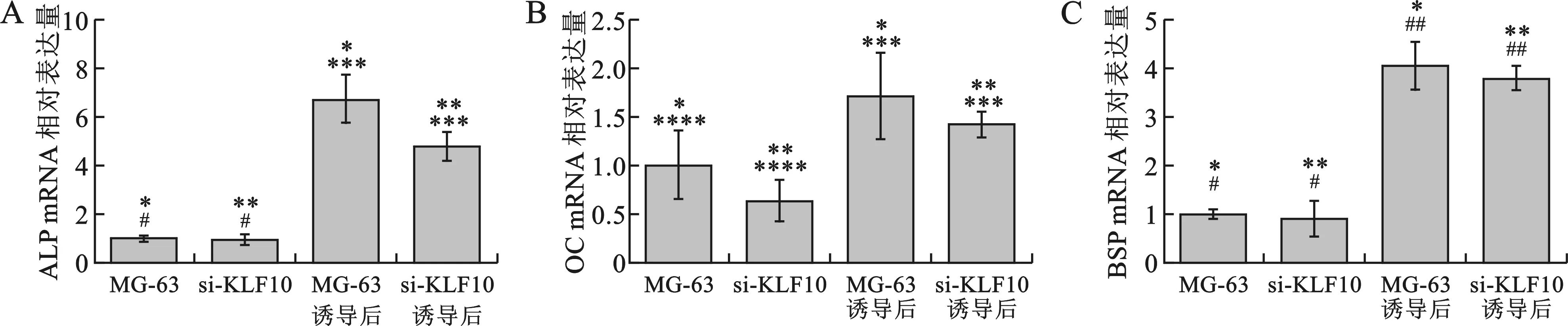
相同*标识的两组之间存在统计学差异(P<0.05);相同#标识的两组之间不存在统计学差异(P>0.05)
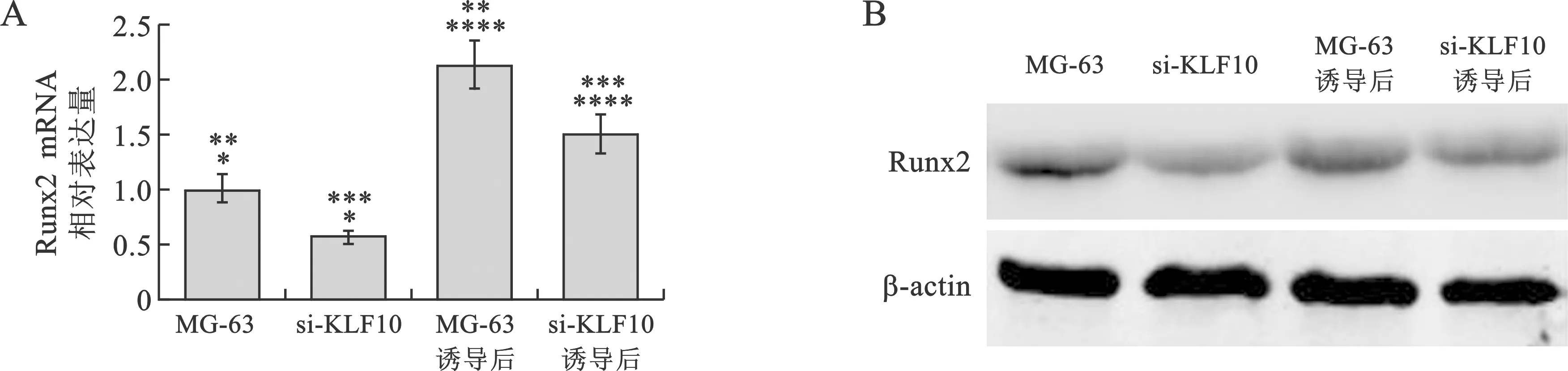
图3 各组细胞中Runx2 mRNA (A)及蛋白(B)的表达
讨 论
MG-63细胞系是骨肉瘤细胞来源的永生化细胞系,经过成骨分化诱导液及多种因子如TGF-β、BMP2等诱导后可表现出成骨细胞的特性并形成矿化结节,因此众多实验都将选用它进行成骨分化调控的研究[5-7]。TGF-β对成骨细胞分化的调控较为复杂,不仅通过其下游的smads分子发挥作用,还与notch、Wnt等多种信号通路均有交通与对话。KLF作为其直接的效应分子,也与成骨发育密切相关。从KLF10基因敲除小鼠颅盖中分离的成骨细胞在体外培养时呈现分化延迟及基质分泌、矿化障碍[3],说明KLF10在成骨细胞分化过程中起到不可或缺的作用。另一方面,KLF10还在肝癌、乳腺癌、胰腺癌等众多恶性肿瘤细胞增殖、凋亡的调控机制中发挥重要作用[4,8]。那么KLF10在肿瘤细胞来源的MG-63细胞系中是依旧行使其成骨活性,还是促使细胞向肿瘤增殖方向发展呢?本实验在体外采用RNA干扰的方法抑制MG-63细胞中KLF10的表达,以观察其成骨特性的改变。
ALP在组织矿化过程中发挥非常重要的作用,常在成骨细胞分化早期表达。而OC则是成骨细胞分化的晚期标志物[7]。本实验结果表明KLF10抑制的细胞经过分化诱导后ALP,OC表达的增加量低于正常细胞。这表明KLF10对ALP、OC的表达都有着调控作用。而在分化诱导之前KLF10被抑制并没有直接导致MG-63细胞中ALP mRNA表达量的减少,这可能是由于未分化的MG-63细胞中ALP的表达量很低造成的。BSP是也一种和成骨密切相关的的胞外糖蛋白,本实验中发现虽然成骨分化诱导能够显著提高BSP的表达,但KLF10表达抑制对BSP的表达无显著影响。有研究表明BSP不仅在矿化相关细胞中表达,在肿瘤细胞中也有明确表达并发挥重要作用[9],因此,在MG-63细胞系中,BSP可能到其他信号通路的调节。
Runx2是成骨细胞分化调控的一个关键性转录因子,同时,它也被证实是受TGF-β调控的下游分子。本实验表明在MG-63细胞系中,KLF10对Runx2有直接的调控作用,这与Hawse等[3]在KLF10基因敲除的狗颅盖骨成骨细胞的研究结果相一致。由于Runx2作为转录因子直接调控众多成骨相关因子的表达[10],因此KLF10在MG-63细胞系中的调控作用可能是通过Runx2实现的,但其中的确切机制仍需进一步研究。
[1] Chen G, Deng C, Li YP. TGF-β and BMP signaling in osteoblast differentiation and bone formation[J]. Int J Biol Sci,2012,8(2):272-288.
[2] Subramaniam M,Hawse JR,Rajamannan NM,etal.Functional role of KLF10 in multiple disease processes[J]. Biofactors,2010 ,36(1):8-18.
[3] Hawse JR,Cicek M,Grygo SB,etal.TIEG1/KLF10 modulates Runx2 expression and activity in osteoblasts[J]. PLoS One,2011,6(4):e19429.
[4] Hwang YC,Yang CH,Lin CH,etal.Destabilization of KLF10, a tumor suppressor, relies on thr93 phosphorylation and isomerase association[J]. Biochim Biophys Acta,2013,1833(12):3035-3045.
[5] Liu B,Wu S,Han L,etal. β-catenin signaling induces the osteoblastogenic differentiation of human pre-osteoblastic and bone marrow stromal cells mainly through the upregulation of osterix expression[J]. Int J Mol Med,2015,36(6):1572-1582.
[6] Sefat F,Khaghani SA,Nejatian T,etal.Transforming growth factor beta (TGF-β) isomers influence cell detachment of MG-63 bone cells[J]. Tissue Cell,2015,47(6):567-574.
[7] Ongaro A,Pellati A,Bagheri L,etal.Characterization of Notch Signaling During Osteogenic Differentiation in Human Osteosarcoma Cell Line MG63[J]. Cell Physiol,2016 ,231(12):2652-2663.
[8] Yao K,Xing HC,Wu B,etal.Effect of TIEG1 on apoptosis and expression of Bcl-2/Bax and Pten in leukemic cell lines[J]. Genet Mol Res,2015,14(1):1968-1974.
[9] Wang J,Wang L,Xia B,etal.BSP gene silencing inhibits migration, invasion, and bone metastasis of MDA-MB-231BO human breast cancer cells[J].PLoS One,2013,8(5):e62936.
[10] Komori T. Regulation of osteoblast differentiation by Runx2[J]. Adv Exp Med Biol, 2010,658:43-49.
(收稿:2016-12-21)
RNA干扰 成骨细胞 细胞分化 类Kruppel转录因子 @MG-63细胞系
R783.5
A
10.3969/j.issn.1000-7377.2017.06.006
