连花定喘片治疗支气管哮喘的疗效
2017-06-27冯娜娜宋元林白春学
包 晨 周 霞 冯娜娜 李 静 宋元林 白春学 杨 冬 周 建△
(1复旦大学附属中山医院呼吸科 上海 200032; 2复旦大学附属华山医院呼吸科 上海 200040)
连花定喘片治疗支气管哮喘的疗效
包 晨1周 霞2冯娜娜1李 静1宋元林1白春学1杨 冬1周 建1△
(1复旦大学附属中山医院呼吸科 上海 200032;2复旦大学附属华山医院呼吸科 上海 200040)
目的 评价连花定喘片治疗支气管哮喘的疗效。方法 将50只SPF级BALB/C小鼠随机分为对照组、模型组、地塞米松组、连花高剂量组、连花低剂量组,每组10只。采用卵清白蛋白+氢氧化铝致敏,并雾化激发复制小鼠支气管哮喘模型,给药组于每次激发前30 min给药,共计7次。采用特殊气道阻力值评估气道高反应性,肺组织HE染色及肺泡灌洗液(bronchoalveolar lavage fluid,BALF)细胞分类计数评价各组小鼠气道炎症性改变,ELISA法和磁性Luminex®分析法检测BALF和血清中IL-4、IL-13、INF-γ的表达。结果 地塞米松组和连花高剂量组能显著降低气道阻力(P<0.05)。地塞米松组和连花高、低剂量组BALF中的各类炎性细胞数量和IL-13的表达均明显减少(P<0.05)。血清IL-13的表达在地塞米松组明显降低(P<0.05),但在连花高、低剂量组中没有变化。各组小鼠BALF和血清中IL-4和INF-γ的表达没有统计学差异。结论 连花定喘片可缓解哮喘症状,可能与其降低Th2型细胞因子IL-13的含量,从而减轻气道炎症有关。
连花定喘片; 支气管哮喘; 气道高反应性; 细胞因子; 地塞米松
支气管哮喘是一种由嗜酸性粒细胞、肥大细胞、T淋巴细胞等多种炎性细胞参与的气道慢性炎症性疾病,具有可逆性气流受限的特点。在哮喘病理生理过程中,Th1/Th2细胞比例失衡,尤其是Th2细胞过度增殖活化、分泌细胞因子过多是引起气道炎症的主要原因之一[1]。目前,中医药治疗哮喘在临床上取得了一定进展,一些研究证明中西医结合治疗控制气道炎症的作用优于单独使用激素或常规西药治疗[2-4]。连花定喘片是一种纯中药制剂,其主要成分为麻黄、白果、桑白皮等,具有宣肺降气平喘,清热化痰通络之功效。本文拟通过建立哮喘小鼠模型,观察连花定喘片和地塞米松对哮喘小鼠外周血和支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF) 中各类炎性细胞以及Th2型细胞因子IL-4、IL-13,Th1型细胞因子INF-γ的影响,以评价连花定喘片的治疗效果。
材 料 和 方 法
实验动物及分组 健康BALB/C小鼠,SPF级,雄性,6~8周龄。购于上海斯莱克实验动物有限责任公司,生产许可证号:SCXK(沪)2012-0002。随机分为5组:对照组、模型组、地塞米松组、连花高剂量组、连花低剂量组。
主要药物和试剂 连花定喘片(批号:A1405001,北京以岭药业股份有限公司);注射用地塞米松磷酸钠(批号:150523-2,马鞍山丰原制药有限公司);卵清白蛋白(五级)、氢氧化铝、乙酰甲胆碱均购于美国Sigma公司;小鼠IL-4、IL-13、INF-γ ELISA试剂盒均购于美国R&D公司;磁性Luminex®分析仪购于美国Life Technologies公司;戊巴比妥钠购于德国默克公司。
主要仪器 压缩式雾化器(型号:AG CLASSIC,德国飞利浦公司);无创式动物肺功能检测分析仪(型号:FinePointeTMNAM,美国Buxco公司);全自动五分类动物血细胞分析仪(型号:ProCyte Dx,美国IDEX公司)。低温高速离心机(型号:5804R,德国Eppendorf公司);高通量多元生物医学应用软件MILLIPLEX Analyst(美国密理博公司)。
动物模型复制 哮喘模型的复制根据Shi等[5]的方法进行改进,于实验第0、7天,除对照组给予0.1 mL 0.9 %生理盐水外,其余各组小鼠均以新鲜配置的卵白蛋白(ovalbumin,OVA)致敏液(0.1 mg OVA+2 mg氢氧化铝溶于0.1 mL生理盐水)作腹腔注射。于实验第14天开始,将小鼠置于自制雾化箱(40 cm×30 cm×20 cm)内,用超声雾化器雾化1% OVA生理盐水溶液30 min (对照组予生理盐水雾化),每天1次,连续7天,以激发哮喘。
给药方法 给药组从实验第14天开始于每次雾化激发前30 min给药,连续7天。连花高、低剂量组分别按5.1、1.3 g/kg (生药/体质量)药物含量煎成水溶液后灌胃(分别相当于临床成人用量的14、3.5倍)。地塞米松组按1 mg/kg体质量左下腹腹腔注射给药。对照组和模型组给予生理盐水作对照处理。
气道反应性检测 最后一次激发后24 h,用Buxco肺功能分析仪进行无创气道反应性检测,以PBS、不同浓度的乙酰甲胆碱溶液(3.125、6.25、12.5、25、50 mg/mL)进行支气管激发,观察不同浓度乙酰甲胆碱激发下其气道阻力参数特殊气道阻力值(specific airway resistance,sRaw)值的变化。
取材 腹腔注射1.5%戊巴比妥钠60 mg/kg麻醉,眼球取血,于4 ℃下900×g离心5 min,分离血清于-80 ℃保存。取血后开胸,气管插管并固定,使用1 mL注射器以无菌PBS行双肺肺泡灌洗,回收率>80%,BALF进行细胞五分类计数后,于4 ℃下100×g离心10 min,取上清于-80 ℃冻存。留取肺组织,未灌洗过的肺组织放入缓冲中性4%甲醛溶液,固定48 h后常规石蜡包埋切片,肺组织HE染色,用于镜下观察肺内支气管损伤以及支气管、肺组织炎性细胞浸润情况,其余肺组织于-80 ℃冻存。
指标检测 运用ELISA方法测定血清和BALF中的IL-4、IL-13、INF-γ的水平,严格按照试剂盒说明书操作,全自动酶标仪在450 nm处检测各孔的吸光度值。运用磁性Luminex®分析法检测血清和BALF中IL-4、IL-13、INF-γ的水平,并用MILLIPLEXTM高通量多元生物医学应用软件进行分析。
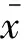
结 果
各组小鼠气道反应性的情况 与对照组比较,模型组的sRaw值随着乙酰甲胆碱浓度的不断增加,在浓度为6.25、12.5和25mg/mL时,差异有统计学意义(P<0.05,图1)。与模型组比较,地塞米松组和连花高剂量组气道阻力有明显改善,在药物浓度为12.5和25mg/mL时,差异有统计学意义(P<0.05,图1);连花低剂量组气道阻力稍有改善,但差异无统计学意义。

(1)vs.Control group,P<0.05;(2)vs.OVA group,P<0.05.
图1 各组小鼠气道反应性的变化
Fig 1 Changes of airway responsiveness in different mice groups
各组小鼠肺组织HE染色 对照组小鼠肺组织HE染色可见支气管和肺泡结构清晰,黏膜无明显破坏及炎性细胞浸润的表现。模型组小鼠支气管壁周围有较明显的炎性细胞浸润,平滑肌层增厚,管腔内上皮结构破坏,管腔内可见脱落的上皮细胞。地塞米松组和连花高、低剂量组小鼠支气管周围炎性细胞浸润明显减轻(图2)。

Original magnification,×100 separately.A:Control group;B:OVA group;C:DEX group;D:High-doseLianhuagroup;E:Low-doseLianhuagroup.
图2 各组小鼠肺组织HE染色
Fig 2 HE staining in lung tissues of different mice groups
各组小鼠BALF中炎性细胞计数的情况 与对照组比较,模型组BALF中白细胞总数、嗜酸性细胞、中性粒细胞、淋巴细胞计数均显著增高,差异有统计学意义(P<0.05,图3)。与模型组比较,地塞米松组BALF中的白细胞总数、嗜酸性细胞、中性粒细胞、淋巴细胞计数均明显减少,差异有统计学意义(P<0.05,图3);连花高剂量组也能显著抑制白细胞总数、嗜酸性粒细胞、淋巴细胞水平,差异有统计学意义(P<0.05,图3),但对中性粒细胞水平的抑制不明显。连花低剂量组炎性细胞数量稍有降低,差异无统计学意义。
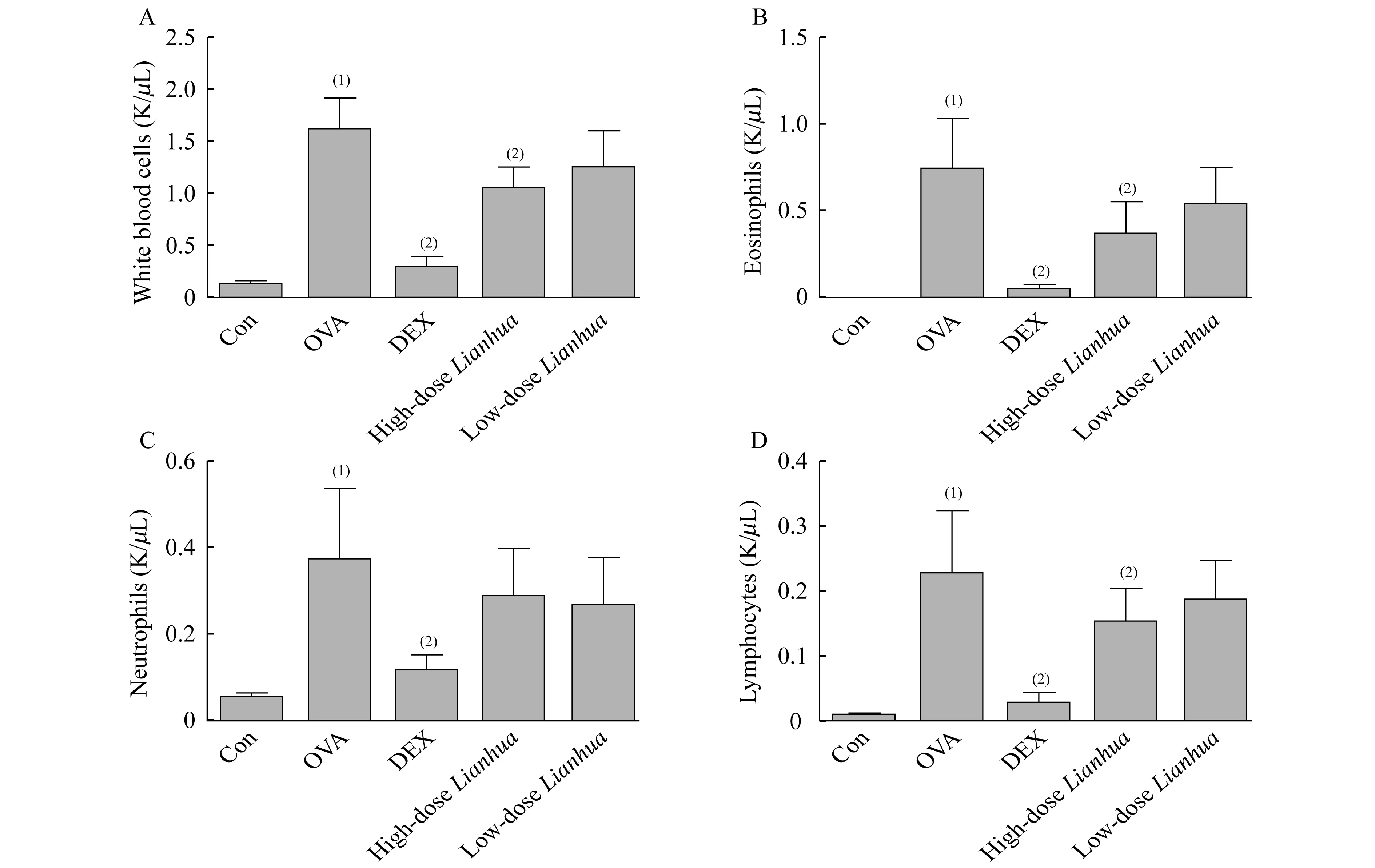
各组小鼠BALF中IL-4、IL-13、INF-γ的水平模型组BALF中IL-13的表达显著高于对照组,差异有统计学意义(P<0.05,图4);地塞米松组BALF中IL-13的表达较模型组明显降低,差异有统计学意义(P<0.05,图4)。连花高、低剂量组BALF中IL-13的表达较模型组明显降低,ELISA法检测显示连花低剂量组差异有统计学意义,磁性Luminex®法检测显示连花高剂量组差异有统计学意义(P<0.05,图4)。IL-4和INF-γ在各组间BALF中的表达差异无统计学意义。ELISA法和磁性Luminex®两种检测方法所得结果较为一致。
各组小鼠血清中IL-4、IL-13、INF-γ的水平 模型组血清中IL-13的表达显著高于对照组,差异有统计学意义(P<0.05,图5);地塞米松组血清中IL-13的表达较模型组明显降低,差异有统计学意义(P<0.05,图5);连花高、低剂量组均不能抑制血清中IL-13的表达。IL-4和INF-γ在各组间血清中的表达差异无统计学意义。ELISA法和磁性Luminex®两种检测方法所得结果较一致。
(1)vs.Control group,P<0.05.(2)vs.OVA group,P<0.05.
图3 各组小鼠BALF中炎性细胞的比较
Fig 3 Inflammatory cells in BALF in different mice groups
A,B and C:Quantified by ELISA;D,E and F:Quantified by Magnetic Luminex®.(1)vs.Control group,P<0.05;(2)vs.OVA group,P<0.05.
图4 各组小鼠BALF中细胞因子的比较
Fig 4 Cytokines in BALF in different mice groups
A,B and C:Quantified by ELISA;D,E and F:Quantified by Magnetic Luminex®.(1)vs.Control group,P<0.05;(2)vs.OVA group,P<0.05.
图5 各组小鼠血清中细胞因子的比较
Fig 5 Cytokines in serum in different mice groups
讨 论
支气管哮喘是一种以可逆性气流受限、嗜酸性粒细胞和Th2型细胞因子浸润、气道高反应性和气道重塑为特征的气道慢性炎症性疾病[6]。众多研究表明,体内Th1/Th2比例失调是引起哮喘发生的主要原因,在哮喘发病过程中Th2细胞功能亢进,Th1细胞功能降低[1,7]。Th1细胞主要分泌IL-2、INF- γ,介导1型免疫反应;Th2细胞主要分泌IL-4、IL-5、IL-13,刺激2型免疫反应[8-9]。IL-4是B细胞的生长因子,作用在B 淋巴细胞上可刺激 B 淋巴细胞产生IgE,还可通过B细胞对T细胞的抗原提呈作用,促进IgE介导体液免疫应答,从而诱发支气管哮喘[10]。IL-13可通过募集和激活炎性细胞而介导嗜酸性粒细胞的聚集,还可促进IgE的产生,抑制Th1细胞的分化,诱导其向Th2细胞分化[11-12];此外,IL-13还可增加气道高反应性、促进支气管内黏液的分泌和细胞外基质的合成,增强气道平滑肌细胞的收缩力,从而参与气道炎症和气道重塑的过程[13]。IFN-γ不仅能够调节嗜酸性粒细胞活化和募集,下调嗜酸粒细胞趋化因子受体的表达,还能抑制IgE的生成;此外,IFN-γ作为NO合成酶的主要诱导剂,在NO抑制平滑肌细胞增殖的过程中具有重要作用[14-15]。实验结果显示,哮喘模型组BALF和血清中IL-13水平显著高于对照组,且BALF中白细胞总数、嗜酸性细胞、中性粒细胞、淋巴细胞计数明显增高且伴有气道高反应性,病理结果也显示哮喘模型组小鼠气道黏膜水肿、支气管壁增厚等病理改变,提示IL-13与气道炎症和气道重塑有关。但是本实验中各组小鼠BALF和血清中IL-14和IFN-γ的差异无统计学意义。
临床治疗哮喘的主要原则是控制和消除气道炎症,糖皮质激素具有较强的抗变态反应,能够有效控制炎症而抑制哮喘的发作。实验发现,地塞米松治疗能明显缓解哮喘模型组小鼠气道高反应性,降低BALF中各类炎性细胞总数,抑制BALF和血清中IL-13水平,能够较好地控制哮喘气道炎症(P均<0.05)。连花高、低剂量组小鼠BALF中的IL-13水平也较哮喘模型组显著降低(P均<0.05);给予高剂量连花定喘片治疗,能够明显抑制BALF中各类炎性细胞数量,降低气道高反应性(P均<0.05),较低剂量连花定喘片效果更优,但差异无统计学意义。
在临床上,部分哮喘患者常规吸入糖皮质激素治疗无效[16],且高剂量吸入激素的安全性也令人担忧,可增加条件致病菌感染的患病率[17]。连花定喘片主要成分为麻黄、白果、桑白皮等,药理研究发现其可抑制变态反应、肥大细胞脱颗粒等,发挥对支气管哮喘的防治作用。
综上所述,连花定喘片与地塞米松作用相当,可缓解小鼠哮喘症状,可能与其降低哮喘小鼠IL-13水平,减轻气道炎症有关。连花定喘片作为一种中药制剂,不良反应少,安全性好,值得推广。
[1] WEGMANN M.Th2 cells as targets for therapeutic intervention in allergic bronchial asthma[J].ExpertRevMolDiagn,2009,9(1):85-100.
[2] 麻向伟,吴颜昆,李增辉.中药联合激素治疗小儿哮喘疗效分析[J].四川中医,2015,33(4):121-123.
[3] 赵坤,李静,王书玲.中药配合半剂量与全剂量激素吸入控制儿童哮喘的临床对照研究[J].中华中医药杂志,2011,26(8):1881-1883.
[4] 张素华.小青龙汤联合西药治疗支气管哮喘急性发作期随机平行对照研究[J].实用中医内科杂志,2013,27(2):85-86.
[5] SHI JP,LI XN,ZHANG XY,etal.Gpr97 is dispensable for inflammation in ova-induced asthmatic mice[J].PLoSOne,2015,10(7):e0131461.
[6] HALL S,AGRAWAL DK.Key mediators in the immunopathogenesis of allergic asthma[J].InterImmunopharmacol,2014,23(1):316-329.
[7] FAHY JV.Type 2 inflammation in asthma-present in most,absent in many[J].NatRevImmunol,2015,15(1):57-65.
[8] VOEHRINGER D,REESE TA,HUANG XZ,etal.Type 2 immunity is controlled by IL-4/IL-13 expression in hematopoietic non-eosinophil cells of the innate immune system[J].JExpMed,2006,203(6):1435-1446.
[9] SPELLBERG B,EDWARDS JE.Type 1 type 2 immunity in infectious diseases[J].ClinInfectDis,2001,32(1):76-102.
[10] KESKIN O,KESKIN M,KUCUKOSMANOGLU E,etal.Exhaled RANTES and interleukin 4 levels after exercise challenge in children with asthma[J].AnnAllergyAsthmaImmunol,2012,109(5):303-308.
[11] OOI AT,RAM S,KUO A,etal.Identification of an interleukin 13-induced epigenetic signature in allergic airway inflammation[J].AmJTranslRes,2012,4(2):219-228.
[12] 诸留珍,黄杰,葛蕾,等.哮喘儿童 PBMC培养上清中 IL-13变化及其与嗜酸细胞计数、IgE关系探讨[J].临床儿科杂志,2005,23(9):613-614.
[13] 王正东,姚汉清,闵凌峰,等.白介素13受体α2在哮喘小鼠肺组织细胞内表达与气道重塑的关系[J].中华肺部疾病杂志:电子版,2015,8(1):30-33.
[14] TORRONE DZ,KURIAKOSE JS,MOORS K,etal.Reproducibility and intraindividual variation over days in buccal cell DNA methylation of two asthma genes,interferon γ (IFNγ) and inducible nitric oxide synthase (iNOS)[J].ClinEpigenetics,2012,4(1):3.
[15] MITCHELL C,PROVOST K,NIU N,etal. IFN-γ acts on the airway epithelium to inhibit local and systemic pathology in allergic airway disease[J].JImmunol,2011,187(7):3815-3820.
[16] 郝敏,林江涛.糖皮质激素抵抗性支气管哮喘诊治进展[J].中华结核和呼吸杂志,2014,37(4):296-298.
[17] 李陶,李静超,亓倩,等.地塞米松增强烟曲霉孢子侵袭力的研究[J].中华医院感染学杂志,2014,24(8):1824-1826.
Efficacy ofLianhuaDingchuanTablets in bronchial asthma
BAO Chen1, ZHOU Xia2, FENG Na-na1, LI Jing1, SONG Yuan-lin1, BAI Chun-xue1, YANG Dong1, ZHOU Jian1△
(1DepartmentofRespiratoryMedicine,ZhongshanHospital,FudanUniversity,Shanghai200032,China;2DepartmentofRespiratoryMedicine,HuashanHospital,FudanUniversity,Shanghai200040,China)
Objective To evaluate the efficacy ofLianhuaDingchuanTablets in bronchial asthma.Methods Fifty BALB/C mice were randomly and equally divided into control (Con) group,ovalbumin (OVA) group,dexamethasone (DEX) group,high-doseLianhuagroup,low-doseLianhuagroup.The mice were sensitized and challenged with OVA plus aluminium hydroxide to establish asthmatic model and were pre-treated 30 minutes before challenge.Specific airway resistance(sRaw) was used to evaluate airway hyperresponsiveness,and airway inflammatory changes were measured.ELISA and Magnetic Luminex®were used to quantified the levels of IL-4,IL-13 and INF-γ. Results Airway resistance significantly decreased in DEX group and High-doseLianhua group (P<0.05).Levels of inflammatory cells and IL-13 in BALF evidently reduced in DEX group,high-doseLianhuagroup and low-doseLianhuagroup (P<0.05),while IL-13 level in serum only decreased in DEX group.There was no significant changes in the levels of IL-4 and INF-γ among those groups.ConclusionsLianhuaDingchuanTablets might relieve the symptoms of asthma by reducing IL-13 level and inhibiting the airway inflammation.
LianhuaDingchuanTablets; bronchial asthma; airway hyperresponsiveness;cytokines; dexamethasone
北京市科委“十病十药专项”(Z121102001112002);国家自然科学基金(81400018,81570028);高等学校博士学科点专项科研基金(20130071120063);科技部国家重点研发计划(2016YFC1304104)
R562.2
A
10.3969/j.issn.1672-8467.2017.03.013
2016-10-24;编辑:王蔚)
△Corresponding author E-mail:zhou.jian@fudan.edu.cn
*This work was supported by “Ten Diseases and Ten Drugs Research Project” of Beijing Municipal Science and Technology Commission(Z121102001112002),National Natural Science Foundtion of China (81400018,81570028),Doctoral Fund of Ministry of Education of China (20130071120063) and National Key R&D Plan from Ministry of Science and Technology (2016YFC1304104).
