地塞米松抑制烟曲霉菌暴露的支气管哮喘大鼠肺组织IL-33的表达
2017-06-27金先桥
周 霞 金先桥
(复旦大学附属华山医院呼吸科 上海 200040)
地塞米松抑制烟曲霉菌暴露的支气管哮喘大鼠肺组织IL-33的表达
周 霞 金先桥△
(复旦大学附属华山医院呼吸科 上海 200040)
目的 研究烟曲霉菌暴露对支气管哮喘大鼠肺组织IL-33水平的影响及地塞米松的作用。方法 将24只Wistar大鼠随机分为A组(正常对照组)、B组(哮喘组)、C组(烟曲霉菌暴露组)、D组(地塞米松干预组),每组6只。B、C、D组均以卵白蛋白(ovalbumin,OVA)致敏、激发的方法构建哮喘模型;C、D组在哮喘模型构建成功后,给予烟曲霉菌孢子鼻腔滴入;D组在OVA激发阶段给予地塞米松干预;A组则予等量生理盐水致敏、激发、滴鼻作为对照。通过气道高反应性检测、嗜酸性粒细胞百分比及血清IgE水平确定哮喘模型的建立,ELISA法及qRT-PCR法检测肺组织IL-33的表达,大鼠肺组织和全血于马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)上培养24 h后观察烟曲霉菌菌落生长情况。结果 B、C组与A组比较,肺泡灌洗液中嗜酸性粒细胞百分比、血清IgE水平及肺组织IL-33的表达均明显升高(P<0.05),且C组比B组升高更明显。各组间气道反应性指标sRaw变化值差异不明显。D组与C组比较,嗜酸性粒细胞百分比及肺组织IL-33的表达均明显降低(P<0.05),血清IgE水平降低不显著,但肺组织烟曲霉菌培养阳性率高于C组。结论 糖皮质激素(地塞米松)能够抑制烟曲霉菌暴露的支气管哮喘大鼠肺组织IL-33的表达,但增加了气道真菌定植的风险,针对IL-33的阻断治疗有待进一步研究。
烟曲霉菌; 支气管哮喘; 白细胞介素33; 地塞米松; Wistar大鼠
烟曲霉菌孢子作为一种重要的外源性过敏原,广泛飘散于空气中,并与呼吸道疾病密切相关。大量的研究显示,环境中高浓度烟曲霉菌孢子吸入与支气管哮喘(以下简称哮喘)急性发作及加重密切相关[1-2]。对烟曲霉菌过敏成为哮喘加重的重要危险因素之一,持续或间歇性烟曲霉菌暴露及其在气道内的定植与生长可能是哮喘恶化的驱动因素。随着变态反应性支气管肺曲霉病(allergic bronchopulmonary aspergillosis,ABPA)、变态反应性支气管肺霉菌病(allergic bronchopulmonary mycosis,ABPM) 和真菌致敏性重症哮喘(severe asthma associated with fungal sensitization,SAFS)等概念的提出[3-4],烟曲霉菌与重症哮喘及难治性哮喘的联系越来越受到重视。
Th1/Th2细胞比例失调是引起哮喘的主要原因,Th2细胞过度活化所产生的Th2型细胞因子在哮喘慢性气道炎症中起重要作用。近年来,白细胞介素33 (interleukin 33,IL-33)作为一种新发现的细胞因子受到关注,当致敏原刺激气道上皮后,上皮细胞来源的IL-33与其受体ST2结合可激活II型固有淋巴细胞(group 2 innate lymphoid cells,ILC2s),产生大量的Th2细胞因子,从而介导Th2型免疫反应,参与哮喘的发生发展[5-7]。但是,烟曲霉菌相关的难治性哮喘发生是否与IL-33有关,哮喘常用药物糖皮质激素治疗对IL-33表达有无影响,目前仍不清楚。
本文通过模拟哮喘患者真菌暴露的状态,给予慢性哮喘大鼠烟曲霉菌孢子吸入,观察和分析哮喘大鼠相关症状与指标。本研究目的在于分析暴露于烟曲霉菌环境中的哮喘大鼠肺组织内IL-33水平的改变以及地塞米松治疗的利弊,从而为哮喘的治疗提供新思路。
材 料 和 方 法
实验动物 SPF级Wistar大鼠购于上海斯莱克实验动物有限责任公司,生产许可证号:SCXK(沪)2012-0002,雄性,体质量180~200 g,实验前适应性饲养1周。动物饲养及实验方案均严格按照复旦大学动物伦理委员会动物实验规范执行。
主要试剂与仪器 烟曲霉菌株(复旦大学附属华山医院皮肤科真菌室保存菌株,菌株号Af 293);马铃薯葡萄糖琼脂培养基(PDA,上海盛思公司);卵白蛋白(OVA,美国Sigma公司);氢氧化铝(美国Sigma公司);乙酰甲胆碱(美国Sigma公司);大鼠IL-33 ELISA试剂盒(美国R&D公司);大鼠IgE ELISA试剂盒(英国Abcam公司);注射用地塞米松磷酸钠(批号:150523-2,安徽马鞍山丰原制药公司);易氟烷(美国百特公司);戊巴比妥钠(德国默克公司);Trizol试剂盒(美国Invitrogen公司);SYBR Green PCR试剂盒(日本TOYOBO公司);压缩式雾化器(型号:AG CLASSIC,德国飞利浦公司);无创式动物肺功能检测分析仪(型号:FinePointeTMNAM,美国Buxco公司);五分类血液细胞分析仪(型号:SA-3B100123,深圳迈瑞生物公司);Real-time PCR分析仪(型号:7900HT,美国ABI公司);移液器(法国吉尔森公司);组织匀浆机(型号:Tissuelyser-24,上海净信公司)。
动物分组与模型建立 将24只Wistar大鼠随机等分为A组(正常对照组)、B组(哮喘组)、C组(烟曲霉菌暴露组)、D组(地塞米松干预组)。参照文献[8],B、C、D组大鼠于第1天和第8天给予OVA悬液腹腔注射致敏(1 mL/只,1 mg OVA+100 mg氢氧化铝溶于1 mL无菌生理盐水中);第15天起,将B、C、D组大鼠置于透明密闭雾化箱中连续6周给予1% OVA悬液雾化吸入以激发哮喘(每周5次,每次30 min),A组给予生理盐水致敏并激发以作对照处理;D组大鼠于OVA激发期间(雾化前30 min)给予每周3次的0.5 mg/kg 地塞米松腹腔注射治疗。第57天起,将C、D组大鼠于异氟烷麻醉后垂直位放置,用移液枪吸取100 μL 1.0×107/mL 烟曲霉菌孢子悬液缓慢滴入每侧鼻腔,连续3天,其余各组给予生理盐水滴鼻作为对照。建模流程见图1。实验中观察各组大鼠行为学改变、打喷嚏、流涕等症状。
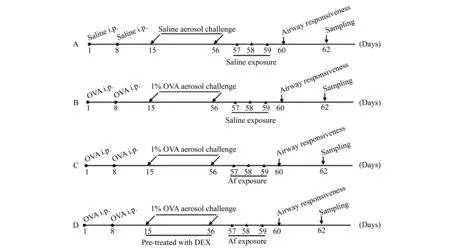
A:Normal control; B:Asthma group; C :Aspergillusfumigatus-exposed group; D :Dexamethasone-treated group.The same in Fig 2 to 4 and Tab 1.
图1 动物实验时间流程图
Fig 1 Time schedule of the experimental procedures
气道反应性检测 于最后一次烟曲霉菌孢子滴鼻24 h后对各组大鼠进行气道反应性测定。本实验采用FinePointeTMNAM无创式动物肺功能检测分析仪,通过检测鼻部气流与胸部气流的相位差计算出特殊气道阻力sRaw[9]。将大鼠置于双腔体积描记器,用不同浓度的乙酰甲胆碱溶液激发支气管哮喘(3.125、6.25、12.5、25.0和50.0 mg/mL),以PBS作为基线。通过FinePointe软件分析各组大鼠在不同浓度乙酰甲胆碱激发下特殊气道阻力sRaw (cmH2O · sec-1· mL-1)的变化。
标本采集 腹腔注射2 %戊巴比妥钠麻醉大鼠后腹主动脉取血,3 000 r/min (离心半径为10 cm),4 ℃离心15 min,取上清于-80 ℃冻存。结扎右肺根部后气管插管并固定,使用无菌PBS行左肺肺泡灌洗,3次共10 mL,肺泡灌洗液(bronchoalveolar lavage fluid,BALF)于1 000 r/min (离心半径10 cm),4 ℃离心10 min,取上清于-80 ℃冻存,细胞沉淀使用200 μL PBS重悬后进行嗜酸性粒细胞百分比计数(EOS%)。
ELISA检测 运用ELISA方法检测大鼠血清中IgE及BALF中IL-33的表达。试剂盒敏感度分别为:IgE,1.419 ng/mL;IL-33,14.3 pg/mL。按照试剂盒说明书操作,全自动酶标仪在450 nm处检测各孔的吸光度值。
qRT-PCR检测 运用qRT-PCR方法检测各组大鼠肺组织中IL-33 mRNA的表达。Trizol法提取肺组织总RNA,逆转录合成样本cDNA。引物由上海生工生物工程有限公司设计并合成,序列如下:β-actin,上游引物 5′-GCA GGA GTA CGA TGA GTC CG-3′,下游引物5′-ACG CAG CTC AGT AAC AGT CC-3′;IL-33,上游引物 5′- GCC CTG AGC ACA TAC AAC GA-3′,下游引物 5′-CGT AGT AAC GGA GTA GCA CC TT-3′。实 验 数 据 采 用 仪 器 自 带 软 件分析,通过2-ΔΔCT计算cDNA相对转录水平。
烟曲霉菌定植的观察 各组大鼠肺组织取相同部位,称重、匀浆(100 mg/mL PBS,置于无菌EP管中)。取肺组织匀浆液和全血各100 μL均匀涂于加有双抗的PDA培养基,37 ℃培养24 h后观察菌落形成。
结 果
一般情况观察A组大鼠给予生理盐水激发前后一般状态没有明显改变,呼吸平稳,状态活跃;B、C组大鼠激发后典型表现为:搔鼻,打喷嚏或咳嗽,呼吸急促,严重者可闻及明显的喘息声,呼吸幅度加大且不齐,活动明显减少;D组大鼠上述症状明显减轻。与A组比较,B、C、D组大鼠在OVA致敏、激发阶段体质量增长较为缓慢,差异有统计学意义(表1,P<0.05),D组尤为明显甚至停止增长(表1,P<0.05)。
气道反应性检测 用乙酰甲胆碱进行激发时,A组大鼠无明显反应,C组的特殊气道阻力sRaw变化值随着乙酰甲胆碱浓度的增加呈上升趋势。在乙酰甲胆碱浓度为25mg/mL时,C组的sRaw变化值与A组比较,差异有统计学意义(图2,P<0.05)。D组大鼠的sRaw变化值较C组有一定程度降低,但差异无统计学意义(图2,P >0.05),表明D组气道高反应性接近于正常。
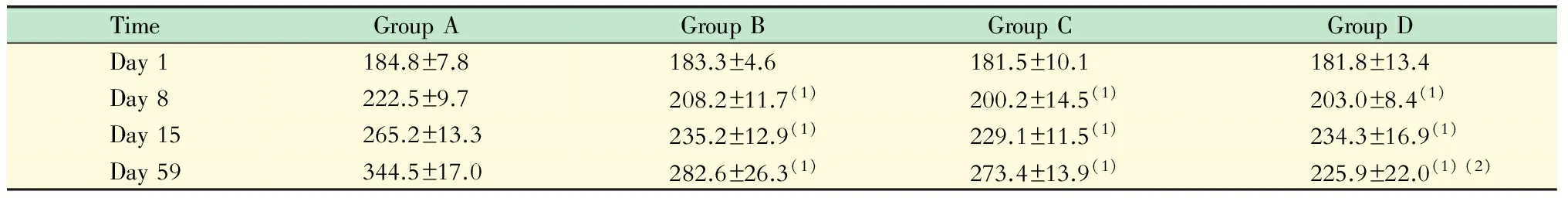
表 1 各组大鼠体质量的改变
All values are displayed as means ± SEM.(1)vs.A group,P<0.05,(2)vs.B and C group,P<0.05.
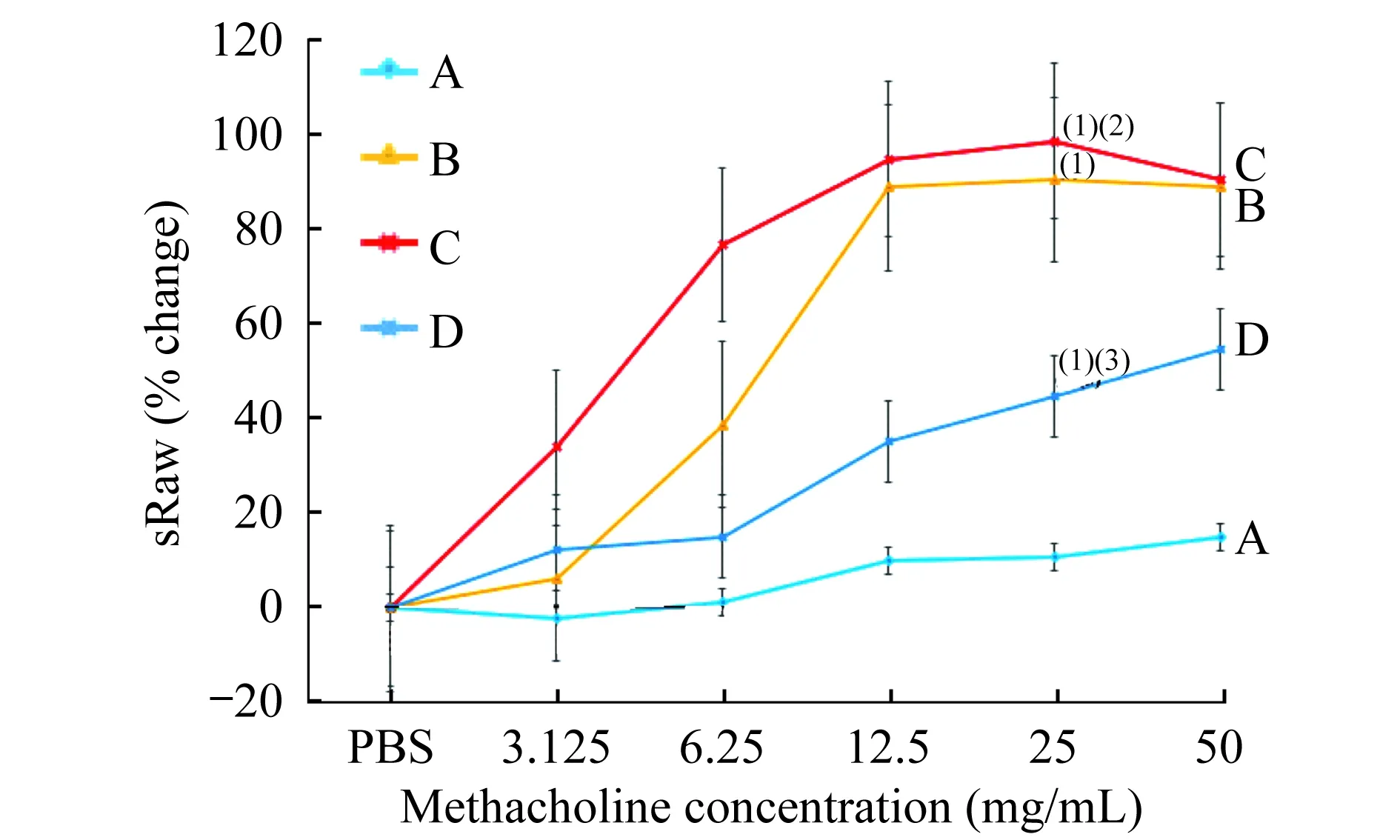
(1)vs.A group,P=0.050,0.031,0.129 (t=2.429,2.795,1.757);(2)vs.B group,P=0.875(t=0.165);(3)vs. C group,P=0.192(t=1.470).
图2 各组大鼠气道反应性的变化
Fig 2 Changes in airway responsiveness of the rats in different groups
血清中的IgE水平和BALF中的Eos% B、C组大鼠血清中的IgE表达水平和BALF中的Eos%均明显高于A组,差异有统计学意义(图3,P<0.05);C组血清中的IgE表达水平和BALF中的Eos%较B组均有上升趋势,但差异无统计学意义。与C组比较,D组大鼠BALF中的Eos%显著降低,差异有统计学意义(图3B,P<0.05),且D组大鼠BALF中的Eos%接近于A组,差异无统计学意义,说明D组大鼠气道中嗜酸性粒细胞聚集情况趋向于正常。与C组比较,D组大鼠血清中的IgE表达水平也有一定程度减少,但差异无统计学意义(图3A,P>0.05)。
肺组织中IL-33的表达 B、C组BALF中IL-33的表达明显高于A组,差异有统计学意义(图4A,P<0.05);与B组比较,C组BALF中的IL-33水平有上升趋势,但两组间差异无统计学意义;D组与C组比较,BALF中的IL-33的表达明显降低,差异有统计学意义(图4A,P<0.05);D组与A组比较,BALF中IL-33水平差异无统计学意义,说明D组BALF中的IL-33水平接近于正常。B、C组肺组织中的IL-33 mRNA表达水平明显高于A组,差异有统计学意义(图4B,P<0.05); C组肺组织中的IL-33 mRNA水平较B组有升高趋势,但两组间差异无统计学意义;与C组比较,D组肺组织的IL-33 mRNA表达水平显著降低,差异有统计学意义(图4B,P<0.05);D组与A组比较,肺组织中IL-33m RNA水平差异无统计学意义,说明D组肺组织中的IL-33 mRNA水平接近于正常。
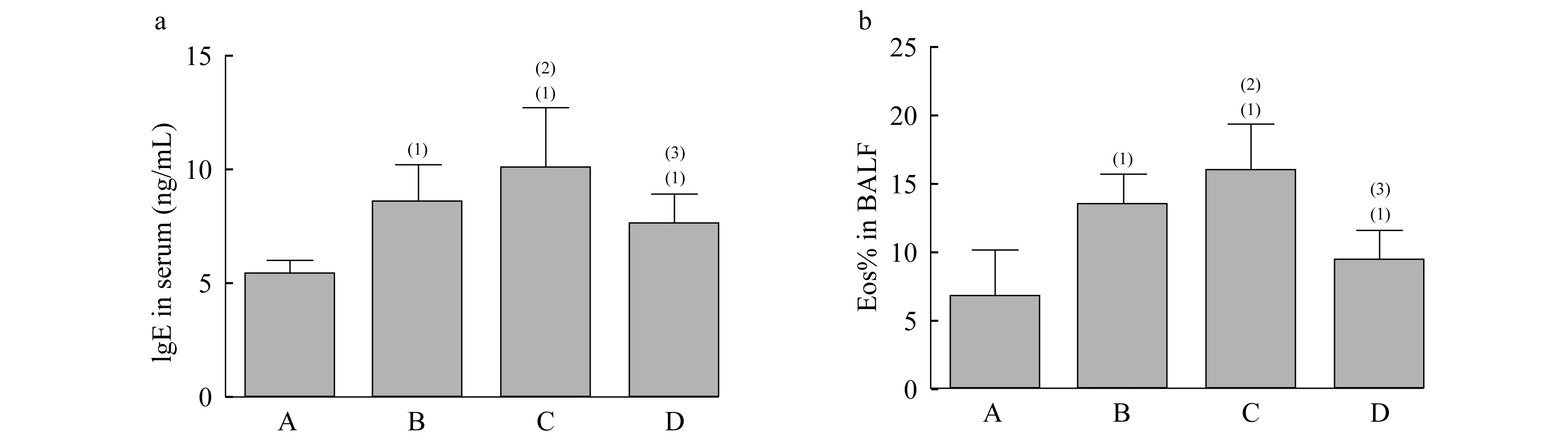
A:The levels of IgE in serum;(1)vs.A group,P=0.009,0.012,0.022 (t=3.763,3.563,3.064);(2)vs.B group,P=0.367 (t=0.976);(3)vs.C group,P=0.134 (t=1.730).b:The percentage of eosinophil cells in BALF.(1)vs.A group,P=0.021,0.015,0.232 (t=3.325,3.635,1.360);(2)vs.B group,P=0.250 (t=1.273);(3)vs.C group,P=0.016 (t=3.315).
图3 各组大鼠血清中的IgE水平和BALF中的Eos%的比较
Fig 3 The levels of IgE in serum and eosinophil percentage in BALF of the rats in different groups
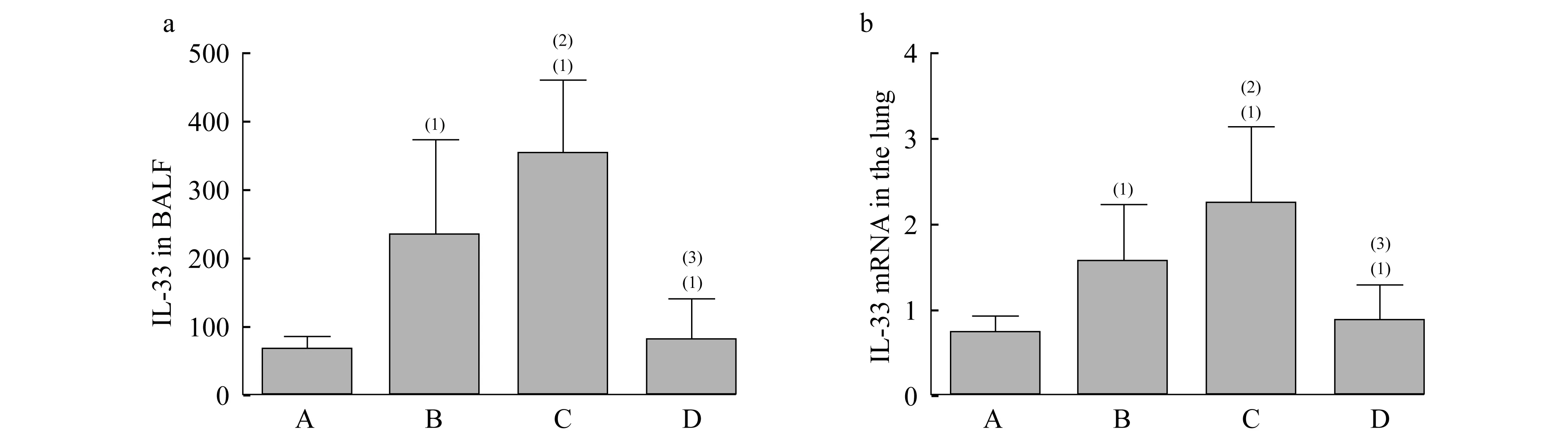
A:The levels of IL-33 in BALF(ELISA);(1)vs.A group,P=0.025,0.000,0.523 (t=2.750,5.968,0.664);(2)vs.B group,P=0.170(t=1.506);(3)vs.C group,P=0.000 (t=5.346).b:The levels of IL-33 mRNA in the lung(q-RT PCR).(1)vs.A group,P=0.043,0.015,0.574 (t=2.461,3.222,0.590);(2)vs.B group,P=0.222 (t=1.324);(3)vs.C group,P=0.015 (t=3.070).
图4 各组大鼠肺组织中IL-33表达水平的比较
Fig 4 The expression levels of IL-33 in the lung of the rats in different groups
相关性分析 Pearson相关分析结果显示,BALF中的IL-33水平与BALF中的Eos%、血清中的IgE水平均呈明显正相关(r=0.853 6,P<0.000 1;r=0.648 9,P=0.006 5),提示IL-33水平的变化可能与支气管哮喘的严重程度具有一定的关联性。
烟曲霉菌定植的情况 PDA培养结果显示,A、B组大鼠肺组织匀浆未见烟曲霉菌菌落形成,C组大鼠肺组织匀浆半数有菌落生成(3/6,定植率为50%),而D组大鼠肺组织匀浆均有烟曲霉菌菌落生成(6/6,定植率为100%)。各组大鼠血培养均未见烟曲霉菌菌落生成。
讨 论
近年来,随着免疫抑制剂、广谱抗生素、激素的广泛应用以及骨髓移植、器官移植的普遍开展,条件致病菌感染的患病率和死亡率逐渐增高。烟曲霉菌是一种广泛存在于环境中的重要的条件致病菌,其微小的孢子结构使之被吸入后易于到达宿主肺泡,通过菌丝生长而定植于气道内或引发侵袭性感染。流行病学研究显示,烟曲霉菌致敏是哮喘加重的危险因素[3],在0.7%~3.5%的哮喘患者中,烟曲霉菌在气道内的定植与生长导致了一种以气道高反应性为表现的疾病的发生,即ABPA[4]。烟曲霉菌能激发宿主CD4+Th2细胞反应及分泌Th2型细胞因子,介导适应性免疫,刺激IgE、IgG抗体的产生[10],烟曲霉菌特异性IgE致敏还与哮喘患者肺功能恶化密切相关[11]。
随着ILC2s的发现,固有免疫在哮喘病程中的作用越来越受到关注[12],尤其是对于固有细胞因子IL-33的重视[13]。IL-33是最新发现的IL-1家族成员,在重症哮喘患者的气道上皮和平滑肌上均有表达[14-15]。一项关于哮喘的全基因组相关性分析也证实了IL-33基因与哮喘相关联[16]。作为前炎症因子,IL-33与其配体ST2结合后,刺激ILC2s分泌大量的Th2型细胞因子IL-5和IL-13,参与组织损伤、炎症和过敏性反应[6,17-19],这也与我们过去研究中发现的烟曲霉菌暴露的哮喘大鼠肺组织IL-5、IL-13高表达相吻合[8]。在慢性哮喘小鼠模型的研究中发现,将ILC2或IL-33基因敲除后,气道炎症、气道高反应性、血清IgE水平和气道重塑均有改善,而单独将T细胞敲除,气道高反应性却不能缓解[19-20]。在慢性哮喘持续发作过程中,气道上皮来源的IL-33刺激ILC2s分泌的IL-13反过来又促进IL-33和ST2的高表达,这种反馈性调节可能在慢性哮喘持续性气道高反应性中起重要作用[20]。
本研究发现,哮喘大鼠经烟曲霉菌暴露后,其气道高反应性、BALF中Eos%和血清中IgE水平较单纯哮喘组均有上升的趋势,肺组织内IL-33的表达也较单纯哮喘组有所增高,但是两组间差异无统计学意义,分析其原因可能与大鼠的免疫状态、烟曲霉菌暴露的时间和浓度有关。栗芳等[21]在建立侵袭性肺曲霉菌病小鼠模型的研究中发现,免疫抑制感染组(环磷酰胺免疫抑制+烟曲霉菌接种)较正常状态感染组(无免疫抑制+烟曲霉菌接种)肺间质充血、肺泡内炎性细胞浸润、支气管壁破坏等情况更为严重,且正常感染组肺组织未发现菌丝,说明正常免疫状态具有清除真菌孢子的作用。刘婷婷等[22]在利用烟曲霉菌提取物诱导小鼠哮喘模型的研究中发现,给予3周烟曲霉菌暴露后,BALF中总炎症细胞数和Th2细胞因子、血清IgE水平、气道黏液分泌显著增多。本研究以侵袭性肺曲霉菌病成模平均时间3天作为参考给予烟曲霉菌暴露,缺陷在于未将不同时间梯度和浓度梯度的烟曲霉菌暴露对哮喘各项指标的变化进行分析。
相关性分析显示,肺组织内IL-33水平与BALF中Eos%、血清中IgE水平均呈正相关,提示IL-33水平在一定程度上反应哮喘的严重程度。糖皮质激素因其良好的抗炎效果,仍被认为是哮喘治疗的金标准。本研究中地塞米松预处理能有效地降低烟曲霉菌暴露组大鼠的嗜酸性粒细胞和血清IgE水平,对肺组织内IL-33的表达也有明显的抑制作用,但对气道高反应性的缓解不明显。另一方面,糖皮质激素的使用也增加了烟曲霉菌气道定植的风险,地塞米松预处理组大鼠肺组织烟曲霉菌培养均为阳性,定植率达100%,而单纯哮喘组大鼠气道烟曲霉菌定植率为50%。其原因可能为:糖皮质激素对免疫过程的多个环节有抑制作用,包括对巨噬细胞吞噬、处理抗原作用的抑制和细胞免疫的抑制;糖皮质激素还能增强烟曲霉孢子的侵袭力,并且与作用的时间与浓度呈正相关[23]。近期研究还发现,糖皮质激素治疗只是抑制Th2细胞的作用,并不能抑制ILC2s介导的炎性反应[24],因此,ILC2s介导的固有免疫可能与糖皮质激素抵抗型哮喘相关。
总之,IL-33和ILC2s的发现扩展了我们对哮喘的认识,肺组织和BALF中IL-33水平的升高有可能成为衡量哮喘严重程度的新指标。尽管糖皮质激素在一定程度上可抑制IL-33的表达,但也增加了真菌气道定植的风险。对于哮喘固有免疫的研究还处在初级阶段,具体的致病机制、信号通路有待进一步研究和探讨。IL-33作为新的治疗靶点在重症哮喘及难治性哮喘,尤其是糖皮质激素抵抗型哮喘中可能具有广阔的应用前景。
[1] ZUBAIRI AB,AZAM I,AWAN S,etal.Association of airborneAspergilluswith asthma exacerbation in Southern Pakistan [J].AsiaPacAllergy,2014,4(2):91-98.
[2] SHEVCHENKO MA,BOLKHOVITINA EL,SERVULI EA,etal.Elimination ofAspergillusfumigatusconidia from the airways of mice with allergic airway inflammation [J].RespRes,2013,14(1):1-13.
[3] DENNING DW,O′DRISCOLL BR,HOGABOAM CM,etal.The link between fungi and severe asthma:a summary of the evidence [J].EurRespirJ,2006,27(3):615-626.
[4] KNUTSEN AP,BUSH RK,DEMAIN JG,etal.Fungi and allergic lower respiratory tract diseases [J].JAllergyClinImmunol,2012,129(2):280-291.
[5] DOHERTY TA.At the bench:understanding group 2 innate lymphoid cells in disease [J].JLeukocBiol,2015,97(3):455-467.
[6] KLEIN WOLTERINK RG,KLEINJAN A,VAN NIMWEGEN M,etal.Pulmonary innate lymphoid cells are major producers of IL-5 and IL-13 in murine models of allergic asthma [J].EurJImmunol,2012,42(5):1106-1116.
[7] HALIM TY,STEER CA,MATHA L,etal.Group 2 innate lymphoid cells are critical for the initiation of adaptive T helper 2 cell-mediated allergic lung inflammation [J].Immunity,2014,40(3):425-435.
[8] GAO FS,QIAO JO,ZHANG Y,etal.Chronic intranasal administration ofAspergillusfumigatusspores leads to aggravation of airway inflammation and remodelling in asthmatic rats [J].Respirology,2009,14(3):360-370.
[9] PENNOCK BE,COX CP,ROGERS RM,etal.A noninvasive technique for measurement of changes in specific airway resistance [J].JApplPhysiolRespirEnvironExercPhysiol,1979,46(2):399-406.
[10] TILLIE-LEBLOND I,TONNEL AB.Allergic bronchopulmonary aspergillosis [J].Allergy,2005,60(8):1004-1013.
[11] FAIRS A,AGBETILE J,HARGADON B,etal.IgE sensitization toAspergillusfumigatusis associated with reduced lung function in asthma [J].AmJRespirCritCareMed,2010,182(11):1362-1368.
[12] HOLGATE ST.Innate and adaptive immune responses in asthma [J].NatMed,2012,18(5):673-683.
[13] LLOYD CM.IL-33 family members and asthma-bridging innate and adaptive immune responses [J].CurrOpinImmunol,2010,22(6):800-806.
[14] PREFONTAINE D,LAJOIE-KADOCH S,FOLEY S,etal.Increased expression of IL-33 in severe asthma:evidence of expression by airway smooth muscle cells [J].JImmunol,2009,183(8):5094-5103.
[15] PREFONTAINE D,NADIGEL J,CHOUIALI F,etal.Increased IL-33 expression by epithelial cells in bronchial asthma [J].JAllergyClinImmunol,2010,125(3):752-754.
[16] MOFFATT MF,GUT IG,DEMENAIS F,etal.A large-scale,consortium-based genomewide association study of asthma [J].NewEnglJMed,2010,363(13):1211-1221.
[17] MARTINEZ-GONZALEZ I,STEER CA,TAKEI F.Lung ILC2s link innate and adaptive responses in allergic inflammation [J].TrendsImmunol,2015,36(3):189-195.
[18] MOLOFSKY AB,SAVAGE AK,LOCKSLEY RM.Interleukin-33 in tissue homeostasis,injury,and inflammation [J].Immunity,2015,42(6):1005-1019.
[19] IIJIMA K,KOBAYASHI T,HARA K,etal.IL-33 and thymic stromal lymphopoietin mediate immune pathology in response to chronic airborne allergen exposure [J].JImmunol,2014,193(4):1549-1559.
[20] CHRISTIANSON CA,GOPLEN NP,ZAFAR I,etal.Persistence of asthma requires multiple feedback circuits involving type 2 innate lymphoid cells and IL-33 [J].JAllergyClinImmunol,2015,136(1):59-68.
[21] 栗方,曹彬,刘颖梅,等.侵袭性肺曲霉菌病小鼠动物模型建立的实验研究[J].中华临床医师杂志(电子版),2015,9(8):107-110.
[22] 刘婷婷,戴璐,王绿娅,等.烟曲霉提取物诱导小鼠哮喘模型的建立 [J].心肺血管病杂志,2015,34(2):137-140.
[23] 李陶,李静超,亓倩,等.地塞米松增强烟曲霉孢子侵袭力的研究 [J].中华医院感染学杂志,2014,24(8):1824-1826.
[24] KABATA H,MORO K,FUKUNAGA K,etal.Thymic stromal lymphopoietin induces corticosteroid resistance in natural helper cells during airway inflammation [J].NatCommun,2013,4(4):2675.
Dexamethasone inhibits IL-33 expression in the lung in a rat model ofAspergillusfumigatus-exposed bronchial asthma
ZHOU Xia, JIN Xian-qiao△
(DepartmentofRespiratoryMedicine,HuashanHospital,FudanUniversity,Shanghai200040,China)
Objective To investigate the levels of IL-33 in the lung induced byAspergillusfumigatus(A.fumigatus) exposure in bronchial asthmatic rats and the effects of dexamethasone. Methods Twenty-four Wistar rats were randomly and equally divided into group A (normal control),group B (asthma group),group C (A.fumigatus-exposed group),and group D (dexamethasone-treated group).B,C and D group were sensitized and challenged with ovalbumin (OVA) to establish asthmatic models.Then,group C and D were givenA.fumigatusspores intranasally.Group D was pre-treated with dexamethasone during ovalbumin challenge.Group A was sensitized and challenged intranasally with normal saline as control.Airway hyperresponsiveness,eosinophils percentage and serum IgE levels
were measured to confirm the establishment of asthmatic model.Expression of IL-33 in the lung were quantified by ELISA and qRT-PCR.Lung tissues and blood were plated on the potato dextrose agar (PDA)medium and cultivated for 24 h to measure the number of colony. Results Eosinophils percentage in bronchoalveolar lavage fluid (BALF),IgE levels in serum and IL-33 levels in the lung in group B and C were much more higher than in group A (P<0.05),and the increasing range in group C was more obvious than group B.However,the changes of sRaw values in these groups had no statistical significance.Esosinophils percentage in BALF and IL-33 levels in the lung were significantly decreased (P<0.05),and IgE levels in serum was slightly decreased (P>0.05) in group D when compared with group C,but the ratio ofA.fumigatuscolonization in the lung was higher than group C.Conclusions Dexamethasone can inhibit the expression of IL-33 in the lung induced byA.fumigatusexposure in an asthmatic rat,but it also increases the risk of fungal colonization in the airway.Anti-IL-33 antibody treatment needs further research.
Aspergillusfumigatus; bronchial asthma; interleukin 33; dexamethasone;Wistar rat
R562.25
A
10.3969/j.issn.1672-8467.2017.03.012
2016-09-27;编辑:张秀峰)
上海市科委基础研究领域重点项目(12JC1407501)
△Corresponding author E-mail:jinxianqiao@126.com
*This work was supported by the key Basic Research Project from Science and Technology Commission of Shanghai Municipality (12JC1407501).
