MMP-2和TIMP-2在激光诱导形觉剥夺的高度近视豚鼠脉络膜新生血管中的表达变化
2017-06-27丁雯芝马晓昀
刘 林 丁雯芝 张 昀 马晓昀 邹 俊△
(1上海市第十人民医院眼科 上海 200072; 2上海市光华中西医结合医院眼科 上海 200052)
MMP-2和TIMP-2在激光诱导形觉剥夺的高度近视豚鼠脉络膜新生血管中的表达变化
刘 林1丁雯芝1张 昀2马晓昀2邹 俊1△
(1上海市第十人民医院眼科 上海 200072;2上海市光华中西医结合医院眼科 上海 200052)
目的 构建高度近视豚鼠脉络膜血管新生(choroidal neovascularization,CNV)模型,探讨基质金属蛋白酶(matrix metalloproteinase-2,MMP-2)和基质金属蛋白酶抑制剂(tissue inhibitor-2 of metalloproteinase,TIMP-2)在高度近视CNV形成中的作用。方法 72只2周龄三色豚鼠随机分为实验组(n=36)和对照组(n=36),实验组右眼行6周形觉剥夺诱导高度近视。两组各选取30只豚鼠右眼行532 nm激光光凝视网膜诱导CNV。于激光前和光凝后7、14、21、28、35天进行免疫组化观察光凝区域MMP-2和TIMP-2的表达,real-time PCR检测视网膜色素上皮层(retinal pigment epithelium,RPE)-脉络膜-巩膜复合物中的MMP-2和TIMP-2 mRNA表达对MMP-2和TIMP-2免疫组化阳性表达的积分光密度值(integral optical desnsity,IDO)及mRNA相对表达水平进行统计学分析。结果 激光光凝后实验组和对照组MMP-2和TIMP-2表达均明显上调,MMP-2于光凝后21天、TIMP-2于光凝后28天时表达高峰。激光前及光凝后各观察时间点,实验组MMP-2阳性表达和mRNA相对表达量均明显高于对照组,差异有统计学意义(P<0.05);而激光前实验组TIMP-2表达较对照组明显减少(P<0.05),光凝后各时间点两组TIMP-2表达差异无统计学意义。结论 MMP-2和TIMP-2与高度近视CNV形成密切相关,MMP-2与TIMP-2表达平衡紊乱可能参与高度近视CNV的发生发展。
高度近视; 脉络膜新生血管; 豚鼠; 激光; MMP-2; TIMP-2
病理性近视(pathologic myopia,PM)又称进行性高度近视,以眼轴过度延长伴巩膜、脉络膜、Bruch膜、视网膜色素上皮层(pigment epithelium layer retina,RPE)和神经视网膜特征性的退行性改变为主要特征。脉络膜新生血管(choroidal neovascularization,CNV)是PM引起中心视力严重损害的常见原因[1],CNV病理过程极其复杂,包括多种细胞因子、蛋白水解酶、变性改变、Bruch膜-RPE-脉络膜内皮细胞损伤等参与。 Bruch膜的损伤及细胞外基质(extracellular matrix,ECM)的降解在CNV形成过程中至关重要[2]。ECM的降解平衡主要由基质金属蛋白酶(matrix metalloproteinase,MMP)和基质金属蛋白酶抑制剂(tissue inhibitor of metalloproteinase,TIMP)调控。MMP是一种蛋白水解酶,能降解ECM、Bruch膜和毛细血管基底膜,导致血管内皮细胞的增殖迁移。TIMP是内源性抑制因子,可高度特异性地抑制MMP,MMP活性增强或TIMP活性减低常导致ECM降解,促进新生血管形成。其中MMP-2和TIMP-2的平衡紊乱在CNV发生中发挥重要作用[3]。研究表明后极部巩膜MMP-2/TIMP-2之间动态失衡也参与豚鼠形觉剥夺性近视的形成[4-5],巩膜MMP-2活性表达增高而TIMP-2表达减少可促使巩膜ECM主动重塑形成近视,但相关研究尚不多见。
本研究以前期建立的高度近视豚鼠CNV模型为基础,应用免疫组化及RT-PCR技术观察高度近视豚鼠CNV中MMP-2、TIMP-2 mRNA及蛋白在质表达,初步探讨其在高度近视CNV形成中的作用。
材 料 和 方 法
实验动物 清洁级英国短毛种三色豚鼠,雌性,2周龄,体质量100~150 g,由上海市松江区松联实验动物场提供,于上海市第十人民医院动物实验中心饲养。动物生产许可证:SCXK (沪)2012-0011,使用许可证:SYXK(沪)2011-0128。实验前检查确认所有豚鼠身体健康,眼部无特殊疾患,双眼屈光均为远视且无明显屈光参差(双眼屈光度差值小于2.50 D)。饲养环境安静,室温恒定20~22 ℃,室内自然光12 h/12 h交替照明,自由进食饮水并每日2次给予新鲜绿色蔬菜补充维生素C。实验动物按3R原则给予人道主义关怀。实验操作均由上海市第十人民医院伦理委员会审核通过。
激光诱导高度近视豚鼠脉络膜新生血管模型的建立 72只2周龄三色豚鼠随机分为实验组(n=36)与对照组(n=36),实验组右眼进行6周形觉剥夺诱导为高度近视组(FDM组)。实验组采用自制半透明眼罩(材料为乳白色医用乳胶手套)用强力胶粘于眼周毛发以完全遮盖,每日检查3次遮盖情况,发现脱落立即重新粘贴,并确保形觉剥夺眼遮盖完全且未对眼球造成压迫,采用检影镜进行屈光度测量,屈光度均达到-6.00 D以上的高度近视,左眼不予干预;对照组两眼均不予以眼罩干预。
实验组与对照组均选取30只豚鼠右眼采用532 nm激光光凝视网膜诱导CNV。应用4%戊巴比妥以1.5 mL/100 g腹腔注射浅麻醉豚鼠,用0.5%复方托吡卡胺滴眼液充分散瞳后,于90D前置镜下采用532 nm 激光,距离视盘1~1.5 PD围绕视盘行视网膜光凝6~8个点。光斑直径50μm,曝光时间0.05 s,激光功率为1 500 mW。以光凝处产生气泡伴或不伴少量出血为击破Bruch膜标志,作为有效点。光凝后实验组右眼继续遮盖形觉剥夺,以免形觉剥夺性近视发生逆转。
免疫组化 两组于激光前、光凝后7、14、21、28和35天这6个时间点分别随机选取3只豚鼠进行免疫组化,观察光凝区域MMP-2和TIMP-2的表达,所有豚鼠仅选择右眼进行以下实验及分析。
麻醉处死豚鼠后完整摘除眼球,置眼球固定液(甲醛-戊二醛混合液,由复旦大学附属眼耳鼻喉科医院病理科提供)内48 h,经常规梯度酒精脱水、二甲苯透明、石蜡包埋,于角膜至视盘的矢状位行3μm连续切片。免疫组化采用ABC法[7]。一抗为兔抗MMP-2多克隆抗体及兔抗TIMP-2多克隆抗体(上海生工),二抗为羊抗兔IgG抗体。应用IPP 6.0图像分析软件测量激光斑处积分光密度值(integral optical density,IOD),每组各时间点分别选取10张切片进行测量取平均值。
real-time PCR 两组于激光前、光凝后7、14、21、28和35天这6个时间点随机抽取3只豚鼠进行PCR实验。所有豚鼠仅右眼进行实验分析。过量麻醉处死豚鼠后,显微操作下获得RPE-脉络膜-巩膜复合物;显微镜下用眼科剪沿角巩膜缘剪开球壁,沿锯齿缘分离视网膜后去除,获得RPE-脉络膜-巩膜复合物,剪取部分复合物(以视盘为中心、半径为5 mm,所有激光斑均在此范围内),加入预冷的500μL Trizol裂解液,充分研磨,按照RNA提取试剂盒步骤提取总RNA(北京康为世纪生物科技有限公司)。紫外分光光度法测定总RNA浓度及纯度。按照第一链cDNA合成试剂盒步骤逆转录cDNA(北京康为世纪生物科技有限公司)。PCR反应使用ABI7500荧光定量PCR仪(美国Life Technology公司),反应条件为95 ℃变性5 min,40个循环(95 ℃下10 s,60 ℃下30 s,72 ℃下30 s)。引物序列参见表1,设3个副孔,取平均值。

表1 real-time PCR引物序列
结 果
免疫组化结果
MMP-2 激光前对照组视网膜神经节细胞层、感光细胞层、RPE层及脉络膜血管层基质中都有MMP-2表达,其表达程度较低;而高度近视组中各层MMP-2表达明显升高(图1)。光凝后7~14天,两组光凝区域视网膜、增殖迁移的RPE样细胞、成纤维细胞及CNV的基质中均有MMP-2阳性表达,于21天时达高峰,呈强阳性染色,之后逐渐下降;光凝后各时间点高度近视组CNV中MMP-2阳性表达均较对照组更加显著(P均<0.05,表2)。
TIMP-2 激光前对照组视网膜神经节细胞层、感光细胞层、RPE层及脉络膜层基质中均有少量TIMP-2表达;而高度近视组巩膜中TIMP-2表达明显减少(图1)。光凝后7~21天两组光凝区域CNV的基质、成纤维细胞及增殖迁移的RPE细胞中TIMP-2呈阳性表达,28天时阳性表达最强;光凝后各时间点高度近视组CNV中TIMP-2阳性表达与对照组相比差异无统计学意义(P均>0.05,表2)。

Cell nucleus or matrix brown staining is regard as positive.Bar=100 μm.
图1 光凝前后各时间点MMP-2和TIMP-2的免疫组化结果
Fig 1 Immunohistochemistry of MMP-2 and TIMP-2 at different time points before and after laser photocoagulation
Real-time PCR结果
MMP-2 光凝后7~28天高度近视组与对照组MMP-2 mRNA表达均较激光前明显上调(P均<0.05),且两组MMP-2 mRNA相对表达量均于21天时达到高峰,之后逐渐下降,对照组于35天时恢复至激光前水平,而高度近视组MMP-2 mRNA表达仍明显上调(P<0.05)。两组各时间点比较发现,激光前及激光后各时间点高度近视组MMP-2 mRNA相对表达量均明显高于对照组(P均<0.05,图2A)。
TIMP-2 高度近视组与对照组于光凝后7天时TIMP-2 mRNA表达较激光前未见明显升高(P>0.05),14天时才开始明显上调(P<0.05),两组TIMP-2 mRNA相对表达量均于28天时达到高峰,35天时仍处于表达高水平(P<0.05)。各时间点两组比较,高度近视组激光前TIMP-2 mRNA相对表达量明显高于对照组(P<0.05),而光凝后各时间点两组比较,差异均无统学意义(图2B)。
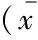
表2 各时间点光凝损伤区MMP-2及TIMP-2阳性表达的IOD
Control group and FDM group,n=3.
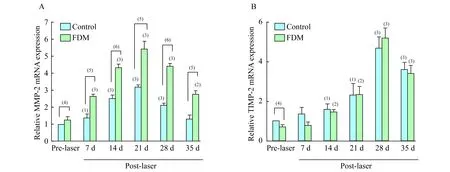
A:MMP-2;B:TIMP-2.Post-laservs. pre-laser photocoagulation,(1)P<0.05,(2)P<0.01,(3)P<0.001;Controlvs.FDM:(4)P<0.05,(5)P<0.01,(6)P<0.001.Control group and FDM group,n=3.
图2 光凝前后各时间点MMP-2及TIMP-2 mRNA相对表达量
Fig 2 Relative mRNA expressions of MMP-2 and TIMP-2 at different time points before and after laser photocoagulation
讨 论
新生血管生成是一个基底膜降解、内皮细胞增殖迁移和毛细血管形成的多重步骤进程。VEGF在内皮细胞的增殖迁移中起重要作用,但迁移的微血管内皮细胞必须穿过毛细血管的基底膜及周围的ECM才能增殖和形成管腔。因此,内皮细胞基底膜及ECM的降解是血管形成的关键。在近视发展过程中,巩膜ECM也历经主动重塑过程[4-6]。可见ECM的重塑与新生血管生成和近视的发生都密切相关,而ECM动态平衡主要由MMP和TIMP表达平衡维系,因而我们推测MMP和TIMP的平衡紊乱可能参与高度近视CNV的形成。本研究以高度近视豚鼠CNV作为病理性高度近视的研究模型,初步探讨MMP-2和TIMP-2在高度近视CNV中的作用。
文献研究[4-5,7]显示巩膜成纤维细胞及ECM中都有MMP-2及TIMP-2表达。刘桂香等[4]在豚鼠形觉剥夺性近视模型的研究中发现近视眼巩膜MMP-2表达明显上调,而TIMP-2表达减少,提示MMP-2/TIMP-2平衡破坏可能是启动豚鼠形觉剥夺近视巩膜ECM主动重塑的重要因素。本研究中也发现类似结果,激光前后各时间点高度近视眼巩膜MMP-2的阳性表达均较对照眼更加显著,TIMP-2表达则明显降低。同时各时间点高度近视组内两两比较发现,巩膜中MMP-2和TIMP-2表达不再发生明显改变,可能是随着形觉剥夺时间延长其表达变化逐渐趋于稳定的结果,因而mRNA结果组内比较时可忽略巩膜的影响。
研究表明Bruch膜及其周围基质的变化、以及MMP的活化是CNV发生的早期重要步骤[8]。MMP-2作为MMP家族的重要成员,可降解大部分新生血管基底膜和周围ECM的成分如Ⅰ型、Ⅳ型胶原和纤连蛋白,在CNV形成中发挥重要作用[4]。TIMP-2作为一种蛋白水解酶抑制剂,主要抑制MMP-2的合成和活性,两者之间的动态平衡对于内皮细胞形态和管腔形成具有关键作用[3],研究显示在老年黄斑变性患者中CNV膜和激光诱导的大鼠CNV中均存在MMP-2 mRNA及蛋白高表达[8-11]。Lambert等[11]在野生型小鼠中应用腺病毒转染过表达的MMPs内源性抑制剂TIMP-2,发现激光诱导的CNV生长受到显著抑制;在体外,病毒转染过表达TIMP-2的脉络膜内皮细胞移行和管腔形成也明显减少。MMP-2表达水平升高,而TIMP-2表达水平下降或不能与MMP-2对应升高,即两者平衡失调,可导致MMP-2水解作用增加,破坏ECM的正常结构和生理功能,从而促进新生血管生长。
本研究结果显示,激光后高度近视组MMP-2 mRNA及蛋白表达均明显上调,21天时达到高峰,之后该酶表达仍高于激光前,但呈下降趋势。激光后TIMP-2 mRNA及蛋白表达也明显增加,但与MMP-2并不同步,TIMP-2早期(7天时)变化不明显,14天时才开始升高,表明早期MMP-2的活性受TIMP-2干预较少,因而能持续地降解基底膜促进内皮细胞增殖迁移。且MMP-2表达高峰(21天)早于TIMP-2高峰期(28天),提示CNV形成过程中,先有MMP-2的活化表达,随着MMP-2的积累,TIMP-2浓度逐渐增加以限制MMP-2的活化。综上可见,MMP-2与TIMP-2的表达动态平衡紊乱,蛋白酶水解作用增加,从而促进高度近视CNV的发生发展。在血管生成初期MMP-2选择性的降解Bruch膜和ECM,为血管内皮细胞增殖迁移提供了空间,促进新生血管生长进入视网膜下,CNV膜形成后又能降解毛细血管的基底膜,保证内皮细胞继续增殖延伸。除了MMP-2/TIMP-2以外,其他MMP也参与CNV形成,例如MMP9和MMP13[12-13]。这些MMP是否参与高度近视诱导的CNV形成尚需进一步研究。
为探讨近视因素的影响,本研究对高度近视组与对照组进行比较,发现激光后各观察时间点高度近视组MMP-2 mRNA和蛋白表达均明显高于对照组,我们推测高度近视组持续的缺氧条件使MMP-2在新生血管膜及巩膜中表达增加,提示缺氧可能也是MMP-2活化和表达的诱导因素之一。然而,光凝后各时间点高度近视组TIMP-2表达与对照组均无显著差异,甚至由于巩膜的影响其mRNA表达略有降低,但差异无统计学意义,表明高度近视组持久的缺氧状态未对TIMP-2表达造成明显影响,但MMP-2的显著升高导致高度近视组MMP-2和TIMP-2失调更为严重,这可能也是高度近视组CNV的发生率及发生程度更高的原因之一。然而,本研究仅做了MMP-2与TIMP-2的免疫组化和PCR的检测,未进行MMP-2的酶谱分析及蛋白印迹相关研究,有待进一步完善,以深入探讨其作用机制。
综上所述,我们认为MMP-2和TIMP-2与高度近视豚鼠CNV的形成密切相关,MMP-2与TIMP-2可能通过表达平衡紊乱参与高度近视CNV的发生发展进程。通过进一步探索MMP-2和TIMP-2的相关信号通路,可为病理性高度近视CNV形成的分子机制及其防治的研究提供新线索。
[1] SOUBRANE G.Choroidal neovascularization in pathologic myopia:recent developments in diagnosis and treatment[J].SurvOphthalmol,2008,53(2):121-138.
[2] GROSSNIKLAUS HE,GREEN WR.Choroidal neovascularization[J].AmJOphthalmol,2004,137(3):496-503.
[3] NITA M,STRZALKA-MROZIK B,GRZYBOWSKI A,etal.Age-related macular degeneration and changes in the extracellular matrix[J].MedSciMonit,2014,18(20):1003-1016.
[4] 刘桂香,王玲,彭鑫,等.豚鼠形觉剥夺早期后极部巩膜基质金属蛋白酶-2 及其抑制剂动态表达[J].中国眼耳鼻喉科杂志,2010,10(2):75-78.
[5] 贾丁,周翔天,吕帆,等.豚鼠形觉剥夺性近视眼巩膜基质金属蛋白酶-2表达的实验研究[J].眼视光学杂志,2007,8(6):360-363.
[6] RADA JAS,SHELTON S,NORTON TT.The sclera and myopia[J].ExpEyeRes,2006,82(2):185-200.
[7] 朱洁,王雨生,惠延年.细胞外基质与脉络膜新生血管[J].中华眼底病杂志,2005,21(1):60-63.
[8] HARTNETT ME,LAPPAS A,DARLAND D,etal.Retinal pigment epithelium and endothelial cell interaction causes retinal pigment epithelial barrier dysfunction via a soluble VEGF-dependent mechanism[J].ExpEyeRes,2003,77(5):593-599.
[9] KVANTA A,SHEN WY,SARMAN S,etal.Matrix metalloproteinase (MMP) expression in experimental choroidal neovascularization[J].CurrEyeRes,2000,21(3):684-690.
[10] 李瑾,郝玉华.实验性脉络膜新生血管中环氧合酶-2,血管内皮生长因子和基质金属蛋白酶-2的表达[J].眼科研究,2010,28(9):836-840.
[11] LAMBERT V,WIELOCKX B,MUNAUT C,etal.MMP-2 and MMP-9 synergize in promoting choroidal neovascularization[J].FasebJ,2003,17(15):2290-2292.
[12] LAMBERT V,MUNAUT C,JOST M,etal.Matrix metalloproteinase-9 contributes to choroidal neovascularization[J].AmJPathol,2002,161(4):1247-1253.
[13] LECOMTE J,LOUIS K,DETRY B,etal.Bone marrow-derived mesenchymal cells and MMP13 contribute to experimental choroidal neovascularization[J].CellMolLifeSci,2011,68(4):677-686.
Expression of MMP-2 and TIMP-2 in laser-induced choroidal neovascularization in guinea pigs model with form-deprivation high myopia
LIU Lin1, DING Wen-zhi1, ZHANG Yun2, MA Xiao-yun2, ZOU Jun1△
(1DepartmentofOphthalmology,ShanghaiTenthPeople’sHospital,Shanghai200072,China;2DepartmentofOphthalmology,ShanghaiGuanghuaHospitalofIntegrativeMedicine,Shanghai200052,China)
Objective To establish the high myopic choroidal neovascularization (CNV) in guinea pigs and to investigate the role of (matrix metalloproteinase-2,MMP-2) and tissue inhibitor-2 of metalloproteinase (TIMP-2) in high myopic CNV. Methods Seventy-two 2-week-old guinea pigs were randomized into control group (n=36) and high myopia group (n=36).Right eyes were indued form deprivation high myopia for 6 weeks.Thirty guinea pigs were randomly selected in each group,and CNV were induced in the right eyes by the 532 nm laser.MMP-2 and TIMP-2 expressions were investigated by immunohistochemistry pre-laser and 7,14,21,28,35 days after laser induction,respectively,while MMP-2 and TIMP-2 relative expression levels in retinal pigment epithelium (RPE)-
choroid-sclera complex were detected by real-time PCR.Integral opitical density (IODs) of positive expression and mRNA relative expression levels of these factors were performed by statistical analyses. Results The expressions of MMP-2 and TIMP-2 were up-regulated in the two groups after laser photocoagulation through immunohistochemistry and real-time PCR examinations.Expression of MMP-2 peaked at 21 d and TIMP-2 at 28 d,respectively.IODs of positive expression and mRNA relative expression levels of MMP-2 were higher in high myopia group than those in control group at each inspective time point,and the differences were statistically significant (P<0.05).TIMP-2 expression was significantly reduced in high myopia group compared with control group before laser photocoagulation (P<0.05),while there was no significant difference between the two groups at each time point after laser photocoagulation. Conclusions MMP-2 and TIMP-2 were closely related to the formation of high-myopic CNV.Balance disorders of MMP-2 and TIMP-2 might participate in the occurrence and development of high-myopic CNV.
high myopia; choroidal neovascularization; guinea pig; laser; MMP-2; TIMP-2
R778.1+1
A
10.3969/j.issn.1672-8467.2017.03.011
2016-09-01;编辑:段佳)
上海市科委基础研究重点项目(11JC1401202)
△Corresponding author E-mail:zoujun70@126.com
*This work was supported by the Key Basic Research Project from Science and Technology Commission of Shanghai Municipality (11JC1401202).
