起泡葡萄酒的酵母菌耐受性研究
2017-06-27周鹏辉李泽福蹇木栋袁小单
周鹏辉,李 进,李泽福,蹇木栋,袁小单
(中粮长城葡萄酒(烟台)有限公司/山东省葡萄酒工程技术研究中心/山东省企业技术中心,山东蓬莱265608)
起泡葡萄酒的酵母菌耐受性研究
周鹏辉,李 进,李泽福,蹇木栋,袁小单
(中粮长城葡萄酒(烟台)有限公司/山东省葡萄酒工程技术研究中心/山东省企业技术中心,山东蓬莱265608)
为了研究起泡葡萄酒的酵母菌稳定性,进行山梨酸钾和游离二氧化硫不同浓度的梯度实验,以确定不同压力条件下酵母菌的安全耐受浓度。实验结果表明,0.20 MPa的低泡葡萄酒山梨酸钾使用浓度范围为100~150 mg/L、游离二氧化硫浓度为30~40 mg/L;0.40 MPa的高泡葡萄酒产品山梨酸钾使用浓度范围为50~100 mg/L、游离二氧化硫浓度为20~30 mg/L。
起泡葡萄酒; 酵母菌; 耐受性; 山梨酸钾; 游离二氧化硫; 压力
在干型葡萄酒的发酵过程中酵母菌能彻底将葡萄汁中的葡萄糖转化代谢,以保证产品在瓶储销售阶段的微生物稳定性,而对于保留了部分残糖的半甜型、甜型葡萄酒,因其糖分的存在适于酵母菌等微生物的生长繁殖,在生产中若工艺管理不善,极易出现浑浊或沉淀,因此微生物安全问题成为限制残糖含量较高的葡萄酒产品发展的一个技术瓶颈。根据现有研究报道,酵母菌的活性受化学因素(如高浓度葡萄糖)、物理条件(如温度)、培养条件(如营养物质)、菌龄等诸多因子的影响,而酵母菌在压力条件下对山梨酸钾和游硫二氧化硫相关的研究较少,为此,本实验通过对酵母菌在不同压力条件的起泡葡萄酒中耐受性的研究,以探索完善该技术难题。
1 材料与方法
1.1 材料
起泡葡萄酒基酒:烟台产区含有适量残糖的玫瑰香原酒,经下胶处理热稳定检测合格,基本指标为:酒精度6.0%vol;残糖55 g/L(以葡萄糖计);总酸6.0 g/L(以酒石酸计);pH3.21;浊度0.84 NTU。
酵母菌:起泡葡萄酒发酵专用酵母菌,由国内知名葡萄酒辅料商提供;山梨酸钾溶液:配制浓度为150 g/L的山梨酸钾溶液;亚硫酸稀释液:按6%亚硫酸溶液∶水=1∶3的体积比稀释,配制1.5%的亚硫酸溶液;双氧水溶液:将30%的双氧水原液稀释100倍配成0.3%的双氧水稀释液。
设备与仪器:浊度仪、恒温生化培养箱各1台;酵母培养基、香槟塞、铁丝扣、香槟杯、750 mL起泡葡萄酒专用耐压白料玻璃瓶若干;起泡葡萄酒用混气机和等压灌装机等配套生产设施1套,意大利进口。
1.2 实验方法
1.2.1 酵母菌纯化
将活性干酵母活化进行单菌落分离,涂布培养,制得纯种酵母菌。
1.2.2 菌液制备
将酵母菌溶于生理盐水中制得酵母菌原液,然后再逐级稀释制成10-1、10-2、10-3。
1.2.3 接种培养
用起泡葡萄酒混气机和等压灌装机等专业设备分别生产0.20 MPa和0.40 MPa两种压力条件下的酒样若干瓶,其中每个压力条件下在打塞前分别添加上述浓度梯度酵母菌液1 mL,山梨酸钾按照0 mg/L、50 mg/L、100 mg/L、150 mg/L、200 mg/L梯度适量添加(按照750 mL/瓶计,下同),游离二氧化硫按照0 mg/L、20 mg/L、40 mg/L、60 mg/L梯度添加,打塞后置于25℃生化培养箱中培养,定期观察酒体变化情况。
1.2.4 酵母菌计数:将接种液(或经培养的酒样)吸1 mL于培养基上培养,计算酵母总数。
1.2.5 酒体观察:用手电照经培养的酒样,记录酒体内部有浑浊或沉淀出现的时间(以天数计),同时检测浊度,其余酒样继续培养。
2 结果与分析
2.1 酒样初始指标的测定
酒样经过滤、混气、灌装等工艺处理后,两个压力下的基本指标为:0.20 MPa酒样:CO24.3 g/L,游离二氧化硫18 mg/L,酒精度6.0%vol,残糖55 g/L(以葡萄糖计),总酸6.0 g/L(以酒石酸计);0.40 MPa酒样:CO27.6 g/L,游离二氧化硫18 mg/L,酒精度6.0%vol,残糖55 g/L(以葡萄糖计),总酸6.0 g/L(以酒石酸计)。以不添加山梨酸钾和游离二氧化硫的酒样作为实验空白酒样。
2.2 酵母菌接种液的浓度
为了准确了解接种液中的酵母菌浓度情况,需要对接种液进行培养计数(平行实验),以掌握酒样接种后酒中的实际菌浓,经测定:酵母原液的菌浓为5.6×106个/mL。
2.3 酒样接种酵母菌的山梨酸钾作用实验
山梨酸是一种短链的不饱和脂肪酸,可以被人体的代谢系统吸收而迅速分解为二氧化碳和水,在体内无残留,是国家标准中允许添加的高效安全防腐剂。生产中常用其钾盐的存在形式——山梨酸钾,通过抑制微生物体内的脱氢酶系统,对霉菌、酵母菌有很强的抑制作用。
实验将山梨酸钾的添加浓度分别设为0 mg/L、50 mg/L、100 mg/L、150 mg/L、200 mg/L,目的在于考察0.20 MPa和0.40 MPa两个不同压力条件下不同山梨酸钾浓度对酵母菌生长繁殖的抑制作用。山梨酸钾实验的结果见表1、表2。
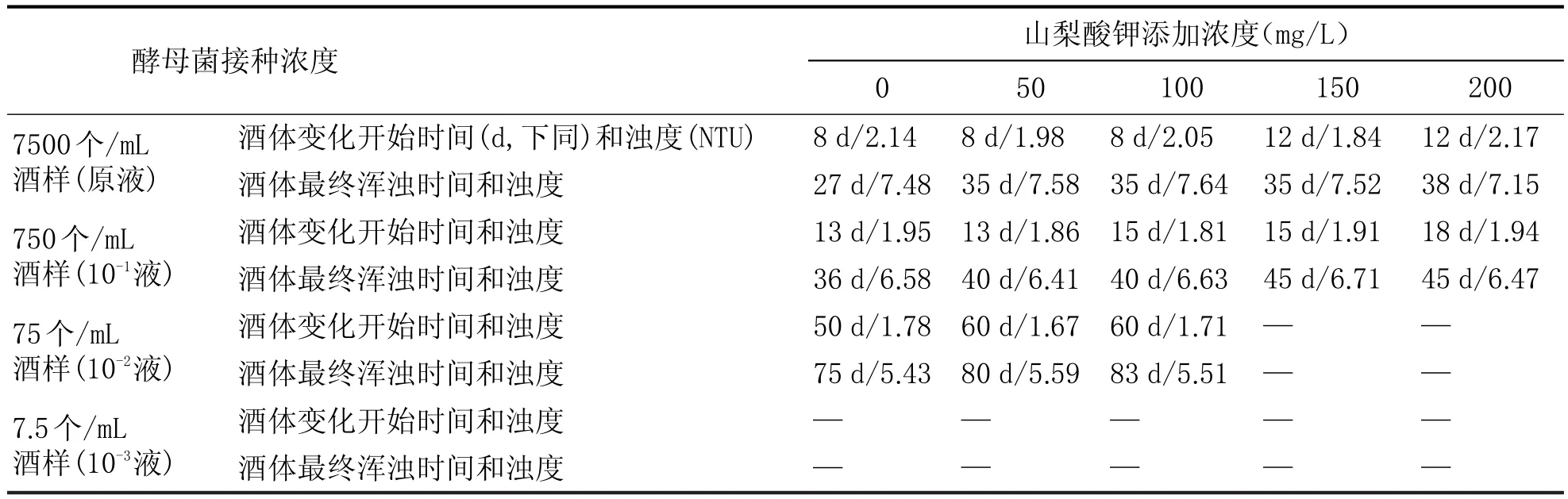
表1 0.20 MPa压力下不同山梨酸钾添加浓度的实验结果
由表1、表2可以看出:
(1)接种酵母菌液原液后,在0.20MPa和0.40MPa两个不同压力条件下,酒体都出现了严重的浑浊现象,最终的浊度都大于7.0 NTU,说明在此酵母菌浓度下即使添加200 mg/L的山梨酸钾仍不能达到抑制菌体生长和繁殖的目的。但在0.20 MPa压力下酒液开始变化的时间和最终浑浊时间都比0.40 MPa下的更早,说明压力对酵母菌的生长和繁殖具有一定的抑制作用。
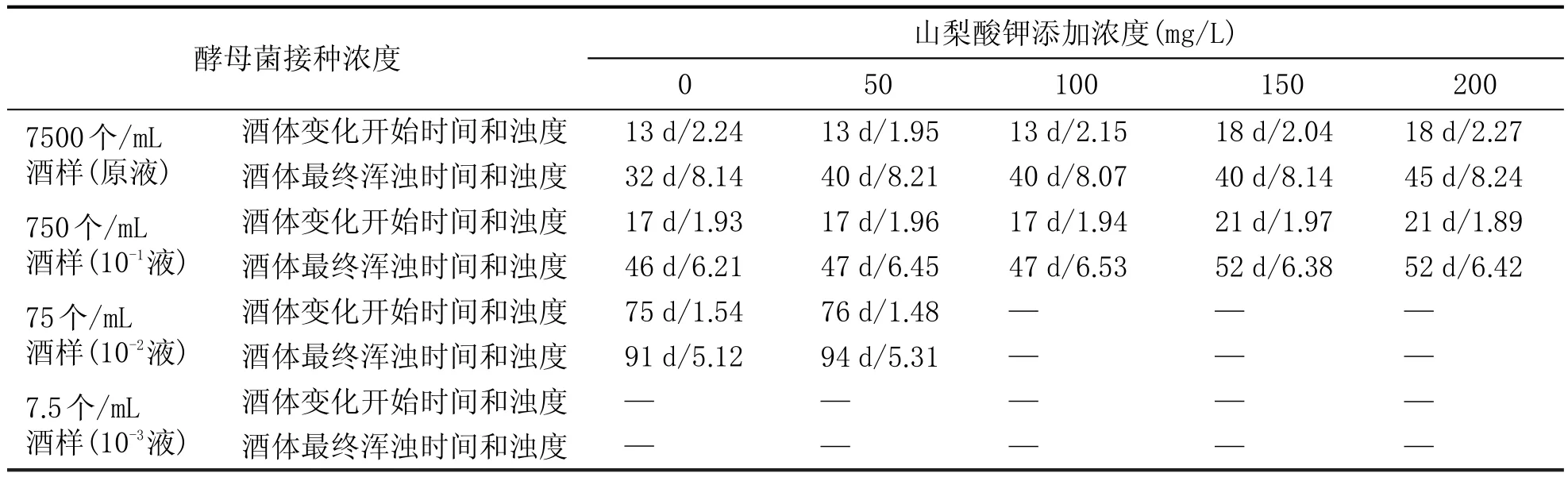
表2 0.40 MPa压力下不同山梨酸钾添加浓度的实验结果
(2)接种10-1酵母菌液后,两个压力条件下,酒体也都出现了较为严重的浑浊现象,说明此酵母菌浓度下山梨酸钾仍不能起到作用,但开始变化的浊度和最终表现浊度都较接种100酵母菌液的稍低,说明酵母菌的接种量直接影响浊度等酒液外观指标。在0.20 MPa压力下酒液开始变化的时间和最终浑浊时间都比0.40 MPa下出现的更早,与酵母菌液原液表现规律一致。
(3)10-2的酵母接种浓度,酒体已经不会出现严重浑浊的现象,在0.20 MPa压力下,山梨酸钾在150 mg/L时酒体就未出现异常变化;0.40 MPa压力下,山梨酸钾在100 mg/L时酒体未出现异常变化;说明此酵母菌浓度时,在0.20 MPa和0.40 MPa压力条件下,山梨酸钾对酵母菌产生有效抑制作用的添加浓度范围分别为100~150 mg/L、50~100 mg/L。
(4)10-3的酵母接种浓度,两个压力条件下,酒体均未出现异常变化,说明在此酵母浓度下,在压力存在时,即使0 mg/L的山梨酸钾添加量,压力也对酵母菌的生长和繁殖产生胁迫。
2.4 酒样接种酵母菌的游离二氧化硫影响实验
在添加山梨酸钾的同时,需要考虑游离二氧化硫与山梨酸钾对酵母菌生长抑制的协同作用,根据上述实验初步确定0.20 MPa和0.40 MPa压力下山梨酸钾浓度为150 mg/L、100 mg/L,在此基础上考虑对游离二氧化硫的浓度进行梯度实验。
将游离二氧化硫的梯度浓度分别设定为0 mg/L、20 mg/L、40 mg/L、60 mg/L酒样的初始游离二氧化硫浓度为18 mg/L,通过计算加入适量双氧水使其浓度达到上述梯度值。具体实验结果见表3、表4。
由表3、表4可以看出:
(1)接种酵母菌原液后,在0.20 MPa和0.40 MPa压力条件下,酒体都出现了严重的浑浊现象,最终的浊度都大于7.5 NTU,说明在此酵母菌浓度下即使60 mg/L的游离二氧化硫仍不能达到抑制菌体生长和繁殖的目的。但在0.20 MPa压力下酒液开始变化的时间和最终浑浊时间都比0.40 MPa下的更早,说明压力对酵母菌的生长和繁殖具有一定的抑制作用。
(2)接种10-1酵母菌液后,两个压力条件下,酒体也都出现了较为严重的浑浊现象,说明此酵母菌浓度下游离二氧化硫仍不能起到作用,但开始变化的浊度和最终表现浊度都较接种酵母菌原液的延迟和降低。在0.20 MPa压力下酒液开始变化的时间和最终浑浊时间仍都比0.40 MPa下的出现的更早,与酵母菌原液表现规律一致。
(3)10-2的酵母接种浓度,在0.20 MPa压力下,酒体仍出现浑浊现象,但在0.40 MPa压力下,游离二氧化硫在40 mg/L时酒体未出现异常变化;说明此酵母菌浓度时,0.20 MPa压力和游离二氧化硫的协同胁迫并未对酵母菌产生明显作用,而在0.40 MPa压力下,协同胁迫作用明显,此压力下游离二氧化硫产生有效抑制作用的添加浓度范围分别为20~40 mg/L。
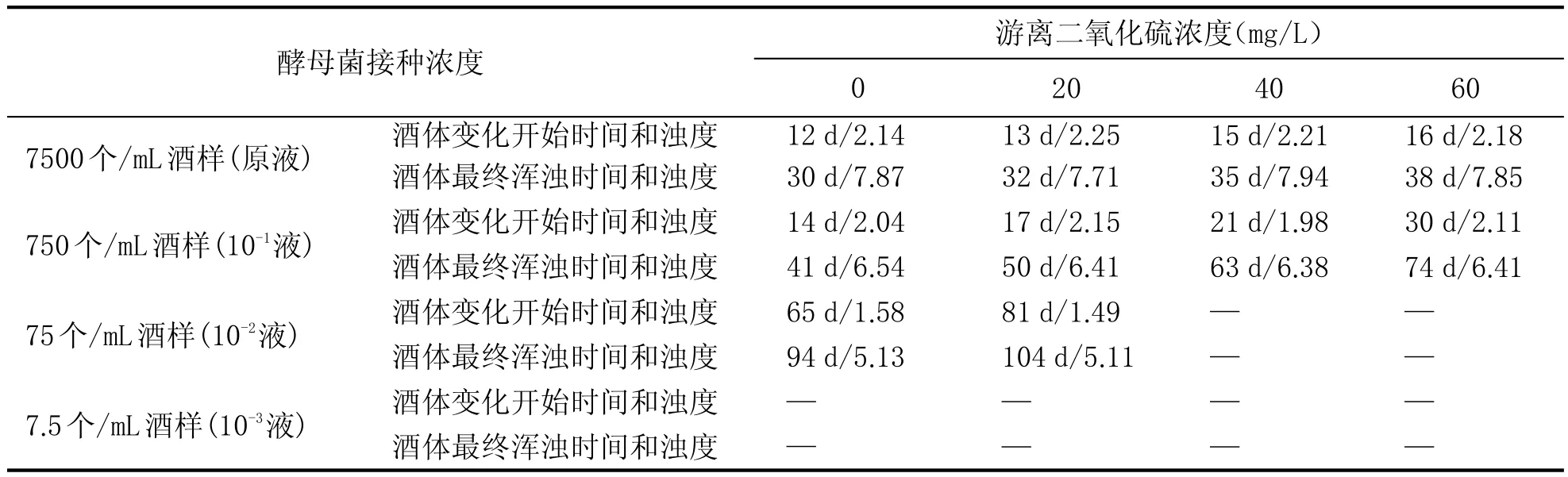
表4 0.40 MPa压力下不同游离二氧化硫添加浓度的实验结果
(4)10-3的酵母接种浓度,在0.20 MPa压力下,游离二氧化硫的添加量直至60 mg/L时,酒体才未出现异常变化,说明在此压力和酵母菌浓度下,游离二氧化硫产生协同胁迫的有效作用浓度范围为40~60 mg/L。而在0.40 MPa压力下,酒体均未出现异常变化,说明在此压力和酵母菌浓度下,即使0 mg/L的游离二氧化硫添加量,压力也对酵母菌的生长和繁殖产生胁迫。
3 结论
(1)当酵母接种量达到7500个/mL酒样时,6~8 d后酒体会因酵母的生长繁殖开始出现沉淀。酵母接种量越低,酒体出现沉淀或浑浊程度就会越小,出现的时间就会越晚;山梨酸钾的添加浓度越大,开始出现酵母繁殖现象的时间就越晚,根据实验结果,建议在0.20 MPa和0.40 MPa两个压力条件下,山梨酸钾添加浓度范围分别为100~150 mg/L、50~100 mg/L。
(2)对酵母的生长抑制作用来讲,游离二氧化硫和山梨酸钾之间存在协同抑制作用,总体来看,山梨酸钾对微生物的抑制作用更强,当游离二氧化硫浓度较低时,微生物的繁殖较快,且对酒体造成的浑浊和沉淀影响更为明显,且压力也对酵母菌产生生存胁迫,压力越高越明显。从实验中可以得知,建议在0.20 MPa和0.40 MPa两个压力条件下,游离二氧化硫添加浓度范围分别为40~60 mg/L、20~40 mg/L。
(3)从微生物安全和感官质量角度综合考虑,建议对于0.20 MPa左右的低泡葡萄酒产品山梨酸钾使用浓度范围为100~150 mg/L、游离二氧化硫浓度为30~40 mg/L浓度过高会对感官产生刺激,影响消费者体验;0.40 MPa左右的高泡葡萄酒产品山梨酸钾使用浓度范围为50~100 mg/L、游离二氧化硫浓度为20~30 mg/L。但无论何种类型的产品,灌装前均应通过除菌过滤,确保装瓶的酒液中无任何酵母菌的存在。
[1] 杨亚珍,查凡,果然,等.酿酒酵母的紫外诱变选育及发酵条件研究[J].湖北农业科学,2015(7):1664-1667.
[2] 李进,李泽福,都振江.低醇半干白葡萄酒的酵母菌耐受性研究[J].中国酿造,2011(10):119-121.
[3] 高年发,高玉荣.低醇干白葡萄酒生产工艺的研究[J].酿酒科技,2000(6):76-78.
[4] 黄宏慧.低度甜型葡萄酒微生物超标的原因及对策[J].食品与生物,2007(7):9.
[5] 樊玺,李记明.酵母菌的生长因子及特性[J].酿酒科技, 2001(6):28-29.
[6] 福杰桑.葡萄酒酿造微生物学——实验技术与规程[M].徐岩,康文怀,译.北京:中国轻工业出版社,2010.
[7] 翁秀花.山梨酸钾如何防止葡萄酒二次发酵[J].饮料, 1999,6(5):44-45.
[8] 尹卓容,王飚.葡萄酒生产中合理使用SO2[J].中外葡萄与葡萄酒,2000(2):54-57.
Tolerance of Yeast Strains of Sparkling Wine
ZHOU Penghui,LI Jin,LI Zefu,JIAN Mudong and YUAN Xiaodan
(Shandong Enterprise Technology Center,Shandong Wine Engineering Research Center, COFCO Greatwall Winery(Yantai)Co.Ltd.,Penglai,Shandong 265608,China)
In order to investigate yeast stability in sparkling wine,a gradient experiment of different concentration of potassium sorbate and free sulfur dioxide was performed to determine the safe tolerance concentration of yeast under different pressure conditions. The experimental results suggested that,the concentration range of potassium sorbate and free sulfur dioxide of 0.20 MPa semi-sparkling wine were 100~150 mg/L and 30~40 mg/L respectively,and the concentration range of potassium sorbate and free sulfur dioxide of 0.40 MPa sparkling wine were 50~100 mg/L and 20~30 mg/L respectively.
sparkling wine;yeast strains;tolerance;potassium sorbate;free sulfur dioxide;pressure
TS262.6;TS261.4;TS261.7
A
1001-9286(2017)06-0049-04
10.13746/j.njkj.2017022
2017-02-23
周鹏辉(1987-),男,河南周口人,助理工程师,大学本科,主要从事葡萄酒酿造相关的研究。
李泽福。
优先数字出版时间:2017-05-04;地址:http://kns.cnki.net/kcms/detail/52.1051.TS.20170504.0848.003.html。
