海洋棘皮动物脂质的研究进展
2017-06-27徐清云吴靖娜苏永昌刘智禹陈丽娇
徐清云,潘 南,吴靖娜,苏永昌,许 旻,刘智禹*,陈丽娇
(1.福建农林大学食品科学学院,福建 福州,350002;2.福建省水产研究所,国家海水鱼类加工技术研发分中心,福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门361013;3.福建省海洋生物资源开发利用协同创新中心,福建 厦门 361013)
海洋棘皮动物脂质的研究进展
徐清云1,2,3,潘 南2,3,吴靖娜2,3,苏永昌2,3,许 旻2,3,刘智禹2,3*,陈丽娇1*
(1.福建农林大学食品科学学院,福建 福州,350002;2.福建省水产研究所,国家海水鱼类加工技术研发分中心,福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门361013;3.福建省海洋生物资源开发利用协同创新中心,福建 厦门 361013)
棘皮动物因其油脂中含有许多独特的功能和活性物质,而成为开发保健食品和海洋药物的重要资源之一。目前海洋油脂研究主要集中在鱼油上,而对海洋棘皮动物油脂的研究很少。脂肪酸是海洋棘皮动物中重要的生物活性物质,具有降血脂、抗癌、抗炎等功能活性。因此,本文根据国内外的研究进展对海洋棘皮动物脂质的提取、分离纯化、生物活性等方面进行了概述,以期为海洋棘皮动物的综合利用奠定基础,进而为更好地开发新型海洋食品、药品提供科学依据。
海洋棘皮动物;脂质;提取;分离纯化;生物活性
海洋棘皮动物(Echinodermata)是生活在海底的一种无脊椎动物,现存种类有7 000多种,分为海百合纲(Crinoidea)、海胆纲(Echinoidea)、海星纲(Asteroidea)、蛇尾纲(Ophiuroidea)、海参纲(Holothuroidea)。我国海洋棘皮动物资源丰富,目前对海洋棘皮动物的研究主要是物种系统进化论、生长习性、生长发育及食品加工、活性物质等方面[1],而对海洋棘皮动物脂质进行系统的分析却鲜有报道,我国对海洋棘皮动物脂质的研究刚刚起步,本文总结与概述了海洋棘皮动物脂质的提取方法、分离纯化方法、生物活性等研究的进展,以期为海洋棘皮动物综合资源的开发提供科学依据。
1 提取
脂肪的提取主要是利用脂肪不溶于水的特性,其传统方法是有机溶剂提取法,但该方法具有一定的局限性,因此目前国内外对脂质的提取主要是利用有机溶剂和其他技术相结合的方法,如加压溶剂萃取技术、超临界萃取技术、超声波萃取技术等,这些方法具有加快提取速度、提高脂质得率、减少环境污染等优点。
1.1 压榨法、蒸煮法、碱水解法
这三种方法简单、易操作,其原理及优缺点见表1。

表1 压榨法、蒸煮法、碱水解法Tab.1 Squeezing,boiling and alkali hydrolysis
1.2 有机溶剂提取法
溶剂提取法是利用相似相溶的原理,将样品中的油脂分离出来。提取油脂常用的有机溶剂主要有氯仿、二氯甲烷、正己烷、石油醚和甲醇等,可单独或混合使用。国内外对海洋棘皮动物脂肪的提取大多使用此方法,该方法简单、易操作、时间短、提取率高、成本低,但是使用有毒试剂会对人体和环境造成一定的危害。
秦磊等*秦磊, 周大勇, 吴婧,等. 大连紫海胆性腺油脂的提取研究[C].中国食品科学技术学会第六届年会暨第五届东西方食品业高层论坛论文摘要集,2009:54-55.采用索氏提取法(Soxhlet)、氯仿-甲醇提取法(Folch)和超临界二氧化碳萃取法(SFE)三种方法提取大连紫海胆性腺中的油脂,结果显示:Soxhlet、Foch和SFE三种方法的粗油得率分别为28.3%、16.2%和15.2%,索氏法的提取率最高。刁全平等[3]采用Bligh-Dyer(氯仿-甲醇)提取紫海胆黄的脂质,利用气质联用(GC-MS)对脂肪酸进行分析,共检测出14种脂肪酸,其中6种饱和脂肪酸占总脂肪的32.89%、8种不饱和脂肪酸占总脂肪的67.11%,其中EPA和DHA的相对百分含量分别为12.73%和1.21%。王洪英[4]等利用索氏法提取马粪海胆黄中的油脂,经正交优化后的最佳提取条件为:料液比1∶80、提取温度70℃、提取时间6 h、提取次数2次,在该条件下粗脂肪的得率为17.4%。刁全平等[5]利用Bligh-Dyer法提取海参中的脂质,结果显示海参中的不饱和脂肪酸含量占总脂肪的71.24%,其中EPA和AA是不饱和脂肪酸的主要成分,分别占有10.39%、9.9%。楼乔明[6]根据Folch法测定并计算了9种海参体壁中总脂含量,同时对其中的磷脂、胆固醇、甘油三酯和游离脂肪酸的含量进行测定。桑已曙[7]等使用氯仿/甲醇(2∶1,V/V)提取总脂,再利用乙酸乙酯/正丁醇(2∶1,V/V)提取脑苷脂。滕瑜[8]和温燕梅[9]利用索氏提取法分别提取陶氏太阳海星和海星体壁中的脂肪酸,结果显示太阳海星的脂肪酸含量占11%以上、海星体壁中的脂肪酸为4.53%。李烈英[10]采用改进的Bligh-Dyer法[11],采用氯仿-甲醇(1∶2,V/V)提取多棘海盘车幽门盲囊中的脂肪,粗脂肪含量为7.85%(湿重)。关崇新[12]利用Bligh-Dyer法提取俄罗斯海参中的粗脂肪,共检测出25种脂肪酸,其中含有9.46%的EPA和11.77%的DHA。
1.3 超临界流体萃取(SFE)
超临界流体萃取是由萃取和分离两部分构成,指在超临界条件下,流体对脂肪酸具有特殊的溶解作用,样品在设定的温度下与超临界流体(CO2)接触,从而使样品中的油脂溶解,然后改变温度或压力,改变超临界流体的密度,将溶解后的脂肪降解,从高压溶剂中分离出来,从而达到提取脂肪的目的。利用超临界流体提取油脂简单易操作、萃取时间短、可以有效地防止油脂的氧化,具有油脂质量好、萃取效率高、CO2可循环使用、环保无毒害等优点,但是设备昂贵、成本高、操作繁琐。超临界流体萃取油脂法刚刚起步,处于实验研发和中试阶段,目前较少用于海洋棘皮动物油脂的提取。
朱蓓薇等[13]以光棘球海胆黄为原料,使用超临界CO2法辅助水酶法提取粗脂肪,其中多不饱和脂肪酸的相对含量为总脂肪酸的36.80%,得率与索氏提取法相近。近几年各类海洋动物超临界CO2萃取油脂的工艺对比见表2。
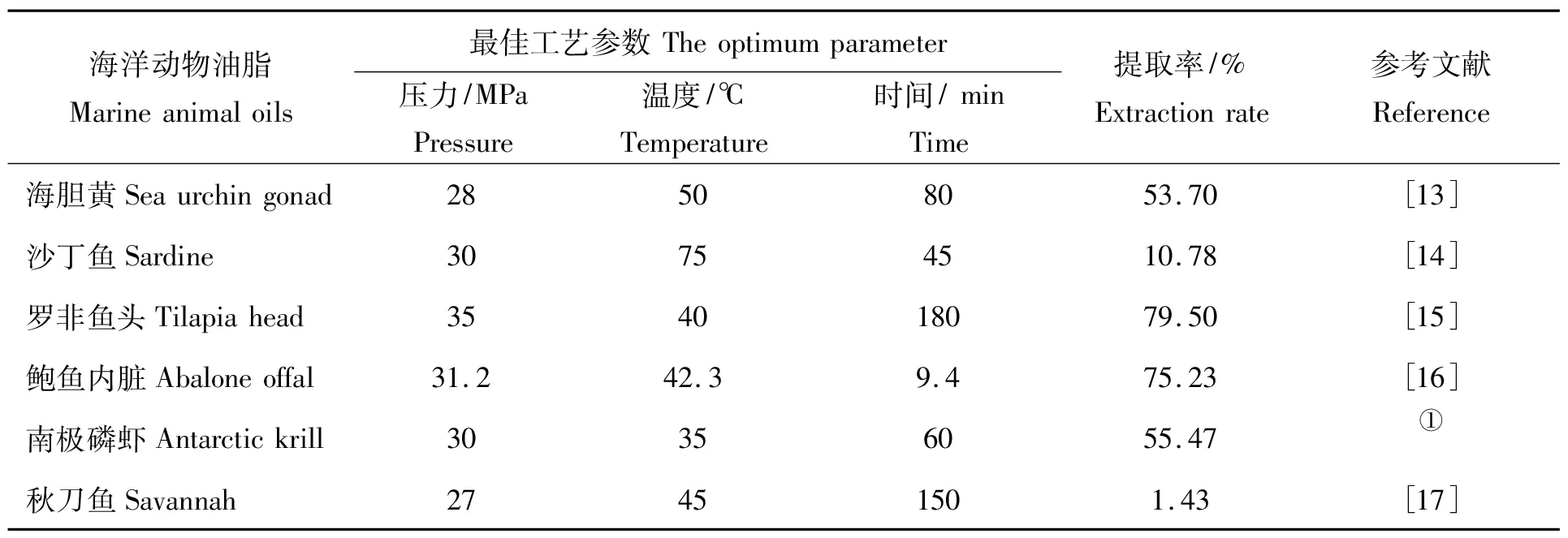
表2 各类海洋动物油超临界CO2萃取工艺对比Tab.2 Comparison of supercritical CO2 extraction process of various marine animal oils
①徐文思,妥丰艳,周大勇.超临界二氧化碳法萃取南极磷虾油的研究[J].中国食品科学技术学会第十一届年会论文集,2014:307-308.
1.4 超声辅助萃取(UAE)
超声波辅助萃取是指利用超声波和其他方法相结合进而提取出油脂的方法,具有易操作、好控制、萃取时间短、适用范围广等优点,但也存在噪音大、易吸入有机溶剂、提高温度会破坏提取物的生物活性等缺点。周红等[18]采用超声波辅助Folch法提取细雕刻肋海胆性腺中的脂肪酸,利用气质联用(GC-MS)对脂肪酸进行分析,共检测出34种脂肪酸,其中不饱和脂肪酸的相对含量在60%以上,脂肪酸主要成分为E-6-十八碳烯酸(9.45%)、十六碳酸(13.72%)、硬脂酸(7.98%)、(Z,Z,Z,Z,Z)-5,8,11,14,17-二十碳五烯酸(12.77%)、(Z,Z,Z,Z,Z,Z)-4,7,10,13,16,19-二十二碳六烯酸(10.63%)、Z-11-十八碳烯酸(6.43%)。陈文娟等[19]采用超声辅助法提取磷脂,在42℃、210 W功率的条件下,利用93%的乙醇进行提取,磷脂的提取率为59.73%。
1.5 水酶法
酶解法是利用蛋白酶使蛋白质分解,破化蛋白质和脂肪的结缔作用,再对其进行破乳,从而提取出油脂。水酶法在环境友好方面有着不可替代的优势,有机溶剂排放几乎为零,其不需要任何特殊设备,操作简便,还可以在提取脂质的同时回收蛋白质、肽和多糖等水溶性营养成分,且比传统提取方法更能保留所得提取物的生物活性,发展前景相当广阔。朱蓓薇等[13]采用水酶法提取光棘球海胆黄中的脂肪酸,通过条件优化得出最佳提取条件为:木瓜蛋白酶、提取时间3 h、料液比1∶20、提取温度55℃,利用25%氯化钠(m/V)、65%乙醇(V/V)进行破乳。
2 分离纯化
2.1 柱层析法
柱层析法分离是利用脂质中的各组分在层析柱上具有不同的吸附力而达到分离提纯的目的。柱层析分离脂质的方法比较简单,但是如果没有确定好分离参数,得到的组分纯度不高。
牛宗亮等[20]用硅胶柱层析分离马粪海胆生殖腺脂肪酸,得到含量丰富的花生四烯酸和EPA。楼乔明[6]多次利用硅胶柱层析对脂质进行分离纯化:用氯仿将氨丙基硅胶固相萃取小柱活化后,利用甲醇溶液为洗脱液从海参中分离出磷脂;用硅胶柱层析从海量和海参中分离出鞘磷脂;还将脂质样品经甲醇、丙酮反复清洗除杂,利用丙酮收集不溶物,并用氯仿溶解,利用硅胶柱层析和TLC点板层析,得到高纯度的磷脂样品。熊雄等[21-24]采取阴离子交换柱层析分别从海胆、海参中提取神经节苷脂。黄如彬等[25]采用凝胶过滤层析结合离心硅胶层析的方法纯化出高纯度的神经节苷脂。刘小芳等[26]用硅胶柱层析分离纯化出刺参中的磷脂,纯度达到85%以上。王海龙[27]采用Folch法得到糖脂粗提物,然后利用硅胶柱层析法先加10倍柱体积的氯仿洗去磷脂以及硫脂类,最后加入氯仿∶甲醇∶蒸馏水(30∶60∶20,V/V)洗脱出鞘糖脂。柳叶等[28]以甲醇∶氨水为流动相,磷脂PC和PE的洗脱率分别达到了98.6%和32.3%。
2.2 高效液相色谱法(HPLC)
高效液相色谱法是利用样品中各组分在流动相和固定相的分配系数、吸附能力、分子尺寸的大小或离子交换作用的差异进行分离。利用高效液相色谱法对脂质进行分离纯化,其分离效果较好,能防止活性成分被氧化,但成本较高,不适用于大量纯化。
Bernaldo等[29]利用高效液相色谱法分离纯化海胆中的磷脂时,选取Extrasil 5μm SI的柱子,以乙腈-甲醇-85%磷酸(50∶50∶1.8,V/V)作为流动相,研究发现当此流动相中磷酸含量增加时,虽然分离纯化的时间缩短了,但是其分离效果比较差。徐杰[30]采用反相HPLC法分离纯化海地瓜中的脑苷脂单体,通过优化实验,采用96%的甲醇水溶液作为流动相时,海参中的脑苷脂单体的纯度均在90%以上。利用反相高效液相色谱法选取反相C18半制备柱、100%的甲醇为流动相时,提取海参中的脑苷脂单体的纯度高、分离效果好[31-33]。研究[34]显示分离纯化DHA、EPA和DPA最有效的方法是反相高效液相色谱法。袁成凌等[35]利用反相高效液相色谱法纯化油脂中的花生四烯酸,采用C18半制备柱、流速5 mL/min、流动相为95%的甲醇,将尿素包合法提取的花生四烯酸的纯度从38%提高到99%。Medina[36]等采用高效液相色谱法分离纯化粗脂肪中的DHA和EPA,以80%的甲醇作为流动相,分别得到纯度90%以上的EPA和DHA。
2.3 高速逆流色谱法(HSCCC)
高速逆流色谱法的固定相和流动相都是液体,根据被分离组分在两相中的分配系数不同而达到分离。优于传统色谱的是使用液体作为固定相,能防止样品的损失、速度快、效果好,提取率比正常硅胶柱高1倍左右[37],适合中小分子类物质的分离纯化等。目前高速逆流色谱法是分离纯化技术的研究热点,已经在天然产物、医药、食品等领域中被广泛应用[38]。
HSCCC技术是目前分离纯化的重要方法,仍处于研究阶段,较少应用于海洋棘皮动物脂质的分离纯化。徐杰[30]采用HSCCC法纯化仿刺参中的脑苷脂,得率为12.4%,纯度为92.38%;Kisa[39]等利用HSCCC法从日本刺参中分离纯化出三种脑苷脂系列物,刺参中SJC-2的总得率和HPLC法基本一致,但SJC-1和SJC-3 得率均比HPLC法高出1倍以上。
2.4 其它
分离纯化脂肪酸除了柱层析法、高效液相色谱法、高速逆流色谱法,还有低温结晶法、尿素包合法、方法结合纯化等。这些方法简单、易操作、提取率高,但是对于不饱和度相近的脂肪酸分离效果不明显。Chen T C等[40]利用低温结晶法,在-80℃、乙腈-丙酮(3∶7 V/V)下提取α-亚麻酸,将α-亚麻酸的纯度从55.0%提高到85.7%。Hegisthe等[41]利用尿素包合法分离纯化ω-3PUFAs,将ω-3PUFAs的纯度从55%提高到91%。Chakraborty等[42]利用尿素包合法和涂银层析法提取沙丁鱼中的EPA,其纯度从93.74%提高到99.6%。
3 生物活性
3.1 降血脂、防治动脉粥样硬化
随着人们生活水平的提高,目前高血脂、高血压等疾病影响着人类的健康,具有降血脂等功能的活性物质也成为目前的研究热点。海胆黄中的不饱和脂肪酸以EPA和花生四烯酸为主[20],研究显示EPA可以改变脂蛋白中脂肪酸的组成,降低血液的粘稠度,促进血液的流动,起到降血脂作用[43-44]。楼乔明[6]研究显示,海参中的EPA、磷脂能显著降低肝脏和血清中的甘油三酯和胆固醇水平,降低AI指数以及改善脂肪肝变性。张蓓[45]和楼乔明[6]发现从海参、海地瓜和海盘车中分离提取出的脑苷脂均可以促进肝脏脂质的代谢。海星中的不饱和脂肪酸占总脂肪酸的27.57%[46],研究表明[47-48]不饱和脂肪酸可降低血清胆固醇的生物活性。徐杰等[49]等发现日本刺参(Apostichopusjaponicus)、墨西哥海参(Holothuriamexicana)和菲律宾刺参(Pearsonothuriagraeffei)中的活性物质均可以显著降低血清中胆固醇和甘油三酯水平,是预防高血脂症和动脉粥硬化的有效治疗药物。刘小芳[50]的研究结果显示刺参中的EPA磷脂能显著抑制肾周脂肪的蓄积,降血脂效果比卵黄磷脂和大豆磷脂更好。
3.2 抗癌
海洋棘皮动物中的脂肪酸具有抗肿瘤活性。Shah等[51]将海星中的脑苷脂添加到Caco-2结肠癌细胞、L1210白血病细胞中,结果显示其可以促使Caco-2肿瘤细胞凋亡、抑制L1210白血病细胞增长。杜磊[52]利用MTT法将海参中的脑苷脂添加到Caco-2、HGC-27、HepG2等肿瘤细胞中,得出海参中的脑苷脂具有良好的抗肿瘤增殖活性;还将海参和海星中的脑苷脂分别添加到S180中,结果显示海星中的脑苷脂的抗肿瘤效果优于海参中的脑苷脂;最后进行了体内抗肿瘤试验,其抗肿瘤效果优于体外。EPA[53-54]具有良好的抗癌效果,可以显著地抑制乳腺癌、胃癌、胰腺癌等癌细胞的生长、诱导癌细胞的凋亡。Fukunaga等[55]和Hossain等[56]研究显示,海星中的EPA磷脂可以调节Caco-2肿瘤细胞内的脂质过氧化物产量和活性氧水平,进而导致Caco-2肿瘤细胞凋亡。海参和海胆中的神经节苷脂可以使大鼠嗜铬瘤细胞PC-12产生轴突,进而抑制嗜铬瘤细胞的生长[47-59]。徐杰[30]将海参总脑苷脂添加到Caco-2细胞,观察细胞的生长,研究显示海参中的脑苷脂能抑制Caco-2细胞的生长,表明了脑苷脂可以影响肿瘤细胞的活性。从北大西洋瓜参(C.frondosa)中分离得到一种支链脂肪酸12-甲基十四院酸(12-MTS),能够抑制前列腺癌细胞的增殖[60]。Sahara等[61]从虾夷马粪海胆(Strongylocentrotusintermedius)肠中分离得到四种糖脂,其中3’-sulphonoquinovosyl-1’-monoacylglyceride(A5)具有显著的细胞毒性;在接种人体肺腺癌细胞系A-549实体癌的裸鼠实验发现,A-5能抑制实体癌的生长并显示了出血性坏死区域,说明该糖脂具有开发成有效抗癌药物的潜质。
3.3 抗炎
炎症是身体正常的免疫防御反应,但是如果处理不当会从急性炎症转变为慢性炎症,影响人体健康。在体内和体外实验中已经证明海洋棘皮动物中的一些脂肪酸具有抗炎作用。
用EPA喂养患有炎症的小鼠,结果显示EPA可以抑制具有致炎作用的LTB4的形成,进而降低小鼠的炎症[62]。徐杰[30]将不同浓度的叶瓜参脑苷脂和TNF-α添加到Caco-2分化成的小肠上皮细胞中,利用荧光定量PCR法检测Caco-2细胞炎症因子,得出叶瓜参中的脑苷脂可以显著降低IL-8 mRNA炎症因子的表达量。刘小芳[50]将刺参中的EPA磷脂、软磷脂、大豆磷脂分别添加到患有炎症的小鼠中,结果表明刺参中的EPA磷脂可以改变小鼠血清中的IL-6水平,且抑炎效果比大豆磷脂和卵黄磷脂的好。
3.4 其它活性
海洋棘皮动物脂质除了上述主要活性外,还具备有抗菌、降血糖、抗病毒、代谢等活性。王田[63]研究显示海星中的脑苷脂对变形杆菌的抑制作用随样品浓度的增大而增大,结论得出浓度为55 mg/mL的脑苷脂样品抑制金黄色葡萄球菌的效果最佳。InagakiM等[64]将海星中的神经节苷脂添加到患有Ⅱ型糖尿病的大鼠中可以显著降低Ⅱ型糖尿病大鼠中的血糖水平,发现海星中的神经节苷脂具有良好的降血糖活性。Nair等[65]从绿海胆黄中分离出8,11,14—二十碳三烯酸的胆固醇酯、二十碳三烯酸的甘油三酯,它们在器官组织中具有重要的代谢功能,可以抑制肾上腺素、ADP,对豚鼠回肠的前列腺素样平滑肌起到兴奋作用等。研究显示海参中的脑苷脂还具有抗肝毒、免疫调节等活性[66]。
4 展望
综上所述,从海洋棘皮动物中提取脂质的方法较多,且每种方法都有各自的优缺点。在具体的提取分离过程中,可以根据不同的原料、药理作用等,选择最佳的方法或结合多种方法,通过取长补短提高提取效率,将所需要的脂质最大限度地提取出来。海洋棘皮动物中的脂肪酸组成多样,具有降血脂、抗癌、抗炎等活性,可开发成治疗心血管疾病、辅助治疗恶性肿瘤的药物制剂,也可开发成特殊医用配方的功能食品。继续深入对海洋棘皮动物动物脂质的研究,尤其是对多不饱和脂肪酸的研究,找出功能因子,明确其作用机理,进而为开发海洋新产品、新药物提供可行的实行方法以及可靠的科学依据。
[1]Sheean P D,Hodges L D,Kalafatis N,et al.Bioactivity of extracts from gonadal tissue of the edible Australian purple sea urchinHeliocidariserythrogramma[J].Journal of the Science of Food & Agriculture,2007,87(4):694-701.
[2]臧丽芹.鱼肝脂质提取及组成分析研究[D].舟山:浙江海洋学院,2013:2-3.
[3]刁全平,侯冬岩,回瑞华,等.紫海胆黄脂肪酸的气相色谱-质谱分析[J].特产研究,2012,(3):49-51.
[4]王洪英,马娜娜,李梦鑫,等.正交试验设计优化马粪海胆生殖腺粗脂肪提取工艺研究[J].安徽农业科学,2013,27(27):11064-11065.
[5]刁全平,侯冬岩,回瑞华,等.海参脂肪酸的气相色谱-质谱分析[J].鞍山师范学院学报,2008,10(6):33-35.
[6]楼乔明.几种海洋动物脂质分析及海参EPA磷脂生物活性研究[D].青岛:中国海洋大学,2011:87.
[7]桑已曙,闵知大.脑苷脂类化合物研究进展[J].中国生化药物杂志,2000,21(4):211-213.
[8]滕瑜,苑德顺,王东升,等.陶氏太阳海星的营养评价[J].农产品加工,2016,(1):37-39.
[9]温燕梅,冯亚非,李先文.海星中脂肪酸的GC-MS分析[J].水生态学杂志,2008,28(3):30-32.
[10]李烈英,陈念红,孙作庆.多棘海盘车幽门盲囊极性脂和脂肪酸组分的研究[J].海洋科学,1995,19(5):49-52.
[11]Bligh E G,Dyer W J.A rapid method of total lipid extraction and purification.[J].Canadian Journal of Biochemistry & Physiology,1959,37(8):911-917.
[12]关崇新,刁全平,侯冬岩,等.俄罗斯海参脂肪酸的气相色谱-质谱分析[J].鞍山师范学院学报,2015,34(4):33-35.
[13]Zhu B W,Qin L,Zhou D Y,et al.Extraction of lipid from sea urchin(Strongylocentrotusnudus) gonad by enzyme-assisted aqueous and supercritical carbon dioxide methods[J].European Food Research and Technology,2010,230(5):737-743.
[14]Létisse M,Rozières M,Hiol A,et al.Enrichment of EPA and DHA from sardine by supercritical fluid extraction without organic modifier :I.Optimization of extraction conditions[J].Journal of Supercritical Fluids,2006,38(1):27-36.
[15]张春华,包斌,陈山乔,等.响应面优化超临界CO2萃取罗非鱼头油的研究[J].上海海洋大学学报,2015,24(2):293-302.
[16]汤鹏,段海霞,夏金梅,等.响应面法优化超临界CO2萃取鲍鱼内脏油脂及其脂肪酸种类测定[J].食品科学,2015,36(12):153-159.
[17]宋维春,徐云升,范桂林,等.秋刀鱼鱼油的提取与胶囊化研究[J].琼州学院学报,2015,22(5):37-40.
[18]周红,林翠梧,朱定姬,等.细雕刻肋海胆性腺脂肪酸的超声波提取与化学成分分析[J].精细化工,2010,27(3):238.
[19]陈文娟,陈丽娇.大黄鱼鱼卵磷脂提取及磷脂成分分析[J].福建农林大学学报(自然科学版),2012,41(4):498-502.
[20]牛宗亮,王荣镇,董新伟,等.马粪海胆生殖腺营养成分的含量测定[J].中国海洋药物,2009,28(6):26-30.
[21]熊雄,刘松青.神经节苷脂分离纯化过程中的共性问题[J].药学专论,2002,11(5):41-42.
[22]Ledeen R W,Yu R K,Eng L F.Ganglioside of human myelin:sialosylgalactosylceramide(G7)as a major component[J].Journal of Neurochemistry,1973,21(4):829-839.
[23]Nakamuru K,Inagaki F,Tamai Y.A novel gangliosides in dogfish brain[J].The journal of biological Chemistry,1988,263(20):9896-9900.
[24]Keiko T A,Harumi K,Philip I,et al.Isolation and characterization of a unique sulfated gangliosides,sulfated GM1a from rat kidney[J].Glycobiology,1998,8(4):341-350.
[25]黄如彬,潘颖,王泽生,等.猪脑中提取高纯度神经节苷脂[J].生物化学与生物物理进展,1994,21(5):444-446.
[26]刘小芳.刺参营养成分的地域性差异分析及其磷脂的活性研究[D].青岛:中国海洋大学,2014:62-63.
[27]王海龙,孙润广,张静,等.神经节苷脂的红外、紫外光谱分析及其多聚体结构的原子力显微镜观测[J].光谱学与光谱分析,2009,29(4):1045-1049.
[28]柳叶,吕秀阳.氧化铝柱层析分离磷脂工艺的洗脱研究[J].浙江化工,2006,37(9):3-4.
[29]Cdela C G,Lopezhernandez J,Gonzalezcastro M J,et al.Protein,amino acid and fatty acid contents in raw and canned sea urchin(Paracentrotuslividus)harvested in Galicia(NW Spain)[J].Journal of the Science of Food & Agriculture,2000,80(8):1189-1192.
[30]徐杰.海参脑苷脂的分离纯化、结构分析及其生物活性研究[D].青岛:中国海洋大学,2011:28-101.
[31]Maruta T,Saito T,Inagaki M,et al.Biologically active glycosides from Asteroidea,41.Isolation and structure determination of glucocerebrosides from the starfishLinckialaevigata[J].Chemical and Pharmaceutical Bulletin,2005,53(10):1255-1258.
[32]Kawatake S, Nakamura K, Inagaki M,et al.Isolation and structure determination of six glucocerebrosides from the starfishLuidiamaculata[J].Chemical six glucocedrosides and Pharmaceutical Bulletin,2002,50(8):1091-1096.
[33]Ikeda Y,Inagaki M,Yamada K,et al.Isolation and structure of a galactocerebroside from the sea cucumberBohadschiaargus[J].Chemical and Pharmaceutical Bulletin,2009,57(3):315-31.
[34]李晶.海狗油中三种多烯脂肪酸EPA、DHA与DPA的分离纯化及定量分析方法研究[D].北京:中国药品生物制品检定所,2002:1-79.
[35]袁成凌,张鉴,王相勤,等.高效液相色谱法分离纯化微生物油脂中的花生四烯酸[J].色谱,2003,21(1):60-62.
[36]Medina A R,Gimenez A G,Camacho F G,et al.Concentration and purification of stearidonic,eicosapentaenoic and docosahexaenoic acids from cod liver oil and the marine microalgaIsochrysisgalbana[J].Journal of the American Oil Chemists’ Society,1995,72(5):575-583.
[37]Sugawara T,Zaima N,Yamamoto A,et al.Isolation of sphingoid bases of nsea cucumber cerebrosides and their cytotoxicity against huaman colon cancer cells[J].Bioscience Biotechnology and Biochemistry,2006,70(12):2906-2912.
[38]尚远宏,曾桢,田金凤.应用高速逆流色谱分离天然产物中成分的研究进展[J].西南民族大学学报(自然科学版),2016,42(2):156-161.
[39]Kisa F,Yamada K M,Inagaki M,et al.Constituents of Holothuroidea,14.Isolation and structure of new glucocerebroside molecular species from the sea cucumberStichopusjaponicas[J].Chemical and Pharmaceutical Bulletin,2005,53(4):382-386.
[40]Chen T C,Ju Y H.Polyunsaturated fatty acid concentrates from borage and linseed oil fatty acids[J].Journal of the American Oil Chemists’ Society,2001,78(5):485-488.
[41]Hegisthe S.Separation of Omega 3 from Flaxseed Oil using Urea In clusion Method[J].Journal of Engineering Research and Technology,2011,4(4):417-421.
[42]Chakraborty K,Raj R P.Eicosapentaenoic acid enrichment from sardine oil by argentation chromatography[J].Journal of Agricultural and Food Chemistry,2007,55(18):7586.
[43]Angerer P,Schacky C V.n-3 polyunsaturated fatty acids and the cardiovascular system[J].Current Opinion in Lipidology,2000,11(1):57-63.
[44]Takada K,Ishikawa S,Yokoyama N,et al.effects of eicosapentaenoic acid on platelet function in patients taking long-term aspirin following coronary stent implantation[J].International Heart Journal,2014,55(3):228-233.
[45]张蓓,薛长湖,冯婷玉,等.海参脑苷脂对脂肪肝大鼠脂肪代谢的调节作用[J].浙江大学学报(医学版),2010,39(5):493-498.
[46]吴鹏,赵岩,李平亚.GC-MS法分析海星中脂肪酸及脂溶性成分[J].中草药,2007,38(2):180-182.
[47]Zheng J X.Functionality eatables[M].Beijing:China Light Industry Press,1995:119-235.
[48]ZhaoW B,Liu J R,Huang S G.Research on nutrition com-ponents of oil and semen armeniacae amarum of Xinjiang[J].China Oils Fats,2002,27(2):31-33.
[49]徐杰,王静凤,逢龙,等.墨西哥海参和菲律宾刺参的化学成分和降血脂作用比较[J].中国海洋大学学报(自然科学版),2007,37(5):723-727.
[50]刘小芳.刺参营养成分的地域性差异分析及其磷脂的活性研究[D].青岛:中国海洋大学,2014:89-94.
[51]Shah A K,Kinoshita M,Kurihara H,et al.Glycosylceramides obtain from the starfishAsteriasamurensisLütken[J].Journal of Oleo Science,2008,57(9):477-484.
[52]杜磊.海参和海星脑苷脂抗肿瘤及改善癌症恶病质作用的研究[D].青岛:中国海洋大学,2012:16-27.
[53]尹勇,何裕隆,蔡世荣,等.二十碳五烯酸(EPA)对胃癌细胞增殖与凋亡的影响[J].中华临床营养杂志,2012,20(2):88-92.
[54]Fukui M,Kang K S,,Okada K,et al.EPA,an omega-3 fatty acid,induces apoptosis in human pancreatic cancer cells:Role of ROS accumulation,caspase-8 activation,andautophagy induction[J].Journal of Cellular Biochemistry,2013,114(1):192-203.
[55]Fukunaga K,Hossain Z,Takahashi K.Marine phosphatidylcholine suppresses 1,2-dimethylhydrazine-induced colon carcinogenesis in rats by inducing apoptosis[J].Nutrition Research,2008,28(9):635-640.
[56]Hossain Z,Konishi M,Hosokawa M,et al.Effect of polyunsaturated fatty acid-enriched phosphatidylcholine and phosphatidylserine on butyrate-induced growth inhibition,differentiation and apoptosis in Caco-2 cells[J].Cell Biochemistry & Function,2006,24(2):159-165.
[57]Yamada K,Harada Y,Nagaregawa Y,et al.Isolation and structure of biologically active glycosphingolipids from the sea cucumberHolothuriapervicax[J].European Journal of Organic Chemistry,1998,(11):447-452.
[58]Kisa F,Yamada K,Miyamoto T,et al.Constituents of Holothuroidea,17.Isolation and structure of biologically activemonosialo-gangliosides from the sea cucumber Cucumaria echinata[J].Chem Pharm Bull,2006,54(7):982-987.
[59]Inagaki,M,Shiizaki M,Hiwatashi T,et al.Constituents of Crinoidea.5.Isolation and structure of a new glycosyl inositolphosphoceramide-type ganglioside from the feather star Comanthina schlegeli[J].Chemical & Pharmaceutical Bulletin,2007,55(11):1649-1651.
[60]Sedov A M,Apollonin A V,Sevast’Ianova E K,et al.Stimulation of nonspecific antibacterial resistance of mice to opportunistic gram-negative microorganisms withtriterpene glycosides from Holothuroidea[J].Antibiotiki i khimioterapiia,1990,35(1):23-26.
[61]Sahara H,Ishikawa M,Takahashi N,et al.In vivo anti-tumour effect of 3’-sulphonoquinovosyl 1’-monoacylglyceride isolated from sea urchin(Strongylocentrotusintermedius)intestine[J].British journal of cancer,1997,75(3):324-332.
[62]Michael J J,Robert A G,Leslie G C.Dietary polyunsaturated fatty acids and inflammatory mediator production[J].American Journal of Clinic Nutrition,2000,71(1suppl):343S-348S.
[63]王田.海星脑苷脂水解产物的分离纯化及活性研究[D].大连:大连海洋大学,2015:23-37.
[64]Inagaki M.Structure and biological activity of glycosphingolipids from starfish and feather stars[J].J.J.Pharm Soc Jpn,2008,128(8):1187-1194.
[65]Nair M S,Mathur A,Tabei K,et al.Isolation and structure determination of two new bioactive lipids from the gonads of a sea urchin,Strongylocentrotusdroebachiensas[J].Journal of Natural Products,1988,51(1):184-192.
[66]Tan R X,Chen J H.The cerebrosides[J].Natural Product Reports,2003,20(5):509-534.
Advanced in lipids from Echinodermata
XU Qingyun1,2,3,PAN Nan2,3,WU Jingna2,3,SU Yongchang2,3,XU Min2,3,LIU Zhiyu2,3*,CHEN Lijiao1*
(1.Fujian Agriculture and Forestry University,Fuzhou 350002,China;2.National Research and Development Center for Marine Fish Processing,Key Laboratory of Cultivation and High-value Utilization of Marine Organisms in Fujian Province,Fisheries Research Institute of Fujian,Xiamen 361013,China;3.Fujian Collaborative Innovation Center for Exploitation and Utilization of Marine Biological Resources,Xiamen 361013,China)
Marine oils contain many unique functions and active substances,and thus become one of the important resources for the development of health food and marine drugs.Now,marine oils researches mainly focus on fish oils,while the study of Echinodermata oils is less.Fatty acids are important bioactive substances in marine echinoderms,with hypolipidemic,anti-cancer,anti-inflammatory and other functional activities.Therefore,this paper summarized the current stage of knowledge on the Echinodermata lipids from various aspects such as extraction,isolation,purification and biological actives,in order to lay the foundation for the comprehensive utilization of Echinodermata,and provide scientific basis for better development of new marine food and medicine.
Echinodermata;lipids;extraction;purification;bioactivity
2017-04-01
厦门市海洋经济发展专项(14CZP041HJ15);福建重要海洋经济生物种质库与资源高效开发技术公共服务平台(14PZY017NF17).
徐清云(1989-),女,硕士研究生,研究方向:食品加工理论与应用.E-mail:949416291@qq.com
陈丽娇(1962-),女,教授,研究方向:水产品保鲜与深加工、水产品资源综合利用等.E-mail:chenlijiao@126.com; 刘智禹(1972-),男,教授级高工,博士,研究方向:水产品加工与综合利用.E-mail:272132622@qq.com
徐清云,潘 南,吴靖娜,等.海洋棘皮动物脂质的研究进展[J].渔业研究,2017,39(3):229-237.
R931.77
A
1006-5601(2017)03-0229-09
