不同负荷运动对小鼠骨骼肌细胞凋亡的影响
2017-06-26岑人军花奇凯韦雪亮张文珍
岑人军,花奇凯,韦雪亮,张文珍
(1.广西大学体育学院,广西南宁 530004;2.广西医科大学第一附属医院,广西南宁 530004;3.广西医科大学附属口腔医院,广西南宁 530004)
不同负荷运动对小鼠骨骼肌细胞凋亡的影响
岑人军1,花奇凯2,韦雪亮1,张文珍3
(1.广西大学体育学院,广西南宁 530004;2.广西医科大学第一附属医院,广西南宁 530004;3.广西医科大学附属口腔医院,广西南宁 530004)
探讨不同负荷运动对小鼠骨骼肌细胞凋亡及mTOR、Akt蛋白表达的影响。30只小鼠分为3组,依次为对照组(C)、大强度运动组(H)、力竭组(G)。对照组不做运动训练。大强度运动组(H)给予25 m/min的运动训练。力竭组(G)给予10 m/min的运动训练至力竭。6周运动训练结束后,取腓肠肌,TUNEL检测细胞凋亡情况。Western blot检测组织中Bcl-2、Bax、mTOR、Akt蛋白水平。双缩脲法检测丙二醛(MDA)含量。黄嘌呤氧化酶法检测SOD活性。结果表明,大强度运动组(H)和力竭组(G)细胞凋亡指数均高于对照组(C),大强度运动组(H)比力竭组(G)细胞凋亡指数高,大强度运动组(H)和力竭组(G)Bax蛋白水平均高于对照组(C);大强度运动组(H)Bax水平高于力竭组(G),大强度运动组(H)和力竭组(G)Bcl-2、mTOR、p-Akt蛋白水平均低于对照组(C),大强度运动组(H)Bcl-2、mTOR、p-Akt蛋白水平低于力竭组(G);大强度运动组(H)和力竭组(G)Akt蛋白水平与对照组(C)相比没有明显变化;大强度运动组(H)和力竭组(G) MDA含量均高于对照组(C),大强度运动组(H)MDA含量高于力竭组(G);大强度运动组(H)和力竭组(G) SOD活性均低于对照组(C),大强度运动组(H)SOD活性高于力竭组(G);大强度运动和力竭运动均会引起骨骼肌细胞的凋亡,且大强度运动比力竭运动更易引起骨骼肌细胞凋亡。
骨骼肌细胞;不同负荷运动;凋亡;影响
运动训练与体育竞技密不可分。运动训练对机体组织器官的作用也越来越成为研究的热点。运动疲劳引发机体氧化,损害机体的组织器官[1]。特别是超过机体承受的大强度超负荷的运动训练会引发骨骼肌细胞的凋亡[2]。力竭运动引起的肌肉酸痛、骨骼肌细胞凋亡是机体运动能力下降的重要标志[3]。研究运动对骨骼肌细胞凋亡是目前研究的热点。
有研究表明,运动能力下降与骨骼肌组织中的MDA水平和SOD活性有关[4]。本研究以小鼠为研究对象,分别经过大强度运动和力竭运动训练后,检测骨骼肌细胞的凋亡情况,以期为进一步研究运动对骨骼肌细胞凋亡的作用机制提供理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 30只9周龄雄性Balb/c小鼠购自于广西医科大学动物实验室,体重18 g~22 g。
1.1.2 主要试剂 Bcl-2单克隆抗体、Bax单克隆抗体、mTOR单克隆抗体、Akt单克隆抗体、p-Akt单克隆抗体均购自于美国CTS;BCA蛋白浓度检测试剂盒购自于北京鼎国生物技术有限公司;SOD活性检测试剂盒购自于北京博迈斯科技发展有限公司;MDA含量检测试剂盒购自于北京森贝伽生物科技有限公司。
1.2 方法
1.2.1 试验分组及运动训练 30只小鼠分为3组,每组10只,依次为对照组(C)、大强度运动组(H)、力竭组(G)。大强度运动组和力竭组在实验前分别进行7 d的适应性训练,跑台速度为10 m/min,每天运动1次,每次10 min。适应性训练后间隔2 d后开始实验。对照组不进行运动训练。大强度运动组小鼠在10℃坡度适应性训练3 min后,在前4周,以25 m/min的速度负荷运动,运动时间为30 min。从第5周至第6周,速度调整为30 m/min,运动时间为60 min。力竭组运动方式与大强度运动组相同,速度为10 m/min,坡度为10℃至力竭,每天1次,持续6周。实验动物均在室温为22℃~26℃的环境中饲养,自由饮食。6周后,运动结束1 h,取腓肠肌,随机分为两部分,一部分制作切片,一部分做Western blot及MDA含量、SOD活性检测。
1.2.2 小鼠骨骼肌细胞凋亡指数测定 分别取各组小鼠腓肠肌制作切片,经HE染色后,采用TUNEL法检测细胞凋亡情况。切片脱蜡水合后,加入蛋白酶K工作液,放置于室温下反应30 min后,用PBS洗涤两次,放在封闭液中封闭10 min,滴加TdT酶反应液,加盖玻片,放在37℃孵育1 h,PBS洗涤后,加Streptavidin-HRP工作液,避光孵育30 min,PBS洗涤后,加入DAB显示液,苏木素复染后,显微镜下观察细胞。凋亡的细胞被染为棕褐色或者棕色,未发生凋亡的细胞为绿色。计算细胞凋亡指数(AI)。AI=(凋亡细胞数/细胞总数)×100%。
1.2.3 Western blot检测组织中Bcl-2、Bax、mTOR、Akt蛋白水平 取腓肠肌组织,剪碎后,加入含有PMSF的裂解液,取2 ml裂解液加入到匀浆器中,放置于冰上研磨成粉末。取匀浆液转移至离心管中,12 000 r/min离心10 min,吸取蛋白上清液,按照BCA蛋白浓度检测试剂盒说明书检测提取的蛋白浓度。取蛋白样品与Loading buffer充分混合后,放在100℃的孵育器煮沸5 min。取变性蛋白样品加入SDS-PAGE凝胶中,80 V电泳30 min后,调整电压为120 V至电泳结束。取出蛋白凝胶,在4℃转膜1.5 h,将蛋白转印至PVDF膜上。分别与一抗(500倍稀释)、二抗(1 000倍稀释)反应后,滴加显色液,曝光后,以GAPDH为内参,分析蛋白表达情况。
1.2.4 双缩脲法检测MDA含量 取腓肠肌组织,加入含有预冷的匀浆缓冲液的匀浆器中,研磨5 min后,加入适量的生理盐水,制备含有骨骼肌组织为10%的匀浆液。用MDA含量检测试剂盒检测MDA含量,计算MDA含量。
MDA含量(nmol/L/g)=10 nmol/L/g×样品稀释倍数×(测定管吸光度-空白管吸光度)/(标准管吸光度-标准空白吸光度)
1.2.5 黄嘌呤氧化酶法检测SOD活性 取腓肠肌组织,根据SOD活性检测试剂盒检测组织中的SOD活性。550 nm处检测吸光度。如果样品中含有SOD,SOD会抑制超氧阴离子的氧化为亚硝酸盐。
SOD活性(U/g)=2×稀释倍数×(对照管吸光度-测定管吸光度)/对照管吸光度
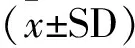
2 结果
2.1 细胞凋亡指数检测结果
各组小鼠运动训练后,取腓肠肌组织,TUNEL法检测细胞凋亡指数。结果显示,大强度运动组(H)和力竭组(G)细胞凋亡指数均高于对照组(C),差异极显著(P<0.01)。大强度运动组(H)凋亡指数明显高于力竭组(G)(图1)。
C.对照组;H.大强度运动组;G.力竭组;a.P<0.01 vs 对照组;b.P<0.01 vs 大强度运动组
C.Control group; H.High intensity exercise group; G.Exhaustive group; a.P<0.01 vs control group;b.P<0.01 vs high intensity exercise group
图1 骨骼肌细胞凋亡指数检测结果
Fig.1 Apoptosis index of skeletal muscle cells
2.2 Bcl-2、Bax蛋白水平检测结果
各组小鼠腓肠肌组织经蛋白提取,Western blot检测组织中Bcl-2、Bax蛋白水平。结果显示,大强度运动组(H)和力竭组(G)Bax蛋白水平均高于对照组(C),差异极显著(P<0.01)。大强度运动组(H)Bax蛋白水平明显高于力竭组(G),差异极显著(P<0.01)。大强度运动组(H)和力竭组(G)Bcl-2蛋白水平均低于对照组(C),差异极显著(P<0.01)。大强度运动组(H)Bcl-2蛋白水明显低于力竭组(G),差异极显著(P<0.01)(图2)。
2.3 mTOR、Akt蛋白水平检测结果
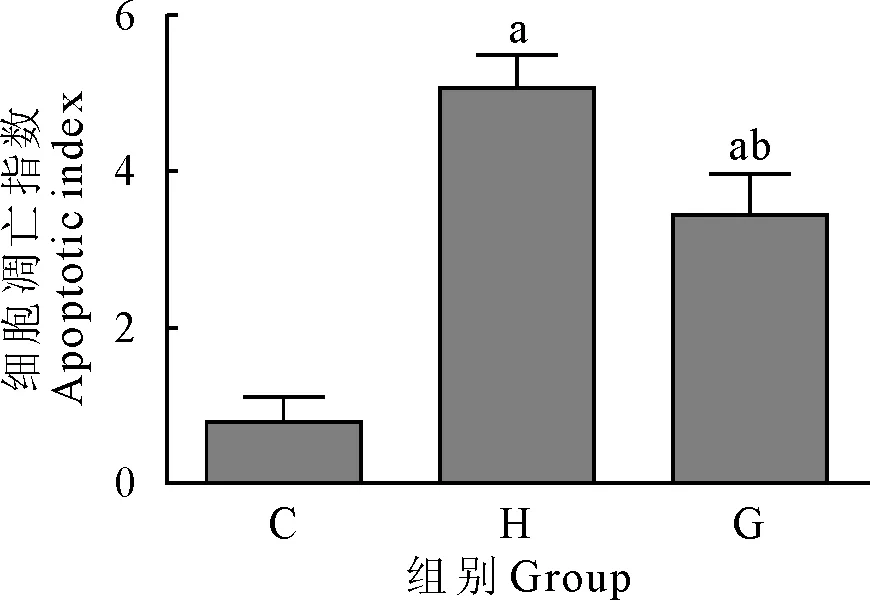
各组小鼠腓肠肌组织经蛋白提取,Western blot检测组织中mTOR、Akt蛋白水平。结果显示,大强度运动组(H)和力竭组(G)mTOR、p-Akt蛋白水平均低于对照组(C),差异极显著(P<0.01)。大强度运动组(H)mTOR、p-Akt蛋白水平均低于力竭组(G),差异极显著(P<0.01)。大强度运动组(H)和力竭组(G)Akt蛋白水平与对照组(C)相比没有明显变化(图3)。
2.4 MDA含量检测结果
取各组小鼠腓肠肌组织,检测组织中MDA含量。结果显示,大强度运动组(H)和力竭组(G) MDA含量均高于对照组(C),差异极显著(P<0.01)。大强度运动组(H)MDA含量高于力竭组(G),差异极显著(P<0.01)(图4)。

C.对照组;H.大强度运动组;G.力竭组;A.Western blot结果图;B.蛋白表达率;a.P<0.01 vs 对照组;b.P<0.01 vs 大强度运动组
C.Control group; H.High intensity exercise group;G.Exhaustive group;A.Western blot results ;B.Protein expression rate;a.P<0.01 vs control group;b.P<0.01 vs high intensity exercise group
图2 Bcl-2、Bax蛋白水平检测结果
Fig.2 Detection results of Bcl-2 and Bax protein levels
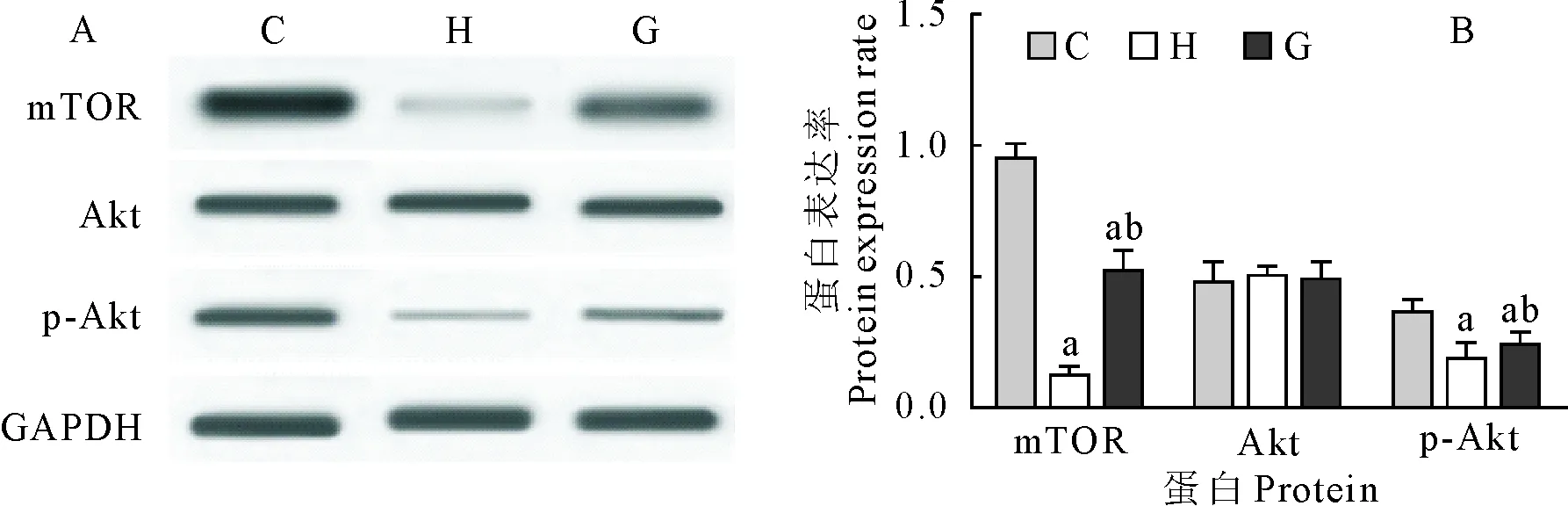
C.对照组;H.大强度运动组;G.力竭组;A.Western blot结果图;B.蛋白表达率;a.P<0.01 vs 对照组;b.P<0.01 vs 大强度运动组
C.Control group; H.High intensity exercise group;G.Exhaustive group;A.Western blot results ;B.Protein expression rate;a.P<0.01 vs control group;b.P<0.01 vs high intensity exercise group
图3 mTOR、Akt蛋白水平检测结果
Fig.3 Detection results of mTOR and Akt protein levels
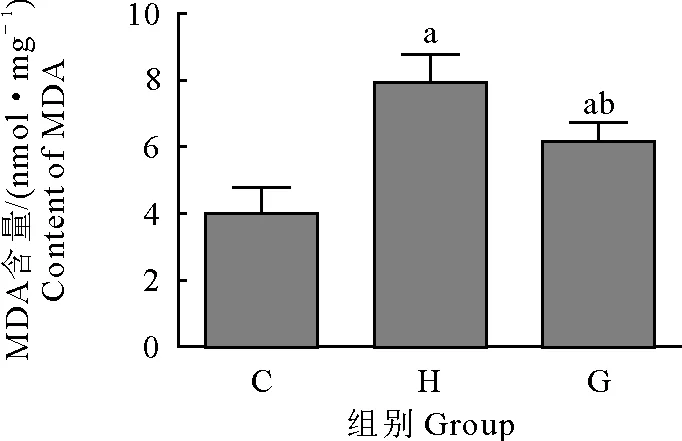
C.对照组;H.大强度运动组;G.力竭组;aP<0.01 vs 对照组;bP<0.01 vs 大强度运动组
C.Control group; H.High intensity exercise group;G.Exhaustive group;aP<0.01 vs control group;bP<0.01 vs high intensity exercise group
图4 MDA含量检测结果
Fig.4 Detection results of MDA level
2.5 SOD活性检测结果
取各组小鼠腓肠肌组织检测 SOD活性。结果显示,大强度运动组(H)和力竭组(G) SOD活性均低于对照组(C),差异极显著(P<0.01)。大强度运动组(H)SOD活性高于力竭组(G),差异极显著(P<0.01)(图5)。
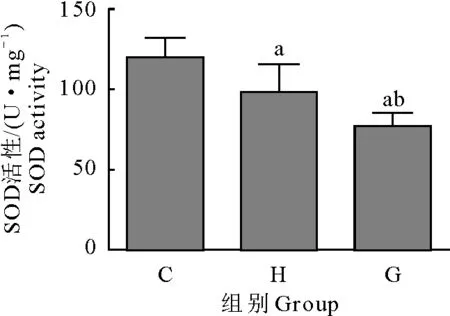
C.对照组;H.大强度运动组;G.力竭组;aP<0.01 vs 对照组;bP<0.01 vs 大强度运动组
C.Control group; H.High intensity exercise group;G.Exhaustive group;aP<0.01 vs control group;bP<0.01 vs high intensity exercise group
图5 SOD活性检测结果
Fig.5 Detection results of SOD level
3 讨论
不同运动方式和运动时间对骨骼肌细胞凋亡的影响不同。在一定条件下,肌肉组织中细胞凋亡增多,临近的正常的肌细胞能够吞噬肌细胞产生的凋亡小体[5]。纯种马经过3个月的跑台训练后,运用TUNEL法检测了组织中肌细胞的凋亡情况,发现运动后的肌细胞凋亡率高于不训练的纯种马[6]。大鼠力竭运动后,大鼠的骨骼肌细胞凋亡明显增多[7]。不同负荷的游泳训练能够损害大鼠骨骼肌细胞的微细结构,影响大鼠的运动能力[8]。本研究将试验分为三组,经过大强度运动和力竭运动后,取各组小鼠的腓肠肌,通过TUNEL法检测骨骼肌组织中骨骼肌细胞的凋亡情况,结果发现,大强度运动和力竭运动均能引起骨骼肌细胞的凋亡。且大强度运动对骨骼肌细胞凋亡的促进作用更为显著。
Bax和Bcl-2都属于Bcl-2蛋白家族成员。在细胞凋亡过程中发挥不同的作用。Bcl-2和Bax广泛存在于生物体细胞中,在线粒体膜、细胞膜、内质网膜中广泛表达。Bcl-2具有抑制细胞凋亡的作用,属于抗凋亡基因,而Bax属于促凋亡基因,在细胞凋亡过程中发挥促进作用[9]。Bcl-2参与调控细胞的增殖,发挥琥珀酸脱氢酶活性,能够延长细胞的寿命,抑制脂质的氧化[10]。大鼠在夜间经过轮形笼跑步后,大鼠骨骼肌细胞出现凋亡,检测大鼠骨骼肌中Bcl-2水平,结果发现,肌纤维中的Bcl-2水平下调[11]。大鼠经过8周的跑台运动后,骨骼肌细胞凋亡明显,且Bax水平升高,Bcl-2水平下降[12]。经过长期反复力竭运动后,骨骼肌细胞抗凋亡能力减弱,引发骨骼肌损伤[13]。研究表明,细胞凋亡与氧自由基密切相关。细胞内的氧自由基能够促进细胞凋亡,且这种促进关系具有剂量依赖的特点[14]。SOD活性和MDA含量能够间接反应组织器官中氧自由基的水平。SOD的活性减弱,细胞凋亡增多。而MDA含量增加,细胞凋亡增多。当MDA含量大幅度增加,而SOD活性大幅度降低时,则可能出现细胞坏死[15]。
雷帕霉素靶蛋白(mTOR)属于丝/苏氨酸蛋白激酶,分子质量约为289 ku。mTOR蛋白是一种保守蛋白,人和鼠的mTOR蛋白有95%的氨基酸是一致的[16-18]。丝氨酸/苏氨酸蛋白激酶(Akt)广泛存在于生命机体中,在细胞生长、凋亡过程中发挥重要作用[19]。运动对骨骼肌组织中mTOR和Akt的影响不一。有研究表明,渐增负荷运动能够促进老年小鼠骨骼肌内mTOR的活化,改善骨骼肌的质量[20]。
本研究中,Western blot检测了各组小鼠腓肠肌组织中Bcl-2、Bax、mTOR、Akt蛋白水平。结果发现,大强度运动和力竭运动均能引起Bax蛋白表达上调,抑制Bcl-2蛋白的表达。而大强度运动和力竭运动小鼠骨骼肌组织中mTOR、p-Akt表达下调。运动后的小鼠SOD活性降低,MDA含量增加。综上所述,大强度运动和力竭运动能够引起小鼠骨骼肌细胞凋亡,这可能与mTOR、Akt蛋白表达及氧自由基有关。这为进一步研究运动对骨骼肌细胞凋亡的作用机制奠定了基础。
[1] Jaiswal N,Maurya C K,Arha D,et al.Fructose induces mitochondrial dysfunction and triggers apoptosis in skeletal muscle cells by provoking oxidative stress[J].Apoptosis,2015,20(7):930-947.
[2] Sciorati C,Rigamonti E,Manfredi A A,et al.Cell death,clearance and immunity in the skeletal muscle[J].Cell Death & Differentiation,2016,23(6):927-937.
[3] Harding R L,Clark D L,Halevy O,et al.The effect of temperature on apoptosis and adipogenesis on skeletal muscle satellite cells derived from different muscle types[J].Physiol Reports,2015,3(9):e12539.
[4] Cheema N,Herbst A,McKenzie D,et al.Apoptosis and necrosis mediate skeletal muscle fiber loss in age-induced mitochondrial enzymatic abnormalities[J].Aging Cell,2015,14(6):1085-1093.
[5] Deshmukh A S,Murgia M,Nagaraj N,et al.Deep proteomics of mouse skeletal muscle enables quantitation of protein isoforms,metabolic pathways,and transcription factors[J].Mol Cell Proteomics,2015,14(4):841-853.
[6] Shelar S B,Narasimhan M,Shanmugam G,et al.Disruption of nuclear factor (erythroid-derived-2)-like 2 antioxidant signaling:a mechanism for impaired activation of stem cells and delayed regeneration of skeletal muscle[J].FASEB J,2016,30(5):1865-1879.
[7] Favero G,Rodella L F,Nardo L,et al.A comparison of melatonin and β-lipoic acid in the induction of antioxidant defences in L6 rat skeletal muscle cells[J].AGE,2015,37(4):1-10.
[8] Flück M,von Allmen R S,Ferrié C,et al.Protective effect of focal adhesion kinase against skeletal muscle reperfusion injury after acute limb ischemia[J].Eu J Vasc Endovasc Surg,2015,49(3):306-313.
[9] Narasimhan K K S,Paul L,Sathyamoorthy Y K,et al.Amelioration of apoptotic events in the skeletal muscle of intra-nigrally rotenone-infused Parkinsonian rats byMorindacitrifolia-up-regulation of Bcl-2 and blockage of cytochrome c release[J].Food Function,2016,7(2):922-937.
[10] Varanita T,Soriano M E,Romanello V,et al.The OPA1-dependent mitochondrial cristae remodeling pathway controls atrophic,apoptotic,and ischemic tissue damage[J].Cell Metab,2015,21(6):834-844.
[11] Schöneich C,Dremina E,Galeva N,et al.Apoptosis in differentiating C2C12 muscle cells selectively targets Bcl-2-deficient myotubes[J].Apoptosis,2014,19(1):42-57.
[12] Yu A P,Pei X M,Sin T K,et al.Acylated and unacylated ghrelin inhibit doxorubicin-induced apoptosis in skeletal muscle[J].Acta Physiol,2014,211(1):201-213.
[13] 张学林,高晓娟,史冀鹏,等.离心运动引起骨骼肌过度使用损伤机理研究[J].中国运动医学杂志,2013,31(12):1064-1074.
[14] 闵 柱,刘文杰,耿 潇,等.原花青素干预大负荷运动大鼠腓肠肌相关凋亡蛋白的表达[J].中国组织工程研究,2013,17(2):309-314.
[15] García-Prat L,Sousa-Victor P,Muoz-Cánoves P.Functional dysregulation of stem cells during aging:a focus on skeletal muscle stem cells[J].FEBS J,2013,280(17):4051-4062.
[16] 张丽勇.AKT-mTOR 信号通路在大鼠椎间盘软骨终板细胞自然退变中的意义[J].中国老年学杂志,2016,36(15):3651-3653.
[17] Sandri M,Barberi L,Bijlsma A Y,et al.Signalling pathways regulating muscle mass in ageing skeletal muscle.The role of the IGF1-Akt-mTOR-FoxO pathway[J].Biogerontology,2013,14(3):303-323.
[18] Jaafar R,De Larichaudy J,Chanon S,et al.Phospholipase D regulates the size of skeletal muscle cells through the activation of mTOR signaling[J].Cell Commun Sign,2013,11(1):1-15.
[19] Miniaci M C,Bucci M,Santamaria R,et al.CL316,243,a selective β3-adrenoceptor agonist,activates protein translation through mTOR/p70S6K signaling pathway in rat skeletal muscle cells[J].Pflugers Archiv-Euro J Physiol,2013,465(4):509-516.
[20] Seldin M M,Lei X,Tan S Y,et al.Skeletal muscle-derived myonectin activates the mammalian target of rapamycin (mTOR) pathway to suppress autophagy in liver[J].J Biol Chem,2013,288(50):36073-36082.
Effect of Different Load Exercises on Skeletal Muscle Cell Apoptosis in Mice
CEN Ren-jun1,HUA Qi-kai2,WEI Xue-liang1,ZHANG Wen-zhen3
(1.CollegeofPhysicalEducationofGuangxiUniversity,Nanning,Guangxi,530004,China;2.TheFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning,Guangxi,530004,China;3.StomatologicalHospitalAffiliatedtoGuangxiMedicalUniversity,Nanning,Guangxi,530004,China)
To investigate the effect of different load exercise on the apoptosis of skeletal muscle cells and the expression of Akt and mTOR protein in mice,30 mice were divided into three groups,which were control group (C),high intensity exercise group (H),and exhaustive exercise group (G).The control group did not exercise training.High intensity exercise group (H) gave 25m/min exercise training.Exhaustive exercise group (G) was given 10m/min exercise training to exhaustion.After 6 weeks of exercise,the gastrocnemius muscle was taken to detect the apoptosis by TUNEL.Detection of Bcl-2,Bax,mTOR,Akt protein levels in the organization by Western blot.Content of malondialdehyde (MDA) was detected by biuret method.SOD activity was detected by xanthine oxidase method.The apoptosis indexes of high intensity exercise group (H) and exhaustion group (G) were higher than that of control group (C).The apoptosis index of high intensity exercise group (H) was higher than that of exhaustive group (G).High intensity exercise group (H) and exhaustion group (G) Bax protein levels were higher than the control group (C).High intensity exercise group (H) Bax level was higher than the exhaustive group (G).The levels of Bcl-2,mTOR and p-Akt in the high intensity exercise group (H) and the exhaustion group (G) were lower than those in the control group (C).High intensity exercise group (H) Bcl-2,mTOR,p-Akt protein levels were lower than the exhaustive group (G).High intensity exercise group (H) and (G) Akt protein levels had no significant change compared with the control group (C).High intensity exercise group (H) and exhaustion group (G) MDA contents were higher than the control group (C).The content of MDA in high intensity exercise group (H) was higher than that in exhaustion group (G).SOD activities in high intensity exercise group (H) and exhaustion group(G) were lower than that in the control group (C).High intensity exercise group (H) SOD activity was lower than the exhaustive group (G).High intensity exercise and exhaustive exercise could induce the apoptosis of skeletal muscle cells,and high intensity exercise exercise is more likely to cause apoptosis in skeletal muscle.
skeletal muscle cell; different load exercise; apoptosis; influence
2016-11-09
岑人军(1978-),男,广西北海人,讲师,硕士,主要从事体育运动训练、运动医学与运动人体科学。
S852.2
A
1007-5038(2017)06-0052-05
