刺糖对酒精性肝病TNF-α和TLR4表达及病理变化的影响
2017-06-26库尔班江麦麦提敏艾力艾尔肯蒋志惠张小莺米克热木沙衣布扎提
库尔班江·麦麦提敏,艾力·艾尔肯,蒋志惠,张小莺,,米克热木·沙衣布扎提*
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830052;2.西北农林科技大学动物医学院,陕西杨凌 712100)
刺糖对酒精性肝病TNF-α和TLR4表达及病理变化的影响
库尔班江·麦麦提敏1,艾力·艾尔肯1,蒋志惠2,张小莺1,2,米克热木·沙衣布扎提1*
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830052;2.西北农林科技大学动物医学院,陕西杨凌 712100)
探讨刺糖对酒精性肝病(Alcoholic liver disease, ALD)小鼠肝组织TNF-α和TLR4表达及组织病理变化的影响。将42只小鼠随机分成空白组、模型组、水飞蓟宾阳性组、刺糖高、中、低剂量组。模型组以500 mL/L酒精造模,空白对照组(15 mL/kg 生理盐水)、刺糖高、中、低(600、300、150 mg/kg)、水飞蓟宾(300 mg/kg)灌胃,每日药物处理后用500 mL/L酒精(10 mL/kg)灌胃2次(分别为药物处理后2 h和药物处理后10 h),连续3 d,末次灌胃酒精12 h后,取肝脏提取mRNA,制备肝脏标本进行HE染色,实时荧光定量PCR检测肝组织TNF-α和TLR4 mRNA表达。结果表明,与模型组相比,小鼠肝脏中TNF-α和TLR4 mRNA表达水平明显降低。各刺糖给药组均抑制酒精引起的TNF-α和TLR4基因 mRNA表达水平的增强。刺糖高、中、低剂量组均能够改善酒精所引起的肝脏病理变化。可推出刺糖对酒精引起的小鼠肝损伤有一定的保护作用,其作用机制可能与抑制TNF-α和TLR4基因mRNA表达有关。
刺糖;肿瘤坏死因子-α;Toll样受体4;病理变化;酒精性肝损伤
酒精性肝病(ALD)已经成为世界上一个主要的健康问题,据世界卫生组织的调查,全球所有死亡人数的5.9%由有害使用酒精而起[1]。过量饮酒一直被认为是肝脏疾病发展的一个重要因素。目前,研究发现酒精性肝损伤的机制途径很多,相关损伤途径包括酒精代谢产物乙醛毒性、炎症反应损伤、氧化应激损伤、细胞线粒体功能障碍、内毒素(LPS)损伤及营养不良等,其中炎症反应性损伤在ALD的发生发展过程中起到了至关重要的作用[2]。酒精进入体内后使LPS入血而激活Kupffer细胞,并产生大量的肿瘤坏死因子-α(TNF-α)等炎症因子,导致肝损伤[3]。Toll样受体(Toll-like receptors, TLRs)是一类模式识别受体, 在细胞活化信号的传导信号中起重要作用,可直接识别某些病原微生物或其产物特定的分子结构,在急慢性肝炎、酒精性肝病和非酒精性肝病等各种肝脏疾病的发生中起重要作用[4]。现今为止,在哺乳动物中已发现13种TLR超基因家族成员,Toll样受体4(TLR4)为其中重要的一个[5]。近年来的研究显示,TLR4是各种肝脏疾病发生肝脏炎症的关键介质[6],它可以诱导各种不同细胞因子的合成与释放继而引发炎症反应造成肝脏损伤,导致氧化应激并产生和促进炎症细胞因子产生,如TNF-α、IL-6等,这些炎症因子在急性酒精性肝损伤的病理发展过程中具有重要作用[3,7]。尽管有许多药物可以治疗ALD,但均有疗效不确定及存在不同程度毒副作用,因此研制开发高效低毒防治ALD的天然药物已成为科学领域研究的热点。刺糖(terenjiwil)是维吾尔民间药用植物骆驼刺叶分泌的甜蜜,黄棕色粉末状物质。本草纲目记载刺糖为上品无毒、解热药、解毒中药。它是一种重要的民间药用植物,已被用于发汗、利尿、祛痰、溃疡[8]和肝脏损害[9]的治疗。刺糖的主要成分为多糖,目前已表明多糖具有促进肝脏解毒作用,提高肝细胞内肝糖原的含量,同时还可以抑制肝糖原的合成,有利于肝细胞的恢复。试验研究表明,刺糖具有较强的还原能力,以及良好的自由基清除能力[10]。根据这些结果和民族药学记载,我们推测刺糖可能对ALD有保护作用。本研究旨在探讨刺糖对酒精过量引起的肝损伤的影响并探讨其可能的作用机制。
1 材料与方法
1.1 材料
1.1.1 主要试剂 苏木精和伊红,北京索莱宝科技有限公司;多聚甲醛,天津市科密欧化学试剂有限公司;中性树胶,中国上海标本模型厂;无水乙醇、二甲苯,成都市科龙化工试剂厂;总RNA 提取试剂盒,天根生化科技(北京)有限公司;2×TaqMaster Mix,HiScript QSelect RT SuperMix for qPCR,AceQ qPCR SYBR Green Master Mix,诺唯赞生物技术有限公司。
1.1.2 主要仪器 LGJ-12 型冷冻干燥机,北京松源华兴科技发展有限公司; RE-52AA 型旋转蒸发仪,上海亚荣生化仪器厂; SHB-Ⅲ型循环水式多用真空泵,郑州长城科工贸有限公司; iQ5 实时荧光定量PCR仪,美国Bio-Rad;Leica RM 2235 轮转式切片机,德国Leica公司;显微镜,尼康仪器有限公司;FRESCO17 高速冷冻离心机,美国Thermo公司。
1.1.3 实验动物 清洁级昆明种小鼠,雌性,体重28 g±2 g,购买于第四军医大学实验动物中心。饲养于西北农林科技大学动物医学院实验动物中心,自由进食和饮水。试验前适应性饲养1周。
1.2 方法
1.2.1 植物材料及制备 刺糖(采摘自吐鲁番盆地)购买于新疆维吾尔自治区维吾尔医医院。将10 g刺糖放入加有200 mL蒸馏水的圆底烧瓶中,煮沸2 h,过滤,残渣加100 mL蒸馏水再提取,最后两次滤液混合,随后集中在旋转真空蒸发器中浓缩,浓缩液冷冻后放入冷冻干燥机(-65 ℃)中进行冷冻干燥,干燥提取物存储在4 ℃冰箱备用。
1.2.2 分组及给药 取42只健康昆明雌性小鼠,随机分为6个组,每组7只小鼠。分别为:①正常对照组(NC组),②用500 mL/L酒精处理的模型组(ALC组),③酒精和低剂量刺糖组(AHL+ALC组),④酒精和中剂量刺糖组(AHM+ALC组),⑤酒精和高剂量刺糖组(AHH+ALC组),⑥酒精处理水飞蓟宾组(SL+ALC组)。注:上述各组酒精剂量为10 mL/kg,低剂量刺糖为150 mg/kg,中剂量刺糖为300 mg/kg,高剂量刺糖为600 mg/kg。 给药后,小鼠称重,采集血液样本进行生化分析,解剖分离肝脏。
1.2.3 实时荧光定量PCR测定mRNA的表达 肝组织标本用天根RNA提取试剂盒,提取总mRNA, HiScriptTM RT Super Mix for qPCR试剂盒要求,逆转录成cDNA。采用SYBER Green嵌合荧光法,实时荧光定量PCR仪扩增目的基因和内参基因。按照Vazyme实时荧光定量PCR试剂盒说明加样。以β-actin作为内参照,设计引物序列如下。TNF-α:上游为5′ATTGAGCACAGGCATAAAGAT3′,下游为5′TCTAGTTCTGGTTTTGAACAGTG 3′;片段长度为715 bp。TLR4:上游为5′ GCACTGTTCTTCTCCTGCC3′,下游为5′ GTTTCCTGTCAGTATCAAG3′;片段长度为293 bp。内参照:β-actin:上游为5′ GGCTCCCAGCACCATGAA3′,下游为5′ GCCACCGATCCACACAGAGT3′;片段长度为185 bp。
结果判断: 公式1: △循环阈值(cycle threshold, Ct)= 样品Ct均值-内参照Ct均值,公式2: △△Ct = △Ct -(随机阴性对照样品Ct均值-该样品内参照Ct均值), 以2-△△Ct表示样品中目的基因初始cDNA相对表达量。mRNA的相对表达用公式2来控制基因的靶基因的比率(ΔΔCT),ΔΔCt=control (CtTarget-Ctβ-actin)-treatment(CtTarget-Ctβ-actin)。
1.2.4 病理组织切片观察 取肝脏左叶浸泡于40 mL/L多聚甲醛溶液固定48 h,石蜡包埋切片,进行苏木精-伊红(HE)染色,显微镜镜检,拍照成像,观察肝组织病理改变。
1.2.5 统计分析 数值以 mean ± SD 表示。差异显著性通过 SPSS 19.0 软件进行单因素方差分析,t 检验比较各试验组与对照组间的差异,P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 刺糖对小鼠酒精诱导的肝脏TNF-α和TLR4 mRNA表达水平的影响
实时荧光定量PCR结果表明,模型组小鼠的肝脏中TNF-α和TLR4 mRNA表达水平显著增加,作为比较对照组5.2±0.54和5.13±0.48(表1)。各刺糖给药组均抑制酒精所致的TNF-α和TLR4基因 mRNA表达水平的增强。特别是AHH和AHM刺糖给药组显著性降低TNF-α和TLR4 mRNA的表达,TNF-α mRNA表达水平分别为1.48±0.30和1.65±0.65,TLR4 mRNA的表达水平分别为2.81±0.28和3.05±0.06(P< 0.01)。
2.2 刺糖对酒精引起的肝组织病理变化的影响
400倍光镜下观察,空白对照组肝脏组织结构完整,细胞核大、圆而清晰,有的细胞是双核的,肝小叶轮廓清晰,肝细胞排列整齐(图1A)。酒精所灌胃的模型组肝脏出现了显著的病理变化,肝细胞排列紊乱,肝小叶结构破坏。肝小叶界限不清,细胞界限及胞核模糊不清,胞浆内出现弥漫性大小不等的脂肪空泡,并出现坏死和炎性细胞浸润(图1B)。各治疗组损伤有不同程度的减轻,以中、高剂量组较为明显。低剂量组肝细胞核出现少量的双核形式,但细胞轻微水肿(图1C),中、高剂量药组和阳性药物对照组大部分肝细胞结构排列变得紧密,肝细胞坏死程度减小,肝细胞形状基本规则,出现双细胞核现象,与正常组相比无显著性病理变化(图1D,E和F)。结果表明,刺糖能够明显减轻酒精导致的肝组织损伤。图中箭头所指为双核细胞; 圈圈中细胞浆疏松呈空泡样。A为正常对照组,肝细胞呈多面形,细胞核大而圆,有的细胞为双核;B为模型组,肝细胞浆疏松呈空泡样; C为刺糖低剂量(150 mg/kg)+ 酒精组,伴有少量肝细胞水肿,胞浆疏松呈空泡样病变;D为刺糖中剂量(300 mg/kg)+ 酒精组,大量肝细胞恢复双核,肝血窦位于肝板间;E为刺糖高剂量(600 mg/kg)+ 酒精组,肝细胞出现双核,与正常组无差异;F为阳性对照组,肝细胞出现双核,与正常组无差异。

表1 刺糖对小鼠酒精诱导的肝脏TNF-α和TLR4 mRNA表达水平的影响
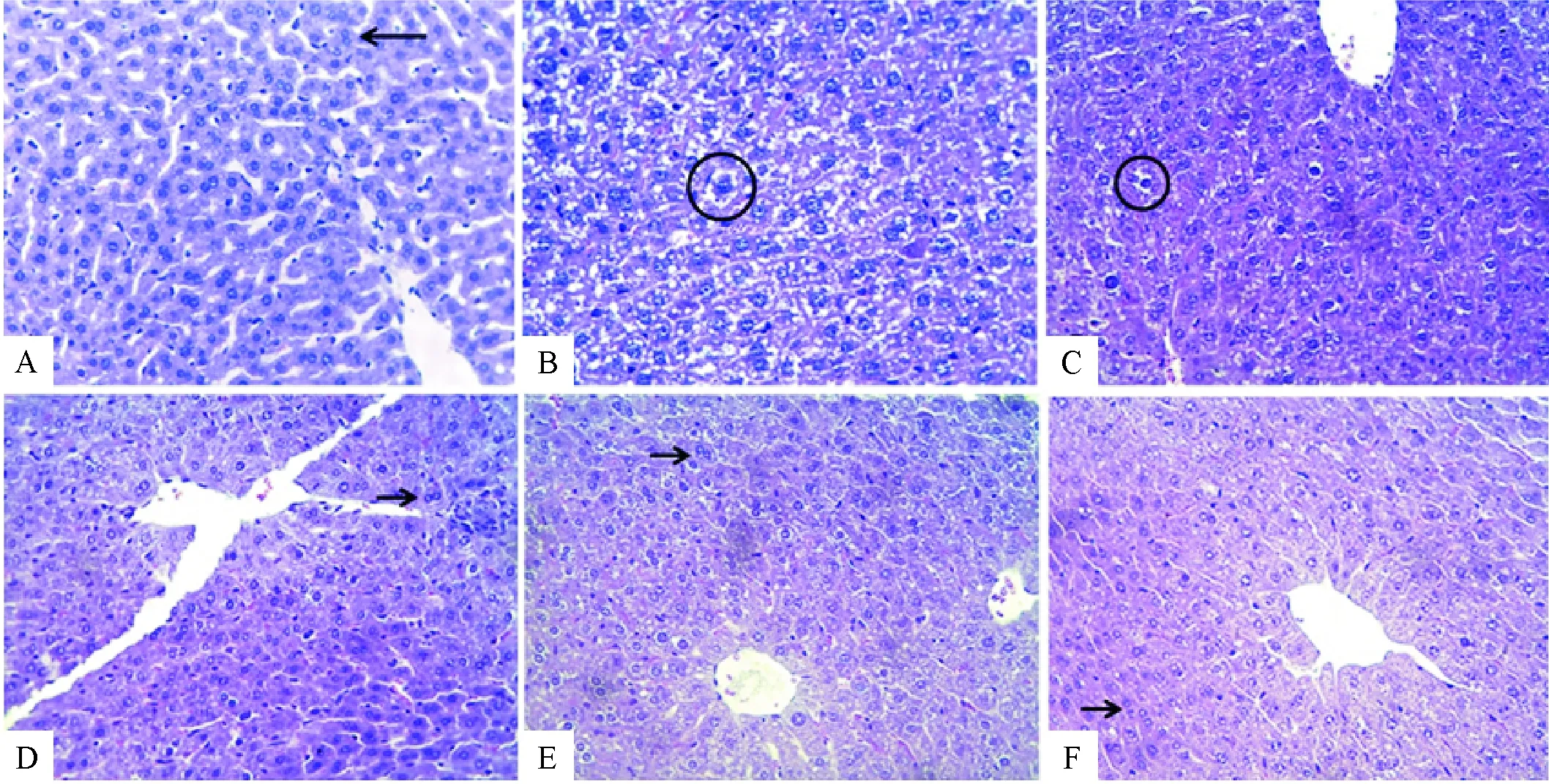
图1 刺糖对酒精引起的小鼠肝脏病理变化的影响
Fig.1 Effect ofAlhagihoney on histopathological lesions in the liver of mice after alcohol induction
3 讨论
本研究中酒精性肝损伤模型的小鼠出现严重的酒精代谢导致的肝损伤,显示肝组织病理变化及炎症因子TNF-α在肝脏中的表达明显增加,提示酒精性肝损伤模型成功建立。ALD作为全世界范围内常见的肝病之一,广泛受到学术界的关注,其最初为急性炎症,然后发展到脂肪肝,酒精性肝炎,最终导致肝纤维化和肝硬化。长期过量饮酒能够造成酒精中毒,但是目前还没有确切的发病机制及有效治疗方法,因此,ALD预防和治疗药物及策略研究成为研究的热点[11]。刺糖是野生骆驼刺分泌的一种天然果糖,是维吾尔医用于治病的上品,主要成分为多聚糖,多糖有利于肝细胞的恢复[12],研究表明多糖可能有肝脏保护作用[13]。
TLR4通路促进TNF-α的释放,然后增加促炎细胞因子和炎症[14]。LPS-TLRs信号通路的下游基因应答产物中,TNF-α主要由活化的单核细胞和巨噬细胞产生,促进白细胞聚集和活化,释放多种炎症介质,引起一系列炎性损伤。研究证实,TNF-α在急性炎症所致的肝衰竭的发病过程中发挥重要作用。酒精增加门静脉血液循环内毒素的水平,激活Kupffer细胞,从而导致关键细胞因子(包括TNF-α)的上调[15]。
本研究结果亦显示了TLR4在LPS信号转导中的重要作用。空白组仅有少量TLR4基因表达, 而模型小鼠肝组织TLR4基因表达量均明显增高。各组刺糖均能显著降低模型大鼠肝组织TLR4基因表达. 在降低TLR4表达方面, 高>中>低刺糖均可降低TLR4的基因表达, 阻止信号的进一步传递。降低内毒素信号传导的效率, 减少炎症因子的产生和对肝细胞的损伤。此外,肝脏病理组织学检查显示,酒精模型组肝损伤比较明显,而刺糖组肝损伤明显减轻。上述结果表明,刺糖通过促进酒精代谢而能够显著降低TNF-α与TLR4 mRNA的表达水平,促进肝组织修复和肝细胞再生,从而对肝损伤产生有效保护作用。
[1] Organization W H. Global status report on alcohol and health 2014[J].Global Status Report Alcohol,2014,18(7):1-57.
[2] Kawaratani H, Tsujimoto T, Douhara A, et al. The effect of inflammatory cytokines in alcoholic liver disease[J].Mediators of Inflammation,2013,2013(3):4951-4956.
[3] Bukong T N, Iracheta-Vellve A, Saha B, et al. Inhibition of spleen tyrosine kinase activation ameliorates inflammation,cell death,and steatosis in alcoholic liver disease[J]. Hepatology, 2016,64(4):1057-1071.
[4] 张宇宏,赵一萍,赵启南,等. 霉变饲料中毒马不同组织中TLR1、TLR2、TLR4和TLR6 mRNA转录水平研究[J]. 动物医学进展,2014(4):25-28.
[5] 何 薇. Toll样受体4下游炎性因子在四氯化碳急性肝损伤和修复中的作用[D].安徽医科大学,2014.
[6] Sun P,Song S Z, Jiang S, et al. Salidroside regulates inflammatory response in Raw 264.7 macrophages via TLR4/TAK1 and ameliorates inflammation in alcohol binge drinking-induced liver injury[J]. Molecules,2016, 21(11):1490.
[7] Ezquer F,Bruna F,Calligaris S,et al. Multipotent mesenchymal stromal cells: A promising strategy to manage alcoholic liver disease[J]. World J Gastroenterol,2016,22(1):24-36.
[8] Sheweita S A,Mashaly S,Newairy A A,et al. Changes in oxidative stress and antioxidant enzyme activities in streptozotocin-induced diabetes mellitus in rats: Role ofAlhagimaurorumextracts[J].Oxid Med Cell Longevity,2016:5264064-5264064.
[9] Muhammad G,Hussain M A,Anwar F,et al.Alhagi: A plant genus rich in bioactives for pharmaceuticals[J]. Phytother Res,2014,29(1):1-13.
[10] 赵 津,李改茹,郑 杰,等. 维药刺糖抗氧化活性多糖筛选研究[J]. 新疆医科大学学报,2015(12):1479-1481.
[11] 梁树才,宗自卫,于海英,等.荷叶总黄酮对小鼠酒精肝损伤的保护作用[J].食品工业科技,2014(9):347-350. [12] 程煜凤. 维药刺糖化学成分的基础研究[D].新疆医科大学, 2010.
[13] 田长城,罗建平.霍山石斛中不同多糖组分的保肝活性[J].食品科学,2015,07:162-166.
[14] 段吉明.内毒素干预离体大鼠淋巴细胞后TLR4、NF-κB、TNF-α及IL-6的体外研究[D].山西医科大学,2014.
[15] Szabo G.Gut-liver axis in alcoholic liver disease[J].Gastroenterology,2015,148(1):30-36.
Effect ofAlhagiHoney on TNF-α, TLR4 Expressions and Pathological Lesions in Mice with Alcohol Induced Liver Disease
KUERBANJIANG-Maimaitimin1, AILI-Aierken1,JIANG Zhi-hui2, ZHANG Xiao-ying1, 2, MIKEREMU-Shayibuzhati1
(1.CollegeofVeterinaryMedicine,XinjiangAgriculturalUniversity,Urumqi,Xinjiang,830052,China; 2.CollegeofVeterinaryMedicine,NorthwestA&FUniversity,Yangling,Shaanxi,712100,China)
To investigate the effect ofAlhagihoney on TNF-α, TLR4 expressions and pathological lesions in mice with alcohol induced liver disease (alcoholic liver diseases, ALD), 42 mice were randomly divided into control group, model group, silybin positive group,Alhagihoney high, medium and low dose groups. A model of alcoholic liver disease was induced by gastric perfusion of alcohol, expect the control group, high, medium and low Alhagi honey (600 mg/kg, 300 mg/kg, 150 mg/kg), silymarin (300 mg/kg) gastric perfusion, after intragastric administration with 50% alcohol (10 mL/kg) 2 times a day, 3 consecutive days, the last 12 h after intragastric administration of alcohol, the liver extraction of RNA, liver tissue sections were stained with HE, real-time quantitative PCR was performed to detection TNF-α, TLR4 mRNA expressions in liver tissue. Results indicated that compared with the model group, the expressions of TNF-α and TLR4 mRNA levels in liver were significantly improved. EachAlhagihoney group inhibited alcohol induced mRNA expressions of TNF-α and TLR4. The high, medium and low dose groups were able to improve the alcohol-induced liver pathological lesions. This study showed thatAlhagihoney has a protective effect on alcohol induced liver injury, and its mechanism may be related to the inhibition of TNF-α and TLR4 mRNA expressions.
Alhagihoney; TNF-α; TLR4; pathological lesion; alcohol liver disease
2016-11-11
国家自然科学基金项目(31460677)
库尔班江·麦麦提敏(1991-),男(维吾尔族),新疆和田人,硕士,主要从事基础兽医学研究。 *通讯作者
S852.3
A
1007-5038(2017)06-0029-04
