海洋放线菌AM8发酵条件的优化及抑菌活性物质的初步研究
2017-06-26倪孟祥
张 莉,倪孟祥
(中国药科大学生命科学与技术学院,江苏 南京 210009)
海洋放线菌AM8发酵条件的优化及抑菌活性物质的初步研究
张 莉,倪孟祥*
(中国药科大学生命科学与技术学院,江苏 南京 210009)
以海洋放线菌AM8发酵液抑菌物质的活性为评价指标,采用单因素实验对海洋放线菌AM8的基础发酵培养基和发酵条件进行优化,并对抑菌活性物质进行了初步研究。确定最佳培养基为:胰蛋白胨17 g·L-1,大豆胨3 g·L-1,蔗糖2.5 g·L-1,NaCl 5 g·L-1,K2HPO42.5 g·L-1,海盐20 g·L-1;最佳发酵条件为:pH值7,温度28 ℃,接种量5%,转速200 r·min-1,发酵时间5 d。该抑菌活性物质为中等极性物质,具有良好的耐酸性和一定的热稳定性,在强碱、高温环境下易失活。
放线菌AM8;发酵条件;优化;抑菌活性物质
自Waksmanfa发现链霉菌以来,以抗生素生产、研究为首的现代技术产业迅速发展。但由于传统陆生来源的抗菌微生物和抗生素的大量重复分离,极大阻碍了寻求新型有效生物活性物质的进程[1]。随着广泛筛选和活性物质的重复发现,以及近年来临床病原微生物和耐药病原菌数量的急剧增加,迫切需要我们开发新型有效的抗生素。
海洋是生命的起源,蕴藏全球80%以上的物种,是包括未培养微生物在内的珍贵宝库[2]。海洋具有复杂多样的生态环境,海洋微生物相对于土壤微生物,更能耐受高压、高盐、低光照、低氧等特殊生存条件,具有遗传、种类及生态功能的多样性,是目前新型微生物及活性化合物的重要来源[3-4]。最新药物发现趋势显示,海洋极端环境可能存在产生特有代谢产物的放线菌群,是开发结构新颖的微生物天然产物的潜力来源。目前已有2/3左右的活性物质在海洋放线菌中被发现,而80%活性物质分离自海洋链霉菌,其分子结构独特新颖,化学结构丰富多样,是土壤链霉菌所不具有的[5-6]。海洋放线菌是海洋微生物中研究最多的群体,已被广泛应用于医药、食品、农业、化工、能源再生、污染治理等领域[7-8]。近年来关于海洋放线菌为新的天然产物的报道逐渐增多,并且有些化合物已进入临床试验阶段[9],开发海洋放线菌资源、寻找新型活性化合物成为当前研究的热点[10-11]。海洋放线菌AM8发酵液的抑菌活性较强且抗菌谱较广。
海洋放线菌AM8发酵液对耐药菌:耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcus aureus,MRSA)、耐甲氧西林表皮葡萄球菌(methicillin-resistantStaphylococcus epidermidis,MRSE)的抑制效果显著,对革兰氏阳性细菌(gram-positivebacteria,G+):金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)、藤黄微球菌(Micrococcus luteus)的抑制效果明显,对革兰氏阴性细菌(gram-negativebacteria,G-):大肠杆菌(Escherichia coli)、绿脓杆菌(Pseudomonas aeruginosa)的抑制作用较弱,但表现出一定的抗黑曲霉(Aspergillus niger)活性。鉴于海洋放线菌AM8次级代谢产物较高的抑菌活性,为提高海洋放线菌AM8次级代谢产物的产率,有必要对该菌株的发酵条件进行优化,为后续次级代谢产物的分离、纯化和结构鉴定积累足够的化合物。作者以海洋放线菌AM8发酵液抑菌活性物质对MRSA的抑制效果为评价指标,优化基础发酵培养基和发酵条件,初步研究抑菌活性物质,以提高菌株产活性物质的产率。
1 实验
1.1 菌种
海洋放线菌AM8(从海泥中分离筛选获得)、MRSA,均保藏于中国药科大学生命科学与技术学院微生物制药教研室。
1.2 仪器
Allegra 25R 型高速冷冻离心机,美国Beckman公司;电子分析天平,上海精密科学仪器有限公司;BXM-30R型压力蒸汽灭菌锅、SW-CJ-2FD型超净工作台,上海博讯实业有限医疗设备厂 ;QHZ-98A型全温振荡培养箱,太仓华美生化仪器厂;GHX-9080B-1型隔水式恒温培养箱,上海福玛实验设备有限公司;HH-S11.2型恒温水浴锅,江苏东台电器厂。
1.3 培养基
种子液体培养基(高氏一号液体培养基)(g·L-1):可溶性淀粉20,KNO31,K2HPO40.5,MgSO4·7H2O 0.5,NaCl 0.5,FeSO4·7H2O 0.01。固体培养基添加琼脂20。
基础发酵培养基:
培养基A(g·L-1):黄豆粉25,可溶性淀粉20,(NH4)2SO42,NaCl 2,K2HPO40.5,CaCO35,海盐20,pH值7.2。
培养基B(g·L-1):胰蛋白胨17,大豆胨3,葡萄糖2.5,NaCl 5,K2HPO42.5,海盐20,pH值7.1~7.5。
培养基C(g·L-1):蛋白胨15,黄豆粉5,可溶性淀粉15,甘油1.5,CaCO32,海盐20,pH值7.8。
培养基D(g·L-1):葡萄糖10,蛋白胨3,小米10,NaCl 2.5,CaCO32,海盐20,pH值7.2~7.4。
培养基E(g·L-1):葡萄糖4,酵母提取物4,麦芽提取物10,CaCO32,海盐20,pH值7.2。
培养基F(g·L-1):可溶性淀粉20,K2HPO40.5,KNO31,MgSO4·7H2O 0.5,FeSO4·7H2O 0.01,NaCl 0.5,酵母粉5,海盐20,pH值7.4~7.6。
指示菌培养基(g·L-1):酪蛋白水解物17.5,淀粉1.5,牛肉浸粉5,琼脂20,pH值7.2。
1.4 方法
1.4.1 发酵液的制备
将甘油管保存的海洋放线菌AM8接种到高氏一号固体培养基上,放入28 ℃培养箱中恒温培养7 d。挑取单菌落接种于装有50 mL种子液体培养基的150 mL三角瓶中,于28 ℃、200 r·min-1摇床振荡培养3 d,即得种子液(期间可不断接种以获取新的种子液)。按1%的接种量将种子液接种于装有150 mL基础发酵培养基的500 mL三角瓶中,于28 ℃、200 r·min-1摇床振荡培养5 d,收集滤液,即得发酵液。
1.4.2 抑菌活性的测定
取生长24 h的MRSA斜面,用2 mL生理盐水悬浮,取20 μL菌悬液加入新鲜配制保温于45 ℃恒温水浴的25 mL指示菌培养基中,其浓度约为1×106CFU·mL-1。离心,取上清液用无菌的0.22 μm微孔滤膜过滤,以MRSA为指示菌,采用管碟法测定抑菌物质的活性。加入量为150 μL,37 ℃培养24 h,每组实验平行测3次,以每组抑菌圈直径的平均值作为抑菌活性评价指标。
1.4.3 基础发酵培养基的筛选
将种子液按1%的接种量分别接入基础发酵培养基A~F,于28 ℃、200 r·min-1摇床振荡培养5 d。收集各发酵液于8 000 r·min-1离心20 min,得发酵上清液,测定抑菌活性。
1.4.4 培养基成分的筛选
采用单因素实验分别对基础发酵培养基的碳源、氮源、无机盐进行筛选。于28 ℃、200 r·min-1摇床振荡培养5 d,过滤,收集滤液测定抑菌活性。
1.4.5 发酵条件的筛选
将种子液按1%、2%、3%、4%、5%、6%、7%、8%的接种量接入到装有优化培养基的三角瓶中,分别调节其初始pH值为4、5、6、7、8、9,于28 ℃、200 r·min-1摇床振荡培养5 d,过滤,收集滤液测定抑菌活性。
1.4.6 发酵液抑菌活性物质热稳定性及酸碱稳定性的测定
取120 mL发酵上清液,平均分成12份,分别调节pH值为1、2、3、4、5、6、7、8、9、10、11、12,再将各份五等分置于5 mL EP管中,分别置于4 ℃、40 ℃、60 ℃、80 ℃、100 ℃水浴2 h,观察抑菌圈产生情况,测量抑菌圈直径。
1.4.7 发酵液抑菌活性物质极性的测定
取120 mL发酵上清液,平均分成12份,分别调节pH值为1、2、3、4、5、6、7、8、9、10、11、12,再将各份五等分置于5 mL EP管中,分别加入等体积的正丁醇、乙酸乙酯、二氯甲烷、氯仿、石油醚,并编号。于4 ℃静置至完全分层后分别取有机相与水相(pH值调回中性),以原发酵上清液为对照、以MRSA为指示菌进行抑菌活性的测定,观察有机相与水相的抑菌圈产生情况,测量抑菌圈直径。
2 结果与讨论
2.1 基础发酵培养基的筛选(图1)

图1 不同基础发酵培养基对发酵液抑菌活性的影响
由图1可以看出,在培养基B中发酵液的抑菌圈直径最大,抑菌活性最高。因此,选择培养基B作为海洋放线菌AM8的基础发酵培养基进行接下来的优化实验。
2.2 基础发酵培养基碳源、氮源、无机盐的筛选
2.2.1 碳源的筛选
以原培养基中的葡萄糖作为对照,分别考察蔗糖、麦芽糖、乳糖、甘露醇、木糖、可溶性淀粉、甘油对发酵液抑菌活性的影响,结果见图2。
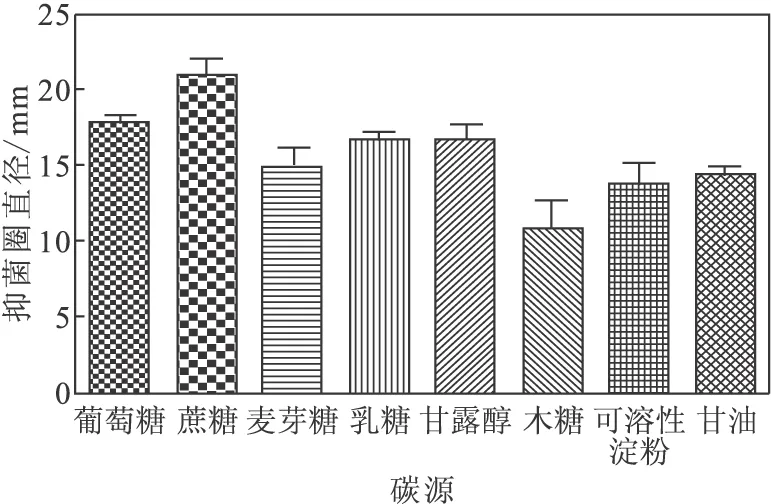
图2 碳源对发酵液抑菌活性的影响
由图2可以看出,以蔗糖为碳源时,发酵液的抑菌圈直径最大,抑菌活性最高,其次是葡萄糖、乳糖和甘露醇,木糖最低。因此,选择蔗糖作为碳源。
2.2.2 氮源的筛选
以原培养基中的复合氮源胰蛋白胨+大豆胨作为对照,分别考察NaNO3、胰蛋白胨、大豆胨、NH4Cl、尿素、蛋白胨、酵母粉、黄豆粉对发酵液抑菌活性的影响,结果见图3。

图3 氮源对发酵液抑菌活性的影响
由图3可以看出,以原复合氮源胰蛋白胨+大豆胨为氮源时,发酵液的抑菌圈直径最大,抑菌活性最高,其次是NaNO3,海洋放线菌AM8几乎不能利用尿素和酵母粉。因此,选择原复合氮源胰蛋白胨+大豆胨。2.2.3 无机盐的筛选
以原培养基中的复合无机盐NaCl+K2HPO4作为对照,分别考察MgSO4·7H2O、K2HPO4、NaCl、FeSO4·7H2O、CaCO3对发酵液抑菌活性的影响,结果见图4。
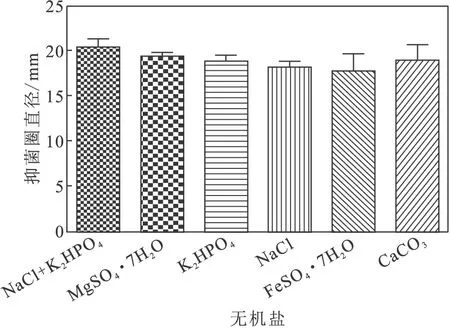
图4 无机盐对发酵液抑菌活性的影响
由图4可以看出,添加等量的不同无机盐对发酵液抑菌活性的影响不大,5种无机盐所培养的菌株的发酵液抑菌活性都比较高,其中原复合无机盐的抑菌活性相对最高。因此,选择原复合无机盐NaCl+K2HPO4。
2.3 发酵条件的筛选
2.3.1 接种量对发酵液抑菌活性的影响(图5)

图5 接种量对发酵液抑菌活性的影响
由图5可以看出,接种量对发酵液抑菌活性的影响呈一定的规律,接种量过少或过多都会影响抑菌活性物质的产生;接种量为5%时,发酵液的抑菌圈直径最大,抑菌活性最高。因此,选择接种量为5%。
2.3.2 pH值对发酵液抑菌活性的影响(图6)

图6 pH值对发酵液抑菌活性的影响
由图6可以看出,pH值为7时发酵液的抑菌圈直径最大,抑菌活性最高;pH值为8时抑菌活性有所下降。因此,在发酵时应保证发酵液的pH值为中性,过酸或过碱都不利于抑菌活性物质的积累。
2.4 发酵液抑菌活性物质的研究
2.4.1 抑菌活性物质的热稳定性及酸碱稳定性(图7)

图7 抑菌活性物质的热稳定性及酸碱稳定性
由图7可以看出,发酵液抑菌活性物质在偏酸性条件下活性较高且稳定,由于不同pH值的水溶液对照均无抑菌圈产生,所以排除pH值本身不同造成的影响。在偏酸性条件下,经过60 ℃以下处理的发酵液抑菌活性相差不大,但是经过80 ℃以上处理后抑菌活性明显降低。因此,强碱、高温条件容易导致发酵液抑菌活性物质失活。
2.4.2 抑菌活性物质的极性(图8)
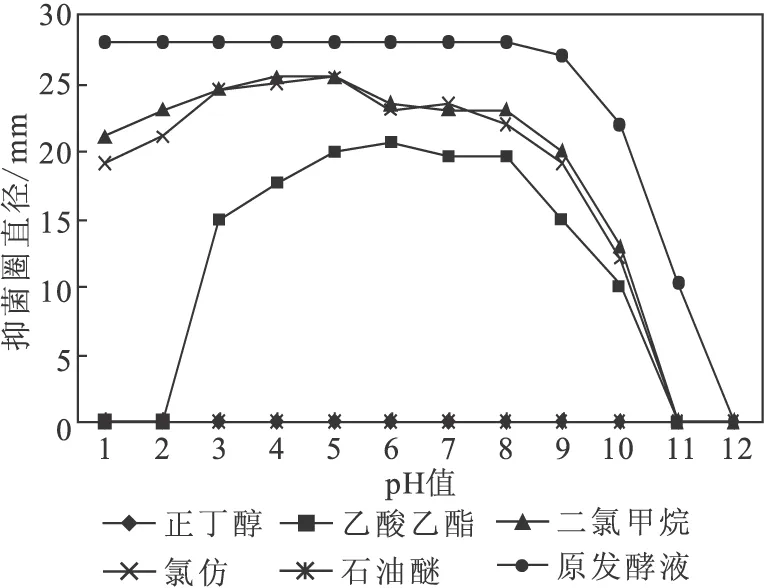
图8 不同萃取剂在不同pH值下萃取的有机相的抑菌活性
由图8可以看出,石油醚和正丁醇萃取后的有机相的抑菌圈直径重合于横坐标轴,说明发酵液抑菌活性物质不溶于石油醚和正丁醇;抑菌活性物质在二氯甲烷、氯仿和乙酸乙酯中有一定的溶解性,但其抑菌活性均低于原发酵液,说明有机溶剂萃取法提取活性物质会造成一定的损失。
实验发现,乙酸乙酯、二氯甲烷和氯仿萃取后的水相仍有一定的抑菌活性,这是因为实验过程只萃取一次,会存在明显的萃取不完全的情况;石油醚和正丁醇萃取后的水相抑菌活性均较高,进一步验证了抑菌活性物质不溶于石油醚和正丁醇,说明该物质为中等极性;在强碱条件下不易溶于有机溶剂,说明该物质在强碱条件下不稳定,易被降解。
3 结论
对海洋放线菌AM8的基础发酵培养基和发酵条件进行优化,并对抑菌活性物质进行初步研究。确定最佳培养基为:胰蛋白胨17 g·L-1,大豆胨3 g·L-1,蔗糖2.5 g·L-1,NaCl 5 g·L-1,K2HPO42.5 g·L-1,海盐20 g·L-1;最佳发酵条件为:pH值7,温度28 ℃,接种量5%,转速200 r·min-1,发酵时间5 d。该抑菌活性物质为中等极性物质,具有良好的耐酸
性和一定的热稳定性,在强碱、高温环境下易失活。该研究为进一步研究海洋放线菌AM8次级代谢产物奠定了理论基础。
[1] INTARAUDOM C,NITTHITHANASILP S,RACHTAWEE P,et al.Phenalenone derivatives and the unusual tricyclic sesterterpene acid from the marine fungusLophiostomabipolareBCC25910[J].Phytochemistry,2015,120:19-27.
[2] CHOI E J,NAM S J,PAUL L,et al.Previously uncultured marine bacteria linked to novel alkaloid production[J].Chemistry & Biology,2015,22(9):1270-1279.
[3] RAJU R,KHALIL Z G,PIGGOTT A M,et al.Mollemycin A:an antimalarial and antibacterial glyco-hexadepsipeptide-polyketide from an Australian marine-derivedStreptomycessp.(CMB-M0244)[J].Organic Letters,2014,16(6):1716-1719.
[4] 王宏梅,赵心清.可培养海洋放线菌生物多样性的研究进展[J].微生物学通报,2007,34(5):996-1000.
[5] MANIVASAGAN P,VENKATESAN J,SIVAKUMAR K,et al.Marine actinobacterial metabolites:current status and future perspectives[J].Microbiological Research,2013,168(6):311-332.
[6] DHARMARAJ S.MarineStreptomycesas a novel source of bioactive substances[J].World Journal of Microbiology & Biotechnology,2010,26(12):2123-2139.
[7] SATHIYANARAYANAN G,GANDHIMATHI R,SABARATHNAM B,et al.Optimization and production of pyrrolidone antimicrobial agent from marine sponge-associatedStreptomycessp.MAPS15[J].Bioprocess and Biosystems Engineering,2014,37(3):561-573.
[8] SARICAOGLU S,ISIK K,VEYISOGLU A,et al.Streptomycesburgazadensissp.nov.,isolated from soil[J].International Journal of Systematic & Evolutionary Microbiology,2014,64(12):4043-4048.
[9] FENICAL W.Marine pharmaceuticals:past,present,and future[J].Oceanography,2006,19(2):110-119.
[10] 李巧莲,李可,谢明杰,等.海洋放线菌次级代谢产物及其活性研究进展[J].中国海洋药物,2010,29(5):57-65.
[11] FENICAL W,JENSEN P R.Developing a new resource for durg discovery:marine actinomycete bacteria[J].Nature Chemical Biology,2006,2(12):666-673.
版权声明
为适应我国信息化建设,扩大本刊及作者知识信息交流渠道,本刊已被《中国学术期刊网络出版总库》及CNKI系列数据库、《万方数据——数字化期刊群》、《中文科技期刊数据库(全文版)》、《台湾华艺数据库》等收录。如作者不同意论文被收录,请在来稿时向本刊声明,本刊将作适当处理。
《化学与生物工程》编辑部
Optimization on Fermentation Conditions of MarineActinomyceteAM8 and Preliminary Study on Antibacterial Active Substance
ZHANG Li,NI Meng-xiang*
(CollegeofLifeScienceandTechnology,ChinaPharmaceuticalUniversity,Nanjing210009,China)
UsingtheactivityofantibacterialsubstanceofthefermentationbrothfrommarineActinomyceteAM8asanindex,asinglefactorexperimentwasusedtooptimizethebasicfermentationculturemediumandfermentationconditions.Theantibacterialactivesubstanceofthefermentationbrothwaspreliminarilystudied.Theoptimalculturemediumwasasfollows:tryptone17g·L-1,soybeanpeptone3g·L-1,sucrose2.5g·L-1,NaCl5g·L-1,K2HPO42.5g·L-1,andseacrystal20g·L-1.Theoptimalfermentationconditionswereasfollows:pHvalue7,temperature28 ℃,inoculum5%,shakingspeed200r·min-1,andfermentationtime5d.Theantibacterialactivesubstancewasmediumpolaritysubstance,whichhadgoodacidresistanceandcertainthermalstability,andeasilybecameinactivatedunderstrongalkalisandhightemperatureconditions.
AntinomyceteAM8;fermentationcondition;optimization;antibacterialactivesubstance
2017-01-03
张莉(1992-),女,甘肃天水人,硕士研究生,研究方向:微生物与生化药学,E-mail:zldyxzl@126.com;通讯作者:倪孟祥,副教授,E-mail:nimx-2000@aliyun.com。
10.3969/j.issn.1672-5425.2017.06.011
TQ920.6
A
1672-5425(2017)06-0051-05
张莉,倪孟祥.海洋放线菌AM8发酵条件的优化及抑菌活性物质的初步研究[J].化学与生物工程,2017,34(6):51-55.
