不同给药方式建立阿霉素心肌病模型的评价
2017-06-24王庆涛王玉璟
王庆涛,王玉璟
(长江大学第一临床医学院 荆州市第一人民医院心内科,湖北 荆州 434020)
不同给药方式建立阿霉素心肌病模型的评价
王庆涛,王玉璟
(长江大学第一临床医学院 荆州市第一人民医院心内科,湖北 荆州 434020)
目的:评价3种腹腔注射阿霉素建立SD大鼠扩张型心肌病模型的方案。 方法:雄性SD大鼠随机分为4组,模型组A(阿霉素0.8mg/次×2次/w×8w)、B(阿霉素2.5mg/次×1次/w×6w)、C(阿霉素2mg/次×1次/w×8w)(以下简称模A、模B、模C)腹腔注射不同浓度的阿霉素,对照组给予生理盐水,对大鼠心肌组织的病理改变、血清中脑钠肽(BNP)结果进行评估。结果:与对照组相比,模A全心质量指数增大(P<0.05);与对照组相比,模B、模C全心质量指数降低(P<0.05);与模A相比,模B、C全心质量指数降低(P<0.05);模B、C之间全心质量指数无明显差异(P>0.05)。与对照组相比,模A血清BNP水平增高(P>0.05);与对照组相比,模B、C血清BNP水平增高(P<0.05);与模A相比,模B、C血清BNP水平增高(P<0.05);模B、C之间血清BNP差异无统计学意义(P>0.05);与对照组相比,模A、B、C胶原容积分数增高(P<0.05);与模A相比,模B、C胶原容积分数增高(P<0.05);模B、C之间胶原容积分数差异无统计学意义(P>0.05)。结论:多次间断腹腔注射一定剂量的阿霉素能建立扩张型心肌病模型,但需要达到阿霉素累积剂量。
阿霉素;扩张型心肌病;建模
扩张型心肌病(Dilation Cardiomyopathy,DCM)在原发性心肌病中发病率很高[1],主要表现为心室扩张,收缩或舒张功能下降,最终发展为严重的心力衰竭,死亡率极高,确切的病因尚不清楚。阿霉素(adriamycin,ADR) 是一种蒽醌类广谱高效抗肿瘤药物,临床上应用广泛,但阿霉素的长期使用具有不可逆的心脏毒性[2],最终导致患者出现药源性扩张型心肌病,限制其应用。一般认为,相对于其他细胞,蒽环类药物具有亲心肌特性,更易在心肌细胞停留,而心脏组织缺少过氧化氢酶,抗氧化活性较弱[3]。另外,心肌细胞富含线粒体,也是产生ROS的根源;同时蒽环类药物对于心磷脂的亲和力较高,可进入线粒体,结合心磷脂从而抑制呼吸链,造成心脏损伤[4]。本研究旨在利用阿霉素诱导大鼠扩张型心肌病纤维化来探讨建立阿霉素扩张型心肌病模型的适宜剂量,为药源性扩张型心肌病动物研究提供参考。
1 材料与方法
1.1 材料
1)试验药物 阿霉素(盐酸多柔比星),由深圳万乐药业股份有限公司生产,批号为1505E1。
2)动物 清洁级SD大鼠66只,体重(180.3±5.3)g,雄性,由三峡大学实验动物中心提供,合格证号:NO.42010200000361。实验前适应性饲养1周。
3)试剂 100%乙醚、10%中性甲醛以及相关耗材均由长江大学医学院实验室和长江大学附属第一医院中心实验室提供;苏木素(生产批号585065)、0.5%水溶型伊红液(生产批号580378)、Masson染色液(生产批号615091)均由(台资)珠海贝索生物技术有限公司提供。大鼠血浆脑钠素(brain natriuretic peptide,BNP)Elisa试剂盒(上海轩昊科技发展有限公司)。严格按试剂盒说明书由专人进行操作。
1.2 方法
1)DCM动物模型的建立 清洁级SD大鼠66只,随机分为模型组A(阿霉素0.8mg/次×2次/w×8w)16只,模型组B(阿霉素2.5mg/次×1次/w×6w)16只,模型组C(阿霉素2mg/次×1次/w×8w)16只,及对照组(生理盐水2.5mg/次×1次/w×6w)18只。各组间体重差异无统计学意义(P>0.05)。
2)指标测定 在给药结束后2周将大鼠称重,用100%乙醚行吸入麻醉,取血清,Elisa检测血清中BNP;分离心脏,称重,计算全心质量指数(心脏质量/体重);沿心脏从心底至心尖最大切面取中段放入10 %甲醛固定,用石蜡包埋、组织切片后行HE、Masson染色。所有切片均通过显微摄像系统放大采图,然后输入MICRO-COSMOSMiVnt法医病理图像分析系统,以测量分析目标面积(胶原面积)和视场面积(全视野面积),然后计算出胶原容积分数(CVF) =(胶原面积/全视野面积)×100%。所有计量数据结果均输入SPSS20.0计算机系统分析。
1.3 统计学分析
2 结果
2.1 生存情况
给药结束后,对照组与模型组A生存率均为100%,模型组B组大鼠在第1、5、8周各死亡1只,生存率为 81.3%,模型组C组大鼠在第4、7周各死亡1只, 生存率为87.5%。
2.2 各组大鼠全心质量指数、BNP、胶原容积分数比较
与对照组相比,模A全心质量指数增大(P<0.05);与对照组相比,模B、模C全心质量指数降低(P<0.05);与模A相比,模B、C全心质量指数降低(P<0.05);模B、C之间全心质量指数无明显差异(P>0.05)。与对照组相比,模A血清 BNP水平增高(P>0.05);与对照组相比,模B、C血清BNP水平增高(P<0.05);与模A相比,模B、C血清BNP水平增高(P<0.05);模B、C之间血清BNP差异无统计学意义(P>0.05);与对照组相比,模A、B、C胶原容积分数增高(P<0.05);与模A相比,模B、C胶原容积分数增高(P<0.05);模B、C之间胶原容积分数差异无统计学意义(P>0.05)。

表1 各组大鼠全心质量指数、BNP、胶原容积分数比较
注:与对照组相比,#P<0.05;与模型组A比较,*P<0.05。
2.3 HE染色
对照组心肌细胞排列整齐,无心肌细胞坏死及纤维化;模型组A出现散在心肌细胞排列紊乱,局限性坏死及纤维化;模型组B、C出现弥漫性心肌细胞坏死及纤维化。见图1。
2.4 Masson染色
对照组无明显纤维化;模型组A出现局灶性纤维化增生;模型组B及模型组C出现弥漫性纤维化。见图2。
3 讨论
扩张型心肌病是一种严重威胁着人类健康的常见心肌疾病,发病率较高,至今病因尚未完全清楚,但认为与遗传,病毒感染及药物等因素有关[5]。阿霉素属于蒽环类广谱抗肿瘤药物,临床上应用广泛,研究显示[6]长期使用 ADR 对心脏的慢性毒性作用主要是引起与累计量有关的扩张型心肌病和充血性心力衰竭,而且ADR诱发心肌细胞凋亡和心肌纤维化在心肌损伤中起重要作用[7]。研究显示阿霉素心肌病的发病有以下几种可能的机制:氧自由基学说[8]、铁离子代谢紊乱[9]、细胞凋亡学说[10]、自噬学说[11],目前认为氧自由基增多是阿霉素心肌病最主要的机制。研究阿霉素心肌病机制前,构建相关模型是最基础的一步,国内外研究发现有多种方式可以构建大鼠阿霉素扩张型心肌病模型,包括鼠尾静脉注射,腹腔一次性大剂量注射和腹腔分次注射等,几种方式各有优缺点。本试验选用SD大鼠作为研究对象,采用不同剂量的药物腹腔注射,比较几种小剂量长疗程的ADR造模方案的有效性,评价扩张型心肌病模型的建立方法。
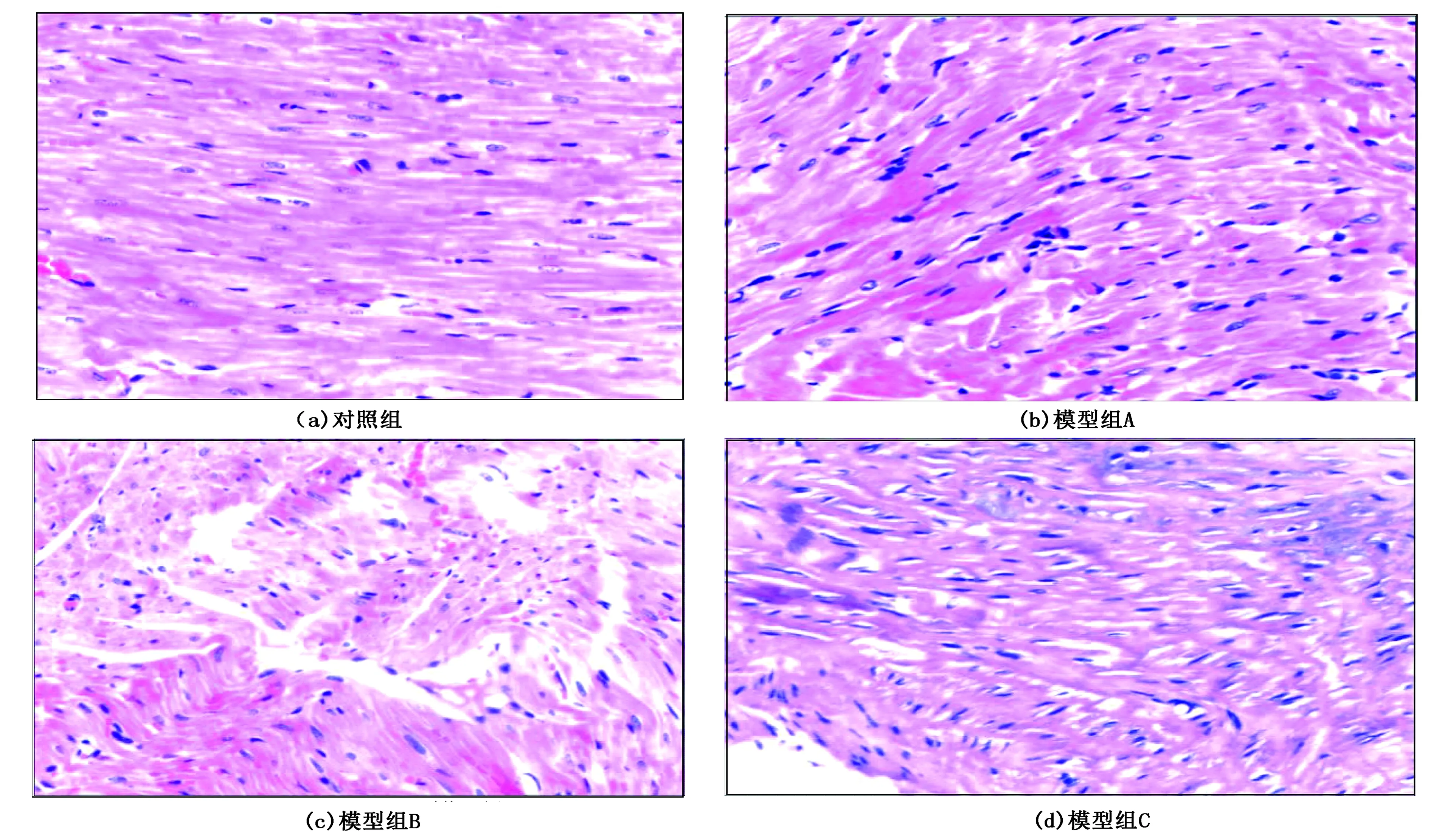
图1 各组HE染色结果比较(×200)
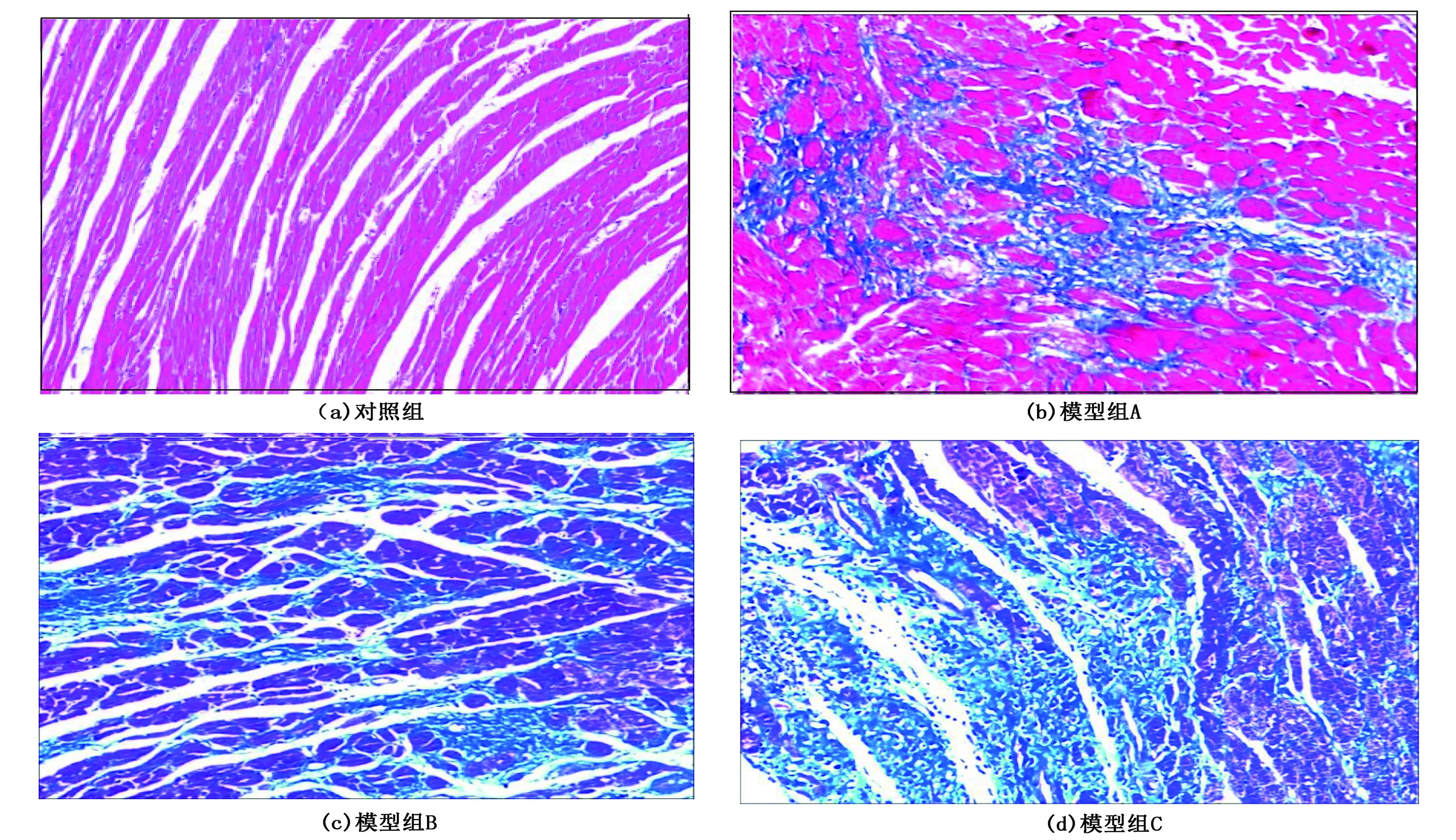
图2 各组Masson染色结果(×100)
从病理学研究结果可知,模型组A、B、C心肌组织已经发生变化,但是模型组A与模型组B、C的全心质量指数变化趋势却不同,与文献[12]的研究结果不同,分析原因如下:模型组B、C大鼠因心脏扩张、心功能下降而产生严重的腹水(平均60ml左右),阿霉素诱导心肌损伤后心脏质量也下降,从而导致数值出现下降;而模型组A也出现心脏质量的下降,但由于心功能尚可,没有产生明显的腹水,同时药物可影响大鼠食欲,故体重下降的幅度超过了心脏质量下降的幅度,从而出现全心质量指数升高的趋势。从本实验可知,当实验中大鼠出现严重的腹水时,利用全心质量指数来衡量心脏受损的程度则意义不大,此时可利用心脏/腓骨长度指数作为指标,因为该指标只是基于大鼠的年龄,而与大鼠体重无关,但本实验并未进一步探究。
血清BNP是急性心力衰竭时最敏感和特异的指标之一,其水平升高的程度与心室扩张和压力超负荷呈正比[13]。本研究中联合血清BNP水平和心脏组织学结果,为建立可靠、实用的理论提供实验依据。模A给予阿霉素0.8mg/次×2次/w×8w,其累积剂量为12.8mg,在实验过程中全部存活,与对照组相比,其血清BNP虽然升高了,但差异无统计学意义,结合模A大鼠的症状及病理学的结果,考虑模A大鼠的造模未成功,与吕腾的研究结果不符[14],分析其原因可能与大鼠的体重、药物厂家及动物耐受不同有关。但是与对照组相比,模型组A的胶原容积分数结果显示其心肌已经出现区域性纤维化,表明阿霉素已经对心肌产生了毒性作用,但是并没有达到扩心病的程度。原因分析如下:①每周分次给药方式使大鼠对阿霉素药物更易耐受。②研究显示给药累积剂量达到15mg/kg造模成功可能性较大[15],模型组A给药累积总量为12.8mg,小于15mg/kg,故心脏毒性表现不明显,导致造模未成功。模B大鼠给予阿霉素2.5mg/次/w×6w,累积剂量为15mg,模B大鼠在第 1、5、8周各死亡 1只,生存率为 81.3%,与李晓倩的结果类似[16]。模C大鼠给予阿霉素2mg/次/w×8w,累积剂量为16mg,模C大鼠在第4、7周各死亡1只, 生存率为87.5%,与白洁等[17]的结果类似。模型组B、C在给药过程中普遍出现脱毛,活动减少,腹泻,食量减少,体重增加(主要是因为腹水激增,腹水量平均60ml)等情况。模型组B、C造模死亡率低, 病理学结果显示心肌细胞坏死,心肌胶原纤维增生明显,血清BNP的结果也提示心功能损害严重,符合慢性扩心病的改变。综上,模A造模不成功可能与累积剂量的相关性最大。
表1中胶原容积分数结果表明模型组B、C相较于模型组A纤维化更明显,结合病理图片结果、BNP及大鼠体征,提示较模A的给药方式而言,模B及模C的给药方式更理想,与之前的研究结果类似。
综上所述,利用阿霉素造模的B、C两种方式结果没有显著差异,均为阿霉素诱导扩心病模型的可靠方式。ADR小剂量长疗程腹腔注射建立阿霉素扩心病大鼠模型成功率高、死亡率低、重复性好,可作为构建ADR扩心病的理想方式,但是需要注意ADR的累积剂量。本实验为建立大鼠阿霉素扩张型心肌病模型提供理论依据,为进一步研究药源性扩心病的机制奠定了基础。
[1]董巍.扩张型心肌病患者的临床治疗进展[J].当代医学,2012,18(19):25~26.
[2] Carvalho F S,Burgeiro A,Garcia R,et al. Doxorubicin-induced cardiotoxicity:from bioenergetic failure and cell death to cardiomyopathy[J].Med Res Rev,2014,34(1):106~135.
[3] 中国临床肿瘤学会,中华医学会血液学分会.蒽环类药物心脏毒性防治指南(2013 年版)[J]. 临床肿瘤学杂志,2013,18(10):925~934.
[4] Simunek T,stérba M,Popelov O,et al.Anthracycline-inducedcardiotoxicity: Overview of studies examining the roles of oxida-tive stress and free cellular iron[J].Pharmacological Reports,2009,61(1):154~171.
[5] Knoll R H, Hoshijima M, Chien K R. Mechanisms of dilated cardiomyopathies [J]. Drug Discovery Today: DiseaseM echanisms, 2004, 1(1): 31~36.
[6]Swain S M,Whaley F S,Ewer M S,et al.Congestive heart failure in patients treated with doxorubicin: a retrospective analysis of three trials[J].Cancer,2003,97(11):2869~2879.
[7] Lipshultz S E,Lipsitz S R,Sallan S E,et al.Chronic progressive cardiac dysfunction years after doxorubicin therapy for childhood acute lymphoblastic leukemia[J].J Clin Oncol,2005,23(12):2629 ~2636.
[8] Simunek T,Stérba M,PopelovO,et al.Anthracycline induced cardiotoxicity:Overview of studies examining of roles of oxidation stress and free cellular iron[J].Pharmacological reports,2009,61(1):154~171.
[9] Stérba M,PopelovO,VavrovA,et al.Oxidative stress,redox signaling,and metal chelation in anthracycline cardiotoxicity and pharmacological cardioprotection[J].Antioxid Redox signal,2013,18(8):899~929.
[10] Liu L,Zhang X J,Qian B,et al.Heat shock protein 27 attenuated doxorubicin-induced myocardial damage by reducing cardiomyocyte apoptosis mitochondria damage and protein carbonylation[J].Chin J Cardiol,2008,36(11):1021~1026.
[11] Sishi B J,Loos B,van Rooyen J,et al.Autophage upregulation promotes survival and attenuates doxorubicin-induced cardiotoxicity[J].Biochem Pharmacol,2013,85(1):124~134.
[12] Shaojun M,Xiaojiang L,Liang D,et al. Protective effect of Sheng-Mai Yin, a traditional Chinese preparation, against doxorubicin-induced cardiac toxicity in rats[J]. BMC Complementary and Alternative Medicine,2016,16:61.
[13]韩曼,于远望.利钠肽家族及其与心力衰竭的关系[J].海南医学,2015,261(17):2558~2561.
[14]吕腾,武璞,肖思源,等. 阿霉素诱导建立扩张型心肌病大鼠和家兔模型的研究[J]. 中药药理与临床,2015,31(2):120~123.
[15] Hayward R,Hydock D S.Doxorubicin cardiotoxicity in the rat:an in vivo characterization[J].J Am Assoc Lab Anim Sci,2007,46(4):20~32.
[16]李倩晓,那荣妹,李晓菲,等. 阿霉素诱导扩张型心肌病大鼠心功能的变化[J].中国医学创新, 2013,10(28):20~21.
[17] 白洁,陈蓉,盛佳,等. SD大鼠扩张型心肌病模型的建立[J]. 江苏大学学报(医学版),2006,16(3):210~212.
[编辑] 刘阳
2017-03-03
王庆涛(1990-),男,硕士生,主要从事心血管专业学习与研究;通信作者:王玉璟,90829359@qq.com。
R542.2
A
1673-1409(2017)12-0080-04
[引著格式]王庆涛,王玉璟.不同给药方式建立阿霉素心肌病模型的评价[J]. 长江大学学报(自科版),2017,14(12):80~83,89.
