洋地黄类药物对慢性房颤电转复后左房机械功能异常的作用
2017-06-24周忠泉王玉璟易绪英马莎杨沙宁杨学新邓士兵
周忠泉,王玉璟,易绪英,马莎 杨沙宁,杨学新,邓士兵
长江大学第一临床医学院 荆州市第一人民医院心血管内科,湖北 荆州 434000
洋地黄类药物对慢性房颤电转复后左房机械功能异常的作用
周忠泉,王玉璟,易绪英,马莎 杨沙宁,杨学新,邓士兵
长江大学第一临床医学院 荆州市第一人民医院心血管内科,湖北 荆州 434000
目的:观察洋地黄类药物对慢性房颤电转复后发生心房顿抑患者的左房及左心耳机械功能有无改善作用。方法:在慢性房颤转复后即刻发现有心房顿抑54例患者,被随机分为洋地黄组与对照组。 转复后1周内,前者接受洋地黄类药物治疗,后者接受安慰剂治疗。转复前、转复后即刻、转复后1d及转复后1周,分别行经胸壁及经食道心脏超声检查,测量跨二尖瓣血流速度及左心耳血流速度。结果:慢性房颤电转复成功后即刻,洋地黄组及对照组左心耳最大排空速度(LAA-PEV)和左心耳最大充盈速度(LAA-PFV)均降低。1d后,两组的E波(73.0±16.8cm/svs77.1±22.8cm/s)、A波(63.0±14.0cm/svs51.7±12.6cm/s)、E/A比率 (1.7±0.7cm/svs1.7±0.8cm/s)、LAA-PEV(23.7±8.4cm/svs21.7±9.8cm/s)、LAA-PFV(26.2±9.9cm/svs24.4±8.4cm/s)和左心耳排空分数(LAA-EF) (31.4%±9.0%vs30.2%±10.7%)等指标差异均无统计学意义(P>0.05)。1周后,两组的E波(72.8±16.9cm/svs72.0±18.8cm/s)、A波(64.7±16.6cm/svs61.0±15.6cm/s)、E/A比率(1.3±0.4vs1.5±0.7)、LAA-PEV(40.7±10.0cm/svs33.9±12.9cm/s)、LAA-PFV(43.0±14.2cm/svs35.3±11.0cm/s) 和LAA-EF(42.4%±12.4%vs39.3%±11.3%)等指标差异均无统计学意义(P>0.05)。 洋地黄组与对照组左房内自发超声显影发生率在转复后1d为11.5%vs8.7%,转复后1周为9.5%vs11.1% (P>0.05),两组差异均无统计学意义(P>0.05)。结论:洋地黄类药物对慢性房颤电转复后左房及左心耳机械功能异常无改善作用, 也不能减轻左房内自发超声显影,这可能与洋地黄加重细胞内钙超载和减慢心率作用有关。
洋地黄;心房颤动; 电转复;心肌顿抑
心房颤动(AF)是临床上最为常见的持续性快速心律失常,经食道心脏超声(TEE)研究发现,房颤电转复后左房的机械功能是延迟恢复,即出现左房顿抑,其主要表现为左心耳最大排空速度(LAA-PEV)降低,左房内出现自发超声显影(SEC),或原有SEC恶化[1]。近来研究显示,左房顿抑广泛见于药物转复、超速起搏、射频消融,甚至于自发转复后[2]。与胺碘酮比较,索他洛尔和心律平加重转复后的心房机械功能异常,提示具有负性肌力的药物可能加重心房顿抑[3]。本研究目的在于,前瞻性对照分析洋地黄类药物对慢性房颤转复后左心房及左心耳机械功能的影响。
1 资料与方法
1.1 一般资料
本项研究为单盲对照,共连续入选54名患者,年龄40~76岁,房颤持续时间 ≥1月,转复前停用所有洋地黄类药物至少5个半衰期,电转复成功后即刻均观察到心房顿抑。左心房顿抑判断标准为二尖瓣A波未出现(最大速度<50cm/s)和/或出现左房自发超声显影(SEC)。所有患者均经TEE筛选左心房及左心耳内有无血栓,并随机分为洋地黄组与对照组。洋地黄组及对照组分别为28例及26例,两组在年龄、体重、性别、基础心脏病、转复能量等方面差异无统计学差异(P>0.05),见表1。 排除标准:正进行抗心律失常药物治疗、近期心肌梗死、心脏手术围手术期、不稳定性心绞痛、中至重度心力衰竭或LVEF<35%、临床诊断甲状腺功能亢进、收缩压<100mmHg、病态窦房结综合征、二度或完全性房室传到阻滞、W-P-W综合征、严重的肝肾功能不全。栓塞事件指突然发生的内脏或四肢血管栓塞、短暂性脑缺血发作、脑栓塞。
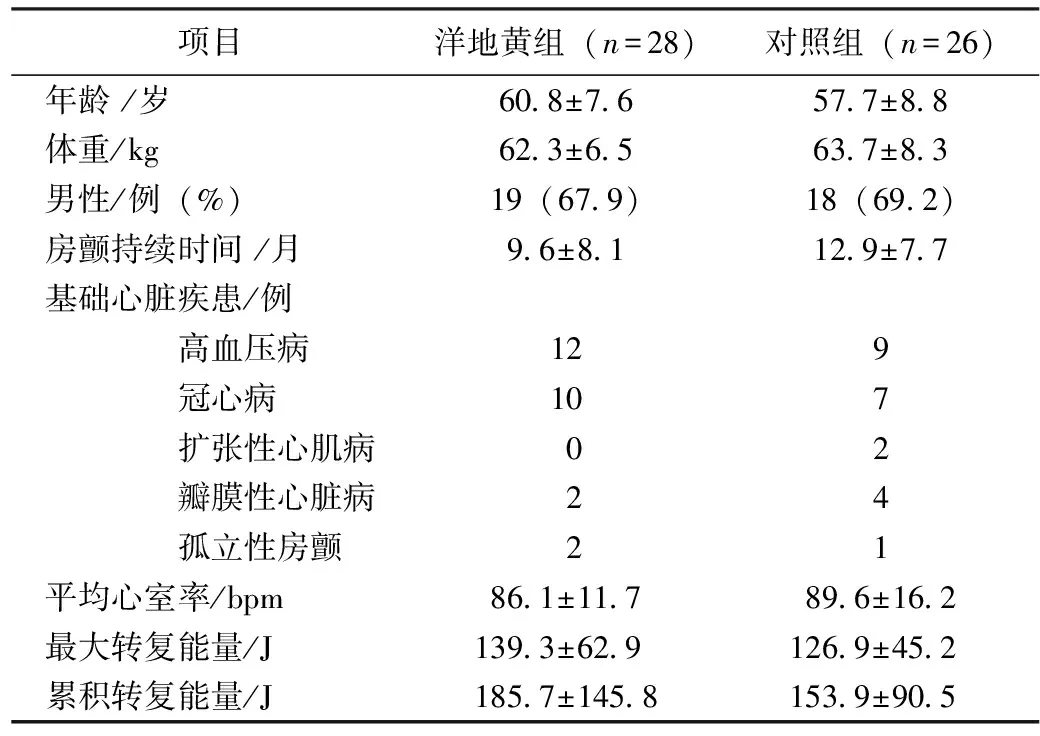
表1 洋地黄组和对照组基础情况及转复能量比较
1.2 方法
1)心脏超声检查 分别于转复前1d、转复后即刻、转复后1d、转复后1周进行经胸壁心脏超声 (TTE)和 TEE检查,超声仪为HP Sonos-5500 (Hewlett-Packard, Andover, Massachusetts),超声时同时连续记录II导心电图。测量跨二尖瓣血流时取心尖四腔面,取样容积置于二尖瓣瓣尖, 测量舒张早期流速峰值(E波)和舒张晚期流速峰值(A波)。随后10%利多卡因喷咽麻醉,进行TEE检查,左房多平面经食道超声探头频率为5.0/3.7MHz。应用常规TEE检查方法,充分显示左心耳结构,取样容积置于左心耳内1cm处,脉冲多普勒模式下取横断面评价左心耳内血液流速, 测量左心耳最大排空速度及最大充盈速度(分别为LAA-PEV 及LAA-PFV)。窦性心律下测量左心耳的最大和最小面积,通过公式计算左心耳排空分数(LAA-EF)=(最大面积-最小面积)/最大面积。电转复前取3个心动周期中各前向最大流速的平均值,恢复窦律后重复检查时取连续3个心动周期的平均值。
2)电转复 心电监护下,静脉推注安定20~30mg,转复仪为HP CodeMasterXL (Hewlett-Packard, Andover, Massachusetts),直径8cm电极板分置于心脏长轴两端,采取直流同步电转复方法,100、200、300J逐步增加能量,转复终点为恢复并维持窦性心律 >10 分钟或放电达3次。
3)洋地黄的应用 一俟明确左房顿抑存在并随机分组后,洋地黄组静脉缓慢推注40mL生理盐水稀释的西地兰,剂量为0.007mg/kg,而对照组仅推注安慰剂(生理盐水40mL)。随后1周内洋地黄组每日1次口服地高辛,剂量为0.005mg/kg,对照组则口服安慰剂。遵循美国胸科医师协会推荐方法,两组患者嘱咐前3周即开始口服华法林,直至转复后4周,INR目标值为2.0~2.5[4]。
1.3 统计学分析
2 结果
2.1 慢性房颤电转复后复发情况
转复24h内,洋地黄组和对照组房颤复发分别有2例 (7.1%)、3例(11.5%)(P>0.05)。随后6d内,洋地黄组和对照组又有2例(7.7%)和5例(21.5%)房颤复发(P>0.05)。两组累积房颤复发率为14.3%及30.8%(P>0.05)。1例患者因出现恶心和频繁呕吐而停用洋地黄。洋地黄组另有2例在转复后一周拒绝复查心脏超声。洋地黄及对照组INR分别保持于(2.2±0.5)及(2.1±0.5)(P>0.05),1周内两组均无栓塞事件发生(P>0.05)。
2.2 超声检查结果
转复前,两组在LAD、LVEF、E波、 LAA-PEV、LAA-PFV及LAA-EF等方面差异无统计学意义(P>0.05),见表1。与转复前比较,转复后两组LAA-PEV及LAA-PFV均显著性降低,但LAD、 LVEF、 E波和LAA-EF变化无统计学差异(P值均大于0.05);上述指标在两组间差异无统计学意义(P>0.05),而且转复后两组在A波及 E/A比率方面差异无统计学意义(P>0.05),见表2。
转复后1d,两组在LAD、 LVEF、 E波、 A 波、 E/A比率、LAA-PEV、 LAA-PFV、 LAA-EF等方面差异无无统计学意义(P值均大于0.05)。 洋地黄组和对照组分别有3例(11.5%)和2例(8.7%)发现SEC(P>0.05)。 转复后1d,洋地黄组A波较转复后即刻增加有统计学意义(P<0.05),对照组则无类似变化。 转复后1d,两组的LAA-PEV、 LAA-PFV 和E波较转复前减少均具有统计学意义(P值均小于0.05),见表2。
转复后1周, 两组间仅有LVEF差异具有统计学意义。 自发超声显影两组分别有2例(9.5%)和2例(11.1%)(P>0.05)。 转复后1周,两组的LAA-PEV、 LAA-PFV、 LAA-EF、 A波、E/A比率与转复后即刻比较差异有显著性,但两组间比较差异无统计学意义(P值均大于0.05)。 洋地黄组中,1周后LVEF和E波与转复前比较差异有显著,见表2。
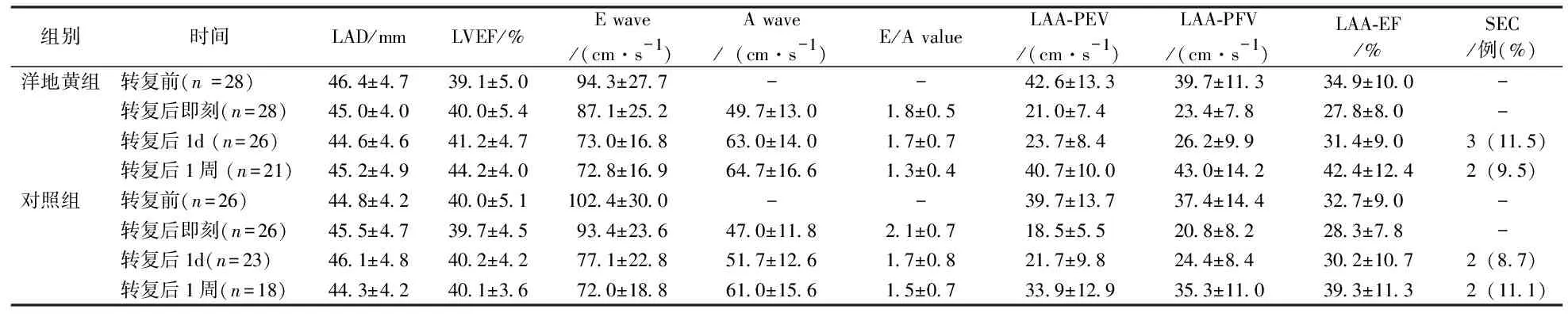
表2 两组超声检查结果
注:LAA-EF=左心耳排空分数; LAA-PEV=左心耳最大排空速度;LAA-PFV=左心耳最大充盈速度; LAD=左房收缩末直径; LVEF=左室射血分数; SEC = 自发超声显影。
2.3 心率
洋地黄组和对照组在转复后即刻、1d、1周的心室率比较分别为(75.0±9.9)bpmvs(73.2±10.8)bpm、(72.2±10.0)bpmvs(75.2±9.2)bpm、(68.1±8.5)bpmvs(77.7±9.0)bpm,两组间均无统计学差异(P<0.05)。
3 讨论
本研究首次在有对照的条件下,以慢性房颤电转复成功患者为研究对象,对顿抑的心房机械功能对洋地黄(临床上最为常用的正性肌力药物)的反应进行了研究。本研究显示,常规剂量洋地黄并不能改善电转复后左房顿抑患者的左房机械功能,也不能预防左房腔内和左心耳内自发超声显影。
本结论与过去的数项研究结果并非完全一致。动物研究发现,另一种洋地黄药物毒毛旋花甙,能够预防房颤后的右房收缩dp/dt下降和右房收缩末容积增加。动物的自主神经被完全阻断,以右房机械功能为主要评价指标[5]。多非利特作为一种Ikr阻断剂,对心室肌有正性肌力作用,治疗房颤亦有效[6].近来资料表明多非利特能减轻转复后的心房机械功能异常,因而推论,它对心房也有正性肌力作用[8]。短期内输注异丙肾上腺素,能提高慢性房颤及房扑转复后的左心耳机械功能[7]。
数周或数月后,慢性房颤还会引起心房解剖改变,细胞结构方面则会出现染色体重新分布、糖原堆积、去分化、肌溶解、心房纤维化等[8,9]。 此外,慢性房颤引起心房肌氧化损害,抑制肌酸激酶,改变能量代谢,可能也是参与原因之一[10]。
肌膜离子通道重构,尤其是钙离子通道异常是转复后心房顿抑的原因之一[11]。相应地,药物对转复后心房顿抑的作用的研究也存在矛盾之处,正性肌力药物如异丙肾上腺素及多巴酚丁胺可改善心房机械功能。本研究中的洋地黄类药物,通过抑制钠-钾ATP酶间接升高细胞内钙浓度,对心房机械功能却无改善作用。至于洋地黄类药物,由于可降低心室率,因而无类似的效果。一项近期的结果也提示心室率的重要作用,以较快的频率进行心房起搏,尤其是双房起搏,可能是改善持续性房颤转复后心房机械功能异常的一种有效方法[12]。
动物模型揭示,除电重构和结构重构外,房颤还伴随有神经重构,主要表现为心房组织交感神经纤维过度分布和突触增加,这种改变并不均一,右房较左房明显,同侧心房内分布亦不均一[13]。
众多研究显示,房颤电转复成功后左心耳血流速度明显降低,新出现自发超声显影或原有增强[1~3],本研究证实了这一现象。本研究还证实,房颤持续时间是房颤复发的预测指标,符合以前的研究结果 。另外,本研究的追踪期相对较短也是可能的因素之一。 本研究还发现,左房机械功能通常在慢性房颤(1~36月,平均11.2±8.0月)转复后1周内恢复,这与Nishino等的结果相近,但比Manning等发现的恢复时间。本研究中,洋地黄组和对照组的左房机械功能均在转复后1周得以恢复,提示地高辛治疗并未加速机械功能恢复的进程。
本研究发现,对于慢性房颤转复成功后即刻经食道超声证实发生左房顿抑者,随后应用常规剂量地高辛1周,并不能显著改善左心房和左心耳的机械功能异常,也不能预防左房腔内和左心耳内自发超声显影,因而不能预防转复后栓塞事件的发生。 这可能与洋地黄类药物加重慢性房颤诱发的心房肌细胞内钙超载及洋地黄的负性频率作用有关。
[1]Yang S, Huang C, Hu X, et al.Predictors of left atrial appendage stunning after electrical cardioversion of non-valvular atrial fibrillation[J].Chin Med J (Engl), 2003,116:1445~1450.
[2] Khan I A.Atrial stunning: basics and clinical considerations[J].International Journal of Cardiology, 2003, 92:113~128.
[3] Zapolski T, Wysokinski, A.Stunning of the left atrium after pharmacological cardioversion of atrial fibrillation[J].Kardiologia Polska, 2005, 63:254~262.
[4] Leung D Y, Grimm R A, Klein A L.Transesophageal echocardiography-guided approach to cardioversion of atrial fibrillation[J].Progress in Cardiovascular Diseases, 1996, 39:21~32.
[5] Friedman H S, Win M, Hussain A, et al.Effects of cardiac glycosides on atrial contractile dysfunction after short-term atrial fibrillation[J].Chest, 2000,118:1116~1126.
[6] Torp-Pedersen C, Moller M, Kober L, et al.Dofetilide for the treatment of atrial fibrillation in patients with congestive heart failure[J].European Heart Journal, 2000, 21:1204~1206.
[7] Date T, Takahashi A, Iesaka Y, et al.Effect of low-dose isoproterenol infusion on left atrial appendage function soon after cardioversion of chronic atrial tachyarrhythmia[J].International Journal of Cardiology, 2002, 84:59~67.
[8] Ausma J, Litjens N, Lenders M H, et al.Time course of atrial fibrillation induced cellular structural remodeling in atria of the goat[J].Journal of Molecular and Cellular Cardiology, 2001, 33:2083~2094.
[9] Thijssen V L, Ausma J, Borgers M.Structural remodelling during chronic atrial fibrillation: act of programmed cell survival[J].Cardiovascular Research, 2001, 52:14~24.
[10] Mihm M J, Yu F, Carnes C A, et al.Impaired myofibrillar energetics and oxidative injury during human atrial fibrillation[J].Circulation, 2001,104:174~180.
[11] Kneller J, Sun H, Leblanc N, et al.Remodeling of Ca-handling by atrial tachycardia: evidence for a role in loss of rate-adaptation[J].Cardiovascular Research, 2002, 54: 416~426.
[12]Takagi M, Doi A, Shirai N, et al.Acute improvement of atrial mechanical stunning after electrical cardioversion of persistent atrial fibrillation: comparison between biatrial and single atrial pacing[J].Heart,2005, 91:58~63.
[13] Chang C M, Wu T J, Zhou S, et al.Nerve sprouting and sympathetic hyper innervation in a canine model of atrial fibrillation produced by prolonged right atrial pacing[J].Circulation, 2001, 103:22~25.
[编辑] 一凡
2016-11-06
周忠泉(1974-),男,副主任医师,硕士,主要从事冠心病介入及房颤射频消融治疗工作; 通信作者:邓士兵,fantasylele1@163.com。
R541.4
A
1673-1409(2017)12-0008-04
[引著格式]周忠泉,王玉璟,易绪英,等.洋地黄类药物对慢性房颤电转复后左房机械功能异常的作用[J].长江大学学报(自科版),2017,14(12):8~11.
