从脊柱内镜手术摘除组织中分离髓核间充质干细胞及其生物学特征鉴定*
2017-06-24尚玉攀曾晓丽郑力恒肖黔龙张嘉晴
尚玉攀, 吴 昊, 曾晓丽, 郑力恒, 余 俊, 肖黔龙, 屠 美, 张嘉晴△
(暨南大学 1附属第一医院骨科, 2基础医学院生物化学与分子生物学系, 3理工学院生物材料系, 广东 广州 510632; 4仁伯爵综合医院, 澳门医学科技研究协会, 中国 澳门 999078)
从脊柱内镜手术摘除组织中分离髓核间充质干细胞及其生物学特征鉴定*
尚玉攀2, 吴 昊1, 曾晓丽2, 郑力恒4, 余 俊2, 肖黔龙2, 屠 美3, 张嘉晴2△
(暨南大学1附属第一医院骨科,2基础医学院生物化学与分子生物学系,3理工学院生物材料系, 广东 广州 510632;4仁伯爵综合医院, 澳门医学科技研究协会, 中国 澳门 999078)
目的: 利用经皮内镜下腰椎间盘切除术获取来源明确的髓核组织,结合组织块培养法高效分离培养人髓核间充质干细胞(human nucleus pulposus mesenchymal stem cells,hNP-MSCs), 并鉴定其生物学特征。方法: 收集6例腰间盘突出症手术摘除的髓核组织,利用组织块培养法分离培养。取第3~6代生长良好的细胞用于实验,采用CCK-8检测增殖能力;用流式细胞术检测细胞表面标志物;并分别向成骨、成脂和成软骨方向诱导分化,用油红O染色、茜素红染色及阿利新蓝染色对分化结果进行检测。结果: 成功从椎间盘内镜摘除的髓核组织中分离培养具有增殖能力的细胞,流式细胞术检测显示细胞高表达CD29、CD44、CD90、CD73和CD105等间充质干细胞抗原,不表达造血干细胞标志CD34和CD45。生长曲线显示符合正常间充质干细胞增殖特征。茜素红染色、阿利新蓝染色及油红O染色均呈阳性,说明分离培养的细胞具有向成骨、成软骨和成脂肪诱导分化的能力。结论: 首次结合椎间盘内镜微创手术和组织块培养法,体外高效分离培养了具有自我更新能力和多向分化潜能的hNP-MSCs。
经皮内镜下腰椎间盘切除术; 组织块培养法; 人髓核间充质干细胞
近年来,椎间盘退变及其引起的下腰痛发病率逐年升高,已成为45岁以下的人群失去劳动力或劳动力下降的主要原因之一,给社会经济带来沉重的负担[1]。目前治疗椎间盘退变的方法仅只能暂时减轻或缓解疼痛症状,并不能从根本上逆转椎间盘退变的病理过程,还有加重病情的风险[2]。以间充质干细胞为基础的组织工程技术为退变椎间盘进行再生和修复带来了新的希望,成为目前最有潜力的治疗途径[3-5]。然而,对人类椎间盘髓核干细胞缺乏足够了解,是阻碍这一技术发展的主要原因。近年来研究发现,椎间盘髓核组织内存在一种可贴壁生长、表达一系列间充质干细胞表面标志物、可三系诱导分化的细胞。该细胞满足国际细胞治疗学会(International Society for Cellular Therapy,ISCT)提出的间充质干细胞判定准则[6],被命名为人髓核间充质干细胞(human nucleus pulposus mesenchymal stem cells,hNP-MSCs)。由于人类髓核组织获取来源极其有限,目前NP-MSCs的研究数据主要来自于动物实验[7-9],但是动物数据的翻译解释对应到人类细胞研究有其不可克服的局限性。
目前绝大多数文献采用酶消化法分离脊柱开放手术摘除组织来获取hNP-MSCs。由于开放手术难以对髓核和其它组织进行精细分离,摘除组织往往夹杂有髓核周围的纤维软骨组织或韧带组织,造成细胞来源混杂。酶消化法单独采用Ⅱ型胶原酶或结合Ⅰ型胶原酶将手术摘取组织置于37 ℃下消化5 h 左右[10-11],存在着步骤繁琐、失败率高、费用昂贵等缺陷[12]。而分离间充质干细胞有另一种方法,即组织块培养法[13-14]。相比酶消化法,组织块培养法操作时间较短且步骤更简便[15]。然而目前尚未见运用组织块培养法分离培养髓核间充质干细胞的报道。鉴于酶消化法分离hNP-MSCs的方法成功率低,细胞数量少,细胞活性受影响,已严重制约hNP-MSCs研究发展,本研究首次结合椎间盘内镜微创手术和组织块培养法,探索新型高效体外分离培养hNP-MSCs的方法并对获取细胞进行生物学特征鉴定,为促进椎间盘退变的细胞治疗提供新的实验方法和理论基础。
材 料 和 方 法
1 人髓核组织的获取
标本来源于暨南大学附属第一医院骨科收治的6例L4/5~L5S1腰椎间盘突出症患者,年龄19~49岁,手术方式为经皮内镜下腰椎间盘切除术。本研究经院伦理委员会同意,患者均签署知情同意书。
2 主要仪器试剂
DMEM/F12培养基和胎牛血清(Gibco);胰蛋白酶(Sigma);CCK-8(Kumamoto);青霉素和链霉素(HyClone);人MSCs 成骨诱导试剂盒、成软骨诱导试剂盒、成脂诱导试剂盒(Cyagen);酶标仪(Lecia);L-谷氨酰胺(Sigma)。
3 组织块培养法分离获取NP-MSCs
无菌条件下用 PBS 清洗人髓核组织3遍,齿镊及眼科剪将髓核组织剪碎至1 mm×1 mm×1 mm大小,然后使用吸管将组织块逐一种植入预先用含20%胎牛血清的DMEM/F12培养基浸泡过的T25培养瓶内,密度大概为20~25块/瓶。放置在37 ℃、5% CO2培养箱中培养。3 h后,待组织块完全贴到培养瓶上,加入2 mL含20%胎牛血清、1%谷氨酰胺、1×105U/L青霉素和100 mg/L链霉素的DMEM/F12培养基,此后每隔2天换液1次。观察贴壁组织周围的细胞生长情况,当细胞达到80%~90%融合度时,用胰蛋白酶消化传代。
4 细胞形态学观察
hNP-MSCs按照5×104/cm2接种于6孔板,培养后每日用倒置相差显微镜观察细胞形态变化及生长状况并拍照。
5 流式细胞术检测细胞表面因子
取第3代长势良好的NP-MSCs,待细胞生长至融合时收集细胞,调整细胞密度为1×109/L保存在1.5 mL的EP管中;每管中分别加入相应hNP-MSCs表面因子 CD29、CD44、CD90、CD73、CD105、CD34和CD45的抗体各10 μL,室温避光孵育30 min,流式细胞仪检测,CellQuest软件分析结果。
6 hNP-MSCs增殖能力的检测
取第3代的hNP-MSCs,细胞计数后调整细胞悬液密度,按照每孔4×104细胞、500 μL培养基接种于24孔板,每组3个复孔。以不含细胞的培养液为空白对照。将24孔板放置于37 ℃、5%CO2饱和湿度培养箱中孵育培养,分别于接种后1、3、5、7、9、11和13 d检测细胞的增殖情况。每到一个时点,抽出一个横向试验,向每孔小心加入50 μL CCK-8溶液,孵育2 h后用检测波长为450 nm的酶标仪测定吸光度(A)值,绘制细胞增殖曲线。
7 hNP-MSCs的三系分化
7.1 成脂诱导分化 取第3代的hNP-MSCs细胞,用0.25%的胰蛋白酶消化以后,调整细胞密度为1×109/L均匀接种于6孔板中,用含10%胎牛血清、1%谷氨酰胺和1%青-链霉素的DMEM/F12培养液培养,直至细胞生长达到95%融合,将培养液更换成成脂诱导培养液。成脂诱导培养基为:含10%胎牛血清、1%谷氨酰胺和1%青-链霉素的高糖DMEM培养基中添加0.5 mmol/L地塞米松、10 μmol/L胰岛素和0.5 mmol/L 3-异丁基-1-甲基黄嘌呤。每隔2 d更换1次成脂诱导液。诱导3周后进行油红O染色[16],并进行拍照保存。
7.2 成骨诱导分化 取第3代的hNP-MSCs,0.25%的胰蛋白酶消化以后,调整细胞密度为1×109/L均匀接种于6孔板中,用含10%胎牛血清、1%谷氨酰胺和1%青-链霉素的DMEM/F12培养液培养培养至70%融合后,将培养液更换为成骨诱导培养液。成骨诱导培养基为:含10%胎牛血清、1%谷氨酰胺和1%青-链霉素的低糖DMEM培养基,并添加10-8mol/L地塞米松、10 mmol/L β-甘油磷酸钠和50 mg/L维生素C。对照组中添加常规培养基。每隔2 d更换1次成骨诱导液。诱导培养3周后用茜素红S进行染色[16],并拍照保存。
7.3 成软骨诱导分化 取第3代的hNP-MSCs,0.25%的胰蛋白酶消化以后,调整细胞密度为1×109/L 均匀接种于6孔板中,用含10%特级胎牛血清、1%谷氨酰胺和1%青-链霉素的DMEM/F12培养液培养培养至 90%以上融合后,将培养液更换为成软骨诱导培养液。成软骨诱导培养基为:含10%胎牛血清、1%谷氨酰胺和1%青-链霉素的DMEM/F12培养基添加0.1 μmol /L地塞米松、10 μg/L TGF-β1、6.25 mg/L转铁蛋白、6.25 mg/L胰岛素和50 mg/L维生素C。对照组中添加常规培养基。每隔2 d更换1次成软骨诱导液。诱导培养3周后用阿利新蓝进行染色,并拍照保存。
结 果
1 人髓核组织标本大体情况
本实验6例患者均顺利完成椎间盘内镜微创手术摘取退变髓核组织,由于手术视野无出血,组织辨别清晰,利用生理盐水使标本基本保持原本的形态和理化特性。术中将取出的标本分为髓核组织、纤维环组织和韧带组织。髓核组织为白色粘弹性物质,退变的髓核组织呈破棉花絮状,正常的髓核组织呈胶冻状,较年轻患者胶冻状态更加明显。纤维环组织和韧带组织镜下可辨别,质地较韧,不予保留。每例患者均取到髓核组织有20~40 g,见图1。

Figure 1.Percutaneous endoscopic lumbar discectomy removal of nucleus pulposus tissues.
图1 从脊柱内镜微创手术摘除的髓核组织
2 人髓核间充质干细胞的生物学特性
经光学倒置显微镜观察,组织块接种7 d后,组织块周围可见零星的一些细胞游出,形态多为梭形。10~12 d,有更多的细胞从组织块中游出,细胞大小较均一,形态多为典型的长梭形,少数为多角形,向四周呈单层贴壁生长。15 d后,去除组织块,细胞达到90%左右的融合。细胞传至第3代时,形态变为均一的梭形,均呈现纺锤样长梭形,见图2。

Figure 2.Morphology of human nucleus pulposus mesenchymal stem cells (×100).A, B: passage 0; C: passage 3.
图2 不同代的人髓核间充质干细胞形态
3 人髓核间充质干细胞的表面标志
流式细胞术检测结果显示,培养至第三代的hNP-MSCs表面因子 CD29、CD44、CD90、CD73和CD105呈阳性表达,其阳性率分别是100%、100%、100%、99.96%和99.99%;而CD34和CD45呈阴性表达,其阳性率分别为0.55%和0.46%,见图3。
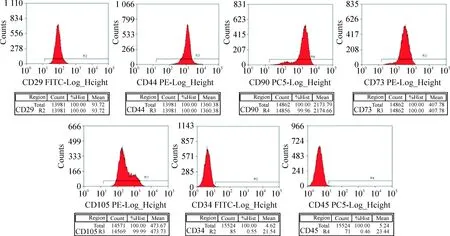
Figure 3.The flow cytometry results of cell surface markers on hNPMSCs at passage 3.
图3 流式细胞术检测 hNP-MSCs 表面因子表达
4 细胞增殖能力
由生长曲线可知,细胞传代后前5 d增殖不是很明显,5~7 d进入对数生长期,8~13 d开始增殖缓慢。正常细胞量传代后,4~5 d即可传代1次,而本实验做细胞增殖能力检测时,为更准确观察细胞增殖过程,细胞种植密度低,13 d后进入平台期,见图4。

Figure 4.Growth curve detection of passage 3 human nucleus pulposus mesenchymal stem cells
图4 第3代人髓核间充质干细胞的生长曲线
5 成脂诱导分化情况
hNP-MSCs用成脂诱导培养基培养5 d后,细胞慢慢开始形变,细胞内部出现微小的脂滴,肉眼可见,随着诱导时间的延长,细胞内的脂滴越来越多,越来越大。此时,形变成脂肪细胞的数目也随之增多,诱导3周后,油红O染色,细胞内可见大量的红染颗粒,见图5A。
6 成骨诱导分化情况
在更换成骨诱导液1周左右,普通倒置显微镜下可以观察到部分细胞发生了形变,呈圆形状大概诱导至第10天左右,会出现絮状物沉积在细胞表面,随着成骨诱导时间的延长,沉积物质越来越多,诱导3周后对细胞进行茜素红S染色鉴定并拍照,结果见图5B。
7 成软骨诱导分化情况
在更换成软骨诱导液21 d后,阿利新蓝染色结果显示,hNP-MSCs成软骨诱导后,染色呈强阳性,细胞外基质被染成蓝色,见图5C。
讨 论
本研究获取6例行脊柱内镜微创手术的髓核组织,通过组织块贴壁培养,5~7 d可在光镜下观察到细胞从组织块中移行出来,形态多为长梭形。经流式细胞术检测,高表达间充质干细胞特异性表面抗原 CD29、CD44、CD90、CD73和CD105(皆高于99%),不表达造血干细胞标志CD34和CD45(<1%),根据ISCT标准,完全符合间充质干细胞的特征[6]。CCK-8法检测结果显示第3代人髓核间充质干细胞的生长曲线呈典型的S形,符合干细胞的生长规律[17],且具有较好的增殖能力。进一步对多向分化潜能检测,结果表明成脂诱导3周时油红O染色,细胞内出现大量的红染颗粒,证实培养的细胞能够向脂肪细胞分化。这与之前认为hNP-MSCs不能分化为脂肪细胞的报道截然不同[18]。此外,成骨与成软骨诱导分化实验结果证实所分离培养的细胞能够向成骨及成软骨细胞方向分化。说明本实验分离出的hNP-MSCs具有较高的多向分化潜能。

Figure 5.Multilineage differentiation of hNP-MSCs. A: oil red O staining after adipogenic induction (×200); B: alizarin red staining after osteogenic induction (×100); C: alcian blue staining after chondrogenic induction (×200).
图5 第3代hNP-MSCs的成脂、成骨和成软骨分化
本研究首次将组织块培养法结合脊柱内镜微创手术获取髓核组织,运用到hNP-MSCs分离培养研究中,获得了具有间充质干细胞形态的、可持续扩增的髓核来源的细胞。经流式细胞术分析和多向分化潜能鉴定,所分离细胞符合国际间充质干细胞标准。而且不使用消化酶,细胞状态更好。本研究所用的方法大大减少了实验操作步骤,将实验时间从5 h缩短到1 h,同时降低了难度。节约了成本,且收获的原代细胞产量较酶消化法更多,能够很好地保持髓核间充质干细胞的生物学特性。更重要的是,本研究首次探索利用脊柱内镜微创手术获取髓核组织,通过高分辨率的视镜系统对组织准确分离,精确去除纤维环软骨和韧带组织,克服了开放手术来源的标本混杂其它组织的缺陷,有利于细胞纯化。此外,研究发现hNP-MSCs的生物活性可能与髓核组织退变程度密切相关[19]。本研究可通过微创手术高分辩内镜系统对髓核组织进行在体观察,结合术前影像学更准确地评估椎间盘退变的程度,为研究hNP-MSCs活性与椎间盘退变程度之间的关系提供更可靠的实验依据。
总之,本研究首次将组织块培养法结合脊柱内镜微创手术获取髓核组织,运用到hNP-MSCs分离培养研究中,为基于hNP-MSCs的再生医学和组织工程研究提供新的实验方法和理论基础。
[1] Dagenais S, Caro J, Haldeman S. A systematic review of low back pain cost of illness studies in the United States and internationally[J]. Spine J, 2008, 8(1):8-20.
[2] Levin DA, Hale JJ, Bendo JA. Adjacent segment degeneration following spinal fusion for degenerative disc disease [J]. Bull NYU Hosp Jt Dis, 2007, 65(1): 29-36.
[3] Wang F, Wu X, Wang Y, et al. Research situation of stem cells transplantation for intervertebral disc degeneration [J]. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi, 2013, 27(5): 575-579.
[4] Comes ME, Bossano CM, Johnston CM, et al.Invitrolocalization of bone growth factors in constructs of biodegra-dable scaffolds seeded with marrow stromal cells and cultured in a flow perfusion bioreactod[J]. Tissue Eng, 2006, 12(1): 177-188.
[5] Smith LJ, Chiaro JA, Nerurkar NL, et al. Nucleus pulposus cells synthesize a functional extracellular matrix and respond to inflammatory cytokine challenge following long-term agarose culture[J].Eur Cell Mater, 2011, 22: 291-301.
[6] Dominici M, Le Blanc K, Mueller I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells: the International Society for Cellular Therapy position statement [J]. Cytotherapy, 2006, 8(4): 315-317.
[7] Larson JW 3rd, Levicoff EA, Gilbertson LG, et al. Biologic modification of animal models of intervertebral disc degeneration [J]. J Bone Joint Surg Am, 2006, 88(Suppl 2): 83-87.
[8] Zhou GQ, Yang F, Leung VL, et al. Molecular and cellular biology of the intervertebral disc and the use of animal models [J]. Orthop Trauma, 2008, 22(4): 267-273.
[9] Masuda K, Imai Y, Okuma M, et al. Osteogenic protein-1 injection into a degenerated disc induces the restoration of disc height and structural changes in the rabbit anular puncture model [J]. Spine (Phila Pa 1976), 2006, 31(7): 34-54.
[10]王 锋, 小 涛, 运 涛, 等. 单纯Ⅱ型胶原酶消化法分离、培养人退变椎间盘髓核细胞的形态学观察[J]. 中国脊柱脊髓杂志, 2010, 20(4): 300-304.
[11]唐 勇, 阳普山, 吴剑宏, 等. 人髓核间充质干细胞的分离提纯方式及生物学活性鉴定[J]. 中国脊柱脊髓杂志, 2015, 25(6):533-540.
[12]Baptista LS, do Amaral RJ, Carias RB, et al. An alternative method for the isolation of mesenchymal stromal cells derived from lipoaspirate samples[J]. Cytotherapy, 2009, 11(6):706-715.
[13]胡文龙, 吴平平, 耿书国, 等. 人脐带间充质干细胞分泌白细胞介素6促进骨肉瘤细胞增殖和迁移[J]. 中国病理生理杂志, 2016, 32(2):201-207.
[14]庞荣清, 何 洁, 李福兵, 等. 一种简单的人脐带间充质干细胞分离培养方法[J]. 2011, 1(2):162-167.
[15]Ishige I, Nagamura-Inoue T, Honda MJ, et al. Comparison of mesenchymal stem cells derived from arterial, venous, and Wharton’s jelly explants of human umbilical cord[J]. Int J Hematol, 2009, 90(2):261-269.
[16]Pittenger MF, Mackay AM, Beck SC, et al. Multilineage potential of adult human mesenchymal stem cells[J]. Science, 1999, 284(5411):143-147.
[17]Campagnoli C, Roberts IA, Kumar S, et al. Identification of mesenchymal stem/progenitor cells in human first-tri-mester fetal blood, liver and bone marrow[J]. Blood, 2001, 98(8):2396-2402.
[18]Blanco JF, Graciani IF, Sanchez-Guijo FM, et al. Isolation and characterization of mesenchymal stromal cells from human degenerated nucleus pulposus: comparison with bone marrow mesenchymal stromal cells from the same subjects[J]. Spine (Phila Pa 1976), 2010, 35(26):2259-2265.
[19]阳普山, 刘子双一, 陶晖, 等. 正常与退变髓核的髓核间充质干细胞代谢活性及干性基因表达的比较[J]. 中国脊柱脊髓杂志, 2014, 24(5):454-461.
(责任编辑: 陈妙玲, 罗 森)
Isolation and identification of nucleus pulposus mesenchymal stem cells from tissues removed by percutaneous endoscopic lumbar discectomy
SHANG Yu-pan2, WU Hao1, ZENG Xiao-li2, CHEANG Lek-hang4, YU Jun2, XIAO Qian-long2, TU Mei3, ZHANG Jia-qing2△
(1DepartmentofOrthopedics,TheFirstAffiliatedHospital,2DepartmentofBiochemistryandMolecularBiology,SchoolofBasicMedicine,3DepartmentofBiologicalMaterial,CollegeofScienceandEngineering,JinanUniversity,Guangzhou510632,China;4CentroHospitalarCondedeSãoJanuário,MacauMedicalScience&TechnologyResearchAssociation,Macau999078,China.E-mail:zhangjiaqing@jnu.edu.cn)
AIM: To explore a novel method to isolate human nucleus pulposus mesenchymal stem cells (hNP-MSCs)invitroand to identify their biological characteristics. METHODS: The explant culture method was employed to isolate hNP-MSCs from nucleus pulposus tissue obtained by percutaneous endoscopic lumbar discectomy (PELD). The isolated cells were passaged for purification and culturedinvitrofollowed by morphological observation. The cell proliferation ability was detected by CCK-8 assay. Growth curves of the cells were drawn and surface antigens were detected by flow cytometry. The cells at the 3rd~6th passages were induced for adipogenic, osteogenic and chondrogenic differentiation, and examined by oil red O staining, alizarin red staining and Alcian blue staining. RESULTS: The cells with self-renewal were obtained from nucleus pulposus tissue obtained by PELD. The results of flow cytometry analysis revealed that the cells were positive for CD29, CD44, CD90, CD73 and CD105, but negative for CD34 and CD45. The proliferative capacity was consistent with the growth characteristics of MSCs and multilineage differentiation potential was identified. CONCLUSION: A novel method to efficiently isolate and culture hNP-MSCs, PELD combined with explant culture method, was established, which would promote the study of regenerative medicine based on hNP-MSCs.
Percutaneous endoscopic lumbar discectomy; Explant culture method; Human nucleus pulposus mesenchymal stem cells
1000- 4718(2017)06- 1147- 06
2016- 11- 15
2017- 03- 28
中央高校基本科研基金(No. 21615436);广东科技项目基金(No. 2016B090913004);广东科技项目基金(No. 201508020035);暨南大学附属第一医院科研培育专业基金项目(No. 511005024)
R616.5; R361
A
10.3969/j.issn.1000- 4718.2017.06.032
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 020-85220256; E-mail: zhangjiaqing@jnu.edu.cn
