Semaphorin 3A 过表达对H2O2诱导的人脐静脉内皮细胞损伤的影响*
2017-06-24王海芳赵向绒霍雪萍孙晶莹武翔龙牛银波刘勤社
王海芳, 赵向绒, 霍雪萍, 孙晶莹, 武翔龙, 牛银波, 胡 军, 刘勤社
(1陕西省人民医院中心实验室, 陕西 西安 710068; 2西北工业大学生命学院, 陕西 西安 710072; 3陕西中医药大学, 陕西 西安 712046)
Semaphorin 3A 过表达对H2O2诱导的人脐静脉内皮细胞损伤的影响*
王海芳1, 赵向绒1, 霍雪萍1, 孙晶莹1, 武翔龙2, 牛银波2, 胡 军1, 刘勤社3△
(1陕西省人民医院中心实验室, 陕西 西安 710068;2西北工业大学生命学院, 陕西 西安 710072;3陕西中医药大学, 陕西 西安 712046)
目的: 探讨semaphorin 3A (Sema 3A)对过氧化氢(H2O2)诱导的人脐静脉内皮细胞(HUVECs)损伤的影响。方法: 构建Sema 3A过表达载体,以脂质体转染法转染HUVECs,过表达效果以qPCR和Western blot法验证;待测细胞以200 μmol/L H2O2处理4 h;qPCR法检测炎性细胞因子水平;乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)和丙二醛(MDA)水平以相应比色法检测;细胞活力以MTT法检测;流式细胞术检测细胞凋亡,凋亡相关蛋白cleaved caspase-3及Bcl-2水平以Western blot法检测。结果: Sema 3A过表达能显著增加H2O2诱导的HUVECs凋亡、炎性细胞因子分泌以及LDH和MDA含量,同时显著抑制SOD活性和细胞活力;Sema 3A对未经H2O2处理的HUVECs没有损伤效应,即其对HUVECs的损伤具有H2O2依赖性。结论: Sema 3A能显著加重H2O2诱导的HUVECs损伤,在氧化应激所致的内皮细胞损伤过程中发挥促进作用。
动脉粥样硬化; Semaphorin 3A; 过氧化氢;人脐静脉内皮细胞
动脉粥样硬化(atherosclerosis,AS)是一种严重危害人类健康的临床常见病,是冠心病、脑血栓等缺血性心脑血管疾病的主要病理基础[1]。在AS发生发展过程中,血管内皮细胞损伤通常会导致内皮功能障碍,进而触发后续病理进程,如巨噬细胞聚集、血管平滑肌细胞增殖及最终的动脉粥样斑块形成等[2-4]。Semaphorin 3A (Sema 3A)是脑信号蛋白家族的重要成员,其已被证实是一种有效的免疫调节分子,并参与调控系统性硬化症的病理进程[5]。近年研究发现,Sema 3A在急性肾损伤[6]及大脑损伤[7]过程中都发挥重要作用,并能够提高脑血管通透性[7]。然而,Sema 3A是否在氧化应激所致的内皮细胞损伤过程中发挥作用尚不清楚。本研究旨在探讨Sema 3A对H2O2诱导的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)损伤的影响,以期为AS的防治提供理论依据。
材 料 和 方 法
1 主要试剂
Pyrobest DNA聚合酶和Trizol试剂盒购自TaKaRa;PCEP4表达载体购自Invitrogen;ECL显色试剂盒购自上海西唐生物科技有限公司;乳酸脱氢酶(lactic dehydrogenase,LDH)、超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)测定试剂盒均购自南京建成生物工程研究所;H2O2和MTT购自Sigma; Annexin V-FITC/碘化丙啶(propi-dium iodide,PI)细胞凋亡检测试剂盒购自南京凯基公司。
2 细胞培养
HUVECs购于ATCC;HUVECs培养于RPMI-1640培养基,内含10%胎牛血清、1×105U/L青霉素及100 mg/L链霉素,置于37 ℃、5% CO2、相对饱和湿度的孵育箱中进行培养,隔日换液,待细胞生长至融合,按1∶3比例进行传代[8]。取对数生长期的细胞进行实验。
3 实验方法
3.1 Sema 3A过表达载体构建及转染 应用Pyrobest DNA聚合酶对Sema3A基因的cDNA进行PCR扩增反应。按照说明书操作将获得的Sema3AcDNA插入到PCEP4表达载体中,并以Lipofectamine 2000将2 μg Sema 3A-PCEP4载体转染至HUVECs中,同时将空载体empty-PCEP4转染设为阴性对照组。转染后,细胞置于37 ℃、5% CO2条件下培养24 h,换液,提取细胞总蛋白,qPCR和Western blot验证Sema 3A的表达水平。收集留存细胞进行其它实验。
3.2 H2O2处理及实验分组 上述细胞可分为3组,即Sema 3A-PCEP4转染组、empty-PCEP4转染组及空白对照组。3组细胞(每孔1×106个)分别经200 μmol/L H2O2处理4 h,未经H2O2处理的细胞设为相应的对照组。qPCR检测炎性细胞因子水平变化。采用试剂盒测定LDH活性、MDA含量及SOD活性。MTT法检测细胞活力。流式细胞术检测细胞凋亡情况,以Western blot法检测凋亡相关蛋白cleaved caspase-3及Bcl-2的蛋白水平。
3.3 qPCR 按照Trizol试剂盒说明书操作,提取待测细胞总RNA。将5 μg总RNA以反转录试剂转录为cDNA,并以之为模板进行qPCR扩增反应,以β-actin为内参照。反应条件为: 95 ℃ 10 min; 95 ℃ 30 s, 57 ℃ 45 s, 72 ℃ 45 s, 循环进行40次。扩增结果以ABI 7500系统检测,并以2-ΔΔCt法定量。所用引物均由上海生工生物工程技术服务有限公司合成,具体引物序列见表1。

表1 实时定量PCR引物序列
F: forward; R: reverse.
3.4 Western blot实验 待测细胞以RIPA裂解液进行裂解,提取总蛋白并以BCA法定量。取40 μg总蛋白进行12% SDS-PAGE,并将分离的蛋白质电转移至PVDF膜。膜经TBST清洗后,以5%脱脂奶粉室温封闭1 h,换液,与目的蛋白 I 抗4 ℃过夜孵育。膜再次经TBS清洗后,换液,用辣根过氧化物酶标记的IgG(II 抗)孵育1.5 h,清洗并以ECL显影液显色。所用抗体为兔抗人Sema 3A多克隆抗体(稀释度1∶1 500)、兔抗人cleaved caspase-3多克隆抗体(稀释度1∶2 000)、兔抗人Bcl-2单克隆抗体(稀释度1∶2 500)、兔抗人β-actin多克隆抗体(稀释度1∶2 500)及辣根过氧化物酶标记的山羊抗兔IgG(稀释度1∶4 000)II 抗[9]。以上抗体均购自Abcam,其中β-actin作为内参照。利用Gel-Pro Analyzer 4.0软件对Western blot条带进行量化分析。
3.5 培养上清液LDH活性和细胞SOD活性、MDA含量的检测 收集待测细胞培养上清液,按照LDH试剂盒说明书操作测定各组LDH水平。收集各组细胞,以适量0.125%胰蛋白酶加0.01% EDTA消化液消化细胞,超声破碎。采用黄嘌呤/黄嘌呤氧化酶法测定SOD活性,操作按照其试剂盒说明书进行,吸光度值于550 nm波长处收集[10]。采用硫代巴比妥酸显色法测定MDA含量,实验按照相应试剂盒说明书操作,吸光度值于532 nm波长处收集[10]。根据吸光度值计算各组LDH、SOD活性及MDA含量。
3.6 MTT法检测细胞活力 将待测细胞等量(1×104)接种于96孔板,按照实验分组处理细胞后,每孔加入20 μL MTT (5 g/L),置于细胞培养箱中继续培养4 h。弃上清,每孔加入200 μL DMSO,摇床振摇10 min。将培养板置于酶标仪,于490 nm波长下测定各孔吸光度值。空白对照组细胞活力视为100%,其余各组细胞活力以其占对照组的百分比表示[11]。
3.7 细胞凋亡的检测 收集各组待测细胞,离心漂洗后,弃上清,按照Annexin V-FITC/PI 凋亡检测试剂盒说明书处理细胞。具体是以结合缓冲液重悬细胞,轻微摇晃至均匀,避光孵育10 min。依次加入适量Annexin V-FITC和PI,混匀,再次避光孵育10 min[12-13]。结束标记后,以流式细胞仪检测细胞凋亡。其中,FITC+/PI-象限代表凋亡早期细胞,FITC+/PI+象限代表坏死和凋亡晚期细胞,两者之和代表细胞总凋亡。
4 统计学处理
本研究实验均独立重复进行3次,实验数据以均数±标准差(mean±SD)表示,应用SPSS 19.0软件进行统计学分析。采用单因素方差分析的LSD-t法比较转染实验各组HUVECs中Sema 3A的表达水平。采用析因设计方差分析法比较各检测实验中各组HUVECs的相关指标;Sema 3A单因素下多组间比较采用LSD-t检验;H2O2单因素下两组间比较采用独立样本t检验。以P<0.05表示差异有统计学意义。
结 果
1 HUVECs中Sema 3A过表达效果的验证
qPCR结果表明,Sema 3A的mRNA水平在Sema 3A-PCEP4转染组中显著高于empty-PCEP4转染组和空白对照组(P<0.05),同时Western blot检测结果与qPCR结果相似,见图1。本部分结果证明,HUVECs中Sema 3A过表达效果良好,满足后续实验要求。

Figure 1.The expression of Sema 3A in the HUVECs. A: the relative mRNA level of Sema 3A by qPCR; B: the relative protein level of Sema 3A detected by Western blot. Mean±SD.n=3.#P<0.05vsSema 3A-PCEP4 group.
图1 Sema 3A在HUVECs中的表达
2 Sema 3A过表达对H2O2诱导的HUVECs炎性细胞因子水平的影响
H2O2处理HUVECs后,以qPCR法检测炎性细胞因子mRNA水平的变化。TNF-α的mRNA水平在200 μmol/L H2O2处理的3组细胞中大幅度提高到至少3.7倍(P<0.05),并在Sema 3A-PCEP4转染组细胞中更为显著,即与empty-PCEP4组相比差异有统计学意义(P<0.05)。MCP-1、IL-1β及IL-6的mRNA水平也出现类似的变化,H2O2处理3组细胞后,MCP-1 的mRNA水平提高到至少1.8倍,IL-1β的mRNA水平提高到至少2.3倍,IL-6的mRNA水平大幅提高到至少4.1倍。此外,H2O2处理后,MCP-1、IL-1β及IL-6在Sema 3A-PCEP4组中的mRNA水平同样显著高于empty-PCEP4组(P<0.05)。单纯Sema 3A过表达不影响HUVECs的炎性因子分泌,见图2。以上结果表明,Sema 3A过表达依赖于H2O2,显著加剧H2O2诱导的HUVECs中炎性因子的分泌。
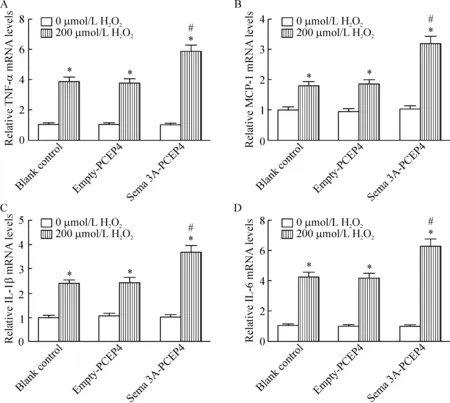
Figure 2.qPCR was used to detect the mRNA levels of inflammatory cytokines TNF-α (A), MCP-1 (B), IL-1β (C) and IL-6 (D) in the HUVECs with different treatments. Mean±SD.n=3.*P<0.05vs0 μmol/L H2O2;#P<0.05vsempty-PCEP4 (200 μmol/L H2O2).
图2 HUVECs中炎性细胞因子mRNA水平的检测
3 Sema 3A过表达对H2O2诱导的HUVECs生成LDH、SOD和MDA的影响
3组细胞组内相比,H2O2处理后的HUVECs生成LDH和MDA的量显著升高(P<0.05),SOD活性显著降低(P<0.05);与empty-PCEP4组相比,Sema 3A过表达显著加剧H2O2诱导的HUVECs中LDH活性、MDA含量及SOD活性的改变(P<0.05),单纯Sema 3A过表达不影响HUVECs的LDH活性、MDA含量及SOD活性,见图3。
4 Sema 3A过表达对H2O2诱导的HUVECs活力的影响
对细胞活力的检测结果发现,未经H2O2处理的3组细胞活力差异无统计学显著性。经200 μmol/L H2O2处理后,3组细胞活力均显著下降(P<0.05),并在Sema 3A-PCEP4组的细胞中更为明显,即与empty-PCEP4组相比差异有统计学显著性(P<0.05),单纯Sema 3A过表达不影响HUVECs的细胞活力,见图4。该实验结果表明,Sema 3A过表达显著降低H2O2诱导的HUVECs活力。
5 Sema 3A过表达对H2O2诱导的HUVECs凋亡的影响
对细胞凋亡的检测结果发现,未经H2O2处理的3组细胞凋亡率的差异无统计学显著性。经200 μmol/L H2O2处理后,3组细胞的凋亡率均显著增加(P<0.05),并在Sema 3A-PCEP4组细胞中更为突出,即与empty-PCEP4组相比差异有统计学显著性(P<0.05),单纯Sema 3A过表达不影响HUVECs的细胞凋亡,见表2。类似变化趋势也体现在促凋亡蛋白cleaved caspase-3的表达上,而抑凋亡蛋白Bcl-2的表达变化则相反,见图5。以上结果表明,Sema 3A过表达显著增强H2O2诱导的HUVECs凋亡。
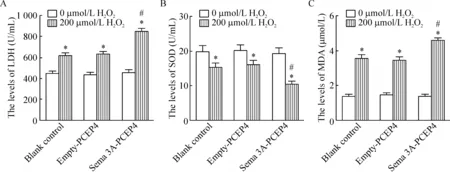
Figure 3.The changes of LDH (A), SOD (B) and MDA (C) levels in the HUVECs. Mean±SD.n=3.*P<0.05vs0 μmol/L H2O2;#P<0.05vsempty-PCEP4 (200 μmol/L H2O2).
图3 HUVECs中LDH、MDA及SOD指标变化的检测

Figure 4.The changes of the viability of the HUVECs with different treatments. Mean±SD.n=3.*P<0.05vs0 μmol/L H2O2;#P<0.05vsempty-PCEP4 (200 μmol/L H2O2).
图4 HUVECs活力的检测
表2 HUVECs总凋亡率
Table 2.The total apoptosis rate of HUVECs (%. Mean±SD.n=3)

Group0μmol/LH2O2200μmol/LH2O2Blankcontrol4.65±0.459.63±0.78*Empty-PCEP44.72±0.498.95±0.75*Sema3A-PCEP44.46±0.4212.59±1.14*#
*P<0.05vs0 μmol/L H2O2;#P<0.05vsempty-PCEP4 (200 μmol/L H2O2).
讨 论
AS是血管壁对各种损伤的异常反应,其发病初期主要表现为急性渗出性炎症,进展期则表现出慢性增生性炎症的特点[14]。目前,有关AS发病机制的学说有很多种,如脂质浸润学说、潴留应答学说、血管平滑肌细胞克隆学说、Ca2+超负荷学说、血栓形成学说、内皮损伤学说及炎症学说等[14]。
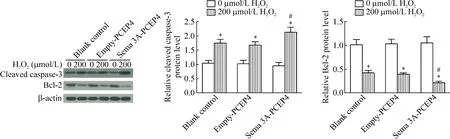
Figure 5.The expression of apoptosis-related proteins in the HUVECs with different treatments. Mean±SD.n=3.*P<0.05vs0 μmol/L H2O2;#P<0.05vsempty-PCEP4 (200 μmol/L).
图5 HUVECs中凋亡相关蛋白的表达
近年来,Sema 3A的免疫调节分子角色已被广泛报道[15],其参与了多种损伤性病理进程,如大脑损伤[7]。然而,有关Sema 3A在血管内皮细胞损伤中的作用尚不清楚。氧化损伤是导致内皮损伤的重要因素之一,本文以HUVECs为研究对象,探讨了Sema 3A过表达对H2O2诱导的HUVECs损伤的影响。本研究发现,HUVECs中Sema 3A过表达后,H2O2诱导的炎性细胞因子分泌继续增加,LDH活性和MDA含量升高加剧,SOD活性下降增强,细胞活力进一步下降,细胞凋亡进一步增加,而未经H2O2处理的HUVECs不受影响,表明Sema 3A能依赖于H2O2加剧H2O2诱导的HUVECs损伤。
本文结果中Sema 3A对HUVECs损伤的促进作用与其在其它损伤细胞中的研究结果相一致。例如,Zhao等[16]发现Sema3A基因沉默的大鼠心肌细胞表现出对低氧环境更强的对抗能力,体现在其对低氧诱导的炎症反应及心肌细胞凋亡的对抗作用上。Ranganathan 等[6]研究发现,Sema 3A在急性肾损伤小鼠及患者中表达上调,对小鼠中Sema 3A的遗传性失活能够保护缺血再灌注诱导的急性肾损伤,体现在改善的组织病理学状态,减少的炎性细胞侵润及肾上皮细胞凋亡上。他们在体外研究中进一步发现,Sema 3A能够增强肾上皮细胞、巨噬细胞及树突状细胞中由TLR4介导炎症应答;且未经缺血再灌注处理的Sema 3A遗传性失活小鼠和野生型小鼠炎性因子分泌水平并无统计学显著性差异,这与本研究单纯Sema 3A过表达对HUVECs没有损伤效应的结果类似。
目前关于Sema 3A在HUVECs中加强H2O2效应的潜在机制,是我们即将研究的方向,结合相关文献,推测可能与Sema 3A的免疫调节作用相关,即可能由H2O2诱发HUVECs产生免疫应激后,再由Sema 3A介入参与免疫调节,进而表现为细胞损伤效应。HUVECs损伤需要经外界条件诱导,本文结果表明Sema 3A不具有直接诱导其损伤的作用,而是需要借助于外界刺激因素H2O2来实现,这可能与H2O2刺激后HUVECs内环境的改变有关,未来需要通过进一步研究来做出解释。
综上所述,本研究发现Sema 3A 过表达能够加剧H2O2诱导的HUVECs损伤,这一加剧过程具有H2O2依赖性,有关其发挥该作用的分子机制将在以后的研究中进一步探究和揭示,以期为AS的防治提供新的研究思路。
[1] Hansson GK. Inflammation, atherosclerosis, and coronary artery disease[J]. N Engl J Med, 2005, 352(16):1685-1695.
[2] Ross R, Kariya B. Comprehensive physiology[M]. 7th ed. Hoboken: Wiley, 2011:69-91.
[3] Griendling KK, Fitzgerald GA. Oxidative stress and cardiovascular injury part I: basic mechanisms andinvivomonitoring of ROS[J]. Circulation, 2003, 108(16): 1912-1916.
[4] Ma L, Guo X, Chen W. Inhibitory effects of oleoylethanolamide (OEA) on H2O2-induced human umbilical vein endothelial cell (HUVEC) injury and apolipoprotein E knockout (ApoE-/-) atherosclerotic mice[J]. Int J Clin Exp Pathol, 2015, 8(6):6301-6311.
[5] Rimar D, Nov Y, Rosner I, et al. Semaphorin 3A: an immunoregulator in systemic sclerosis[J]. Rheumatol Int, 2015, 35(10):1625-1630.
[6] Ranganathan P, Jayakumar C, Mohamed R, et al. Semaphorin 3A inactivation suppresses ischemia-reperfusion-induced inflammation and acute kidney injury[J]. Am J Physiol Renal Physiol, 2014, 307(2):F183-F194.
[7] Hou ST, Nilchi L, Li X, et al. Semaphorin 3A elevates vascular permeability and contributes to cerebral ischemia-induced brain damage[J]. Sci Rep, 2015, 5:7890.
[8] 张营春, 杜祥阁, 颜 昕, 等. 尼古丁对人 RPE 细胞及 HUVEC的影响[J]. 山东大学耳鼻喉眼学报, 2015, 29(2):74-80.
[9] 陈永锋, 王海晶, 刘丁媛, 等. TN-C 在小细胞肺癌中的表达及 STAT3 对 TN-C 表达的影响[J]. 现代生物医学进展, 2014, 14(18):3429-3432.
[10]王菲菲, 王先良, 刘芳盈, 等. 燃煤 PM2. 5不同组分对血管内皮细胞的氧化损伤效应[J]. 中国环境科学, 2014, 34(3):780-785.
[11]展恩欣, 范昊昌, 陈晓凤, 等. 载脂蛋白 AI 模拟肽 L-4F 减轻过氧化氢诱导的小鼠骨髓内皮祖细胞损伤[J]. 中国病理生理杂志, 2016, 32(1):1-7.
[12]贺艳杰, 李玉华, 卢会芳, 等. 线粒体通路和死亡受体通路在中华眼镜蛇毒组分诱导 KG1a 细胞凋亡中的作用[J]. 中国药理学通报, 2013, 29(3): 356-360.
[13]刘 亮, 左连富, 王 静. 青蒿琥酯对食管癌 Ec9706 细胞线粒体膜电位及凋亡的影响[J]. 解放军医学杂志, 2014, 39(1):25-29.
[14]刘俊田. 动脉粥样硬化发病的炎症机制的研究进展[J]. 西安交通大学学报: 医学版, 2015, 36(2):141-152.
[15]Vadasz Z, Haj T, Halasz K, et al. Semaphorin 3A is a marker for disease activity and a potential immunoregulator in systemic lupus erythematosus[J]. Arthritis Res Ther, 2012, 14(3):R146.
[16]Zhao C, Liu J, Zhang M, et al. Semaphorin 3A deficiency improves hypoxia-induced myocardial injury via resisting inflammation and cardiomyocytes apoptosis[J]. Cell Mol Biol, 2015, 62(2):8-14.
(责任编辑: 陈妙玲, 罗 森)
Influences of semaphorin 3A over-expression on H2O2-induced injury in human umbilical vein endothelial cells
WANG Hai-fang1, ZHAO Xiang-rong1, HUO Xue-ping1, SUN Jing-ying1, WU Xiang-long2, NIU Yin-bo2, HU Jun1, LIU Qin-she3
(1LaboratoryCenterofShaanxiProvincePeople’sHospital,Xi’an710068,China;2SchoolofLifeSciences,NorthwesternPolytechnicalUniversity,Xi’an710072,China;3ShaanxiUniversityofChineseMedicine,Xi’an712046,China.E-mail:lqsspph@126.com)
AIM: To explore the influences of semaphorin 3A (Sema 3A) on hydrogen peroxide (H2O2)-induced injury in human umbilical vein endothelial cells (HUVECs). METHODS: Sema 3A over-expression vectors were constructed and transfected into the HUVECs by Lipofectamine 2000, and the over-expression effect was verified by qPCR and Western blot. The HUVECs in different groups were treated with or without 200 μmol/L H2O2for 4 h. The levels of inflammatory cytokines were measured by qPCR. The levels of lactic dehydrogenase (LDH), superoxide dismutase (SOD) and malondialdehyde (MDA) were detected by corresponding colorimetry. The cell viability was measured by MTT assay. The cell apoptosis was analyzed by flow cytometry. The levels of apoptosis-related proteins cleaved caspase-3 and Bcl-2 were determined by Western blot. RESULTS: H2O2induced inflammatory cytokine secretion, increased the levels of LDH and MDA, decreased SOD activity and cell viability, and increased cell apoptosis in the HUVECs. Over-expression of Sema 3A enhanced the above processes. No injury effect of Sema 3A over-expression on HUVECs without H2O2treatment was observed, indicating that the injury effects of Sema 3A on HUVECs depended on H2O2. CONCLUSION: Sema 3A markedly enhances H2O2-induced injury in the HUVECs, which depends on H2O2. Sema 3A may promote oxidative stress-caused endothelial cell injury.
Atherosclerosis; Semaphorin 3A; Hydrogen peroxide; Human umbilical vein endothelial cells
1000- 4718(2017)06- 1080- 06
2016- 09- 30
2017- 03- 28
国家自然科学基金资助项目(No. 81573823)
R543.1+2; R363.2
A
10.3969/j.issn.1000- 4718.2017.06.020
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 029-38185001; E-mail: lqsspph@126.com
