激活PPARγ抑制异烟肼与利福平合用致大鼠肝损伤及HMGB1水平上调
2017-06-23何雪宋育林王莉洪汝涛胡闻
何雪,宋育林,王莉,洪汝涛,胡闻
(1安徽医科大学第一附属医院消化科,安徽省消化系统疾病重点实验室,合肥 230022;2安徽医科大学附属巢湖医院消化科,巢湖238000;3安徽医科大学第四附属医院儿科,合肥 230000;4安徽省立医院病理科,合肥 230001)
激活PPARγ抑制异烟肼与利福平合用致大鼠肝损伤及HMGB1水平上调
何雪1,2,宋育林1*,王莉3,洪汝涛1,胡闻4
(1安徽医科大学第一附属医院消化科,安徽省消化系统疾病重点实验室,合肥 230022;2安徽医科大学附属巢湖医院消化科,巢湖238000;3安徽医科大学第四附属医院儿科,合肥 230000;4安徽省立医院病理科,合肥 230001)
目的探讨激活过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)对异烟肼与利福平合用致肝损伤的作用。方法以异烟肼和利福平合用制作大鼠肝损伤模型,以15d-PGJ2激活PPARγ。造模第14d和第28d分批处死大鼠,测定血清总胆红素(total bilirubin, TBIL) 、直接胆红素(direct bilirubin, DBIL)、谷丙转氨酶(alanine aminotransferase, ALT ),、谷草转氨酶(aspartate aminotransferase, AST )水平,观察大鼠肝病理学和超微结构变化,检测大鼠肝组织超氧化物歧化酶(superoxide dismutase,SOD)活性、丙二醛(malondialdehyde,MDA)含量,免疫组织化学测定肝高迁移率族蛋白B1(high mobility group box 1,HMGB1)表达。结果异烟肼和利福平合用所致肝损伤模型小鼠血清TBIL、DBIL明显升高,肝组织SOD活性显著降低,MDA含量升高,肝脂肪变性和炎症细胞浸润较明显,肝细胞线粒体及内质网结构破坏,HMGB1免疫反应性增强;PPARγ激动剂15d-PGJ2 处理可明显抑制上述变化。结论PPARγ激动剂15d-PGJ2可能通过抗氧化及抑制HMGB1表达对异烟肼、利福平合用致肝损伤发挥保护作用。
过氧化物酶体增殖物激活受体γ;高迁移率族蛋白B1;肝损伤;异烟肼;利福平
高迁移率族蛋白B1(high mobility group box 1, HMGB1)作为一种典型损伤相关分子模式在急慢性无菌性炎症中发挥重要作用[1]。我们前期研究发现,通过抑制NF-κB活性而下调HMGB1表达可有效减轻异烟肼、利福平合用所致肝损伤[2],而过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ, PPARγ)激活后可通过多种机制抑制NF-κB信号通路发挥抗炎作用[3-4]。此外,有研究发现,PPARγ激活后可通过下调HMGB1减轻急性肺损伤、脓毒症等炎症性疾病[5-6]。然而,PPARγ激活能否防治抗结核药物致肝损伤以及PPARγ/HMBG1途径是否参其中目前尚不清楚。本研究检测了异烟肼、利福平合用致肝损伤时PPARγ与HMGB1的关系及PPARγ激活对肝损伤的作用。
材料和方法
1 动物
雄性SPF级SD大鼠48只,体重150 ~180g,由安徽医科大学实验动物中心提供[动物使用许可证号SCXK(皖)2011—002]。清洁级条件下饲养,室温20℃,相对湿度50%,自由进食进水。
2 主要试剂
PPARγ激动剂15d-PGJ2购自美国sigma公司;异烟肼片购自上海信谊药厂有限公司;利福平胶囊购自上海延安药业有限公司;HMGB1多克隆抗体购自北京博奥森生物科技有限公司产品;PV法试剂盒与DAB 试剂盒购于北京中杉科技有限公司。
3 实验分组
SD大鼠适应性喂养7d后,随机分为正常组(Normal)、肝损伤模型组(Model)和15d-PGJ2处理组(Treatment),每组8只大鼠。正常组给予等量生理盐水空腹灌胃;模型组和处理组大鼠分别给予异烟肼50mg/(kg·d)+利福平50 mg/(kg·d)每天一次定时空腹灌胃;处理组同时每日一次腹腔注射15d-PGJ2 10 ug/(kg·d)。造模第14d和第18d分批处死大鼠。处死前,禁食、禁水12h;麻醉后腹主动脉采血,留取血清;留取肝左叶相同部位以福尔马林缓冲液固定;其余组织保存于液氮罐中待测。
4 大鼠血清生化指标测定
全自动生化分析仪检测各组大鼠血清总胆红素(total bilirubin, TBIL)、直接胆红素(direct bilirubin, DBIL)、谷丙转氨酶(alanine aminotransferase, ALT)和谷草转氨酶(aspartate aminotransferase, AST)。
5 HE染色观察肝组织病理学变化
常规脱水、石蜡包埋、切片、HE染色,光学显微镜下观察肝病理学变化。
6 肝超微结构观察
造模第28d,取各组大鼠肝左叶相同部位肝组织,切成大小约0.1cm3组织块,2.5%戊二醛固定6h后,常规电镜技术包埋、超薄切片、醋酸铀-柠檬酸铅双染色,透射电镜(JEM-2100F)观察、拍照。
7 大鼠肝组织超氧化物歧化酶活性和丙二醛含量测定
制备1%肝匀浆,采用考马斯亮兰法测定肝组织中蛋白浓度;分别采用黄嘌呤氧化酶法、硫代巴比测定肝组织超氧化物歧化酶(superoxide dismutase,SOD)活性及丙二醛(malondialdehyde,MDA)含量。
8 肝组织HMGB1表达的免疫组织化学法检测
肝组织石蜡切片常规脱蜡,PV二步法免疫组织化学染色。 HMGB1多克隆抗体工作浓度1∶400;阴性对照为PBS代替一抗。染色完成后光镜下摄片,应用Image-Pro Plus 6.0测定其平均光密度值(OD)代表HMGB1免疫组织化学表达水平。
9 统计学分析
用SPSS 20.0 进行统计学分析,数据用均数±标准差(s)表示。多组间计量资料比较采用单因素方差分析,组内两两比较采用LSD和SNK检验,以P<0.05为差异有统计学意义。
结 果
1 激活PPARγ改善异烟肼与利福平合用所致大鼠肝损伤生化指标
生化分析显示,与正常大鼠比较,以异烟肼与利福平合用致肝损伤的模型组大鼠血清TBIL和DBIL水平明显升高,而血清ALT和AST水平无明显变化。以PPARγ激动剂15d-PGJ2处理的肝损伤大鼠,其血清TBIL、DBIL水平与未用15d-PGJ2处理的模型组大鼠相比明显降低(表1)。
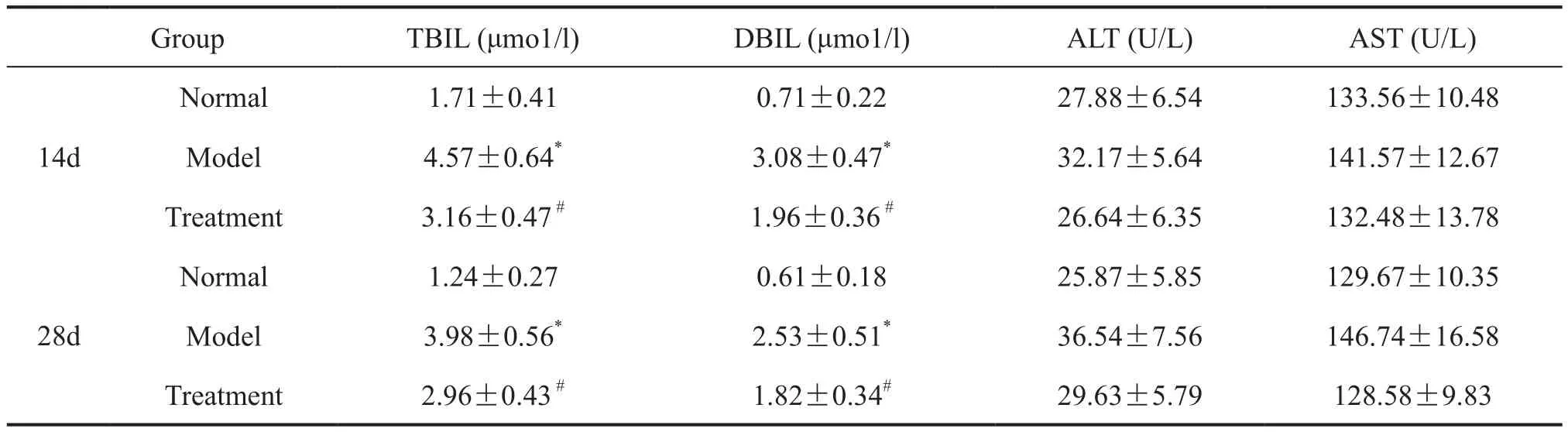
表1 15d-PGJ2对异烟肼与利福平合用致肝损伤大鼠肝生化指标的影响Tab. 1 The effect of 15d-PGJ2 on hepatic biochemical parameters of the rats treated with both isoniazid and rifampicin
2 激活PPARγ改善异烟肼与利福平合用所致大鼠肝损伤的病理学变化
HE染色光镜观察显示,正常组大鼠肝小叶结构完整,肝细胞索围绕中央静脉呈放射状排列,肝细胞形态正常(图1A);14d模型组大鼠肝细胞可见不同程度的空泡变性和脂肪变性,以后者为著,部分小叶内可见点状坏死和炎细胞浸润(图1B);28d模型组小叶内可见明显肝细胞点灶性坏死、炎细胞浸润和界面炎改变(图1C);而14d、28d 15d-PGJ2处理组大鼠肝细胞脂肪变性、炎症浸润及坏死均较模型组显著改善(图1D,图1E)。
透射电镜下见28d 正常组大鼠肝细胞核膜间隙均匀,线粒体及粗面内质网结构基本正常,胞浆内可见丰富的糖原颗粒,少量溶酶体和脂滴(图2A);28d 模型组大鼠肝细胞线粒体肿胀、嵴破坏,结构模糊;粗面内质网断裂,扩张明显;胞浆内脂滴增多增大,糖原颗粒减少(图2B);28d 15d-PGJ2处理组大鼠肝细胞线粒体少量空泡变性,嵴轻度破坏,结构基本清晰;粗面内质网轻度扩张,无断裂;胞浆内有少量脂滴,较模型组显著改善(图2C)。

图1 15d-PGJ2对异烟肼与利福平合用大鼠肝病理学的影响(HE染色)。A,正常组;B,14d模型组;C,28d模型组;D,14d 15d-PGJ2处理组;E,28d 15d-PGJ2处理组;比例尺,100μmFig. 1 The efect of 15d-PGJ2 on liver pathology of the rats treated with both isoniazid and rifampicin. A, Normal group; B, 14d Model group; C, 28d Model group; D, 14d Treatment group; E, 28d Treatment group; scale bar, 100μm
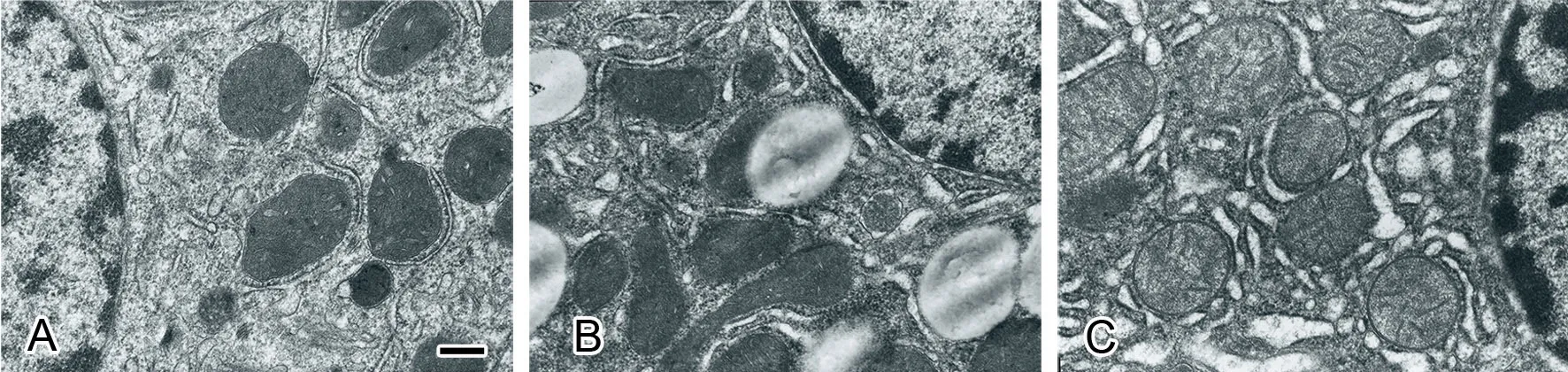
图2 15d-PGJ2对异烟肼与利福平合用大鼠肝超微病理学的影响。A,正常组;B,28d模型组;C,28d 15d-PGJ2处理组;比例尺,200nmFig. 2 The efect of 15d-PGJ2 on liver ultrastractural pathology of the rats treated with both isoniazid and rifampicin. A, Normal group; B, 28d Model group; C, 28d Treatment group; scale bar, 200nm
3 激活PPARγ使异烟肼与利福平合用大鼠肝组织SOD活性升高和MDA含量降低
与正常组比较,14d和28d模型组肝组织内SOD活性降低,MDA含量升高。与模型组相比,14d和28d 15d-PGJ2处理组肝组织SOD活性明显升高,MDA含量明显降低(表2)。
4 激活PPARγ降低异烟肼与利福平合用大鼠肝组织HMGB1免疫反应性
免疫组织化学检测显示,正常组肝细胞仅少数肝细胞质浆和细胞核内呈弱HMGB1免疫反应性(图3A)。与正常组比较,模型组肝细胞HMGB1免疫反应性显著增强:14d模型组以胞质表达为主,28d模型组以胞核表达为主,同时可见肿胀、核固缩的肝细胞胞浆及炎症浸润区表达增强,Kupfer细胞和淋巴细胞也可见表达(图3B,图3C)。在15d-PGJ2处理组,肝细胞HMGB1免疫反应性较模型组显著降低(图3D,图3E)。
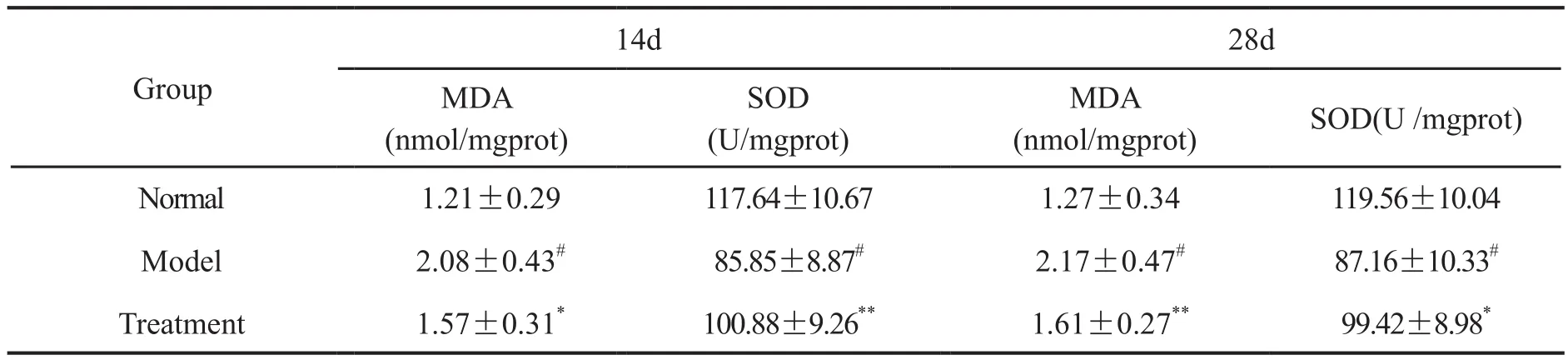
表2 15d-PGJ2对异烟肼与利福平合用大鼠肝匀浆SOD活性和MDA含量的影响Tab. 2 The effect of 15d-PGJ2 on SOD activity and the MDA content in the liver tissue homogenate of the rats treated with both isoniazid and rifampicin
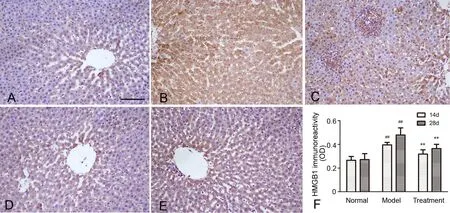
图3 15d-PGJ2对异烟肼与利福平合用大鼠肝组织内HMGB1免疫反应性的影响。A,正常组;B,14d模型组;C,28d模型组;D,14d 15d-PGJ2处理组;E,28d 15d-PGJ2处理组;比例尺,100μm;F,肝组织内HMGB1免疫反应性统计学分析;##,与正常组比较,P<0.01;**,与模型组比较,P<0.01Fig. 3 The efect of 15d-PGJ2 on hepatic HMGB1 immunoreactivity of the rats treated with both isoniazid and rifampicin. A, Normal group; B, 14d Model group; C, 28d Model group; D, 14d Treatment group; E, 28d Treatment group; scale bar, 100μm; F, statistical analysis of hepatic HMGB1 immunoreactivity;##, P<0.01, compared with Normal group; **, P<0.01, compared with Model group
讨 论
与我们前期实验结果相似[2],本实验结果显示异烟肼、利福平合用可致大鼠药物性肝损伤,生化上表现为胆汁淤积,病理学上表现为肝细胞脂肪变性、炎细胞浸润及点灶状坏死等,超微结构上表现肝细胞线粒体结构破坏、内质网扩张、胞浆内脂滴增多等。PPARγ属于核激素受体PPARs家族中一员,在糖脂代谢、肿瘤及炎症信号通路等起着重要调节作用,其通过减少中性粒细胞浸润、增强单核巨噬吞噬作用、抑制NF-κB信号通路等机制在多种炎症性疾病中发挥抗炎保护作用[4-5]。15d-PGJ2为PPARγ强有力激活剂,给予15d-PGJ2干预后,大鼠肝病理学变化及超微结构明显改善,表明激活PPARγ可减轻异烟肼、利福平合用所致的大鼠肝损伤。
Chowdhury等研究发现,异烟肼和利福平合用可引起CYP2E1高表达从而导致氧化应激和线粒体损伤[7]。本实验显示模型组肝组织内SOD活性降低,MDA含量升高,电镜下表现为线粒体结构破坏及粗面内质网扩张,与前述文献一致[7]。Zhang等[8]研究显示,PPARγ激活后可增加非酒精性脂肪肝中SOD、GSH含量,同时降低MDA水平。PPARγ活化后亦可减少大鼠脑动脉和人类脐静脉内皮细胞ROS的产生[9]。本实验中15d-PGJ2处理组大鼠肝组织匀浆MDA含量降低、SOD含量升高,提示PPARγ激活后可能通过抗氧化应激改善异烟肼、利福平合用所致的大鼠肝损伤。
HMGB1作为强有力的促炎因子,参与多种肝病的发生和发展[10]。我们前期研究已证实HMGB1表达增加和分布异常与异烟肼、利福平合用所致大鼠肝损伤发生发展相关[2]。文献报道,PPARγ激动剂罗格列酮可抑制 RAW 264.7 细胞株中LPS诱导的HMGB1释放[11]。PPARγ激动剂曲格列酮可抑制内皮细胞中HMGB1表达[12]。本实验研究发现,通过激活PPARγ可下调异烟肼、利福平合用所致的肝HMGB1表达;同时可减轻肝损伤,提示PPARγ/HMBG1途径可能为PPARγ激活改善异烟肼、利福平合用所致大鼠肝损伤的重要机制之一,HMGB1表达和分布至少部分受到PPARγ调控。许多文献资料指出,HMGB1的转位是ROS依赖的过程,氧化应激可促进HMGB1的转位和释放,释放后的HMGB1可进一步介导炎症瀑布反应[1,10,13-14]。因此我们推测抗氧化作用可能为PPARγ调控HMBG1表达和分布的一个重要途径之一。
[1] Tsung A, Tohme S, Billiar TR. High-mobility group box-1 in sterile infammation. J Intern Med, 2014, 276(5)∶ 425-443.
[2] 何雪, 宋育林, 王莉,等. 吡咯烷二硫代氨基甲酸盐对抗结核药所致肝损伤时高迁移率族蛋白 B1 表达的影响. 中国临床药理学杂志,2015,31(7):519-522.
[3] Luconi M, Cantini G, Serio M. Peroxisome proliferator-activated receptor gamma (PPARγ)∶ is the genomic activity the only answer? Steroids, 2010, 75(8)∶ 585-594.
[4] Croasdell A, Dufney PF, Kim N, et al. PPARγ and the Innate Immune System Mediate the Resolution of Infammation. PPAR Res, 2015, 2015∶549691.
[5] Wang G, Liu L, Zhang Y, et al. Activation of PPARγ attenuates LPS-induced acute lung injury by inhibition of HMGB1-RAGE levels. Eur J Pharmacol, 2014, 726∶ 27-32.
[6] Yuan Z, Luo G, Li X, et al. PPARγ inhibits HMGB1 expression through upregulation of miR-142-3p in vitro and in vivo. Cell Signal, 2016, 28(3)∶ 158-164.
[7] Chowdhury A, Santra A, Bhattacharjee K, et al. Mitochondrial oxidative stress and permeability transition in isoniazid and rifampicin induced liver injury in mice. J Hepatol, 2006, 45(1)∶ 117-126.
[8] Zhang Y, Cui Y, Wang XL, et al. PPARα/γ agonists and antagonists differently affect hepatic lipid metabolism, oxidative stress and inflammatory cytokine production in steatohepatitic rats. Cytokine, 2015, 75(1)∶ 127-135.
[9] Wang P, Li B, Cai G, et al. Activation of PPAR-γ by pioglitazone attenuates oxidative stress in aging rat cerebral arteries through upregulating UCP2. J Cardiovasc Pharmacol, 2014, 64(6)∶ 497–506.
[10] Chen R, Hou W, Zhang Q, et al. Emerging role of High-mobility group box 1 (HMGB1) in liver diseases. Mol Med, 2013, 19(1)∶ 357-366.
[11] Hwang JS, Kang ES, Ham SA, et al. Activation of peroxisome proliferator-activated receptor by rosiglitazone inhibits lipopolysaccharide- induced release of high mobility group box 1. Mediators Infamm, 2012, 2012∶ 352807.
[12] Gao M, Hu Z, Zheng Y, et al. Peroxisome proliferator-activated receptor γ agonist troglitazone inhibits high mobility group box 1 expression in endothelial cells via suppressing transcriptional activity of nuclear factor κB and activator protein 1. Shock, 2011, 36(3)∶ 228-234.
[13] Yu Y, Tang D, Kang R. Oxidative stress-mediated HMGB1 biology. Front Physiol, 2015, 6∶ 93.
[14] A Nogueira-Machado J, M de Oliveira Volpe C. HMGB-1 as a target for infammation controlling. Recent Pat Endocr Metab Immune Drug Discov, 2012, 6(3)∶ 201-209.
Activation of PPARγ inhibits rat liver injury and HMGBl overexpression induced by isoniazid and rifampicin
He Xue1,2, Song Yulin1*, Wang Li3, Hong Rutao1, Hu Wen4
(1Anhui Key Laboratory of Digestive Diseases, Department of Gastroenterology, The First Affiliated Hospital of Anhui Medical University, Hefei 230022, China;2Department of Gastroenterology, Chaohu Hospital of Anhui Medical University, Chaohu 238000, China;3Department of Pediatrics, The Fourth Affiliated Hospital of Anhui Medical University, Hefei 230000, China,4Department of Pathology, Anhui Provincial Hospital, Hefei 230001, China)
ObjectiveTo Study the efect of activation of peroxisome proliferator-activated receptor γ (PPARγ) on rat liver injury induced by isoniazid and rifampicin.MethodsThe model of rat liver injury was established by combined treatment of isoniazid and rifampicin. PPARγ was activated by 15d-PGJ2. The rats were killed on 14d and 28d of model establishment, respectively. The serum levels of total bilirubin (TBIL), direct bilirubin (DBIL), alanine aminotransferase (ALT) and aspartate aminotransferase (AST) were measured. The pathological and ultrastructural changes of the liver tissue were observed. The activity of superoxide dismutase (SOD) and level of malondialdehyde (MDA) in the liver tissue were examined. The expression of high mobility group box 1 (HMGBl) was detected by Immunohistochemistry.ResultsIn the models of rat liver injury induced by isoniazid and rifampicin, the serum TBIL and DBIL increased obviously, the hepatic SOD activity signifcantly decreased, and the hepatic MDA content increased. Hepatic steatosis and infammatory cell infltration were observed, as well as structural damage of the mitochondrium and endoplasmic reticulum in hepatocytes. HMGBl immunoreactivity increased. Activation of PPARγ by 15d-PGJ2 obviously inhibited the changes above.ConclusionActivation of PPARγ by 15d-PGJ2 can protect against the liver injury induced by isoniazid and rifampicin viaantioxidation and inhibiting HMGB1 expression.
Peroxisome proliferator-activated receptor γ; high mobility group box 1; liver injury; isoniazid; rifampicin
R575
A
10.16705/ j. cnki. 1004-1850.2017.02.006
2016-12-19
2017-04-10
安徽省自然科学基金资助项目(NO.1208085MH155)
何雪(1989年),女,汉族,住院医师
*通讯作者(To whom correspondence should be addressed):ylsongcn@163.com
