北京河流底栖硅藻沿城乡梯度带空间分布及其季节变化
2017-06-22周伟奇李伟峰
陈 向,周伟奇,李伟峰
1 中国科学院生态环境研究中心,城市与区域生态国家重点实验室, 北京 100085 2 中国科学院大学, 北京 100049
北京河流底栖硅藻沿城乡梯度带空间分布及其季节变化
陈 向1, 2,周伟奇1,2,*,李伟峰1
1 中国科学院生态环境研究中心,城市与区域生态国家重点实验室, 北京 100085 2 中国科学院大学, 北京 100049
研究了北京市区沿城乡梯度带河流底栖硅藻的空间分布及其季节变化特征。通过在2014年的春季、夏季和秋季在山区对照溪流、城市上游河道和城市下游河道3个样区,共23个样点进行了底栖硅藻样品采集。分析表明,主要优势种的空间差异明显。在对照溪流,主要优势种为极小曲丝藻(Achnanthidiumminutissimum);在城市上游河道,主要优势种分别为短文假十字脆杆藻(Pseudostaurosirabrevistriata)和连结十字脆杆藻腹面变种(Staurosiraconstruensvar.venter);在城市下游河道,主要优势种为谷皮菱形藻(Nitzschiapalea)。然而,3个样区内的主要优势种相对丰度季节变化较小(P>0.05)。其中,A.minutissimum及P.brevistriata的季节变化特征均为春季>秋季>夏季,而S.construensvar.venter及N.palea的季节变化特征均为春季>夏季>秋季。结果发现,北京市城乡梯度带的河流硅藻种类组成差异较大,但主要优势属种季节变化相对较小,表明硅藻种类能较好地反映城乡梯度带的河流环境变化状况,可用于北京市河流水质生物监测。
底栖硅藻;季节变化;城市河流;城乡梯度;北京
城市化的快速发展对城市河流生态系统产生了重要影响。但相关研究主要集中在城市河道水文和地貌的改变[1],水体营养盐浓度的升高[2],以及污染物种类的增加[3]等方面,而对水生生物特别是藻类等初级生产者的研究尚显不足[4-5]。底栖硅藻是河流生态系统主要的初级生产者,其生物多样性甚至超过绿藻、蓝藻及金藻等藻类[6]。由于其具有分布范围广,迁移速度慢,生命周期短,以及对周围环境变化敏感等特性,在国内外常被用于河流水质生物监测及河流生态系统健康评价[7-9]。我国河流生物监测和生态系统健康评价起步较晚,相关基础资料相对较少,尚未建立起基于硅藻的生物监测与评价方法和体系。
了解硅藻种类组成的季节变化特征,能更准确地评价河流生态状况,并对理解城市化影响河流生态系统的种群演替具有重要意义[10]。例如,在英国,Kelly等人[7]对大多数河流开展了春季和秋季的硅藻采样,并对河流健康状况进行了分类与评价。在美国,National Water Quality Assessment(NAWQA)项目常年对硅藻进行采样,并将其作为水质评价的一部分[11-12]。在北京的一项研究显示,硅藻能很好地反映城市化对城市河流的影响过程[13]。如在受城市化影响较小的山区溪流中,清洁种极小曲丝藻(Achnanthidiumminutissimum)为主要优势种;在城市上游河道,短文假十字脆杆藻(Pseudostaurosirabrevistriata)和连结十字脆杆藻腹面变种(Staurosiraconstruensvar.venter)为主要优势种;而在城市下游河道,耐污种谷皮菱形藻(Nitzschiapalea)为主要优势种。但是该项研究主要是基于夏季的采样,而在不同季节,在城市化影响下的硅藻种类分布是否存在相同的特征尚不清楚。
本文以北京市为例,重点研究城市河流底栖硅藻组成的空间特征及其季节变化规律,主要的研究目的包括:1)探讨河流底栖硅藻沿城乡梯度带的分布特征;2)研究河流底栖硅藻在不同梯度带的季节变化规律。研究可为建立基于硅藻的北京市河流生态健康评价方法提供基础数据。
1 材料与方法
1.1 研究区域及样点设置
北京市位于我国华北平原北部地区,属典型的北温带半湿润大陆性季风气候。1980—2014年间,年平均温度为12.9℃,夏季平均温度为25.8℃,春秋季平均温度在13—14℃左右,冬季平均温度为-1.38℃。年降水量平均为538.2 mm,降水主要发生在6—9月份,约占全年降水量的80%左右。全市面积16410.54 km2,建设用地面积1505 km2。2014年,常住人口2151.6万人,城镇人口1859万人,占常住人口的86.4%;GDP为21330.8亿元,人均GDP达99995元/人[14]。北运河水系是北京市5条主要的水系之一,发源于燕山山脉,全长89.4 km,流域面积4348 km2,贯穿北京市主要城区,是北京市中心城区的主要泄洪和排污河道[15]。2014年12月南水北调工程开通之前,密云水库是是北京市的主要饮用水来源,并通过京密引水渠到达颐和园附近的团城湖供给各自来水厂,其余的水继续从京密引水渠及长河等河道供向市中心(S8—S13),补充市区居民部分生活及工业用水和各大河流与湖泊的景观用水。
根据本文的研究目的,分别在2014年的春季(5月)、夏季(8月)和秋季(11月)进行了采样。以前期的研究为基础[13],本次研究中,在北运河水系的河流中共设置了23个采样点。其中,在人类活动较少,森林植被覆盖度高的山区溪流设置了7个对照样点(S1—S7)。在人类干扰强度较大,建设面积比例较高的五环城区内,共设置了16个采样点,包括城市上游河道共有6个采样点(S8—S13),城市下游河道共有10个采样点(S14—S23)(图1)。研究表明,五环内上下游河道的水质差异明显(表1),城市上游河道样点水质指标浓度显著低于城市下游河道样点(P<0.05)。
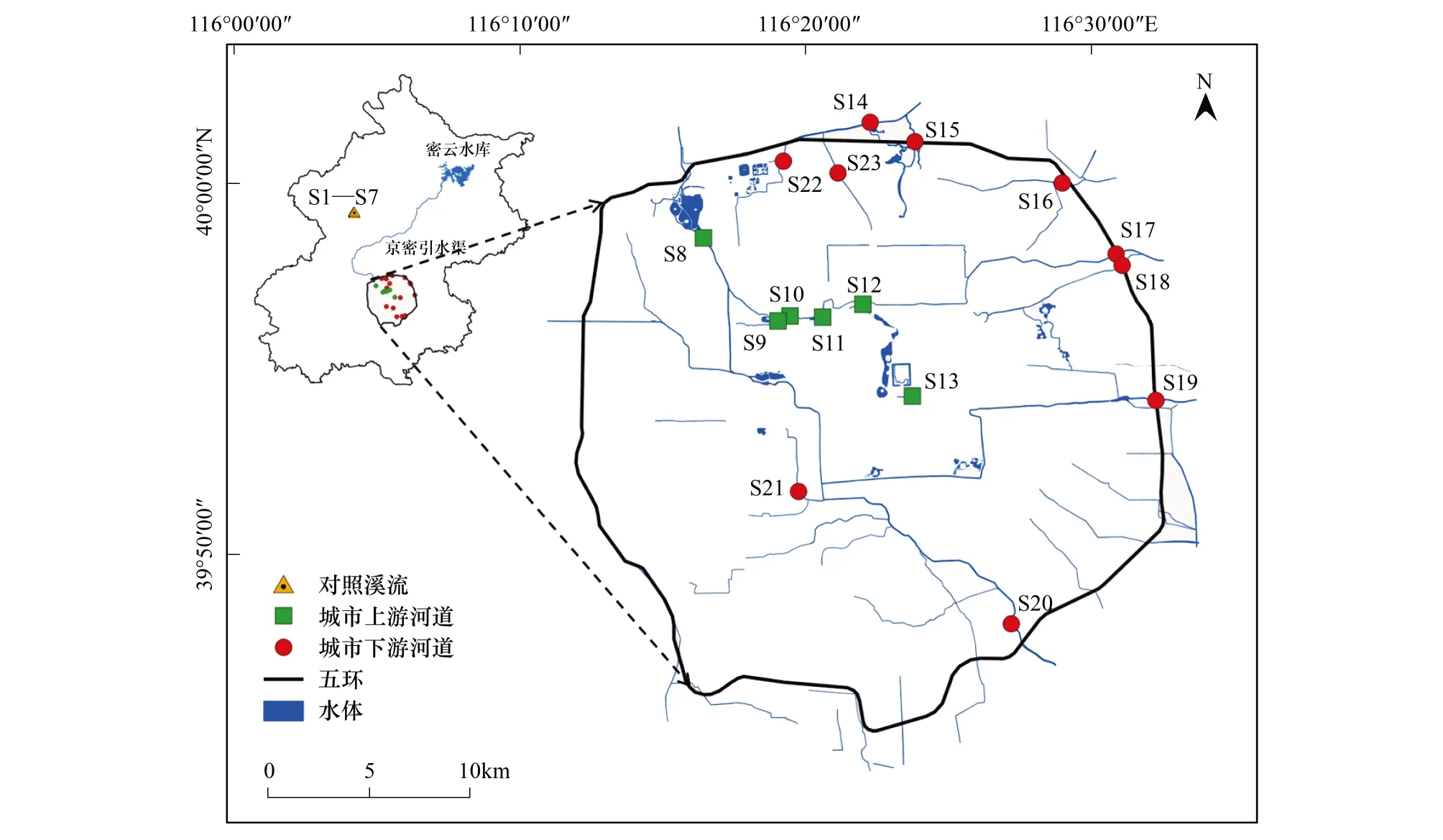
图1 研究区域及样点分布情况Fig.1 The locations of the urban sampling sites within the fifth ring road, and the reference stream sites图中“S”代表不同样点
1.2 样品采集与处理
在采集硅藻时用硬质牙刷将底质上的附着硅藻刷在容器中,并用蒸馏水将底质冲洗干净,然后将刷取到的样品倒入刻度为100 mL的透明瓶中,并定容至100 mL,样品按4%的比例加甲醛溶液固定,用于底栖硅藻的种类鉴定和定量分析。为了能充分反映采样地点的硅藻群落结构,在选择的采样点范围内对不同生境梯度的自然底质进行硅藻采集,每个采样点采集3—5个石块[16]。
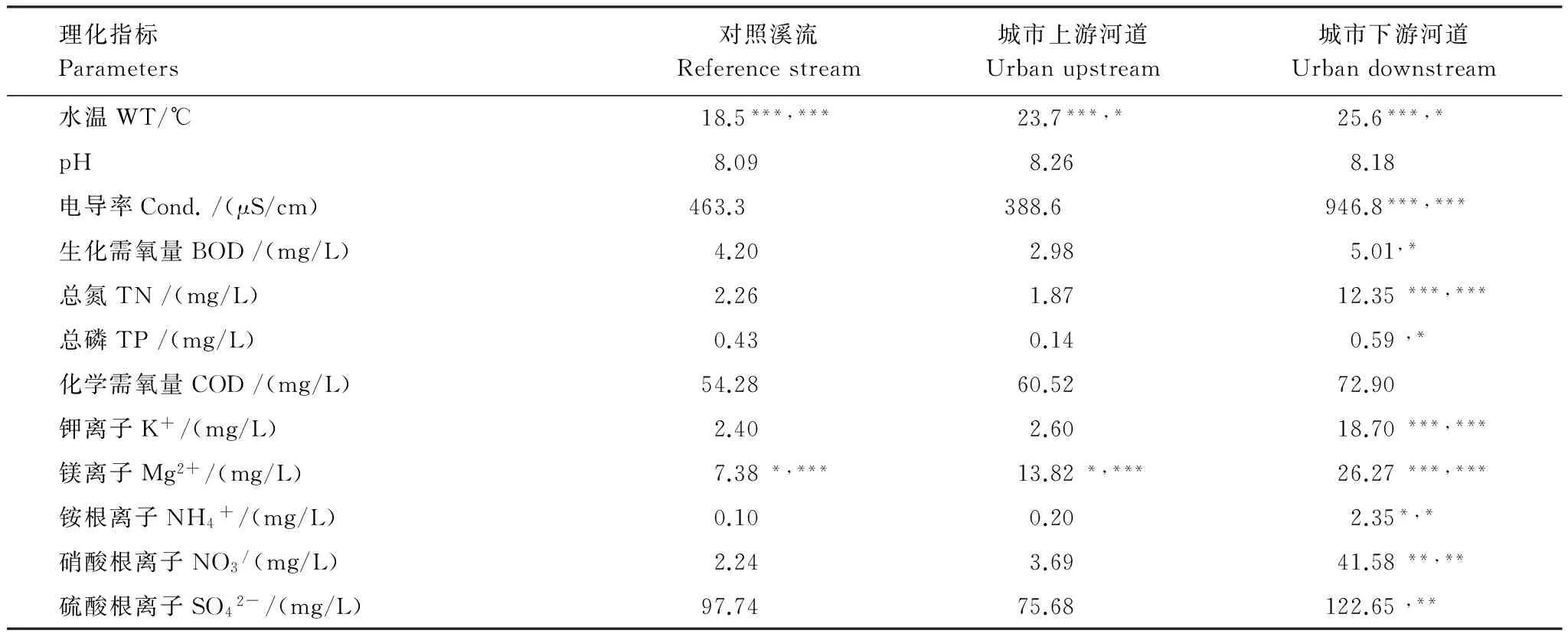
表1 不同采样区的水体理化因子情况
*P≤0.05; **P≤0.01; ***P≤0.001
实验室内将甲醛固定的硅藻样品进行前期处理,并用折射率为1.74的Naphrax®封片胶将样品做成永久玻片,然后在Olympus BX51型光学显微镜下用100倍的油镜进行镜检,每个玻片镜检的硅藻壳数量在500个左右[8]。硅藻种类的鉴定主要参考胡鸿钧和魏印心[17]、Krammer 和 Lange-Bertalot[18]系统分类书及美国密歇根州立大学自然科学研究院帕特里克环境研究中心的标准硅藻图谱(http://diatom.ansp.org/)。
1.3 数据分析
数据分析前,将硅藻种类的相对丰度和水质指标进行log10(X+1)的对数化处理。用单因素方差分析法(One-Way ANOVA)检验不同季节的硅藻组成及各水质指标在对照溪流、城市上游河道及城市下游河道的差异显著性(LSD法,α=0.05)。单因素方差分析在IBM SPSS 19.0软件中完成。
2 结果
2.1 底栖硅藻空间分布特征
本次研究中,共鉴定出硅藻64属200种(包括亚种和变种)。优势属主要有曲壳丝属(Achnanthidium)、卵形藻属(Cocconeis)、小环藻属(Cyclotella)、脆杆藻属(Fragilaria)、异极藻属(Gomphonema)、舟形藻属(Navicula)、菱形藻属(Nitzschia)、假十字脆杆藻属(Pseudostaurosira)及十字脆杆藻属(Staurosira)等(图2)。
3个样区的主要优势属差异明显。其中,对照溪流的主要优势属为Achnanthidium,平均相对丰度达38.3%,高于Nitzschia(16.88%)及Navicula(10.89%)等优势属。其主要优势种为Achnanthidiumminutissimum。而在城市上游河道,主要优势属为Pseudostaurosira和Staurosira,平均相对丰度分别为20.88%和18.03%,高于Achnanthidium(17.00%)及Fragilaria(11.42%)等优势属。主要优势种分别为Pseudostaurosirabrevistriata和Staurosiraconstruensvar.venter。虽然该样区Achnanthidium的平均相对丰度与主要优势属Pseudostaurosira和Staurosira的平均相对丰度相差较小,但其主要是在城市上游河道的S8样点中较高,平均相对丰度为29.68%,而在该样区其它样点相对丰度则相对较低,平均为13.43%。城市下游河道的主要优势属为Nitzschia,平均相对丰度为34.08%,高于Cyclotella(11.14%)及Achnanthidium(10.94%)等优势属。主要优势种为Nitzschiapalea,平均相对丰度为21.7%。

图2 对照溪流、城市上游河道和城市下游河道优势属相对丰度季节变化情况Fig.2 Seasonal variation of the relative abundance of Achnanthidium, Cocconeis, Cyclotella, Fragilaria, Gomphonema, Navicula, Nitzschia, Pseudostaurosira, Staurosira in reference stream, urban upstream, and urban downstream
2.2 主要优势属的季节变化特征2.2.1 不同样区主要优势属的相对丰度季节变化特征
总体上,3个样区的主要优势属相对丰度季节变化较小(图2)。在对照溪流,Achnanthidium的平均相对丰度在春季时为34.03%,在夏季为37.31%,均低于秋季的43.65%,但季节差异均不显著(P>0.05)。在城市上游河道,Pseudostaurosira和Staurosira的平均相对丰度在春季时分别为19.11%和23.38%,高于夏季的16.79%和18.78%及秋季的18.18%和20.49%,但季节差异均不显著(P>0.05)。在城市下游河道,Nitzschia的相对丰度在春季时为35.71%,在夏季为39.27%,均高于秋季的27.25%,季节差异不显著(P>0.05)。
2.2.2 不同样区主要优势属相对丰度季节变化差异特征
在各样区中,主要优势属的相对丰度季节变化差异程度不同,但主要优势属的相对丰度在春季的变化均大于夏季和秋季(图3)。在对照溪流,Achnanthidium的相对丰度季节变化差异为春季>秋季>夏季。在城市上游河道,Pseudostaurosira的相对丰度与其他优势属季节变化差异相比较小,但仍表现为春季>秋季>夏季。而Staurosira的相对丰度季节变化差异为春季>夏季>秋季。在城市下游河道,Nitzschia的相对丰度季节变化差异为春季>夏季>秋季。
2.2.3 不同样区内部硅藻季节变化特征
在不同样区,主要优势属的季节变化差异为城市下游河道>对照溪流>城市上游河道。而在3个样区内部,硅藻的季节变化主要体现为优势属的季节变化及主要优势属相对丰度的季节变化(图3)。在不同样区的部分样点中,优势属季节变化明显。如在对照溪流,在春季,S2样点优势属Navicula,Achnanthidium,Nitzschia的相对丰度均在20%以上,而在夏季,Cocconeis,Achnanthidium的相对丰度分别为33.14%和21.63%,在秋季,Nitzschia的相对丰度达41.57%。在S5样点的春季,Achnanthidium的相对丰度为78.43%,而在夏季,优势属Cocconeis的相对丰度达67.41%,但在秋季,Achnanthidium的相对丰度增加到30.14%,Cocconeis的相对丰度为12.64%。在城市上游河道的S8样点,在春季时,Fragilaria相对丰度为45.5%,而在夏季和秋季,Achnanthidium分别为41.07%和51.06%。城市下游河道的S17样点,在春季,Nitzschia相对丰度达80.74%;在夏季,Nitzschia相对丰度下降到36.29%,Cyclotella相对丰度为17.55%,Navicula为23.47%;在秋季,Nitzschia相对丰度为17.27%,但麦尔藻属(Mayamaea)相对丰度达57.54%,其主要种类为原子麦尔藻(Mayamaeaatmous, 51.82%)。
而在其它部分样点中,主要优势属相对丰度的季节变化明显。如在对照溪流,春季时S1样点的Achnanthidium相对丰度为3.99%,而在夏季和秋季,其相对丰度分别增加到54.63%和57.06%。而在城市上游河道,春季时,S13样点主要优势属Pseudostaurosira相对丰度为45.79%,Achnanthidium为7.14%。而在夏季和秋季,Pseudostaurosira分别为25.3%和23.57%,而Achnanthidium分别为39.44%和23.57%。在城市下游河道,春季时S15样点的Fragilaria相对丰度为34.21%,Achnanthidium为30.26%,Nitzschia为26.13%;在夏季,Fragilaria相对丰度降低到6.65%,Achnanthidium为48.29%,Nitzschia为27.38%;而在秋季,Fragilaria为10.4%,Achnanthidium为14.38%,Nitzschia为39.86%。

图3 23个样点主要优势属组成及季节变化情况Fig.3 Composition of dominant genus of Achnanthidium, Cocconeis, Cyclotella, Fragilaria, Gomphonema, Navicula, Nitzschia, Pseudostaurosira, and Staurosira in 23 sampling sites during spring, summer, and autumn
2.3 主要优势种相对丰度的季节变化特征2.3.1 不同样区主要优势种的相对丰度季节变化特征
3个样区的主要优势种相对丰度季节变化较小。A.minutissimum为对照溪流的主要优势种,在该样区的平均相对丰度为20.51%。其秋季的平均相对丰度为25.23%,高于春季的18.07%和夏季的17.44%,但差异不显著(P>0.05)。P.brevistriata与S.construensvar.venter为城市上游河道的主要优势种,在该样区的平均相对丰度分别为 21.72%和20.17%。春季的平均相对丰度分别为19.11%和22.21%,高于夏季的16.79%和16.71%,及秋季的18.18%和18.86%,但季节差异不显著(P>0.05)。N.palea为城市下游河道的主要优势种,在该样区的平均相对丰度为21.7%。其春季的平均相对丰度为18.43%,低于夏季的24.74%,高于秋季的13.2%,但均无显著差异(P>0.05)。
2.3.2 不同样区主要优势种相对丰度季节变化差异特征
各样区主要优势种的相对丰度季节变化差异程度不同(图4),但主要优势种的相对丰度在春季的变化均大于夏季和秋季。在对照溪流,A.minutissimum的相对丰度季节变化差异为春季>秋季>夏季。在城市上游河道,P.brevistriata的相对丰度与其他优势属季节变化差异同样为春季>秋季>夏季。而S.construensvar.venter的相对丰度季节变化差异为春季>夏季>秋季。在城市下游河道,N.palea的相对丰度季节变化差异为春季>夏季>秋季。
2.3.3 不同样区内部主要优势种季节变化特征
在不同样区,主要优势种的季节变化差异为城市下游河道>对照溪流>城市上游河道。而在不同样区的部分样点中,主要优势种的相对丰度季节变化较大(图4)。如A.minutissimum在对照溪流的S1样点,其相对丰度在春季为2.08%,在夏季和秋季,分别增加到22.01%和37.77%。在城市上游河道和城市下游河道,虽然A.minutissimum不是主要优势种,但在少部分样点,如S8、S15等,其相对丰度较高,且季节变化明显。如城市上游河道的S8样点,其相对丰度在春季时为12.7%,在夏季和秋季分别增加到32.32%和44.01%。P.brevistriata与S.construensvar.venter在城市上游河道的相对丰度季节变化相对较小。但在S13样点,P.brevistriata的相对丰度在春季为45.79%,在夏季和秋季,分别下降到25.3%和23.57%。N.palea在城市下游河道中部分样点中季节变化较大。如在S17样点,其相对丰度在春季为57.78%,在夏季和秋季,分别降低到31.56%和2.91%。但在城市下游河道,S14样点的主要优势种为S.construensvar.venter,其平均相对丰度为74.91%,但季节变化较小。
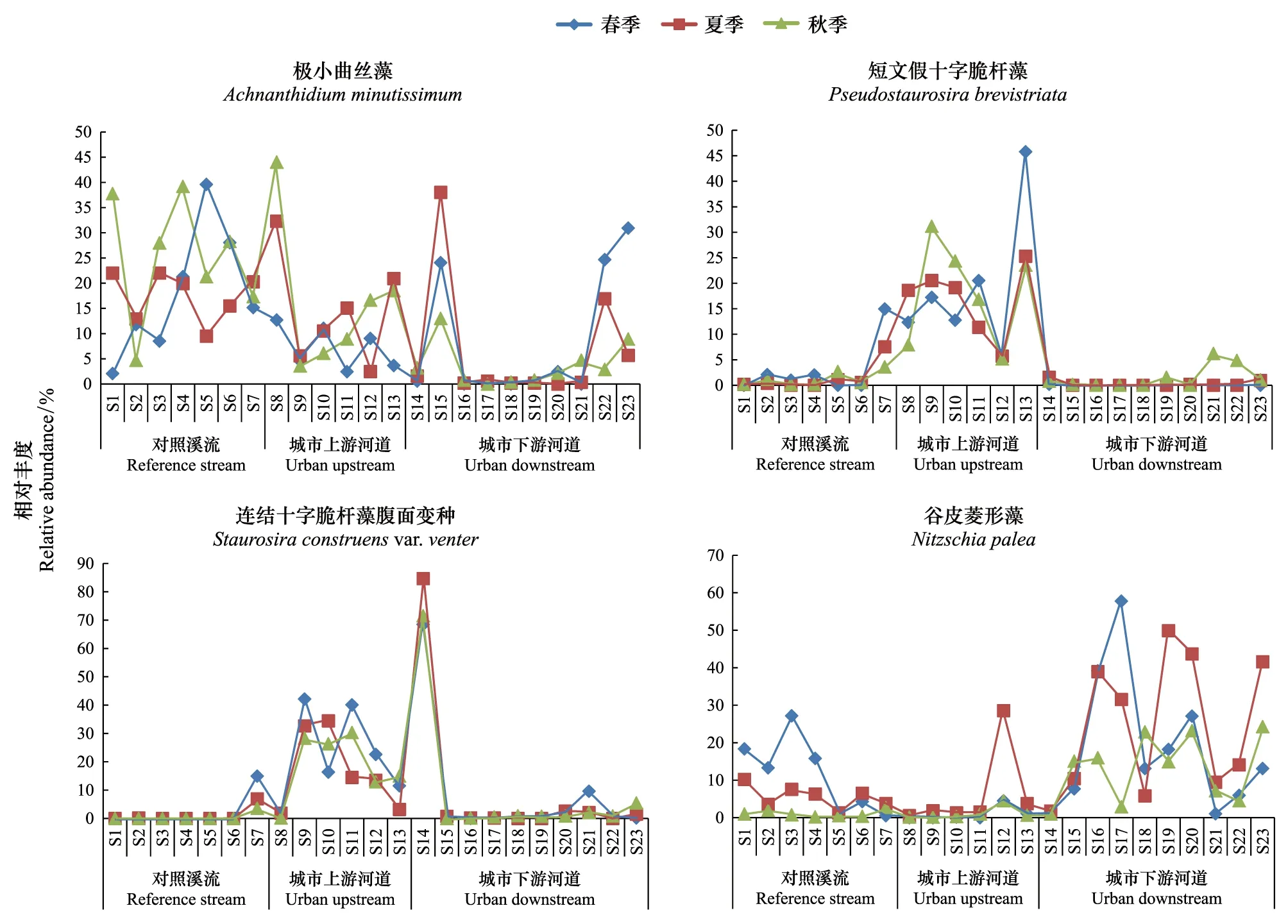
图4 优势种Achnanthidium minutissimum, Pseudostaurosira brevistriata, Staurosira construens var. venter及Nitzschia palea的季节变化Fig.4 Seasonal changes of the dominant species of Achnanthidium minutissimum, Pseudostaurosira brevistriata, Staurosira construens var. venter, and Nitzschia palea in the sampling sites
3 讨论
结果表明,总体上,3个样区之间的硅藻主要优势属种差异明显(图2)。其中,Achnanthidium(A.minutissimum)为对照溪流的主要优势属(种),Pseudostaurosira(P.brevistriata)和Staurosira(S.construensvar.venter)为城市上游河道主要优势属(种),Nitzschia(N.palea)为城市下游河道主要优势属(种)。硅藻组成的空间差异与之前的研究结果一致。这主要与各样区处于不同的环境有关。其中,温度可能是影响硅藻种类分布差异的主要因素之一。城市上游河道和城市下游河道的水温比山区对照溪流高将近5—8℃(P<0.001),呈现明显的城市河流“热岛效应”[19]。Wenger 等人[20]认为,主要可能是由于城市植被覆盖面积少而不透水面积大所产生的热污染,以及在降雨过程中,吸收地表热量后的雨水直接流入到河道中,导致城市中的河流水温较高,从而对硅藻种类组成产生重要影响。
同时,污染物浓度也是各样区硅藻种类差异的重要因素。在山区对照溪流,岸边基本为森林覆盖,大量的林地通过过滤、吸收等作用将地表径流中的营养物截留,同时岸边大量植物根部的微生物通过矿化、转化等作用也降低了水体离子及营养物浓度[21-22],从而使山区溪流水质相对较好,A.minutissimum为主要优势种。但在城市河流中,河道两岸的固化措施虽然缩短了汛期洪水的通过时间,但减少了河流与河岸自然土壤中水分及营养物之间的交换过程[1,23]。同时,由于城市地表径流、污水管网泄漏及部分未经处理的城市污水等因素使大量污染物进入河道中,从而引起城市水体水质恶化,并对水生态系统产生了重要影响[5]。如在本研究中,城市上游河道的第一个样点(S8)为京密引水渠的水体作为北京市景观用水的起始点,其水质仍相对较好,主要优势种与对照溪流类似,均为寡营养型的A.minutissimum[13,24],但在之后的几个样点中(S9—S13),由于受人类活动影响的增加,主要优势种逐渐变为耐中污型的P.brevistriata和S.construensvar.venter[13,25];而在城市下游河道样点中(S15—S23),大量城市污水进入河流,导致污染物的浓度较高,耐污型的N.palea成为主要优势种[13,25]。
虽然3个样区主要优势属种的季节变化较小,但在各样区内部,部分样点的优势属相对丰度季节变化明显。可能是在不同样区的样点,受到的影响因素差异较大。如对照溪流的S1样点位于山区里正在新建公路桥下的一个小型围堰旁边,在春季时,由于融雪等因素的影响,使大量累积的污染物进入到溪流中,使水体营养物浓度升高[26],从而对硅藻种类组成影响较大[27]。如春季时Achnanthidium的相对丰度为3.99%,而Navicula和Nitzschia的相对丰度分别为26.34%和26.86%,并且对S2—S4也产生了同样的影响。但在夏季和秋季,由于雨季大量雨水的冲刷和稀释作用,水体污染物浓度降低[28-29],使该样点的Navicula和Nitzschia均降低到10%—15%左右,而Achnanthidium的相对丰度在夏季和秋季分别增加到54.63%和57.06%。
在北京城市河流中,不同季节降水形成的地表径流对城市水体水质影响明显[14]。地表径流对河流水质的影响主要表现为,在降水产流过程中氮、磷等营养物,病菌,有机污染物及铅、铜、锌等重金属污染物大量进入水体中[30]。早在20世纪90年代,美国EPA发现城市雨水对河流污染的贡献能达9%,并将城市地表径流列为导致美国河流与湖泊水体污染的第三大污染源[31]。研究表明,城市地表径流中TSS、TN和COD等污染物浓度在产流形成后的20 min内能达到峰值,且为径流后期污染物浓度的几十倍[32]。1980—2014年,北京冬季平均降水量为3.2 mm,春季为23.5mm,而夏季达124.6 mm,季节差异十分明显。由于冬季降水很少,春季末夏季初的雨水形成的径流中含有大量高浓度的污染物[26],导致城市上游河道春季的污染物浓度高于夏季和秋季。因此,P.brevistriata和S.construensvar.venter等硅藻优势种的相对丰度在春季时高于夏季和秋季,而A.minutissimum的相对丰度在春季为最低。
城市下游河流中,城市污水处理厂等设施对城市下游河道水质的改善作用明显[33]。目前,污水处理厂排放的再生水已经成为缓解北京水资源紧缺的有效途径[34]。再生水主要用于城市杂用、工业用水、农业灌溉用水及景观用水等方面,不仅能缓解区域水资源短缺的问题,又能改善水环境质量[35-36]。本研究的部分城市下游河道样点在污水处理厂附近。如在S14样点为清河污水处理厂,其再生水日均排放为32万t,对改善清河的水环境有重要作用。研究结果表明,与其他样点相比,S14样点的硅藻主要优势属为耐中污型的Staurosira,优势种为S.construensvar.venter,其平均相对丰度达74.91%,与城市上游河道主要优势属种相同,而耐污型的Nitzschiapalea平均相对丰度为1.26%,远低于城市下游河道18.79%的平均水平。
4 结论
(1)通过在北京城区及对照溪流不同季节的采样,共鉴定出硅藻64属200种(包括亚种和变种),优势属主要有Achnanthidium、Cocconeis、Cyclotella、Fragilaria、Gomphonema、Navicula、Nitzschia、Pseudostaurosira及Staurosira等。
(2)北京城市河流底栖硅藻种类组成空间差异明显。其中,对照溪流的主要优势属为Achnanthidium,主要优势种为A.minutissimum;城市上游河道的主要优势属为Pseudostaurosira及Staurosira,主要优势种为P.brevistriata和S.construensvar.venter;城市下游河道的主要优势属为Nitzschia,主要优势种为N.palea。
(3)在不同样区,主要优势属种季节变化差异为城市下游河道>对照溪流>城市上游河道。各样区主要优势属种的季节变化差异不显著,表现为春季>夏季、秋季。其中,Achnanthidium及A.minutissimum主要表现为春季>秋季>夏季;Pseudostaurosira及P.brevistriata主要表现为春季>秋季>夏季;Staurosira及S.construensvar.venter主要表现为春季>夏季>秋季;Nitzschia及N.palea主要表现为春季>夏季>秋季。
(4)在各样区样点中,主要优势属种的相对丰度季节变化较大。
[1] 陈利顶, 齐鑫, 李芬, 杨丽蓉. 城市化过程对河道系统的干扰与生态修复原则和方法. 生态学杂志, 2010, 29(4): 805- 811.
[2] Pickett S T A, Cadenasso M L, Grove J M, Boone C G, Groffman P M, Irwin E, Kaushal S S, Marshall V, McGrath B P, Nilon C H, Pouyat R V, Szlavecz K, Troy A, Warren P. Urban ecological systems: scientific foundations and a decade of progress. Journal of Environmental Management, 2011, 92(3): 331- 362.
[3] 王和意, 刘敏, 刘巧梅, 侯立军. 城市降雨径流非点源污染分析与研究进展. 城市环境与城市生态, 2003, 16(6): 283- 285.
[4] Paul M J, Meyer J L. Streams in the urban landscape. Annual Review of Ecology and Systematics, 2001, 32(1): 333- 365.
[5] Walsh C J, Roy A H, Feminella J W, Cottingham P D, Groffman P M, Morgan II R P. The urban stream syndrome: current knowledge and the search for a cure. Journal of the North American Benthological Society, 2005, 24(3): 706- 723.
[6] Stevenson R J, Pan Y. Assessing ecological conditions in rivers and streams with diatoms//Stoermer E F, Smol J P, eds. The Diatoms: Applications to the Environmental and Earth Sciences. Cambridge: Cambridge University Press, 1999: 11- 40.
[7] Kelly M, Juggins S, Guthrie R, Pritchard S, Jamieson J, Rippey B, Hirst H, Yallop M. Assessment of ecological status in U.K. rivers using diatoms. Freshwater Biology, 2008, 53(2): 403- 422.
[8] Stevenson R J, Pan Y D, Van Dam H. Assessing environmental conditions in rivers and streams with diatoms//Smol J P, Stoermer E F, eds. The Diatoms: Applications for the Environmental and Earth Sciences. Cambridge: Cambridge University Press, 2010: 57- 85.
[9] 殷旭旺, 渠晓东, 李庆南, 刘颖, 张远, 孟伟. 基于着生藻类的太子河流域水生态系统健康评价. 生态学报, 2012, 32(6): 1677- 1691.
[10] Moore J W. Seasonal succession of algae in a eutrophic stream in southern England. Hydrobiologia, 1977, 53(2): 181- 192.
[11] Potapova M G, Charles D F. Benthic diatoms in USA rivers: distributions along spatial and environmental gradients. Journal of Biogeography, 2002, 29(2): 167- 187.
[12] Potapova M, Charles D F. Diatom metrics for monitoring eutrophication in rivers of the United States. Ecological Indicators, 2007, 7(1): 48- 70.
[13] Chen X, Zhou W Q, Pickett S T A, Li W F, Han L J, Ren Y F. Diatoms are better indicators of urban stream conditions: a case study in Beijing, China. Ecological Indicators, 2016, 60: 265- 274.
[14] 北京市统计局. 北京市2014年国民经济和社会发展统计公报. 北京日报, 2015-02- 12.
[15] Shen Z Y, Hou X S, Li W, Aini G. Relating landscape characteristics to non-point source pollution in a typical urbanized watershed in the municipality of Beijing. Landscape and Urban Planning, 2014, 123: 96- 107.
[16] Battarbee R W, Jones V J, Flower R J, Cameron N G, Bennion H, Carvalho L, Juggins S. Diatoms//Smol J P, Birks H J B, Last W M, eds. Tracking Environmental Change Using Lake Sediments. Terrestrial, Algal, and Siliceous Indicators. Dordrecht: Kluwer Academic Publishers, 2001, 3: 155- 202.
[17] 胡鸿钧, 魏印心. 中国淡水藻类: 系统、分类及生态. 北京: 科学出版社, 2006.
[18] Krammer K, Lange-Bertalot H. Bacillariophyceae. Berlin: Spektrum Akademischer Verlag GmbH Heidelberg, 2000.
[19] Somers K A, Bernhardt E S, Grace J B, Hassett B A, Sudduth E B, Wang S, Urban D L. Streams in the urban heat island: spatial and temporal variability in temperature. Freshwater Science, 2013, 32(1): 309- 326.
[20] Wenger S J, Roy A H, Jackson C R, Bernhardt E S, Carter T L, Filoso S, Gibson C A, Hession W C, Kaushal S S, Martí E, Meyer J L, Palmer M A, Paul M J, Purcell A H, Ramírez A, Rosemond A D, Schofield K A, Sudduth E B, Walsh C J. Twenty-six key research questions in urban stream ecology: an assessment of the state of the science. Journal of the North American Benthological Society, 2009, 28(4): 1080- 1098.
[21] Groffman P M, Boulware N J, Zipperer W C, Pouyat R V, Band L E, Colosimo M F. Soil nitrogen cycle processes in urban riparian zones. Environmental Science & Technology, 2002, 36(21): 4547- 4552.
[22] Dosskey M G, Vidon P, Gurwick N P, Allan C J, Duval T P, Lowrance R. The role of riparian vegetation in protecting and improving chemical water quality in streams. Journal of the American Water Resources Association, 2010, 46(2): 261- 277.
[23] Hopkins K G, Morse N B, Bain D J, Bettez N D, Grimm N B, Morse J L, Palta M M, Shuster W D, Bratt A R, Suchy A K. Assessment of regional variation in streamflow responses to urbanization and the persistence of physiography. Environmental Science & Technology, 2015, 49(5): 2724- 2732.
[24] Rimet F. Recent views on river pollution and diatoms. Hydrobiologia, 2012, 683(1): 1- 24.
[25] Besse-Lototskaya A, Verdonschot P F M, Coste M, Van De Vijver B. Evaluation of European diatom trophic indices. Ecological Indicators, 2011, 11(2): 456- 467.
[26] 孙少晨, 肖伟华, 于翔, 王浩. 寒区河流冰体中污染物融出对水质的影响. 南水北调与水利科技, 2015, 13(4): 664- 666, 680- 680.
[27] Gomà J, Rimet F, Cambra J, Hoffmann L, Ector L. Diatom communities and water quality assessment in Mountain Rivers of the upper Segre basin (La Cerdanya, Oriental Pyrenees). Hydrobiologia, 2005, 551(1): 209- 225.
[28] 任玉芬, 王效科, 韩冰, 欧阳志云, 苗鸿. 城市不同下垫面的降雨径流污染. 生态学报, 2005, 25(12): 3225- 3230.
[29] 陈向, 刘静, 何琦, 林秋奇, 韩博平, 韦桂峰. 东江惠州河流段人工基质附着硅藻群落的季节性动态. 湖泊科学, 2012, 24(5): 723- 731.
[30] 杨柳, 马克明, 郭青海, 赵景柱. 城市化对水体非点源污染的影响. 环境科学, 2004, 25(6): 32- 39.
[31] United States Environmental Protection Agency. National water quality inventory. Report to Congress Executive Summary. Washington DC, US: EPA, 1995.
[32] 黄金良, 杜鹏飞, 欧志丹, 李梅香, 赵冬泉, 何万谦, 王志石. 澳门城市小流域地表径流污染特征分析. 环境科学, 2006, 27(9): 1753- 1759.
[33] Jin L Y, Zhang G M, Tian H F. Current state of sewage treatment in China. Water Research, 2014, 66: 85- 98.
[34] 吕斯丹, 陈卫平, 王美娥. 模型模拟再生水灌溉对土壤水盐运动的影响. 环境科学, 2012, 33(12): 4100- 4107.
[35] Yi L L, Jiao W T, Chen X N, Chen W P. An overview of reclaimed water reuse in China. Journal of Environmental Sciences, 2011, 23(10): 1585- 1593.
[36] Pedrero F, Kalalvrouziotis I, Alarcón J J, Koukoulakis P, Asano T. Use of treated municipal wastewater in irrigated agriculture-review of some practices in Spain and Greece. Agricultural Water Management, 2010, 97(9): 1233- 1241.
Benthic diatom assemblages and their seasonal variation in streams along an urban-rural gradient in the Beijing metropolitan area
CHEN Xiang1, 2, ZHOU Weiqi1, 2 *, LI Weifeng1
1StateKeyLaboratoryofUrbanandRegionalEcology,ResearchCenterforEco-EnvironmentalSciences,ChineseAcademyofSciences,Beijing100085,China2UniversityofChineseAcademyofSciences,Beijing100049,China
Here, we investigated benthic diatom assemblages and their seasonal variation in streams along an urban-rural gradient in the Beijing metropolitan area. The samples were collected from 23 sites (7 from rural reference streams, 6 from upstream urban areas, and 10 from downstream urban areas) across three seasons of 2014, namely, spring (May), summer (August), and autumn (November). A total of 200 diatom species and sub-species belonging to 64 genera were identified during the period of sampling. AlthoughAchnanthidium,Cocconeis,Cyclotella,Fragilaria,Gomphonema,Navicula,Nitzschia,Pseudostaurosira, andStaurosirawere the dominant genera in the sampling sites, the major dominant genera and species differed considerably among the samples. In rural reference streams,Achnanthidiumwas the major dominant genus, with an average relative abundance of up to 40.6%.Achnanthidiumminutissimumwas the major dominant species, with an average relative abundance of 20.51%. In urban upstream sites,PseudostaurosiraandStaurosirawere the major dominant genera, with average relative abundances of 21.72% and 22.18%, respectively.PseudostaurosirabrevistriataandStaurosiraconstruensvar.venterwere the major dominant species, with average relative abundances of 21.72% and 20.17%, respectively. In urban downstream sites,Nitzschiawas the major dominant genus, with an average relative abundance of 37.46%, andNitzschiapaleawas the major dominant species, with an average relative abundance of 21.7%. There was no significant effect of seasonal variation in the relative abundance of the major dominant genera among the three sampling zones (P> 0.05). The relative abundance ofAchnanthidiumin reference streams was 34.03% in spring and 37.22% in summer, both of which were lower than that of 43.75% in autumn (P> 0.05). The relative abundances ofPseudostaurosiraandStaurosirain urban upstream sites were 19.11% and 23.38% in spring, which were higher than those of 16.79% and 18.78% in summer and 18.18% and 20.49% in autumn (P> 0.05). The relative abundance ofNitzschiain urban downstream sites was 35.71% in spring and 39.27% in summer, both of which were higher than that of 27.25% in autumn (P> 0.05). The relative abundance of the major dominant species did not differ significantly in the three seasons. The relative abundance ofA.minutissimumin the reference streams was 18.07% in spring and 17.44% in summer, which were lower than that (25.23%) in autumn (P> 0.05). The relative abundances ofP.brevistriataandS.construensvar.venterin urban upstream sites were 19.11% and 22.21% in spring, respectively, which were higher than the corresponding values of 16.79% and 16.71% in summer, and 18.18% and 18.86% in autumn (P> 0.05). The relative abundance ofN.paleain urban downstream sites was 18.43% in spring and 13.2% in autumn, which were lower than that of 24.74% in summer (P> 0.05). However, the results showed that changes in the relative abundance ofAchnanthidiumandA.minutissimumin reference streams andPseudostaurosiraandP.brevistriatain urban upstream sites were larger in spring than in autumn and summer. Similarly, changes in the relative abundance ofStaurosiraandS.construensvar.venterin urban upstream sites andNitzschiaandN.paleain urban downstream sites were larger in spring than in summer and autumn. Our results indicate that the distribution of diatom assemblages and their seasonal compositions might well reflect differences in urban-rural stream environments and their changes, and thus the diatom assemblages can be used for biological monitoring of streams in Beijing.
benthic diatom; seasonal change; urban stream; urban-rural gradient; Beijing
国家自然科学基金重大项目(41590840)
2016- 02- 20; 网络出版日期:2017- 02- 17
10.5846/stxb201602200302
*通讯作者Corresponding author.E-mail: wzhou@rcees.ac.cn
陈向,周伟奇,李伟峰.北京河流底栖硅藻沿城乡梯度带空间分布及其季节变化.生态学报,2017,37(10):3586- 3595.
Chen X, Zhou W Q, Li W F.Benthic diatom assemblages and their seasonal variation in streams along an urban-rural gradient in the Beijing metropolitan area.Acta Ecologica Sinica,2017,37(10):3586- 3595.
