霍山铁皮石斛多糖的脱蛋白工艺及结构分析
2017-06-22王琳炜欧阳臻张碧娟王笃军于一凡
王琳炜,欧阳臻*,张碧娟,杨 倩,王笃军,于一凡,张 杰,马 青
(江苏大学药学院,江苏 镇江 212013)
霍山铁皮石斛多糖的脱蛋白工艺及结构分析
王琳炜,欧阳臻*,张碧娟,杨 倩,王笃军,于一凡,张 杰,马 青
(江苏大学药学院,江苏 镇江 212013)
优选霍山铁皮石斛多糖脱蛋白工艺,并对其进行分离纯化及结构分析。以蛋白脱除率和多糖损失率为评价指标,比较Sevag法、酶法及酶-Sevag法3 种脱蛋白方法。结果表明,酶-Sevag法脱蛋白效果最佳,蛋白脱除率为81.58%,多糖损失率为15.63%。采用DEAE-52纤维素柱、Sephadex G-100凝胶柱分离纯化石斛多糖,得活性组分DOPA-1;采用紫外扫描光谱、高效液相色谱鉴定DOPA-1为均一多糖;采用气相色谱分析表明组分单糖由甘露糖、葡萄糖和半乳糖组成(各单糖的物质的量比为1∶0.42∶0.27);采用红外光谱和刚果红实验分析糖链结构表明,DOPA-1有典型的糖类特征吸收峰,存在β-D-甘露吡喃糖苷,且具有三股螺旋构象。
铁皮石斛多糖;脱蛋白;分离纯化;结构分析
铁皮石斛为兰科植物铁皮石斛(Dendrobium off i cinale Kimura et Migo)的干燥茎[1],是药食两用的名贵药材之一,具有独特的药用价值。早在我国第一部药学专著《神农本草经》中,就有石斛“除痹,下气,补五脏虚劳,羸瘦,强阴。久服厚肠胃,轻身延年”的记载[2]。目前铁皮石斛主要分布在我国安徽、浙江、湖南、云南、广西等地[3],其中安徽霍山铁皮石斛,又名万丈须,生长条件极为苛刻,作为安徽省道地药材一直倍受社会各界的关注,也被历代研究者奉为石斛中的上品,近年来,关于霍山铁皮石斛的研究渐为盛行[4]。铁皮石斛中含有多糖、生物碱、菲类、联苄类、氨基酸等多种活性成分[5],多糖作为其主要有效成分之一,在抗衰老、抗氧化、抗肿瘤、提高机体免疫力[6-9]等方面具有显著疗效。多糖的生物活性与结构密切相关,目前已成为该领域研究的一大核心问题[10-12]。目前多糖的提取方法较多,但在多糖提取过程中都会伴有蛋白质,蛋白质的存在严重影响多糖结构与活性的进一步研究。所以,蛋白质的脱除成为多糖纯化的一个关键步骤,对多糖品质、结构以及活性的研究有着重要影响,现国内外采用的脱蛋白法主要有:Sevag法、三氯乙酸法、酶法、等电点法、盐酸法等[13]。因此,本实验中以霍山产铁皮石斛为原料,优选霍山铁皮石斛多糖脱蛋白工艺,采用DEAE -52纤维素色谱柱和Sephadex G-100凝胶色谱柱分离纯化霍山铁皮石斛多糖,并对其结构进行分析,为进一步揭示多糖结构与活性的关系奠定基础,同时为霍山铁皮石斛保健品的开发以及资源培育提供有价值的依据。
1 材料与方法
1.1 材料与试剂
霍山铁皮石斛(3 a生),采自安徽省六安市霍山县,由江苏大学药学院欧阳臻教授鉴定为兰科植物铁皮石斛(Dendrobium officinale Kimura et Migo)的干燥茎,批号1410C02HS013S3;胰蛋白酶(活力单位大于2 500 U/g,pH 5.0~7.0) 上海生化试剂厂;牛血清白蛋白、单糖标准品(葡萄糖、鼠李糖、阿拉伯糖等)美国Sigma公司;透析袋(截留分子质量3 500 D)北京Solarbio科技有限公司。
1.2 仪器与设备
BSA124S电子天平 北京赛多利斯科学仪器有限公司;HH-S数显恒温水浴锅 江苏金坛市医疗仪器厂;UNIC9100型紫外-可见分光光度计 上海尤尼柯仪器有限公司;R-210旋转蒸发仪 德国Büchi公司;FreeZone®冷冻干燥机 美国Labconco公司;7890气相色谱仪 美国Agilent公司;Nicolet 470傅里叶红外光谱仪美国Nicolet公司。
1.3 方法
1.3.1 霍山铁皮石斛多糖的提取
称取霍山铁皮石斛鲜条20 g,剪成不超过3 mm的小段置于圆底烧瓶中,以料液比1∶20(g/mL)加入蒸馏水,90 ℃水浴提取2 h,重复3 次,合并浸提液,减压浓缩至一定体积后,加入95%乙醇溶液使乙醇体积分数达到80%,静置过夜,经离心(12 000 r/min,15 min)收集沉淀,冷冻干燥,得石斛粗多糖。
1.3.2 蛋白质含量的测定
1.3.2.1 标准曲线溶液的绘制
精密称取10.0 mg牛血清白蛋白于100 mL容量瓶中,加水至刻度,即得0.1 mg/mL的贮备液。分别吸取0、0.2、0.4、0.6、0.8 mL和1.0 mL于具塞试管中,加水至1.0 mL,摇匀后每管加入5.0 mL考马斯亮蓝G-250染色液,混匀,以蒸馏水作空白,于595 nm波长处测定吸光度(A595nm)[14],以牛血清白蛋白溶液质量浓度(mg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线方程:Y=6.586 6X+0.056 7,R2=0.999 1。
1.3.2.2 样品中蛋白质的测定
将冻干的霍山铁皮石斛粗多糖用去离子水配成溶液,按照1.3.2.1节步骤操作,各取1.0 mL样品液至3 支试管内,分别加入考马斯亮蓝染色液5.0 mL,以蒸馏水作空白测定吸光度,代入1.3.2.1节中标准曲线计算蛋白含量,以式(1)计算蛋白脱除率:

式中:Ri、Rj分别为脱蛋白前、后蛋白含量/(mg/mL)。1.3.3 多糖含量的测定
1.3.3.1 标准曲线的绘制
精密称取烘干至质量恒定的葡萄糖标准品25.0 mg,置于250 mL容量瓶中,加水至刻度,即得0.1 mg/mL的葡萄糖对照品溶液。各吸取0、0.2 、0.4 、0.6、0.8 mL和1.0 mL于具塞试管中,分别加水至2.0 mL,加入1.0 mL 5%的苯酚及5.0 mL浓硫酸溶液,摇匀后移至40 ℃水浴锅保温10 min,冷却至室温,同样以蒸馏水作空白,于490 nm波长处测定吸光度(A490nm)[15],以葡萄糖质量浓度(mg/mL)为横坐标,吸光度为纵坐标,得回归方程:Y=8.192X+0.038 9,R2=0.999 2。(采用苯酚-硫酸法测多糖含量,以葡萄糖做标准曲线仅为工艺考察作参考)。
1.3.3.2 样品中多糖的测定
石斛粗多糖按1.3.3.1节方法测定吸光度后,代入回归方程即可得到多糖含量,从而计算出多糖损失率,如式(2)所示:
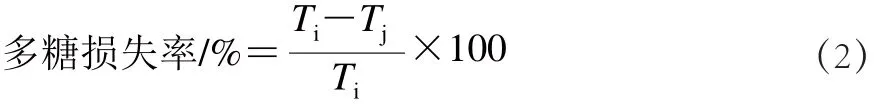
式中:Ti、Tj分别为脱蛋白前、后多糖含量/(mg/mL)。
1.3.4 霍山铁皮石斛多糖脱蛋白方法
1.3.4.1 Sevag法
配制质量浓度为1 mg/mL的粗多糖溶液,加入其1/4体积的氯仿-正丁醇溶液(4∶1,V/V),充分搅拌后离心(5 000 r/min,15 min),弃去中间蛋白层及下层有机试剂,测定蛋白质和多糖含量。按上述方法重复多次,直至无明显沉淀[16]。
1.3.4.2 胰蛋白酶法
称取胰蛋白酶1.0 g,K2HPO4-KH2PO4缓冲液(pH 5.8)溶解后定容至100 mL,配制成pH 5.98、质量浓度10 mg/mL的酶液[17-18]。选取酶添加量、酶解温度及酶解时间3 个因素,在单因素试验的基础上,设计L9(34)正交试验,考察对粗多糖蛋白脱除率及多糖损失率的影响,其因素水平设计如表1所示。待糖液酶解后置沸水浴灭酶10 min,离心(3 000 r/min,10 min)后取上清液测定蛋白含量。

表1 酶法脱蛋白正交试验因素与水平Table1 Coded and corresponding actual values of the independent variables used in the orthogonal array design for the optimization of enzymatic deproteinization of the polysaccharides
1.3.4.3 胰蛋白酶-Sevag法
配制1 mg/mL的石斛粗多糖溶液,采用1.3.4.2节酶法最优脱蛋白工艺,置沸水浴中灭酶10 min,取出后离心,上清液采用1.3.4.1节Sevag法脱蛋白,重复多次,直至无明显蛋白沉淀。
1.3.5 霍山铁皮石斛多糖的分离纯化
1.3.5.1 DEAE-52纤维素柱层析
称取石斛粗多糖0.1 g,溶于5 mL蒸馏水,离心后上清液经DEAE-52纤维素柱层析。用蒸馏水以及不同浓度NaCl溶液洗脱,以1 mL/min的流速收集洗脱液,苯酚-硫酸法示踪,于490 nm波长处隔管测定吸光度,并绘制洗脱曲线。合并各管洗脱液,浓缩、透析、冷冻干燥,最终得到DEAE-52柱分离组分,命名为DOPA。
1.3.5.2 Sephadex G-100凝胶柱纯化
称取多糖组分DOPA 60 mg,溶于5 mL蒸馏水,离心后取上清液,经Sephadex G-100凝胶柱作进一步纯化。用蒸馏水按1 mL/min的流速洗脱,苯酚-硫酸法跟踪检测。绘制洗脱曲线,收集各单一峰,减压浓缩、冷冻干燥,得纯化组分DOPA-1。
1.3.6 纯度鉴定
1.3.6.1 紫外光谱检测
配制1 mg/mL的DOPA-1溶液,于200~400 nm波长范围内进行紫外扫描。
1.3.6.2 高效液相色谱检测
称取样品DOPA-12 mg,溶于2 mL双蒸水配制成1 mg/mL的溶液,用0.45 μm滤膜过滤后进样。色谱柱:TSK-GEL G-3000PWXL(7.8 mm×30 mm);检测器:示差折光检测器;流动相:双蒸水;进样量:10 μL;流速:0.45 mL/min;柱温30 ℃;检测器温度:30 ℃。
1.3.7 单糖组成分析
采用气相色谱分析单糖组成前,通常先将多糖制备成糖腈乙酸酯衍生物[19]。精确称取DOPA-1 10.0 mg至具塞试管中,加入5 mL2 mol/L的硫酸溶液,100 ℃水浴8 h后加碳酸钡至溶液呈中性,离心,上清液减压蒸干,再依次加入盐酸羟胺10 mg、吡啶1 mL,90 ℃水浴30 min,冷却后加入乙酸酐1 mL,90 ℃水浴加热30 min,冷却后即得糖腈乙酸酯衍生物[20]。其余各单糖的制备方法同上。
气相色谱分析条件:色谱柱:HP-1弹性石英毛细管色谱柱(21 m×0.2 mm);载气:氮气;检测器:氢火焰离子化检测器;柱温:以4 ℃/min从130 ℃升至240 ℃,并在240 ℃时保留10 min;汽化室及检测器温度均为250 ℃。
1.3.8 红外光谱分析
称取1 mg干燥的DOPA-1样品,与100 mg KBr粉末在红外灯下混匀后压片,在500~4 000 cm-1范围内进行扫描[21]。
1.3.9 刚果红实验
配制DOPA-1溶液(1 mg/mL)与刚果红溶液(80 μmol/mL)。将1 mL DOPA-1溶液与1 mL刚果红溶液混匀后分别加至10 支试管内,每管逐渐加入1 mol/L的NaOH溶液,使NaOH浓度范围为0~0.5 mol/L,振荡后室温静置,于400~600 nm波长范围内进行波长扫描,记录不同浓度NaOH溶液中刚果红的λmax吸收[22]。
2 结果与分析
2.1 Sevag法脱蛋白
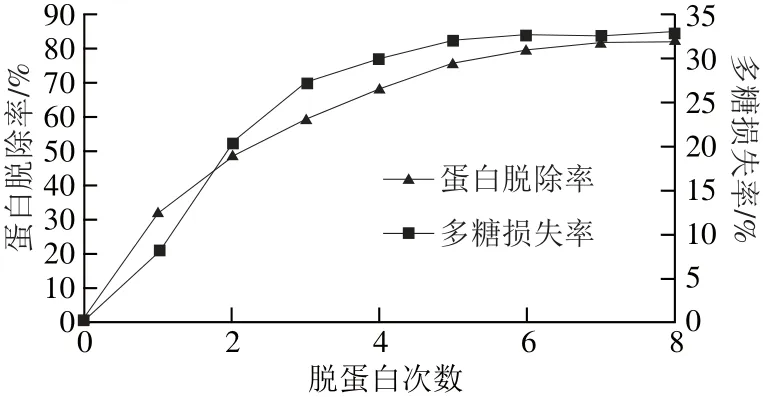
图1 Sevag法脱蛋白Fig.1 Efficiency of protein removal by the Sevag method
由图1可知,随着脱蛋白次数的增加,蛋白脱除率与多糖损失率均呈上升趋势。用Sevag法处理8 次后,蛋白质脱除率达到82.67%,多糖损失率达32.72%。可见在蛋白脱去的同时,会损失部分多糖,且易造成有机试剂的残留。
2.2 胰蛋白酶法脱蛋白
2.2.1 霍山铁皮石斛多糖脱蛋白工艺单因素试验结果
2.2.1.1 酶添加量对石斛多糖蛋白脱除率的影响
固定酶解温度40 ℃、酶解时间40 min,考察酶添加量(0.2、0.3、0.4、0.5、0.6、0.7 mL)对蛋白脱除率的影响,结果见图2。
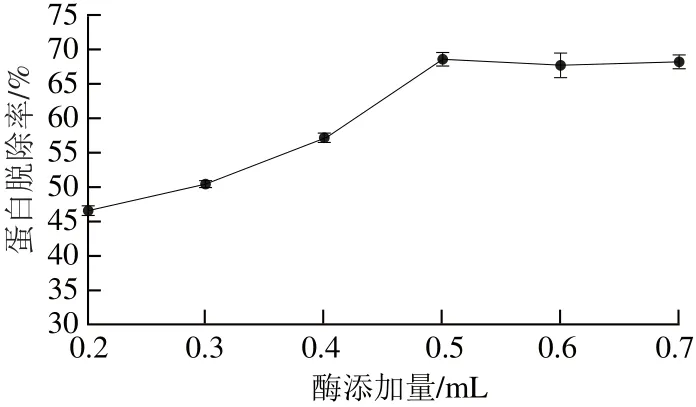
图2 酶添加量对蛋白脱除率的影响Fig.2 Effect of enzyme dosage on protein removal
由图2可知,酶添加量在0.2~0.5 mL范围内,随着酶添加量的增加,蛋白脱除率增加显著;酶添加量为0.5 mL时,蛋白脱除率达到最大;继续添加酶,蛋白脱除率无明显变化。这可能由于当酶添加量低于0.5 mL时,酶与底物的接触面积会随着酶添加量的上升而增加,蛋白脱除率效果显著;当酶添加量高于0.5 mL时,蛋白脱除率效果增加不明显。这可能是多糖中的蛋白质,即胰蛋白酶的作用底物含量有限,限制了酶的进一步反应[23],因此将0.5 mL选为最适酶添加量。
2.2.1.2 酶解时间对石斛多糖蛋白脱除率的影响
固定酶解温度40 ℃、酶添加量0.5 mL,考察酶解时间(30、40、50、60、70 min)对蛋白脱除率的影响,结果见图3。

图3 酶解时间对蛋白脱除率的影响Fig.3 Effect of hydrolysis time on protein removal
图3表明,在30~40 min时间范围内,石斛粗多糖的蛋白脱除率随着酶解时间的延长而显著提高,在40 min时有最高值,50 min后蛋白脱除率变化不明显。可能由于酶促反应在40 min时已基本完成,固定酶添加量,延长酶促反应时间并不能使蛋白脱除率显著增加[24],因此将40 min选为最佳酶解时间。
2.2.1.3 酶解温度对石斛多糖蛋白脱除率的影响
固定酶解时间40 min、酶添加量0.5 mL,考察酶解温度(20、30、40、50、60 ℃)对蛋白脱除率的影响,结果见图4。
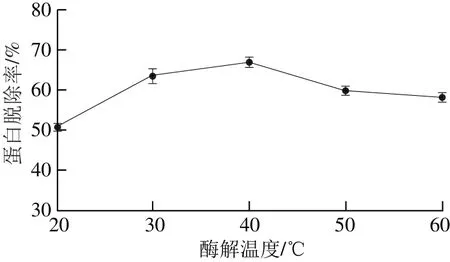
图4 酶解温度对蛋白脱除率的影响Fig.4 Effect of hydrolysis temperature on protein removal
由图4可知,当温度在20~40 ℃范围内,蛋白脱除率随酶解温度的升高显著增加,当酶解温度达到40 ℃时,蛋白脱除率达到最大值;温度高于40 ℃后,蛋白脱除率逐渐下降。这可能与蛋白酶作用的最适温度有关,当温度高于酶的最适温度后,酶活力减弱,直至完全失活
[25],因此选择40 ℃作为最适酶解温度。
2.2.2 正交试验结果
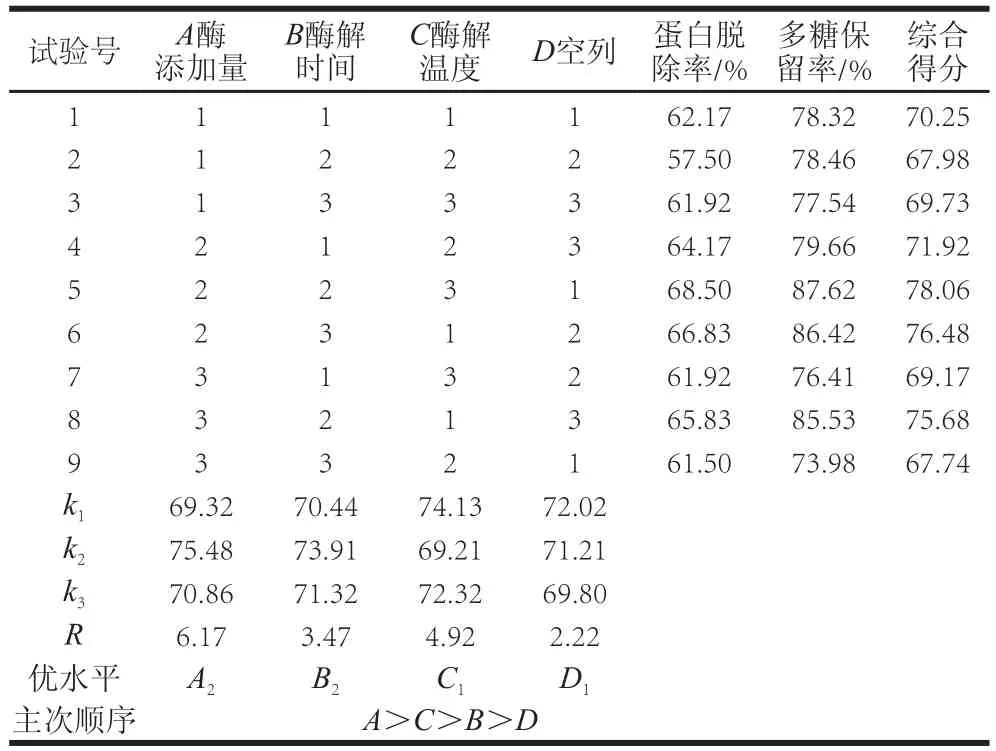
表2 胰蛋白酶法脱蛋白正交试验结果Table2 Orthogonal array design in terms of coded and actual values with experimental results
表2胰蛋白酶法脱蛋白正交试验结果中,综合得分按蛋白脱除率及多糖保留率各50%的权重综合,由极差R分析可得知,影响蛋白脱除程度的主次顺序为A>C>B>D,即酶添加量>酶解温度>酶解时间。
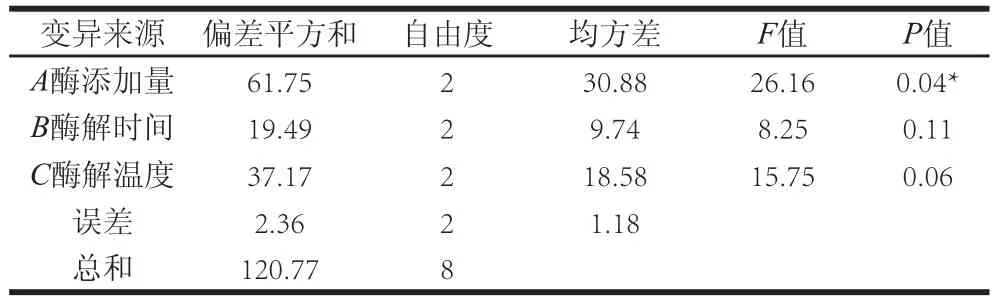
表3 蛋白脱除率方差分析Table3 Variance analysis on the deproteinization rate
由表3可知,酶添加量对蛋白脱除率影响显著,酶解时间和酶解温度对脱蛋白影响不显著。故最优脱蛋白工艺为A2、B2、C1,即胰蛋白酶量0.5 mL、酶解时间40 min、酶解温度35 ℃。在此条件下进行3 次验证实验,蛋白平均脱除率为71.88%(相对标准偏差为0.71%);多糖平均损失率为13.44%(相对标准偏差为0.86%)。
2.3 胰蛋白酶-Sevag法脱蛋白
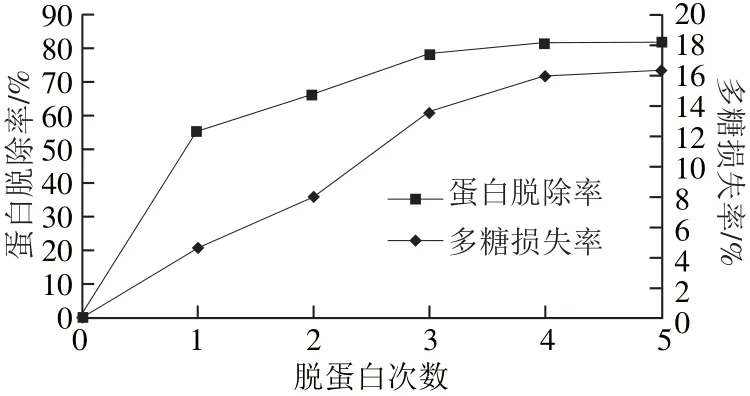
图5 酶-Sevag法脱蛋白Fig.5 Deproteinization efficiency of the combined method
由图5可知,3 次萃取后蛋白脱除率基本保持不变,但多糖损失率仍有增加;5 次萃取后蛋白脱除率为81.61%、多糖损失率为16.33%。综合考虑,以酶-Sevag法萃取3 次较为合理,此时蛋白脱除率为81.58%,多糖损失率为15.63%。
2.4 脱蛋白工艺的比较
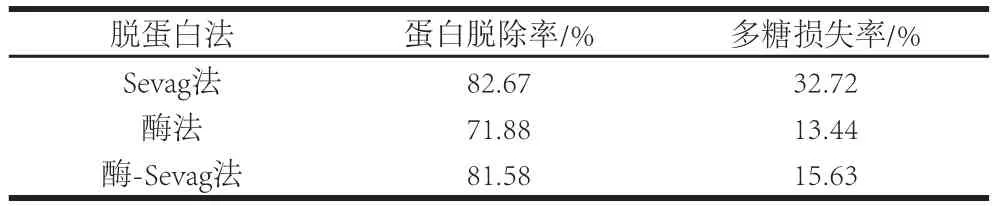
表 43 种脱蛋白方法的比较Table4 Comparison of three protein removal methods
表4表明,采用Sevag法脱蛋白,蛋白脱除率最高,达82.67%,但多糖损失率为32.72%;酶法脱蛋白时,蛋白脱除率最低,仅为71.88%;而将酶-Sevag法联用,蛋白脱除率与Sevag法结果相差不大,但多糖损失率仅为15.63%,远小于Sevag法。这是由于采用酶-Sevag法脱蛋白,胰蛋白酶可酶解蛋白,使其成为相对分子质量较小的多肽或氨基酸,离心后大分子多糖大多数得到沉淀,而相对分子质量较小的多肽和氨基酸大部分保留在溶液中,再结合Sevag法处理3 次,减少了萃取次数,使多糖损失率变低。综合考虑蛋白脱除率与多糖损失率,确定酶-Sevag法为霍山铁皮石斛多糖脱蛋白的最优方法。
2.5 霍山铁皮石斛多糖的纯化结果
2.5.1 霍山铁皮石斛多糖的DEAE-52柱分离
由图6可知,铁皮石斛多糖经DEAE-52纤维素柱洗脱后得到了4 个组分,先后顺序依次为DOPA、DOPB、DOPC和DOPD。其中,以水洗脱部位(DOPA )收集量最大,并对其进一步分离纯化。
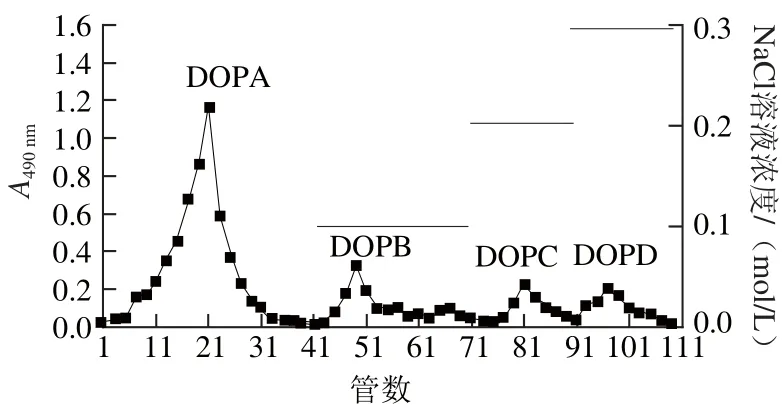
图6 铁皮石斛多糖DEAE-52柱层析洗脱曲线Fig.6 Elution curve of the polysaccharides from Dendrobium officinale on DEAE-52
2.5.2 霍山铁皮石斛多糖的Sephadex G-100柱分离

图7 铁皮石斛多糖DOPA的Sephadex G-100柱层析洗脱曲线Fig.7 Elution curve of the polysaccharides on Sephadex G-100
组分DOPA的Sephadex G-100洗脱曲线如图7所示,显示单一对称峰,表明DOPA-1已达到一定均一纯度。
2.6 纯度鉴定结果
2.6.1 紫外光谱分析
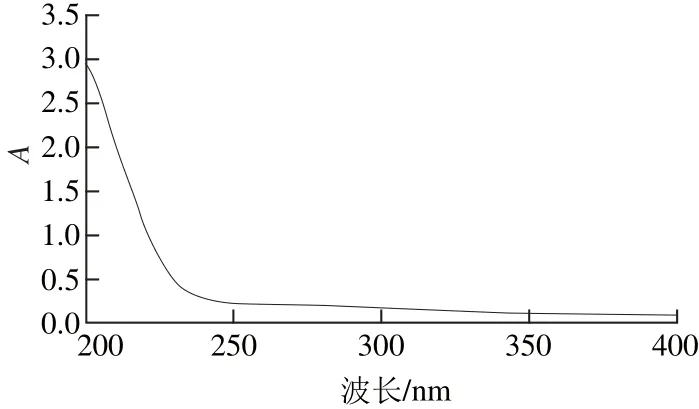
图8 紫外光谱扫描图Fig.8 UV absorption spectrum of the purified polysaccharides
样品DOPA-1的紫外扫描图谱(图8)在260、280 nm波长处无紫外特征吸收峰,表明样品不含核酸和蛋白质。
2.6.2 高效液相色谱分析
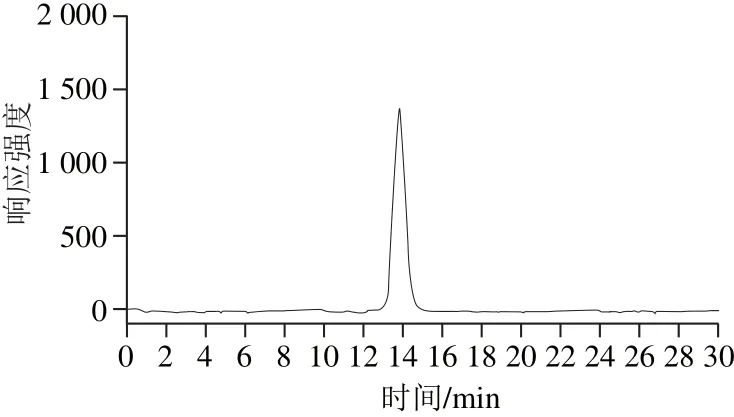
图9 DOPA-1的高效液相色谱图Fig.9 HPLC chromatogram of DOPA-1
样品DOPA-1的高效液相色谱图谱如图9所示,显示单一对称峰,表明该样品为均一组分。
2.7 单糖组成的气相色谱分析结果
气相色谱分析表明,DOPA-1主要由甘露糖、葡萄糖和半乳糖组成,各单糖物质的量比为1∶0.42∶0.27,气相色谱图谱见图10。
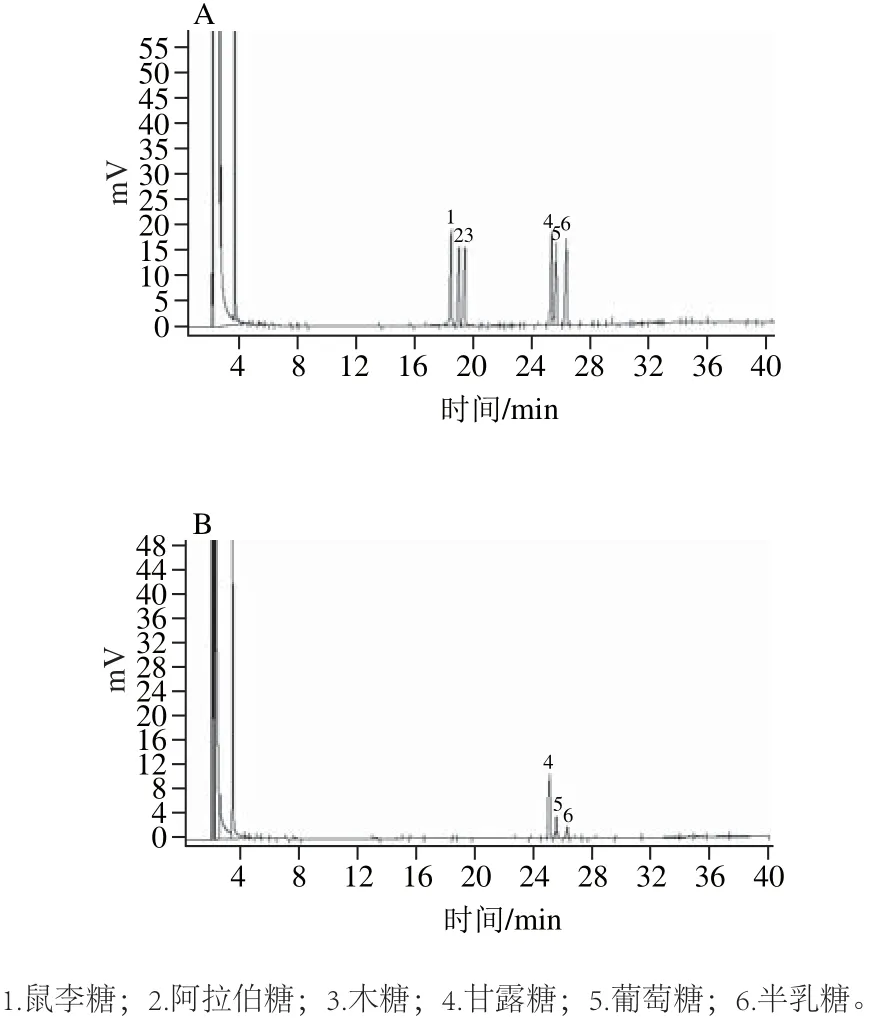
图10 标准单糖(A)和DOPA-1(B)衍生化后的气相色谱图Fig.10 GC chromatograms of derivatives of monosaccharide standards (A) and DOPA-1 (B)
2.8 红外光谱分析结果
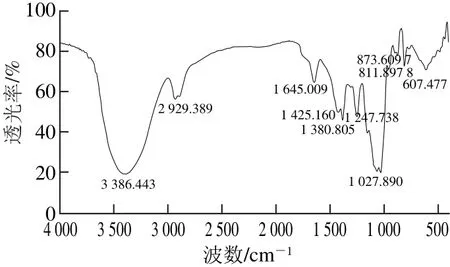
图11 DOPA-1红外光谱图Fig.11 FI-IR spectrum of DOPA-1
从图11可以看出,在3 386.443 cm-1和1 027.890 cm-1处的吸收峰分别是由O—H的伸缩振动和变角振动引起的;2 929.389 cm-1处为C—H伸缩振动峰,1 425.160 cm-1处的吸收峰属于C—H的变角振动,由此可以确证DOPA-1为糖类物质;1 645.009 cm-1出现的吸收峰是由乙酰氨基(—NHCOCH3)中C=O的伸缩振动引起的;1 380.805 cm-1处为羧基中C=O吸收峰;1 300~1 000 cm-1区域属于吡喃糖环的特征吸收峰[26-29]。此外,811.897 8 cm-1和873.6097 cm-1处的吸收峰,表明多糖分子中可能存在β-D-甘露吡喃糖苷[19]。
2.9 刚果红实验结果

图12 刚果红-DOPA-1络合物最大吸收波长变化Fig.12 Maximum absorption wavelength of Congo red-DOPA-1 complex as a function of NaOH concentration
刚果红可与含三股螺旋链构象的多糖发生络合反应,进而使络合物的吸收发生红移,且在一定的NaOH浓度范围内呈亚稳性,呈现最大吸收波长的特征变化[30]。图12显示,当NaOH溶液在0~0.2 mol/mL范围时,紫外吸收移向长波,表明样品与刚果红发生络合反应,但随着继续增大,溶液的λmax逐渐减小,由此推测DOPA-1具有三股螺旋构象。
3 讨 论
本研究比较了Sevag法、酶法以及酶-Sevag法对石斛粗多糖蛋白脱除率及多糖损失率的影响,结果表明传统的Sevag法需经多次重复,耗费试剂的同时会造成有机溶剂的残留,多糖损失率大,高达32.72%;酶法脱蛋白是通过蛋白酶将粗多糖中的蛋白质水解,专属性强,蛋白脱除率最低,为71.88%;而将酶法与Sevag法联用,蛋白脱除率高,多糖损失较少。本实验优选得到的最佳脱蛋白方法为酶-Sevag法联用,此时蛋白脱除率为81.58%,多糖损失率为15.63%。
本实验采用传统的水提醇沉法提取霍山铁皮石斛多糖,酶-Sevag法脱蛋白,再经DEAE-52纤维素柱、Sephadex G-100凝胶柱分离纯化得到石斛多糖组分DOPA-1,并进行结构分析,石斛多糖组分DOPA-1为均一多糖,单糖组成为甘露糖、葡萄糖和半乳糖,其物质的量比为1∶0.42∶0.27。红外光谱及刚果红实验结果表明,DOPA-1具有典型的糖类特征吸收峰,存在β-D-甘露吡喃糖苷,且具有三股螺旋构象。本研究结果可为进一步研究霍山铁皮石斛多糖结构与活性的关系及开发应用提供科学依据。
[1] 卫生部药典委员会. 中华人民共和国药典[M]. 北京: 化学工业出版社, 2015: 282.
[2] 孙星衍, 孙冯翼. 神农本草经[M]. 北京: 商务印书馆, 1959: 22.
[3] 吴建, 王建方, 方玲, 等. 国内铁皮石斛研究概况[J]. 中国药学杂志, 2013, 48(19): 1610-1613.
[4] 黄泽豪, 林文明, 范世明. 中华仙草: 铁皮石斛[J]. 生命世界, 2015(10): 36-37.
[5] 张光浓, 毕志明, 王峥涛, 等. 石斛属植物化学成分研究进展[J]. 中草药, 2003, 34(6): 附5-附8. DOI:10.3321/j.issn:0253-2670.2003.06.042.
[6] 鲍素华. 不同分子量铁皮石斛多糖体外抗氧化活性研究[J]. 食品科学, 2009, 30(21): 123-127. DOI:10.3321/j.issn:1002-6630.2009.21.029.
[7] YANG L, HAN H, NAKAMURA N, et al. Bio-guided isolation of antioxidants from the stems of Dendrobium aurantiacum var. denneanum[J]. Phytotherapy Research, 2007, 21(7): 696-698. DOI:10.1002/ptr.2133.
[8] WU X, MAO G, ZHAO T, et al. Isolation, purification and in vitro anti-tumor activity of polysaccharide from Ginkgo biloba sarcotesta[J]. Carbohydrate Polymers, 2011, 86(2): 1073-1076. DOI:10.1016/ j.carbpol.2011.04.069.
[9] DING Q, YANG D, ZHANG W, et al. Antioxidant and anti-aging activities of the polysaccharide TLH-3 from Tricholoma lobayense[J]. International Journal of Biological Macromolecules, 2015, 85: 133-140. DOI:10.1016/j.ijbiomac.2015.12.058.
[10] JIANG G, WEN L, FENG C, et al. Structural characteristics and antioxidant activities of polysaccharides from longan seed[J]. Carbohydrate Polymers, 2013, 92(1): 758-764. DOI:10.1016/ j.carbpol.2012.09.079.
[11] WANG Y, MAO F, WEI X. Characterization and antioxidant activities of polysaccharides from leaves, flowers and seeds of green tea[J]. Carbohydrate Polymers, 2012, 88(1): 146-153. DOI:10.1016/ j.carbpol.2011.11.083.
[12] HSIEH S Y, CHENG C, LIAO K S, et al. Structure and bioactivity of the polysaccharides in medicinal plant Dendrobium huoshanense[J]. Bioorganic & Medicinal Chemistry, 2008, 16(11): 6054-6068. DOI:10.1016/j.bmc.2008.04.042.
[13] 殷洪梅, 尚强, 萧伟. 金银花多糖脱蛋白方法的研究[J]. 中草药, 2010, 41(4): 584-586.
[14] 秦卫东, 马利华, 陈学红, 等. 生姜多糖的提取及脱蛋白研究[J]. 食品科学, 2008, 29(4): 218-220. DOI:10.3321/j.issn:1002-6630.2008.04.045.
[15] 罗傲雪. 石斛粗多糖脱蛋白方法的研究[J]. 安徽农业科学, 2008, 36(29): 12741-12742. DOI:10.3969/j.issn.0517-6611.2008.29.087.
[16] 李艳辉. 玉竹多糖脱蛋白方法的比较研究[J]. 时珍国医国药, 2011, 22(9): 2127-2128. DOI:10.3969/j.issn.1008-0805.2011.09.033.
[17] YAN Q J. Removal of protein from the crude astragalus polysaccharides by proteases[J]. Food Science & Technology, 2004, 6: 23-26. DOI:10.3969/j.issn.1005-9989.2004.06.007.
[18] 张雅利. 胰蛋白酶-Sevag法联用脱柿多糖蛋白[J]. 食品工业科技, 2005, 26(5): 107-108. DOI:10.3969/j.issn.1002-0306.2005.05.033.
[19] 张惟杰. 糖复合物生化研究技术[M]. 2版. 杭州: 浙江大学出版社, 2006.
[20] 欧阳臻, 陈钧, 李永辉. 桑叶多糖的分离纯化及组成研究[J]. 食品科学, 2005, 26(3): 181-184. DOI:10.3321/j.issn:1002-6630.2005.03.043.
[21] 朱玉婷, 田瑞, 杨洁, 等. 傅里叶红外光谱法测定硫酸酯化葛仙米多糖的取代度[J]. 食品科学, 2013, 34(4): 150-153.
[22] DILIP R, SOUMITRA M, INDRANIL C, et al. The structure and conformation of a water-insoluble (1→3)-(1→6)-β-D-glucan from the fruiting bodies of Pleurotus florida[J]. Carbohydrate Research, 2008, 343(5): 982-987. DOI:10.1016/j.carres.2007.12.022.
[23] 林翔凯, 张龙涛, 陈洁, 等. 紫薯多糖脱蛋白工艺的研究[J].热带作物学报, 2014, 35(2): 381-386. DOI:10.3969/ j.issn.1000-2561.2014.02.029.
[24] 张怡. 金柑多糖酶法脱蛋白工艺的研究[J]. 热带作物学报, 2012, 33(1): 166-170. DOI:10.3969/j.issn.1000-2561.2012.01.034.
[25] 周鸿立, 杨晓虹. 玉米须多糖中蛋白质脱除的Sevag与酶法联用工艺优化[J]. 食品科学, 2011, 32(8): 129-132.
[26] LUO A X, HE X J, ZHOU S D, et al. Purification, composition analysis and antioxidant activity of the polysaccharides from Dendrobium nobile Lindl.[J]. Carbohydrate Polymers, 2010, 79(4): 1014-1019. DOI:10.1016/ j.carbpol.2009.10.033.
[27] FAN Y, HE X J, ZHOU S, et al. Composition analysis and antioxidant activity of polysaccharide from Dendrobium denneanum[J]. International Journal of Biological Macromolecules, 2009, 45(2): 169-173. DOI:10.1016/j.ijbiomac.2009.04.019.
[28] XU W, ZHANG F, LUO Y, et al. Antioxidant activity of a water-soluble polysaccharide purified from Pteridium aquilinum[J]. Carbohydrate Research, 2008, 344(2): 217-222. DOI:10.1016/j.carres.2008.10.021.
[29] LI X L, XIAO J J, ZHA X Q, et al. Structural identification and sulfated modification of an antiglycation Dendrobium huoshanense polysaccharide[J]. Carbohydrate Polymers, 2014, 106(12): 247-254. DOI:10.1016/j.carbpol.2014.02.029.
[30] 刘微微, 刘旭, 曹学丽, 等. 白背三七多糖的结构表征及α-葡萄糖苷酶的抑制活性[J]. 食品科学, 2013, 34(7): 115-120. DOI:10.7506/ spkx1002-6630-201307024.
Deproteinization and Structural Analysis of Polysaccharides from Dendrobium off i cinale Kimura et Migo Grown in Huoshan
WANG Linwei, OUYANG Zhen*, ZHANG Bijuan, YANG Qian, WANG Dujun, YU Yifan, ZHANG Jie, MA Qing
(School of Pharmacy, Jiangsu University, Zhenjiang 212013, China)
In this study, the deproteinization and structural characterization of the polysaccharides extracted from Dendrobium officinale Kimura et Migo grown in Huoshan county of Anhui province were investigated. Three protein removal methods:the Sevage method, enzymatic hydrolysis and their combination were comparatively evaluated in terms of protein removal and polysaccharide loss rates. The combined method was found to have the highest deproteinization efficiency, yielding 81.58% protein removal and 15.63% polysaccharide loss. After purification of the polysaccharides by successive DEAE-cellulose-52 and Sephadex G-100 column chromatography, an active fraction named as DOPA-1 was obtained. By using UV spectroscopy and high performance liquid chromatography (HPLC), the polysaccharide DOPA-1 was confirmed to be homogeneous. Moreover, DOPA-1 was mainly composed of mannose, glucose and galactose as revealed by GC analysis, with a molar ratio of 1:0.42:0.27. IR spectroscopy and Cango red test indicated that DOPA-1 contained β-D-mannopyranose and possessed a triple-helix conformation.
Dendrobium off i cinale polysaccharide; removal of protein; purification; structural analysis
10.7506/spkx1002-6630-201712025
R284.1
A
1002-6630(2017)12-0164-07
王琳炜, 欧阳臻, 张碧娟, 等. 霍山铁皮石斛多糖的脱蛋白工艺及结构分析[J]. 食品科学, 2017, 38(12): 164-170.
10.7506/spkx1002-6630-201712025. http://www.spkx.net.cn
WANG Linwei, OUYANG Zhen, ZHANG Bijuan, et al. Deproteinization and structural analysis of polysaccharides from Dendrobium off i cinale Kimura et Migo grown in Huoshan[J]. Food Science, 2017, 38(12): 164-170. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201712025. http://www.spkx.net.cn
2016-07-24
国家自然科学基金面上项目(81573529;81072985;81373480);中央本级重大增减支项目(2060302);安徽省石斛产业化开发协同创新项目;江苏大学第14批大学生科研立项项目(14A134)
王琳炜(1992—),女,硕士研究生,主要从事中药活性成分研究。E-mail:pplynette@163.com
*通信作者:欧阳臻(1964—),女,教授,博士,主要从事药食两用资源及中药新药开发。E-mail:zhenouyang@ujs.edu.cn
