亚临界水提取红心火龙果茎多糖及其抗氧化活性
2017-06-22马若影杨慧强李国胜邓志勇李幼梅白新鹏
马若影,杨慧强,李国胜,邓志勇,曹 君,李幼梅,白新鹏,*
(1.海南大学食品学院,海南海口 570228;2.海南北纬十八度果业有限公司,海南东方 572600)
亚临界水提取红心火龙果茎多糖及其抗氧化活性
马若影1,杨慧强2,+,李国胜1,邓志勇2,曹 君1,李幼梅1,白新鹏1,*
(1.海南大学食品学院,海南海口 570228;2.海南北纬十八度果业有限公司,海南东方 572600)
本实验以红心火龙果茎为原料,通过单因素和正交实验对亚临界水提取红心火龙果茎多糖的工艺进行优化,并对提取的多糖进行抗氧化活性研究和结构鉴定,以确定红心火龙果茎的生物活性,并评价其体外抗氧化活性的强弱,从而为红心火龙果茎多糖的合理开发和应用提供理论依据。结果表明,亚临界水提取的最佳工艺参数:提取温度为140 ℃,提取时间为25 min,料液比为1∶50,多糖得率38.07%±0.15%。抗氧化性结果表明,火龙果茎多糖具有一定的抗氧化活性,对DPPH·和·OH清除率可达40.09%和95.15%。紫外和红外光谱分析表明,火龙果茎粗多糖不含蛋白质和核酸且具有典型的多糖红外吸收。
红心火龙果茎,多糖,亚临界水,抗氧化
火龙果(Hylocereusundatus)又称红龙果、仙蜜果、长寿吉祥果等,为仙人掌科三角柱属植物三角柱的果用栽培品种,是一种高营养保健价值的热带水果,具有助消化、降血压与血糖、抗氧化等多种功能[1-3]。原产于西半球赤道附近,中美洲热带雨林地区[4]。据2015年数据显示,海南省红心火龙果种植面积约4万亩且呈快速增长趋势。火龙果茎具有生长速度快、分枝能力强,但在火龙果生长种植过程中为加快其生长及保证果实品质一般仅保留1条主茎,因此,需要不断修剪分枝。研究表明,火龙果茎中含丰富的植物多糖活性成分[5],具有很高的研究价值。目前火龙果茎多糖提取方法主要有传统热水浸提法[6]、超声辅助提取法[7]、酶提取法[8]、微波辅助提取法[9]等,这些提取方法存在多糖得率低、提取时间长等缺点,因此有必要研究一种高效快速提取优质火龙果茎多糖的方法。
亚临界水(Subcritical water)是指使用特定的装置,通过升温加压,使水的温度介于沸点以上,亚临界温度以下(100~374 ℃)仍然保持液体状态,此称为亚临界水、高温液态水等。在亚临界状态下,水分子热运动增加,许多特性会发生显著改变,水的介电常数会降低,表现出类似于有机溶剂的特性,使许多弱极性的物质都能溶解到亚临界水中[10-13]。亚临界水提取技术是一种新型高效低耗能的绿色提取技术[14],目前,在天然产物如多酚、多糖、黄酮和花青素等的提取中得到广泛应用[15]。
本文利用亚临界水提取技术对火龙果茎多糖进行提取,确定火龙果茎多糖的最佳提取工艺,并对提取的火龙果茎多糖进行抗氧化活性研究。加强对火龙果茎多糖提取研究,不仅可为进一步研究火龙果茎多糖的性质提供理论依据和参考,还可很大程度提高火龙果的附加值,提高火龙果种植的经济效益。
1 材料与方法
1.1 材料与仪器
火龙果茎(冻干磨粉备用) 由海南省东方市北纬十八度果业有限公司提供;葡萄糖、浓硫酸、苯酚、硫酸亚铁、水杨酸、无水乙醇、过氧化氢、磷酸三钠、钼酸铵、磷酸氢二钠、磷酸二氢钠、铁氰化钾、三氯乙酸、氯化铁 购于广州化学试剂厂;抗坏血酸、1,1-二苯基-2-三硝基苯肼(DPPH) 购于麦克林公司;以上试剂 均为分析纯(AR)。
GL-20G-II型高速冷冻离心机 上海安亭科学仪器厂;A11分析用研磨机 广州仪科实验室技术有限公司;RE52CS型旋转蒸发仪 上海亚荣生化仪器厂;FDU-2100型冷冻干燥机 埃朗科技国际贸易(上海)有限公司;723PC型可见分光光度计 上海奥普勒仪器有限公司;EL204型电子天平 梅特勒-托利多仪器(上海)有限公司;CU-420型电热恒温水槽 上海齐欣科学仪器有限公司;亚临界水设备 本实验装置为课题组自行设计,并已申请专利,设备主体由高温反应釜,加热装置,温控系统三部分组成,具体装置简图如图1。
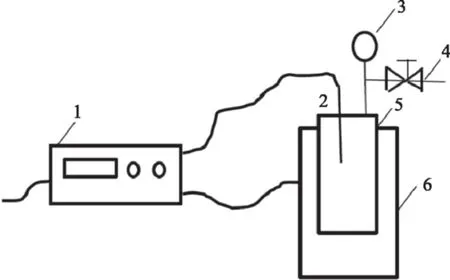
图1 亚临界水设备简图Fig.1 Installation drawing of subcritical water注:1-控温仪,2-温度传感器,3-压力表,4-高压阀门,5-反应釜,6-加热套。
1.2 实验方法
1.2.1 火龙果茎多糖提取 火龙果茎冻干粉→亚临界水提取→离心→上清液→浓缩→乙醇沉淀→冷冻干燥→火龙果茎粗多糖。
称取2.0 g火龙果茎干粉,置于亚临界水反应釜中,按照设定的料液比、提取温度和提取时间对火龙果茎冻干粉进行亚临界水提取,提取完成后于8000 r/min的条件下离心10 min,取上清液旋蒸浓缩并加入无水乙醇至乙醇体积分数为80%,4 ℃静置沉淀12 h,然后于6000 r/min的条件下离心5 min,保留沉淀并冷冻干燥得到火龙果茎粗多糖。
1.2.2 火龙果茎多糖提取的单因素实验 采用1.2.1中的方法提取火龙果茎多糖,固定反应条件为提取温度130 ℃,提取时间20 min,考察不同料液比(1∶20、1∶30、1∶40、1∶50、1∶60、1∶70 g/mL)对多糖得率的影响;固定反应条件提取时间20 min,料液比1∶40,考察不同提取温度(100、110、130、140、150、170 ℃)对多糖得率的影响;固定反应条件提取温度140 ℃,料液比1∶40,考察不同提取时间(5、15、25、35、45、55 min)对多糖得率的影响;每组实验做3次平行实验,最后以火龙果茎多糖得率为指标,考察每个因素对火龙果茎多糖得率的影响。
1.2.3 火龙果茎多糖提取的正交实验 在单因素实验的基础上,选择提取温度、料液比、提取时间三个因素,在各因素最佳值附近分别选取三个水平(表1),以多糖得率为指标,做三因素三水平的正交实验,依据L9(34)正交实验表优化多糖提取的最佳工艺。
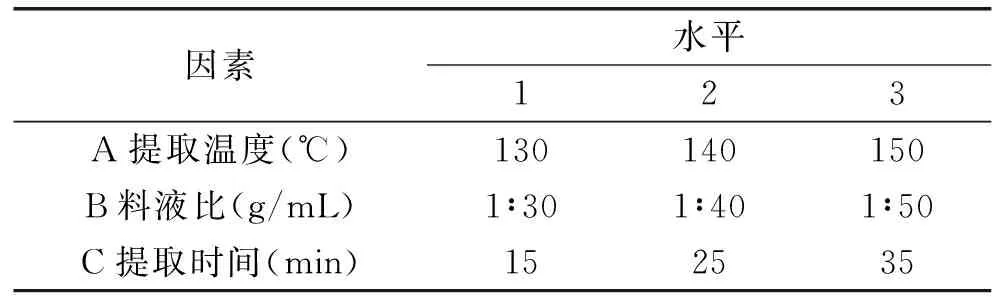
表1 正交实验因素水平Table 1 Factors and levels in the orthogonal array design
1.2.4 标准曲线绘制 参照张保[16]等的方法,精确称取105 ℃干燥至恒重的葡萄糖10 mg,用蒸馏水定容至100 mL,再用0.1 mg/mL的葡萄糖溶液配制成0、20、40、60、80、100 μg/mL的葡萄糖标准待测液,各吸取1 mL然后加入1 mL 4%苯酚溶液,混合均匀后加入3.5 mL浓硫酸,放入冷水中冷却5 min后在波长489 nm处测定吸光度值,以葡萄糖质量浓度(x)为横坐标,吸光度值(y)为纵坐标绘制标准曲线。绘制葡萄糖标准曲线为A=0.0049x+0.0654,相关系数r=0.9984,线性范围在0~100 μg/mL。
1.2.5 火龙果茎多糖的测定 称取提取的火龙果茎多糖5 mg,配成0.1 mg/mL的多糖待测液,按照标准曲线制备方法测定吸光度值,火龙果茎多糖得率以干基计算。
火龙果茎多糖得率(%)=提取液火龙果茎多糖的质量/火龙果茎冻干粉的质量×100
1.2.6 火龙果茎多糖抗氧化活性的测定
1.2.6.1 火龙果茎多糖清除DPPH自由基的能力测定 参考李莉[17]等的方法并加以改进,准确称取4 mg DPPH·,用甲醇溶解,定容至100 mL。准确吸取不同质量浓度的(0、0.1、0.2、0.25、0.5、1 mg/mL)火龙果茎多糖待测液1 mL、配制好的DPPH·甲醇溶液1 mL,混合均匀后室温静置20 min,于517 nm波长处测定吸光度值。用甲醇做空白对照、VC做阳性对照,计算火龙果茎多糖清除DPPH自由基的能力。
式(1)
式中:Ai为1 mL待测液+1 mL DPPH·工作液的吸光度值;Aj为1 mL待测液+1 mL甲醇的吸光度值;A0为1 mL DPPH·工作液+1 mL甲醇的吸光度值。
1.2.6.2 火龙果茎多糖清除·OH的能力测定 参考封燕[18]等的方法并加以改进,往15 mL离心管中依次加入不同质量浓度的火龙果茎多糖待测液1 mL,6 mmol/L的硫酸亚铁溶液1 mL,6 mmol/L的水杨酸-乙醇溶液1 mL,和6 mmol/L的过氧化氢溶液1 mL,混合均匀后37 ℃水浴1 h,在510 nm波长处测定吸光度值(Ai)。计算火龙果茎多糖清除羟自由基的能力。
式(2)
式中:Aj为蒸馏水代替多糖待测液的吸光度值;A0为蒸馏水代替过氧化氢溶液的吸光度值。
1.2.6.3 火龙果茎多糖总抗氧化能力的测定 参考Smirnoff N[19]等的方法并加以改进,精确称取磷酸三钠1.065 g,钼酸铵0.494 g,溶解在少量蒸馏水中后加入浓硫酸3.28 mL,定容至100 mL,取3 mL配制好的混合液,然后加入不同质量浓度的火龙果茎多糖待测液1 mL,混合均匀后95 ℃水浴90 min,695 nm波长处测定吸光度值,蒸馏水作空白对照,VC作阳性对照。
1.2.6.4 火龙果茎多糖总还原力的测定 参考刘晓鹏[20]等的方法并加以改进,在15 mL的离心管中依次加入pH6.6的磷酸盐缓冲液1 mL,不同质量浓度的火龙果茎多糖待测液1 mL,1%的铁氰化钾溶液1 mL,混合均匀后于50 ℃水浴20 min。取出后加入10%的三氯乙酸终止反应,6000 r/min离心10 min,取上清液3 mL,加入蒸馏水3 mL,0.1%的氯化铁0.5 mL,混合均匀后室温静置10 min,700 nm处测吸光度值,蒸馏水作空白对照,VC做阳性对照。
1.2.7 火龙果茎多糖的紫外光谱分析 将火龙果茎粗多糖配制成1 mg/mL的水溶液,用紫外分光光度计在波长200~700 nm范围内进行扫描,观察其在260、280 nm波长处有无吸收峰[21]。
1.2.8 火龙果茎多糖的红外光谱分析 取适量的火龙果茎多糖粉末与溴化钾固体粉末混合均匀,充分研磨,用压片机压成薄片,在4000~500 cm-1范围内进行红外光谱扫描。
2 结果与分析
2.1 单因素实验结果
2.1.1 料液比对火龙果茎多糖得率影响 由图2可知,在1∶20~1∶40的料液比范围内,随着料液比的增加,多糖得率逐渐增加,在1∶40时多糖得率达到最大值。当料液比大于1∶40之后,多糖得率降低,可能是因为料液比的增加使提取液中固形物含量降低,不利于后续操作。所以,亚临界水提取火龙果茎多糖的料液比选择1∶40较为适宜。
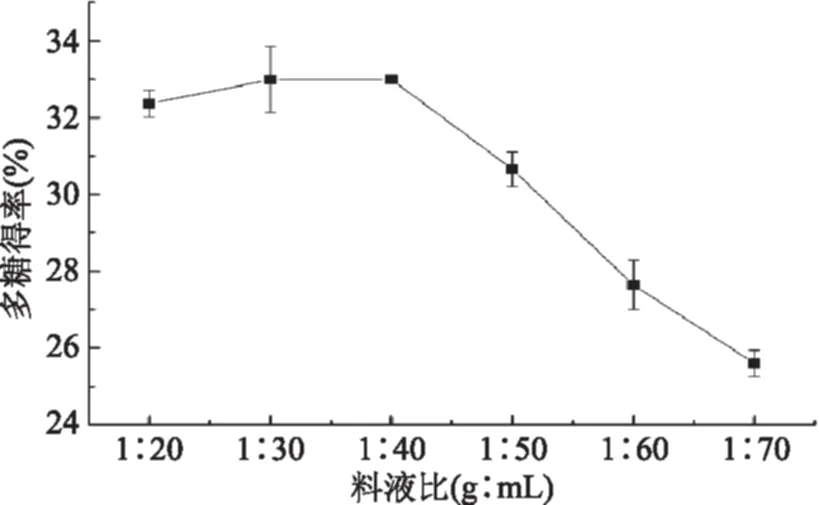
图2 料液比对多糖得率的影响Fig.2 Effects of solid/liquid ratio on polysaccharide yield
2.1.2 提取温度对火龙果茎多糖得率影响 由图3可知,在100~140 ℃的温度范围内,随着温度的升高,多糖溶出率增加,多糖得率升高,在140 ℃时多糖得率达到最大值。140 ℃之后,多糖得率随着温度的升高降低,可能是因为提取温度太高,导致多糖降解,从而使多糖得率降低。所以,亚临界水提取火龙果茎多糖的提取温度选择140 ℃较为适宜。
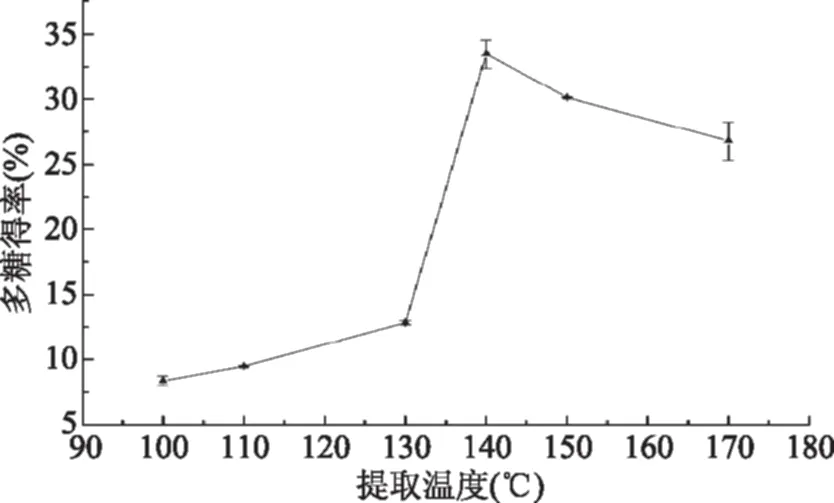
图3 提取温度对多糖得率的影响Fig.3 Effects of extraction temperature on polysaccharide yield
2.1.3 提取时间对火龙果茎多糖得率影响 由图4可知,在5~15 min的时间范围内,随着提取时间的增加,多糖得率逐渐增加,在15~35 min时间范围内,多糖得率基本不变。35 min之后,多糖得率随着提取时间的增加而减少,可能是因为在较高的亚临界提取温度下,长时间的高温加热导致火龙果茎多糖降解,从而使多糖得率降低。所以,亚临界水提取火龙果茎多糖的提取时间选择15 min较为适宜。
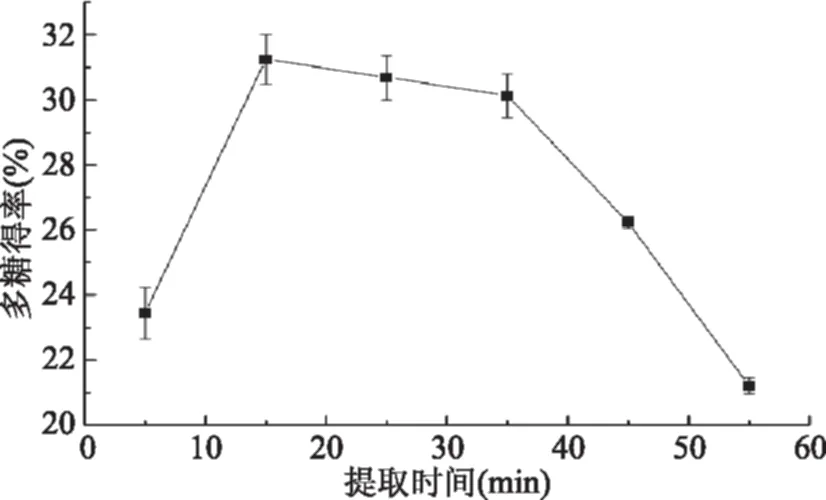
图4 提取时间对多糖得率的影响Fig.4 Effects of extraction time on polysaccharide yield
2.2 正交实验结果
由表2直观分析表明,用亚临界水提取红心火龙果茎多糖选择水作为溶剂,以多糖得率为评价指标,最优工艺组合为A2B3C2,即提取温度140 ℃、料液比1∶50、提取时间25 min。各个因素对亚临界水提取红心火龙果茎多糖的影响程度依次是料液比>提取温度>提取时间。在此最优条件下进行验证实验,提取火龙果茎多糖的提取率为最大值38.07%±0.15%,结果表明优化得到提取工艺稳定可靠。
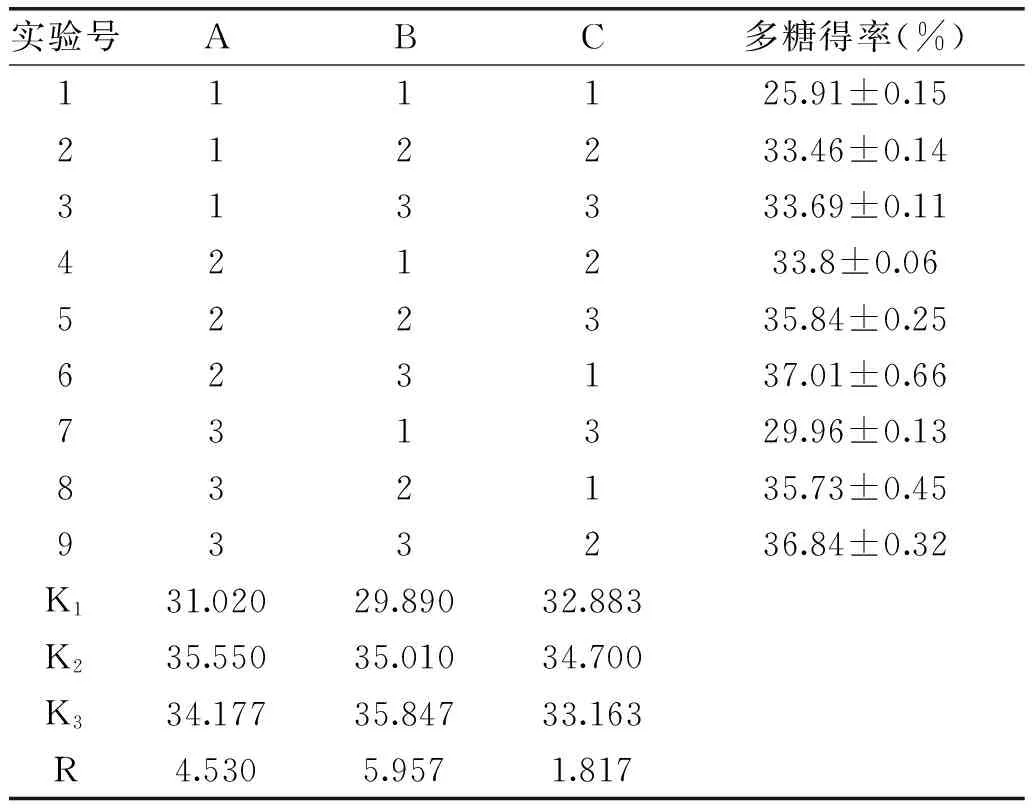
表2 火龙果茎多糖提取正交实验设计方案及结果Table 2 Orthogonal array design matrix and corresponding experimental results of extraction rate of PPL
2.3 抗氧化活性
2.3.1 DPPH自由基清除能力 由图5可知,火龙果茎多糖具有显著的DPPH自由基清除能力,且表现出良好的剂量关系。当质量浓度为0.5 mg/mL时,VC和火龙果茎多糖的清除率分别达到95%、37.43%。当质量浓度在0.2~1.0 mg/mL间时,火龙果茎多糖的DPPH自由基清除率增加缓慢(1.0 mg/mL时清除率达40.09%),但均具有较好的自由基清除率。

图5 火龙果茎多糖对DPPH自由基的清除能力Fig.5 Scavenging effect of polysaccharide from red pulp Hylocereus undatus stem on DPPH radical
2.3.2 ·OH清除能力 由图6可知,火龙果茎多糖清除·OH的能力随着质量浓度的增加而增强,表现出良好的剂量效应关系。与VC相比,当多糖质量浓度在0.1~1 mg/mL之间时,火龙果茎多糖清除·OH的能力显著低于VC,当质量浓度达到2.0 mg/mL时,VC和火龙果茎多糖的·OH清除率分别为99.86%和95.15%,可以看出火龙果茎多糖清除·OH的能力与VC相当。表明火龙果茎多糖对·OH有很明显的清除能力。
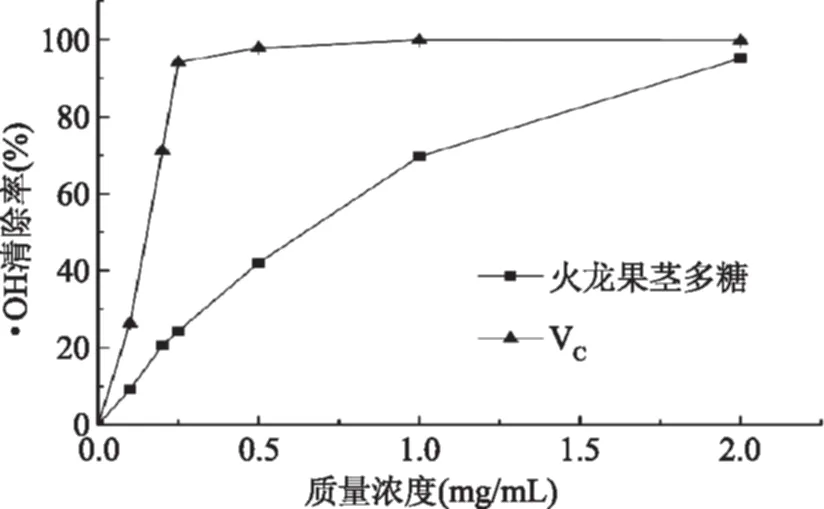
图6 火龙果茎多糖对·OH的清除能力Fig.6 Scavenging effect of polysaccharide from red pulp Hylocereus undatus stem on hydroxyl radical
2.3.3 总还原能力 在一定的吸光度范围内,火龙果茎多糖的总还原能力与其吸光度成正相关,吸光度值越大,表示还原能力越强。由图7可知,在实验质量浓度范围内,火龙果茎多糖具的还原力随着质量浓度的增加而增强。虽然火龙果茎的还原能力明显低于VC,但还是具有一定的还原能力。

图7 火龙果茎多糖的总还原能力Fig.7 Reducing capacity of polysaccharide from red pulp Hylocereus undatus stem
2.3.4 总抗氧化能力 由图8可知,在测定质量浓度范围内,火龙果茎多糖的总抗氧化能力明显低于VC,但随着火龙果茎多糖质量浓度的提高,总抗氧化能力明显增强。
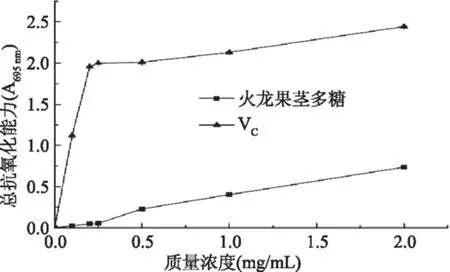
图8 火龙果茎多糖的总抗氧化能力Fig.8 Total antioxidant activity of polysaccharide from red pulp Hylocereus undatus stem
综合以上四种体外抗氧化指标,可以得出红心火龙果茎多糖有良好的DPPH自由基清除能力和·OH清除能力以及一定的还原力和总抗氧化能力。这表明火龙果茎多糖具有良好的抗氧化活性,可以作为天然抗氧化剂开发和利用。
2.4 火龙果茎多糖的紫外光谱分析
将火龙果茎多糖配制成1 mg/mL的溶液,在200~700 nm波长范围内扫描后发现,在波长204 nm处有一个较强的吸收峰,在核酸(260 nm)和蛋白质(280 nm)的特征吸收峰处均无紫外吸收,说明样品中不含有蛋白质和核酸。
2.5 火龙果茎多糖的红外光谱分析
由图9可知,火龙果茎多糖具有典型的多糖特征吸收峰[22]。在3400 cm-1附近有1个强吸收峰,是多糖分子间和分子内的O-H伸缩振动引起的,在2934.30 cm-1处有一个强吸收峰,是CH3、CH2、CH等C-H伸缩振动,在1735.90 cm-1处有一个强吸收峰,是C=O非对称的伸缩振动峰,说明多糖中存在酰胺基,在1419.25 cm-1附近有强的吸收峰,为C-H变角振动峰,在1150~1050 cm-1的峰是吡喃环的伸缩振动峰,可以推测火龙果茎多糖具有吡喃环结构。其他的结构有待通过实验进一步研究确认。

图9 火龙果茎多糖的红外光谱Fig.9 IR of polysaccharide from red pulp Hylocereus undatus stem
3 结论
本实验研究了亚临界水提取红心火龙果茎多糖的工艺,并通过正交实验进行优化得到最佳工艺参数:提取温度为140 ℃,提取时间为25 min,料液比为1∶50,多糖得率为38.07%±0.15%,与超声辅助提取红心火龙果茎多糖相比,亚临界水提取多糖具有省时节能、多糖得率高的优点,具有很高的实际应用价值。
对亚临界水提取的红心火龙果茎多糖进行体外抗氧化活性实验表明,火龙果茎多糖有一定的还原力和总抗氧化能力并且有良好的DPPH自由基清除能力和·OH清除能力,实验质量浓度范围内最大清除率分别达到40.09%和95.15%。说明火龙果茎多糖具有良好的抗氧化活性,可以作为一种天然抗氧化剂。本研究为进一步探讨红心火龙果茎多糖活性与结构的关系奠定基础,也为火龙果茎的开发利用提供了理论依据。
[1]赵志平,杨春霞. 火龙果的开发与发展前景[J]. 中国种业,2006(2):13-14.
[2]罗小艳,郭璇华. 火龙果的研究现状及发展前景[J]. 食品与发酵工业,2007(9):142-145.
[3]王壮,王立娟,蔡永强,等. 火龙果营养成分及功能性物质研究进展[J]. 中国南方果树,2014(5):25-29.
[4]符兆欢. 火龙果高产优质栽培技术[J]. 中国热带农业,2007(5):57-58.
[5]王文康. 浅析火龙果丰产栽培技术[J]. 农民致富之友,2016(16):191.
[6]何聪芬,李鹏,赵进,等. 火龙果茎多糖的提取及结构鉴定[J]. 食品与发酵工业,2009(11):140-143.
[7]伊恒杰,许明,翁武斌,等. 响应面法优化红肉火龙果茎多糖的超声波辅助提取工艺[J]. 亚热带农业研究,2016(1):56-61.
[8]李鹏. 火龙果茎凝胶汁、多糖的初步研究[D].北京:首都师范大学,2009.
[9]He C,Li P,Dong Y,et al. Polysaccharide Extraction from the Stem of Pitaya by Microwave-assisted Extraction and Its Structure Characterization[J]. Food & Fermentation Industries,2009,35(11):140-143.
[10]李婧秋,白新鹏,刘海信,等. 油棕果渣纤维亚临界水降解动力学[J]. 化学反应工程与工艺,2015(4):337-342.
[11]李幼梅. 番木瓜籽粕在亚临界水中降解过程及产物抗氧化活性研究[D].海口:海南大学,2016.
[12]Ju Z,Howard L R. Subcritical Water and Sulfured Water Extraction of Anthocyanins and Other Phenolics from Dried Red Grape Skin[J]. Journal of Food Science,2005,70(4):S270-S276.
[13]戚聿妍,王荣春. 亚临界水中化学反应的研究进展[J]. 化工进展,2015(10):3557-3562,3608.
[14]靳洪允. 亚临界水的应用研究及进展[J]. 湿法冶金,2005(2)66-68.
[15]Thiruvenkadam S,Izhar S,Yoshida H,et al. Process application of Subcritical Water Extraction(SWE)for algal bio-products and biofuels production[J]. Applied Energy,2015,154:815-828.
[16]张保,李立天,张萌,等. 拐枣枝多糖提取工艺优化与其抗氧化性研究[J]. 中国酿造,2016(7):155-160.
[17]李莉. 文蛤多糖的提取纯化、结构分析及抗氧化、免疫活性初步研究[D].无锡:江南大学,2015.
[18]封燕. 金蝉花多糖的结构特征及免疫活性初步研究[D]. 镇江:江苏大学,2016.
[19]Smirnoff N,Cumbes Q J. Hydroxyl radical scavenging activity of compatible solutes[J]. Phytochemistry,1989,28(4):1057-1060.
[20]刘晓鹏,张俊霞,姜宁,等. 响应面实验优化超声辅助提取连钱草多糖工艺及其体外抗氧化活性[J]. 食品科学,2016(4):13-19.
[21]潘莹,许经伟. 冬枣多糖的分离纯化及抗氧化活性研究[J]. 食品科学,2016(13):89-94.
[22]Chylińska M,Szymańska-Chargot M,Zdunek A. FT-IR and FT-Raman characterization of non-cellulosic polysaccharides fractions isolated from plant cell wall[J]. Carbohydrate Polymers,2016,154:48-54.
Study on the extraction and antioxidant activity of polysaccharide from red pulpHylocereusundatusstem by subcritical water
MA Ruo-ying1,YANG Hui-qiang2,+,LI Guo-sheng1,DENG Zhi-yong2,CAO Jun1,LI You-mei1,BAI Xin-peng1,*
(1.College of Food Science and Engineering,Hainan University,Haikou 570228,China; 2.18 Degrees North Latitude Fruit Industry,Dongfang 572600,China)
The extraction condition of polysaccharide from red pulpHylocereusundatusstem(PPL)by subcritical water was optimized using the single factor and orthogonal experiment. Determination of antioxidant activity and composition of polysaccharide were studied to determine the biological activity of red pulpHylocereusundatusstem and evaluate its vitro antioxidant activity,so that we can provide theoretical basis for the rational development and application of red pulpHylocereusundatusstem polysaccharide. The results showed that the optimal extraction conditions were that the extraction temperature was 140 ℃,the time was 25 min and the solid-liquid ratio was 1∶50,and the extraction rate of PPL was up to 38.07%±0.15%. The study on antioxidant revealed that the PPL had certain antioxidant activity and the maximum scavenging rate on hydroxyl radical and DPPH radical were 40.09% and 95.15%,respectively. Ultraviolet and infrared spectrum analysis showed that PPL had the typical polysaccharide IR absorption.
red pulpHylocereusundatusstem;polysaccharide;subcritical water;antioxidant
2016-11-04 +为并列第一作者
马若影(1993-),女,硕士研究生,研究方向:天然产物,E-mail:18289737675@163.com。 杨慧强(1991-),男,硕士研究生,研究方向:农产品加工及贮藏,E-mail:56316596@qq.com。
*通讯作者:白新鹏(1963-),男,博士,教授,研究方向:粮油工程,E-mail:xinpeng2001@126.com。
海南省自然科学基金(20153159);海南省自然科学基金 (314075);校企合作项目:火龙果综合加工研究;2016年海南省普通高校研究生创新科研课题(Hys2016-45)。
TS201.1
B
1002-0306(2017)10-0286-05
10.13386/j.issn1002-0306.2017.10.046
