产L-肉碱的大肠杆菌基因工程改造及生物转化
2017-06-22杨月英黄娇芳史吉平王红英
杨月英,黄娇芳,史吉平,王红英
(1.中国科学院上海高等研究院,上海 201210; 2.大连工业大学,辽宁大连 116034;3.上海科技大学,上海 201210)
产L-肉碱的大肠杆菌基因工程改造及生物转化
杨月英1,2,黄娇芳1,3,*,史吉平1,王红英2
(1.中国科学院上海高等研究院,上海 201210; 2.大连工业大学,辽宁大连 116034;3.上海科技大学,上海 201210)
L-肉碱在脂肪代谢中起重要的作用,本文构建了T7启动子控制下的过表达质粒pET28a-caiBCD和pACYCD-caiF-caiT,并将其转入大肠杆菌BL21(DE3)(简写DE3)中,得到基因工程菌BL21(DE3)/caiBCD+caiF+caiT(简写DE3/BCD+F+T)。将此菌株接种到生长培养基中,并用终浓度为1 mmol/L的 IPTG(异丙基硫代半乳糖苷)诱导培养,然后收集菌体细胞加入到含有巴豆甜菜碱盐酸盐的转化液中进行转化。结果显示,IPTG诱导 4 h比诱导10 h后转化得到的L-肉碱量要高,转入了过表达质粒的工程菌DE3/BCD+F+T(7.244 g/L)比野生型DE3(0.5 g/L)提高了15倍。该巴豆甜菜碱盐酸盐转化生成L-肉碱的反应在2 h后基本达到稳定。
L-肉碱,巴豆甜菜碱,大肠杆菌,生物转化,基因工程
肉碱,即3-羟基-4-三甲基铵丁酸(L-β-Hydroxy-γ-Butyrobetaine),具有L和D两种异构体,其中只有L-肉碱具有参与脂肪氧化的生理功能,特别是在脂肪的β-氧化过程中作为载体将长链脂肪酸转入线粒体膜内参与脂肪酸的氧化。此外,L-肉碱还具有多种生理功能,具有抗疲劳功能[1];保护神经作用[2],L-肉碱是一种有效的抗氧化剂(自由基清除剂)[3-4];研究报道L-肉碱具有清除超氧游离子、过氧化氢和螯合过渡金属离子的能力和对内源性抗氧化防御系统起保护的作用[5-6];治疗先天性神经代谢疾病[7]和提高男性精子质量[8-9],对延迟患阿尔茨海默症的病症也具有重要作用[10],根据以上多种功能,目前L-肉碱已广泛应用于减肥食品、婴儿食品、运动员饮料、动物饲料以及药物方面。
目前L-肉碱的生产方法主要有化学合成法、直接提取法、微生物发酵法和全细胞粗酶转化法[11]。大多数微生物细胞都有能将巴豆甜菜碱、γ-丁基甜菜碱等作为前体物质转化为L-肉碱的能力[12]。目前,Arense P和Kmlmlla H等人报道了大肠杆菌和农杆菌分别能将巴豆甜菜碱和γ-丁基甜菜碱转化生成L-肉碱[13-14]。微生物在转化巴豆甜菜碱合成L-肉碱的途径中起关键作用的酶有:底物辅酶A转移酶、底物辅酶A连接酶、辅酶A水合酶,此外还有转运蛋白,这些酶和蛋白分别由基因caiBCD、caiT以及操纵子caiF表达[13],本文构建了重组质粒pET-caiBCD和pACYCD-caiF-caiT,转化到大肠杆菌DE3中,利用T7启动子对基因caiBCD、caiF和caiT进行过表达后,发现其产量远远高于野生型。
1 材料和方法
1. 1 材料与仪器
菌株E.coliBL21(DE3)(F-ompT gal dcm lon hsdSB(r-B m-B)λ(DE3[lacI lacUV5-T7 gene 1 ind1 sam7 nin5])和E.coliDH5α(F-endA1 glnV44 thi-1 recA1 relA1 gyrA96 deoR nupG φ80dlacZΔM15Δ(lacZYA-argF)U169,hsdR17(r-k m+k),λ-) 本实验室保存;质粒:pACYCDuet-1(Clmr,4008 bp)和pET28a(vector carries an N-terminal His Tag,Kanr,5,369 bp) 购自Novagen®公司;pMD18-T simple(Ampr,TA cloning vector,2,692 bp) 购自Takara公司;质粒pET-caiBCD(pET28a carries caiBCD,over expression under T7 promoter,Kanr,8.8 kbp)和pACYCD-caiF-caiT(caiF and caiT overexpression under T7 promoter,Clmr,6 kbp) 均有实验室构建;引物caiBCD-F:CAGGCCCAT ATGGATCATCTACCCA TGCC;caiBCD-R:CAGCTCGAGTTAACGTCCTTTCC ACACCG;caiF-F:CACGCCCATATGTGTGAAGGAT ATGTTGAAAAAC caiF-R:CAGCTCGAGTTAACGAC GCATACTCTTTGACAA;caiT-FGGGGAATTCATGAA GAATGAAAAGAGAAAAACGG;caiT-R:GCCAAGCTT TTAATCTTTCCAGTTCTGTTTCGCG 均由生工生物工程(上海)股份有限公司合成;各种限制性内切酶、T4 DNA连接酶、DNA凝胶回收试剂盒 均购自大连宝生物工程有限公司;酵母粉、蛋白胨 购自Oxoid(英国)公司;其它试剂 均为国产分析纯;L-肉碱、乙酰 CoA、肉碱乙酰转移酶(CAT) 购自Sigma公司;LB培养基 蛋白胨10 g/L,酵母粉5 g/L,氯化钠10 g/L,添加1.5%琼脂为LB固体培养基;生长培养基 蛋白胨12 g/L,酵母粉24 g/L,甘油4 mL/L,KH2PO42.312 g/L,K2HPO4·3H2O 16.37 g/L,富马酸一钠12.5 mmol/L,巴豆甜菜碱盐酸盐5 mmol/L,pH7.0。
S1000TmThermal Cycler PCR仪 购自USA(Thermo);Gel.Doc.TmXR+电泳成像仪 USA(Bio-RAD);DUR730紫外分光光度计 Germany;NaNoDrop 2000C超微量样本分光光度计 US/Thermal;PB-10 pH计 德国赛多利斯。
1.2 实验方法
1.2.1 转化液的准备 转化液由20 g/L巴豆甜菜碱盐酸盐溶液和50 mmol/L 的磷酸钾缓冲液组成,其中巴豆甜菜碱盐酸盐溶液用CaCO3调至pH5.0±0.3,再加入到终浓度为50 mmol/L(pH7.6)的磷酸钾缓冲液,此时转化液的pH7.0[15]。
1.2.2 L-肉碱检测方法 DNTB法检测,其反应原理[16]:
配制左旋肉碱标准母液(0.05 g/mL),然后稀释五个标准浓度0.002、0.005、0.008、0.01和0.015 g/mL。取1 mL配制好的上述标本,加入0.1 mol/L HEPES(pH8.0)缓冲液200 μL,加入50 mmol/L EDTA 100 μL,再加入25 μL 10 mmol/L DNTB溶液,最后加入20 μL 12 mmol/L乙酰辅酶A,混匀反应3~5 min后,再加入10 μg肉碱乙酰转移酶(CAT),用水定容至2 mL,反应10 min后在OD412下测定吸光值。根据以上实验得出L-肉碱的标准曲线为:y=52.143x+0.0223,R2=0.9997,式中x:L-肉碱浓度,g/L,y:412 nm处吸光值。用同样方法测定实验中L-肉碱的量。
1.2.3 构建基因工程菌DE3/BCD+F+T
1.2.3.1 pET28a-caiBCD质粒的构建 大肠杆菌自身体内存在caiBCD操纵子,在大肠杆菌W3110基因组上通过PCR扩增得到基因片段caiBCD,然后将其克隆到pMD18-T中,测序验证后将pMD18-caiBCD经Nde I/XhoI双酶切后,与同样经Nde I/XhoI双酶切的载体pET28a DNA片段连接,构建过表达质粒pET28a-caiBCD。
1.2.3.2 pACYCD-caiF-caiT质粒的构建 从大肠杆菌W3110基因组扩增出基因片段caiF和caiT。然后片段caiF与载体pACYCD DNA经Xho I单酶切后在KOD酶的作用下进行融合PCR,构建得到pACYCD-caiF过表达质粒,再将此质粒用HindⅢ/EcoR I双酶切后与同样经HindⅢ/EcoR I双酶切后的片段caiT连接,构建过表达质粒pACYCD-caiF-caiT。
1.2.4 大肠杆菌培养方法与IPTG的诱导条件确定 普通大肠杆菌的培养条件为37 ℃,150~200 r/min的生长环境,测定生长OD600值(OD600值表示微生物在600 nm波长下的吸光值,其间接反应了微生物细胞的生长在溶液中达到的浓度值)。IPTG诱导条件:用终浓度为1 mmol/L的IPTG在菌体培养液中进行4 h(培养基中糖分物质基本消耗完)或10 h(培养基中糖分物质已经消耗完)诱导培养[17],然后在低温下收集菌体细胞,用中性的磷酸缓冲液洗涤2次,得到干净菌体细胞,将干净菌体细胞加入到转化液中,在30~37 ℃(根据菌体细胞生长温度推测30~37 ℃应是其最佳酶活(胞内酶)反应温度)振荡反应2~4 h,测定转化液中L-肉碱的生成量[17]。
1.2.5 重组质粒在大肠杆菌DE3中的表达对L-肉碱产量的影响 将质粒pET-caiBCD和pACYCD-caiF-caiT分别或同时转化至大肠杆菌DE3中得到基因工程菌DE3/BCD+F+T,在1 mL液体LB培养基中活化1 h后,涂布卡那霉素和氯霉素双抗平板。挑单克隆接到3 mL LB中过夜活化,再按1%转接至含有50 mg/L 卡那霉素(Kan)和30 mg/L 氯霉素(Clm)的液体生长培养基中,通过收集菌体细胞加入到转化液中测定其生成的L-肉碱量。
1.2.6 基因工程菌转化底物生成L-肉碱的稳定性测定 将大肠杆菌工程菌DE3/BCD+F+T和野生型 DE3在生长培养基中接种培养至OD600达到10后,再用终浓度为1 mmol/L的IPTG诱导培养4 h并收集菌体细胞,加到含有20 g/L的巴豆甜菜碱的液中进行转化,不同时间段进行取样测定生成的L-肉碱量。
2 结果与分析
2.1 L-肉碱标准曲线的绘制
根据以上方法得出L-肉碱标准曲线,见图1,得到标准曲线方程:y=53.123x+0.012,R2=0.9992,其中,x:L-肉碱浓度,g/L;y:OD412吸光值。
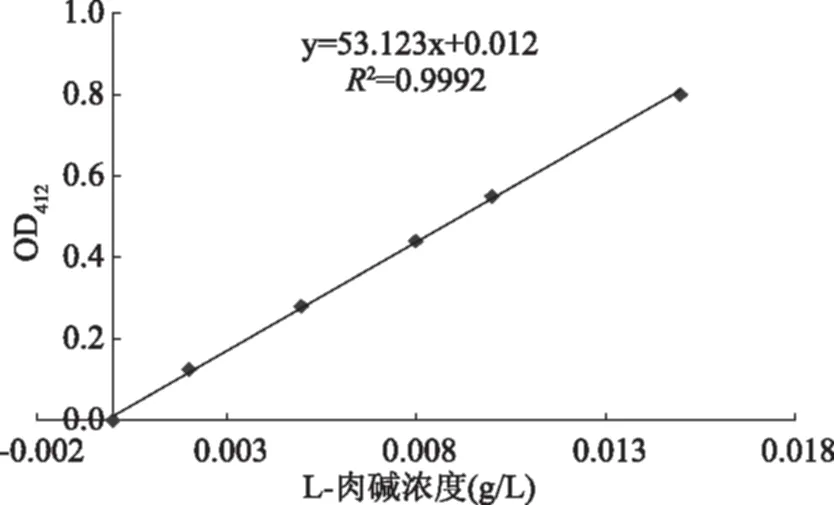
图1 DTNB法绘制L-肉碱的标准曲线Fig.1 The standard curve of L-carnitine in DTNB method
2.2 工程菌DE3/BCD+F+T的构建
2.2.1 重组表达质粒pET28a-caiBCD的构建 经相应的酶切酶连法构建质粒pET28a-caiBCD,构建过程如图2所示。由图3可知,双酶切后的凝胶电泳结果显示载体大小(5369 bp)和目的片段大小(3759 bp)与预期值相符,表明重组的质粒pET28a-caiBCD构建正确。
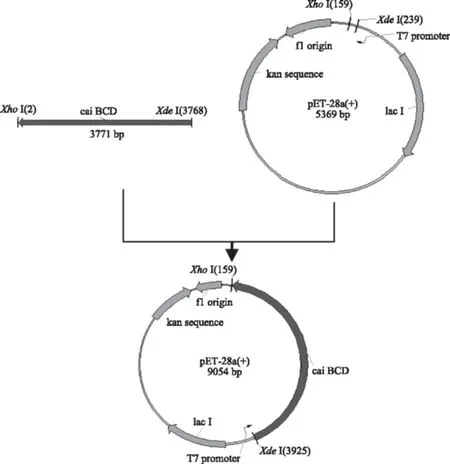
图2 重组质粒pET28a-caiBCD的构建Fig.2 Construction of the plasmid pET28a-caiBCD
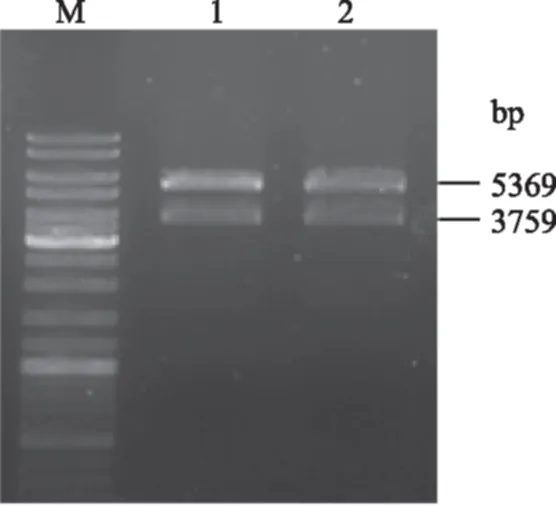
图3 重组质粒pET28a-caiBCD经NdeI/XhoI双酶切的琼脂糖凝胶电泳Fig.3 Agarose gel electrophoresis of PET28a-caiBCD digested by NdeI/XhoI注:M为 DNA Mark DL10000;泳带1和2为酶切过后的质粒pET28a-caiBCD。
2.2.2 重组表达质粒pACYCD-caiF-caiT的构建 构建过程如图4所示,图5表示酶切质粒pACYCD-caiF的凝胶验证图,结果与预期值(4404 bp)相符,表明重组质粒构建正确。再用相应的酶双切和连接后构建过表达质粒pACYCD-caiF-caiT,过程如图4所示,图6表示用HindⅢ酶切重组质粒与对照质粒的凝胶电泳图,重组质粒大小为5894 bp与所预期得值相符,表明重组质粒pACYCD-caiF-caiT也构建正确。
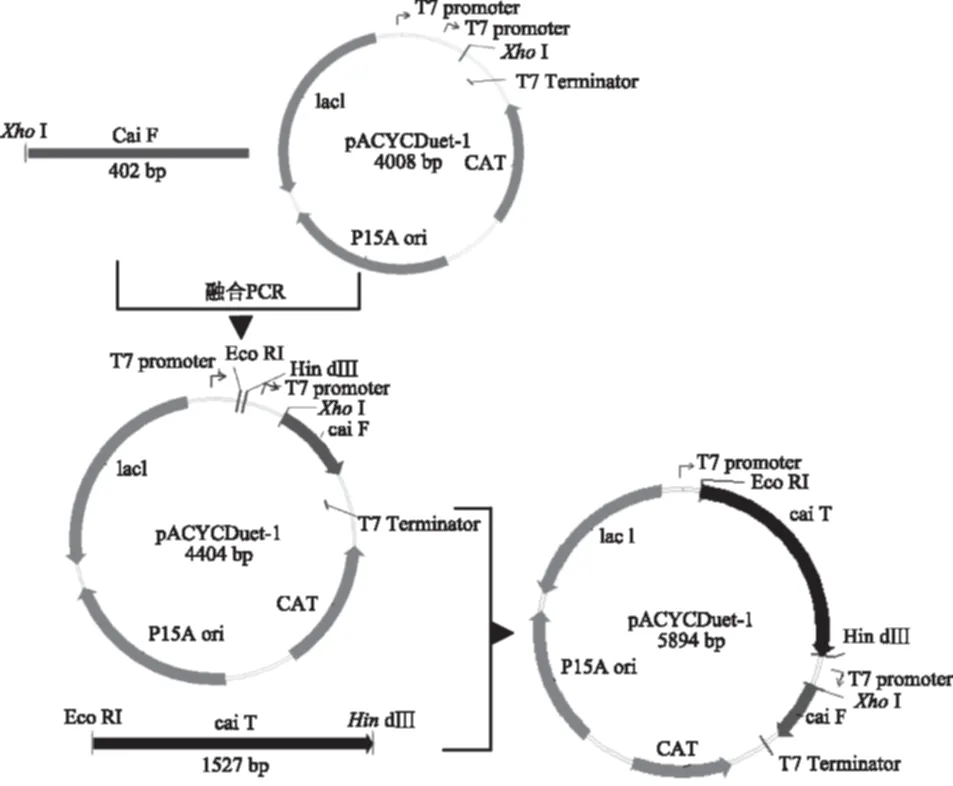
图4 重组质粒pACYCD-caiF-caiT的构建Fig.4 Construction of the plasmid of pACYCD-caiF-caiT

图5 通过融合PCR得到重组质粒pACYCD-caiF用XhoI酶切后的琼脂糖凝胶电泳Fig.5 Agarose gel electrophoresis of pACYCD-caiF digested by XhoI注:M为DNA Mark DL10000;泳带1表示用XhoI 酶切后的质粒pACYCD-caiF的条带;泳带2表示用XhoI 酶切后的质粒pACYCD-1。
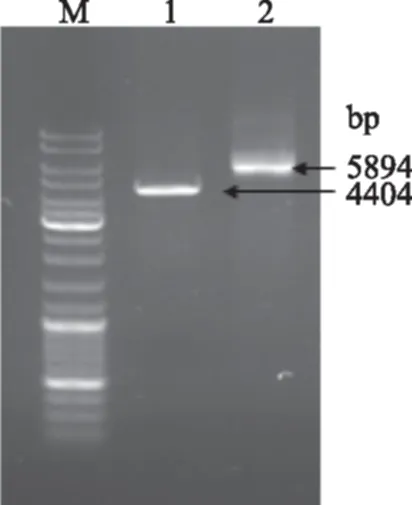
图6 重组质粒pACYCD-caiF-caiT经HindⅢ/EcoRI双酶切的琼脂糖凝胶电泳Fig.6 Agarose gel electrophoresis of pACYCD-caiF-caiT digested by HimdⅢ/EcoRI注:M表示DNA Mark DL10000;泳带1表示HindⅢ酶切后的质粒pACYCD-caiF条带;泳带2表示HindⅢ酶切后的质粒pACYCD-caiF-caiT。
2.3 大肠杆菌培养方法与IPTG的诱导条件确定
2.3.1 不同IPTG诱导时间对产L-肉碱量的影响 如图7所示,基因工程菌DE3/BCD+F+T加IPTG诱导4 h的L-肉碱的产量高于诱导10 h的表达量。
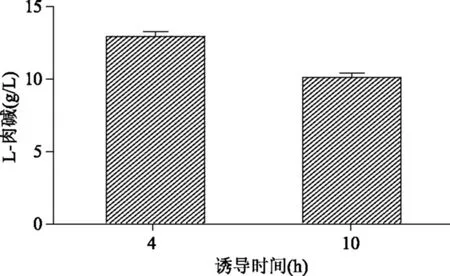
图7 大肠杆菌分别加IPTG诱导4 h和10 h后产L-肉碱的量Fig.7 L-carnitine production in wt and recombinant strain after 4 h and 10 h induction with IPTG
2.3.2 重组质粒在大肠杆菌DE3中的表达对L-肉碱产量的影响 大肠杆菌DE3/BCD+F+T、DE3/BCD和野生型DE3三种菌分别培养、收集后进行转化。结果如图8所示,在大肠杆菌DE3中过表达了基因caiBCD后的工程菌产L-肉碱的量大于野生型,同时过表达了caiBCD和caiFcaiT的工程菌产量大于只过表达了基因caiBCD的菌株。

图8 不同菌株产L-肉碱的量Fig.8 L-carnitine production by different strains
2.3.3 基因工程菌转化底物生成L-肉碱的稳定性测定 如图9所示,当转化相同的底物时,工程菌DE3/BCD+F+T产L-肉碱量在7 g/L以上,远大于野生型DE3(0.5 g/L)。此外,工程菌在1 h后达到稳定后的产量为7.244 g/L,且稳定不变。摩尔转化率(L-肉碱摩尔数与底物巴豆甜菜碱摩尔数之比)为41%。

图9 大肠杆菌野生型和工程菌产L-肉碱量Fig.9 L-carnitine production by wild-type strain and recombinant strain
3 结论
L-肉碱在脂肪氧化过程中起重要的载体作用,对神经类疾病具有良好的预防作用,并且有一定的抗氧化作用。目前L-肉碱的巨大市场需求对其生产方法和技术提出了更高的要求,许多研究者都在探索除化学合成法之外更先进、安全、高效的方法。本实验通过对大肠杆菌DE3体内相关L-肉碱合成的基因进行改造后得到大肠杆菌工程菌DE3/BCD+F+T,当菌体生长到一定密度时加IPTG诱导,能调控菌株产生与L-肉碱相关的酶然后进行全细胞催化底物生产L-肉碱。相比野生菌(L-肉碱的产量不到0.5 g/L)构建的工程菌DE3/BCD+F+T产量提高了(15倍)。然而由于巴豆甜菜碱转化成L-肉碱是一个可逆反应的过程,其在转化2 h后就基本达到稳定不反应的状态。因此,下一步实验要务则是移除产物使反应继续向生成L-肉碱生成方向移动,以进一步提高产量。
[1]周筱燕,陈静,刘常秀,等. 左旋肉碱抗疲劳实验研究[J]. 热带医学杂志,2011,11(7):740-742.
[2]MALAGUARNERA M,VACANTE M,MOTTA M,et al. Acetyl-L-carnitine improves cognitive functions in severe hepatic encephalopathy:a randomized and controlled clinical trial[J]. Metab Brain Dis,2011,26(4):281-289.
[3]TRAINA G. The neurobiology of acetyl-L-carnitine[J]. Front Biosci(Landmark Ed),2016,21:1314-1329.
[4]CURRAN MW,OLSON J,MORHART M. Acetyl-L-carnitine(ALCAR)to enhance nerve regeneration in carpal tunnel syndrome:study protocol for a randomized,placebo-controlled trial[J]. Trials,2016,17(1):1-6
[5]GRAZIELA S RIBAS,CARMEN R VARGAS,MOACIRWAJNER,et al. L-carnitine supplementation as a potential antioxidant therapy for inherited neurometabolic disorders[J]. Gene,2014,533(2):469-476.
[6]AΜGΜGΜGUSTYNIAK A,SKRZYDLEWSKA E. The influence of L-carnitine supplementation on the antioxidative abilities of serum and the central nervous system of ethanolinduced rats[J]. Metabolic Brain Disease,2010,25(4):381-389.
[7]EVANGELIOU A,VLASSOPOΜLΜLOS D. Carnitine metabolism and deficit--when supplementation is necessary?[J]. Curr Pharm Biotechnol,2003,4(3):211-219.
[8]SOFIMAJIDPOUR H,GHADERI E,GANJI O,et al. Comparison of the Effects of Varicocelectomy and Oral L-carnitine on Sperm Parameters in Infertile Men with Varicocele[J].J Clin Diagn Res,2016,10(4):07-10.
[9]AHMED SD,KARIRA KA,JAGDESH,et al. Role of L-carnitine in male infertility[J]. J Pak Med Assoc,2011,61(8):732-736.
[10]CRISTOFANO A1,SAPERE N1,LA MARCA G. Serum Levels of Acyl-Carnitines along the Continuum from Normal to Alzheimer’s Dementia[J]. PLoS One,2016,11(5):1-16.
[11]BERNAL V,SEVILLA A,CáNOVAS M,et al. Production of L-carnitine by secondary metabolism of bacteria[J]. Microbial Cell Factories,2007,31(6):1-17.
[12]杨月英,黄娇芳,顾金杰.L-肉碱的生理功能、生理学制备及检测方法研究进展[J].食品科学,2015,36(5):205-211.
[13]ARENSE P,BERNAL V,CHARLIER D,et al. Metabolic engineering for high yielding L(-)-carnitine production in Escherichia coli[J].Microbial Cell Factories,2013,56(12):1-11.
[14]HOEKS FWJMMOL,KΜLΜLLA H,MEYER H-P. Continuous cell-recycle process for l-carnitine production:performance,engineering and downstream processing aspects compared with discontinuous processes[J]. Journal of Biotechnology,1992,22(1-2):117-127.
[15]张钟元.产L-肉碱脱水酶菌株发酵及酶催化条件的研究[D].北京:中国农业科学院农产品加工研究所,2009.
[16]MARQUIS NORMAN R,FRITZ IRVING B. Enzymological determination of free carnitine concentrations in rat tissues[J]. Journal of Lipid Research,1964,5:184-187.
[17]林晓栩,林晓坚,邱宏端,等.乳糖诱导对大肠杆菌表达CGTase的影响[J].食品工业科技,2015,17:114-120.
Genetically engineeringEscherichiacolistrain and its optimized bioconversion for L-carnitine production
YANG Yue-ying1,2,HUANG Jiao-fang1,3,*,SHI Ji-ping1,WANG Hong-ying2
(1.Shanghai Advanced Research Institute,Shanghai 201210,China; 2.Dalian Polytechnic University,Dalian 116034,China; 3.Shanghai Tech University,Shanghai 201210,China)
L-carnitine plays an important role in fatty acids metabolism. Here a recombinant L-carnitine production strain had been constructed carrying two expression plasmids,pET28a-caiBCD and pACYCD-caiF-caiT,under the control of T7 promoter. This strain was genetically stable and can programmably produce L-carnitine with IPTG induction. 1 mmol/L IPTG was added to induce enzymes expression,after 4 hours induction,cells were collected for the bioconversion of crotonobetaine to L-carnitine. Compared with wild-type strain,the conversion amount of recombinant strain was increased by 15 times. And it took about two hours for the conversion of crotonobetaine to L-carnitine.
L-carnitine;crotonobetaine;Escherichiacoli;bioconversion;biological engineering
2016-11-04
杨月英(1989-),女,硕士研究生,研究方向:微生物基因工程,E-mail:qhyyy0323@163.com
*通讯作者:黄娇芳(1982-),女,博士,助理研究员,研究方向:微生物基因工程,E-mail:huangjf@shanghaitech.edu.cn。
国家自然科学基金 (31400042)。
TS201.1
A
1002-0306(2017)10-0163-05
10.13386/j.issn1002-0306.2017.10.023
