总氨态氮对太平洋鳕仔稚鱼的急性毒性研究
2017-06-19傅泽王华刘萱冷金慧耿聪何亚曹冰姜志强大连海洋大学水产与生命学院辽宁大连602福建省新型污染物生态毒理效应与控制重点实验室福建莆田500大连理工大学环境学院辽宁大连6024大连市水产产业技术创新联合会辽宁大连602
傅泽,王华、2,刘萱,冷金慧、4,耿聪,何亚,曹冰,姜志强(.大连海洋大学水产与生命学院,辽宁大连602;2.福建省新型污染物生态毒理效应与控制重点实验室,福建莆田500;.大连理工大学环境学院,辽宁大连6024;4.大连市水产产业技术创新联合会,辽宁大连602)
总氨态氮对太平洋鳕仔稚鱼的急性毒性研究
傅泽1,王华1、2,刘萱3,冷金慧1、4,耿聪1,何亚1,曹冰1,姜志强1
(1.大连海洋大学水产与生命学院,辽宁大连116023;2.福建省新型污染物生态毒理效应与控制重点实验室,福建莆田351100;3.大连理工大学环境学院,辽宁大连116024;4.大连市水产产业技术创新联合会,辽宁大连116023)
为确保太平洋鳕Gadusmacrocephalus人工育苗生产过程中的水质安全,采用换水式水生生物毒性试验方法,研究了总氨态氮对不同规格(体长4.37、4.88、5.83、7.46 mm)太平洋鳕仔稚鱼的急性毒性。结果表明:在水温为8.5~10.0益、pH为7.96~8.14、溶氧为7.0~8.0mg/L、盐度为29~30条件下,水中总氨态氮对不同日龄太平洋鳕仔稚鱼的毒性不同;对于4、15、22和35日龄的太平洋鳕仔稚鱼,水中总总氨态氮的安全浓度分别为11.518、9.576、1.982、0.959 mg/L,对应非离子氨态氮的安全浓度分别为0.219、0.182、0.038、0.018 mg/L。研究表明,随着太平洋鳕仔稚鱼个体的发育,其对水中总氨态氮的耐受能力逐渐降低。
太平洋鳕;仔稚鱼;总氨态氮;毒性;安全浓度
由于人工培育的海洋鱼类的鱼苗通常体质较弱,需经较长时间的生长发育才能成为可供养殖和放流的幼苗[10]。在培育过程中,苗种的成活率与养殖水质状况密切相关。尤其是在高密度养殖条件下,养殖水体中的有机物分解及生物排泄会导致水中氨氮逐渐积累,当其浓度达到一定值时,会抑制鱼苗正常生长,而且能够诱发多种疾病,甚至直接产生毒害作用[11]。鱼类早期生命阶段是其生命周期中对外界水环境因子变化最敏感的阶段,为了提高太平洋鳕人工育苗的成活率,有必要明确太平洋鳕仔稚鱼培育阶段养殖水体中总氨态氮的安全浓度。本研究中,以人工繁育的太平洋鳕仔稚鱼为受试生物,考察了总氨态氮对不同规格太平洋鳕仔稚鱼的急性毒性,旨在为科学开展太平洋鳕人工育苗过程中的水质调控提供技术支持,也为总氨态氮对鱼类早期生活阶段的毒理学研究提供基础资料。
1 材料与方法
1.1 材料
试验用太平洋鳕仔稚鱼取自大连海洋大学农业部北方海水增养殖重点实验室,选择发育正常、活力良好、大小相近的健康个体用于试验。试验前鱼苗在室内1200 L水槽中暂养24 h,暂养期间不投饵。所用供试仔稚鱼具体规格如表1所示。
试验用海水取自大连市黑石礁近岸海域的沙滤海水,经紫外线消毒、充分曝气和室内升温后使用。试验水温为8.5~10.0益,盐度为29~30,溶氧为7.0~8.0 mg/L,pH为7.96~8.14。
选择NH4Cl(分析纯)作为外加总氨态氮源先将NH4Cl配制成浓度较高的总氨态氮贮备液,然后向海水中滴入适量总氨态氮贮备液,使试液达到所设定的总氨态氮浓度。试验溶液均现用现配。

表1 试验用太平洋鳕仔稚鱼规格Tab.1Larval size of Pacific cod Gadus macrocephalusused in the experiment
1.2 方法
1.2.1 试验设计试验参照GB/T 13267—91的方法,采用换水式毒性试验方法进行总氨态氮对太平洋鳕仔稚鱼的急性毒性试验,试验溶液体积为1 L。根据预试验结果确定总氨态氮试验浓度区间,然后按等对数距离设置7个试验浓度组和1个对照组。对于4日龄和15日龄太平洋鳕仔稚鱼的毒性试验,每个试验容器中随机移入鱼苗20尾;对于22日龄和35日龄鱼苗,每个试验容器中随机移入鱼苗15尾。定期观察鱼苗的存活状况,鱼苗死亡判定以鱼体被触动5 s无任何反应为准,记录鱼苗
24、48、72、96 h时的死亡数,并及时剔除死亡个体。全部急性毒性试验均以对照组鱼苗未出现死亡为参照。每12 h使用YSIProPlus便携式多参数水质分析仪测量水温、溶氧和pH,每24 h换水近100%,全部试验过程不充气、不投饵。
1.2.2 指标的测定与计算本试验中所提及的氨态氮均指水中总氨态氮(TNH+4-N),水中非离子氨态氮(NH3-N)浓度可依据试验水体的温度和pH值,采用《海水水质标准》(GB3097—1997)规定的换算公式获得。总氨态氮对不同规格太平洋鳕仔稚鱼的半致死浓度(LC50),可根据24、48、72、96 h时太平洋鳕仔稚鱼的存活情况,以概率单位图解法计算,并按下式计算出安全浓度(CS)[12]:

2 结果与分析
2.1 总氨态氮对4日龄太平洋鳕仔鱼的急性毒性
由表2可知,水中TNH+4-N对4日龄太平洋鳕仔鱼的毒性随着试验时间的延长而增强,鱼苗的死亡率逐渐增加。当水中N浓度为58.8 mg/L时,48 h时鱼苗的死亡率为10%,72 h时鱼苗的死亡率达到80%,96 h时鱼苗全部死亡。此外,随着水中-N初始浓度的不断升高,其毒性作用不断增强。当水中-N浓度达到235.2 mg/L时,4日龄太平洋鳕仔鱼在24 h内全部死亡。
表3为总氨态氮对4日龄太平洋鳕仔鱼24、48 h的LC50和CS,TN、NH3-N对4日龄太平洋鳕仔鱼的安全浓度分别为11.518、0.219 mg/L。
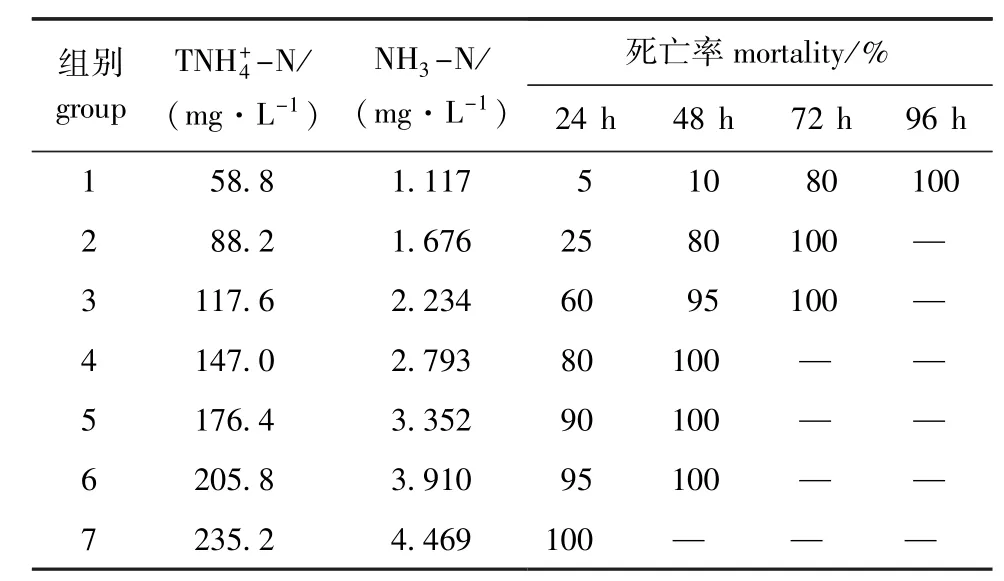
表2TNH+4-N和NH3-N对4日龄太平洋鳕仔鱼的急性毒性试验结果Tab.2Acute toxicity of TNH+4-N and NH3-N to 4 d posthatch larvae of Pacific cod Gadusmacrocephalus
表3 -N和NH3-N对4日龄太平洋鳕仔鱼的半致死浓度和安全浓度Tab.3The LC50and safe concentration(CS)of TNH+4-N and NH3-N to 4 d post-hatch larvae of Pacicifc cod Gadusmacrocephalus

表3 -N和NH3-N对4日龄太平洋鳕仔鱼的半致死浓度和安全浓度Tab.3The LC50and safe concentration(CS)of TNH+4-N and NH3-N to 4 d post-hatch larvae of Pacicifc cod Gadusmacrocephalus
时间/h time回归方程regression equation相关系数R2correlation coefficient TNH+4-N LC50/ (mg·L-1) NH3-N LC50/ (mg·L-1) 24 y=6.1705x -7.5843 0.9977 109.496 2.080 48 y=9.8749x-13.641 0.9756 77.215 1.467安全浓度CS/(mg·L-1)11.518 0.219
2.2 总氨态氮对15日龄太平洋鳕稚鱼的急性毒性
由表4可知,对于15日龄太平洋鳕稚鱼,当水中TNH+4-N浓度为58.8 mg/L时,96 h时鱼苗全部死亡,而当水中-N浓度达到411.6 mg/L时,鱼苗在24 h内全部死亡。
表5为总氨态氮对15日龄太平洋鳕稚鱼24、48 h的LC50和CS,T-N、NH3-N对15日龄太平洋鳕稚鱼的安全浓度分别为9.576、0.182 mg/L。
2.3 总氨态氮对22日龄太平洋鳕稚鱼的急性毒性
由表6可知,当水中TNH+4-N浓度为14.7 mg/L时,96 h时鱼苗死亡率为33.3%,当水中-N浓度为52.9 mg/L时,72 h鱼苗全部死亡。
2.4 总氨态氮对35日龄太平洋鳕稚鱼的急性毒性
表4 N和NH3-N对15日龄太平洋鳕稚鱼的急性毒性试验结果Tab.4Acute toxicity of-N and NH3-N to 15 d post-hatch juvenile of Pacific cod Gadus macro-cephalus

表4 N和NH3-N对15日龄太平洋鳕稚鱼的急性毒性试验结果Tab.4Acute toxicity of-N and NH3-N to 15 d post-hatch juvenile of Pacific cod Gadus macro-cephalus
组别group TNH+4-N/ (mg·L-1) NH3-N/ (mg·L-1)死亡率mortality/% 24 h 48 h 72 h 96 h 1 58.8 1.117 5 15 80 100 2 117.6 2.234 30 80 100—3 176.4 3.352 60 90 100—4 235.2 4.469 80 100——5 294.0 5.586 90 100——6 352.8 6.703 95 100——7 411.6 7.820 100——
表5 -N和NH3-N对15日龄太平洋鳕稚鱼的半致死浓度和安全浓度Tab.5The LC50and CSofN and NH3-N to 15 d post-hatch juvenile of Pacific cod Gadusmacroceph-alus

表5 -N和NH3-N对15日龄太平洋鳕稚鱼的半致死浓度和安全浓度Tab.5The LC50and CSofN and NH3-N to 15 d post-hatch juvenile of Pacific cod Gadusmacroceph-alus
时间/h time回归方程regression equation相关系数R2correlation coefficient TNH+4-N LC50/ (mg·L-1) NH3-N LC50/ (mg·L-1) 24 y=4.3221x -4.422 0.9919 151.356 2.876 48 y=5.0069x-4.796 0.9629 90.365 1.717安全浓度CS/(mg·L-1)9.576 0.182
表6 -N和NH3-N对22日龄太平洋鳕稚鱼的急性毒性试验结果Tab.6Acute toxicity of-N and NH3-N to 22 d posthatch juvenile of Pacific cod Gadusmacrocephalus
组别group TNH+4-N/ (mg·L-1) NH3-N/ (mg·L-1)死亡率mortality/% 24 h 48 h 72 h 96 h 1 14.7 0.279 13.3 20.0 20.0 33.3 2 29.4 0.559 33.3 66.7 66.7 80.0 3 35.3 0.671 40.0 66.7 73.3 86.6 4 43.8 0.832 46.7 66.7 86.6 93.3 5 49.7 0.944 53.3 80.0 93.3 100.0 6 52.9 1.005 80.0 93.3 100.0—7 58.8 1.117 93.3 93.3 100.0—
表7 N和NH3-N对22日龄太平洋鳕稚鱼的半致死浓度和安全浓度Tab.7The LC50and CSof TN and NH3-N to 22 d post-hatch juvenile of Pacific cod Gadus macro-cephalus

表7 N和NH3-N对22日龄太平洋鳕稚鱼的半致死浓度和安全浓度Tab.7The LC50and CSof TN and NH3-N to 22 d post-hatch juvenile of Pacific cod Gadus macro-cephalus
时间/h time回归方程regression equation相关系数R2correlation coefficient TNH+4-N LC50/ (mg·L-1) NH3-N LC50/ (mg·L-1) 24 y=2.2525x +1.2477 0.9993 46.323 0.880 48 y=3.6837x-0.0977 0.9426 24.199 0.460 72 y=4.2479x-0.8272 0.9906 23.534 0.447 96 y=4.0676x-0.1724 0.9987 18.690 0.355安全浓度CS/(mg·L-1)1.982 0.038
表8 -N和NH3-N对35日龄太平洋鳕稚鱼的急性毒性试验结果Tab.8Acute toxicity ofN and NH3-N to 35 d post-hatch juvenile of Pacific cod Gadus macro-cephalus
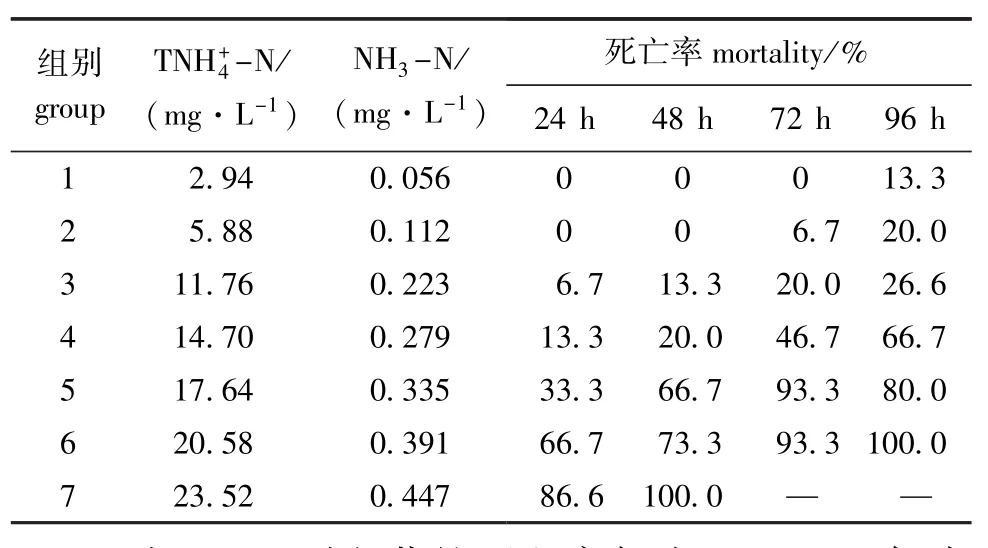
表8 -N和NH3-N对35日龄太平洋鳕稚鱼的急性毒性试验结果Tab.8Acute toxicity ofN and NH3-N to 35 d post-hatch juvenile of Pacific cod Gadus macro-cephalus
组别group TNH+4-N/ (mg·L-1) NH3-N/ (mg·L-1)死亡率mortality/% 24 h 48 h 72 h 96 h 1 2.94 0.056 0 0 0 13.3 2 5.88 0.112 0 0 6.7 20.0 3 11.76 0.223 6.7 13.3 20.0 26.6 4 14.70 0.279 13.3 20.0 46.7 66.7 5 17.64 0.335 33.3 66.7 93.3 80.0 6 20.58 0.391 66.7 73.3 93.3 100.0 7 23.52 0.447 86.6 100.0——
3 讨论
3.1 不同日龄太平洋鳕仔稚鱼对总氨态氮的耐受性
本试验过程中,观察到太平洋鳕仔稚鱼对总氨态氮的反应较敏感,高浓度组的仔稚鱼反应更为强烈。试验早期鱼苗易出现受惊、急游和打转,随着试验时间的延长或总氨态氮浓度的增加,试验鱼苗会出现反应迟钝和栖底的现象。试验中发现,不同日龄的太平洋鳕仔稚鱼对水中总氨态氮的毒性反应明显不同,总氨态氮对太平洋鳕仔稚鱼的安全浓度以4日龄最高,35日龄最低,其顺序为4日龄>15日龄>22日龄>35日龄,当太平洋鳕仔稚鱼发育到35日龄时,其养殖用水中总氨态氮的浓度不得高于渔业用水的水质要求。说明随着太平洋鳕仔稚鱼个体的逐渐发育,其对水中总氨态氮的耐受能力也逐渐降低。这不仅与太平洋鳕仔稚鱼个体发育程度有关,还与太平洋鳕仔稚鱼个体与外界水环境间的物质交换有关。在太平洋鳕仔稚鱼的生长发育过程中,对于4日龄鱼苗,其消化道未完全形成,需要依赖卵黄维持生命活动,因而对外界水环境因子的变化不太敏感,对总氨态氮的耐受能力也较强;对于7日龄后的太平洋鳕稚鱼,其消化道开始具有生理功能,鱼苗开口摄食,开口初期仔稚鱼鱼苗摄食量较少,但随着鱼苗的发育,摄食量逐渐增加,鱼苗与外界水环境间的物质交换增多,总氨态氮对太平洋鳕稚鱼发育和生长的影响也增大。
总氨态氮对于鱼类苗种生长发育的影响,不仅表现在抑制鱼类自身总氨态氮的排泄,还能通过鱼体表面渗入到体内,引起包括鳃组织在内的一些重要器官的损伤,抑制其生长和发育,降低自身免疫力,甚至引起死亡[13]。王志坚等[14]研究了总氨态氮对稀有鮈鲫Gobiocypris rarus卵黄囊期仔鱼的毒性,发现总氨态氮暴露影响了仔鱼功能性鳔的形成,造成卵黄囊水肿以及血液循环障碍等毒性效应。因此,随着太平洋鳕仔稚鱼日龄增加,其对水中总氨态氮的耐受能力也逐渐下降。本试验结果与已报道的其他种类鱼类的研究结果相同。Barimo等[15]报道,海湾豹蟾鱼Opsanus beta早期发育阶段的幼鱼对水中总氨态氮的耐受能力高于成体; Adelman等[16]也发现,托普美洲鱥Notropis topeka在pH 8.0和水温25益时,托普美洲鱥仔稚鱼对总氨态氮的耐受能力强于成体。
表9 N和NH3-N对35日龄太平洋鳕稚鱼的半致死浓度和安全浓度Tab.9The LC50and CSof-N and NH3-N to 35 d post-hatch juvenile of Pacific cod Gadus macro-cephalus larvae

表9 N和NH3-N对35日龄太平洋鳕稚鱼的半致死浓度和安全浓度Tab.9The LC50and CSof-N and NH3-N to 35 d post-hatch juvenile of Pacific cod Gadus macro-cephalus larvae
时间/h time回归方程regression equation相关系数R2correlation coefficient TNH+4-N LC50/ (mg·L-1) NH3-N LC50/ (mg·L-1) 24 y=5.3797x -2.2764 0.9621 19.711 0.375 48 y=7.9932x-4.816 0.8994 16.904 0.321 72 y=12.976x-9.8735 0.9382 14.028 0.267 96 y=2.5725x+2.48 0.9449 9.539 0.181安全浓度CS/(mg·L-1)0.954 0.018
3.2 非离子氨态氮对不同日龄太平洋鳕仔稚鱼的安全浓度
水中的总氨态氮有两种存在形式,即离子氨态氮和非离子氨态氮,两者间的比例关系决定于水的pH、温度和盐度,并且非离子氨态氮对水生动物的毒性远高于离子总氨态氮,研究者多采用非离子氨态氮作为毒性评价指标。本研究中发现,非离子氨态氮对4、15、22和35日龄太平洋鳕仔稚鱼的安全浓度分别为0.219、0.182、0.038、0.018 mg/ L。虽然林忠婷等[17]报道了非离子氨态氮对7日龄裸项栉虾虎鱼Ctenogobius gymnauchen仔鱼的安全浓度为0.91 mg/L,高于本试验结果,但已报道的非离子氨态氮对大部分种类仔稚鱼的安全浓度与本研究结果相近。例如,王甜等[18]以体质量为(2.80依0.36)g的白斑狗鱼Esox lucius幼鱼为研究对象,发现非离子氨态氮对白斑狗鱼幼鱼的安全浓度为0.08 mg/L;陈瑞明[19]报道了非离子氨态氮对10~12日龄鳜鱼Siniperca chuatsi鱼苗的安全浓度为0.06 mg/L;杜浩等[20]报道了非离子氨态氮对8~12日龄中华鲟Acipenser sinensis稚鱼96 h的半致死浓度为0.39 mg/L,当安全系数取值为0.1时,可推算出非离子氨态氮的安全浓度为0.039 mg/L;武玉强等[21]报道了非离子氨态氮对90日龄文昌鱼Branchiostoma lanceolatum幼鱼的安全浓度为0.032 mg/L;郑乐云[22]发现,非离子氨态氮对平均全长4.4 cm的斜带石斑鱼Epinephelus coioides鱼苗的安全浓度为0.011 mg/L,表明该种类鱼苗的苗种培育过程中用水必须优于渔业用水的水质标准。诸多文献报道说明,非离子氨态氮的毒性会因鱼的种类及其不同发育阶段而异。不同种类、不同发育阶段的鱼苗,对非离子氨态氮的耐受性也不同,本试验中不同日龄太平洋鳕仔鱼的非离子氨态氮安全浓度均不同也说明了这一点。
为了保证太平洋鳕人工育苗生产的顺利进行,必须注重鱼苗培育过程中的水质监测,严格控制养殖用水中总氨态氮的含量,提高水质管理措施和调控技术,保持水质稳定。同时,要根据太平洋鳕仔稚鱼不同发育阶段进行水质管理,注重改善苗种生长发育的水环境条件,以提高苗种培育的成活率。
[1]刘静,宁平.黄海鱼类组成、区系特征及历史变迁[J].生物多样性,2011,19(6):764-769.
[2]高天翔,武云飞,张秀梅,等.四种鳕鱼的形态学研究[J].青岛海洋大学学报,2002,32(6):884-896.
[3]高天翔,张肖荣,王丹,等.几种鳕鱼的生物学初步研究[J].海洋湖沼通报,2003(1):35-42.
[4]毕潇潇,高天翔,肖永双,等.4种鳕鱼线粒体16S rRNA、COI和Cyt b基因片段序列的比较研究[J].南方水产,2009,5(3): 46-52.
[5]毛明光,温施慧,姜志强,等.太平洋鳕神经坏死病毒衣壳蛋白(CP)的原核表达及条件优化[J].大连海洋大学学报,2016, 31(2):117-123.
[6]尹伟力,方绍庆,耿金培,等.鳕鱼物种特异性鉴定的PCR方法研究[J].动物医学进展,2011,32(2):19-24.
[7]姜志强,张志明,赵翀,等.太平洋鳕性腺发育及营养来源的初步研究[J].大连海洋大学学报,2012,27(4):315-320.
[8]王伟,姜志强,孟凡平,等.急性温度胁迫对太平洋鳕仔稚鱼成活率、生理生化指标的影响[J].水产科学,2012,31(8):463-466.
[9]李艳秋,吴洪,孙阳,等.不同光照强度对太平洋鳕仔鱼摄食的影响[J].现代农业科技,2013(4):272-273,277.
[10]林浩然.海洋鱼类的生长与发育生物学研究与苗种培育[J].中山大学学报:自然科学版,2001,40(4):1-4,12.
[11]Weber R A,Maceira J JP,Mancebo M J,et al.Effects of acute exposure to exogenous ammonia on cerebralmonoaminergic neuro-transmitters in juvenile Solea senegalensis[J].Ecotoxicology, 2012,21(2):362-369.
[12]雷衍之.养殖水环境化学[M].北京:中国农业出版社,2004.
[13]Miron D D S,Moraes B,Becker A G,et al.Ammonia and pH effects on some metabolic parameters and gill histology of silver catfish,Rhamdia quelen(Heptapteridae)[J].Aquaculture,2008, 277(3-4):192-196.
[14]王志坚,鲁增辉,石萍.氨氮对稀有鮈鲫胚胎及卵黄囊期仔鱼的毒性效应研究[J].环境科学,2012,33(4):1323-1330.
[15]Barimo JF,Walsh P J.The effects of acute and chronic ammonia exposure during early life stages of the gulf toadfish,Opsanus beta [J].Aquatic Toxicology,2005,75(3):225-237.
[16]Adelman IR,Kusilek L I,Koehle J,etal.Acute and chronic tox-icity of ammonia,nitrite,and nitrate to the endangered Topeka shiner(Notropis topeka)and fathead minnows(Pimephales promelas)[J].Environmental Toxicology and Chemistry,2009,28 (10):2216-2223.
[17]林忠婷,李建军,陈琳,等.非离子氨和亚硝酸氮对虾虎鱼仔鱼的急性毒性及安全浓度评价[J].中国比较医学杂志, 2011,21(9):45-48.
[18]王甜,杜劲松,高攀,等.氨氮对白斑狗鱼幼鱼的急性毒性研究[J].水产学杂志,2010,23(3):37-39.
[19]陈瑞明.铵态氮和亚硝酸盐氮对鳜鱼苗的急性毒性试验[J].水利渔业,1998(1):17-20.
[20]杜浩,危起伟,刘鉴毅,等.苯酚、Cu2+、亚硝酸盐和总氨氮对中华鲟稚鱼的急性毒性[J].大连水产学院学报,2007,22 (2):118-122.
[21]武玉强,陈学豪,张孝杰,等.非离子氨对文昌鱼的急性毒性影响[J].水产科学,2012,31(12):745-748.
[22]郑乐云.氨氮和亚硝酸盐对斜带石斑鱼苗的急性毒性效应[J].海洋科学,2012,36(5):81-86.
Acute toxicity of total ammonia nitrogen to larval and juvenile Pacific cod Gadusmacrocephalus
FU Ze1,WANG Hua1,2,LIU Xuan3,LENG Jin-hui1,4,GENG Cong1, HE Ya1,CAO Bing1,JIANG Zhi-qiang1
(1.College of Fisheriesand Life Science,Dalian Ocean University,Dalian 116023,China;2.Fujian Provincial Key Laboratory of Ecology-Toxicologi-cal Effects&Control for Emerging Contaminants,Putian 351100,China;3.School of Environment Science&Techonlogy,Dalian University of Tech-nology,Dalian 116024,China;4.Dalian Fisheries Industry Technology Innovation Association,Dalian 116023,China)
The acute toxicity of total ammonia nitrogen to different ages of larval and juvenile Pacific cod Gadus macrocephalus with body length of 4.37,4.8,5.83 mm and 7.46 mm were studied using aquatic toxicitymethods atwater temperature from 8.5益to 10.0益,pH 7.96-8.14,dissolved oxygen levels ranging from 7.0 mg/L to 8.0 mg/L,and a salinity of29-30 in order to evaluate toxic effects of total ammonia nitrogen to larval and juvenile Pacific cod during breeding in a hatchery.The results showed that the acute toxicity of total ammonia nitrogen was significantly varied with different old age larval and juvenile Pacific cod.Itwas found that the safety concentration of total total ammonia nitrogen nitrogen to the 4,15,22 d and 35 d post-hatched larval and juvenile Pacific cod were 11.518,9.576,1.982 and 0.959 mg/L,with un-ionic total ammonia nitrogen safety concentration of 0.219,0.182,0.038 mg/L and 0.018mg/L,respectively.The findings demonstratedthat the tolerance capability of larval and juvenile Pacific cod for total ammonia nitrogen is decreased with the juvenile growth,being essential to control the water quality,especially un-ionic total ammonia nitrogen,during the Pacific cod larval and juvenile culture.
Gadusmacrocephalus;larva and juvenile;total ammonia nitrogen;toxicity;safety concentration
S941
A太平洋鳕Gadusmacrocephalus隶属于鳕形目、鳕科、鳕属,系海洋冷温性鱼类,主要分布于太平洋北部沿岸海域,其肉质细嫩、味道鲜美、营养丰富,是一种重要的海洋经济鱼类。太平洋鳕曾是中国黄海大陆架浅水底层鱼类中的传统优势种类,但由于环境变化和过度捕捞,近几十年间,中国太平洋鳕的渔业资源出现明显衰退[1]。研究表明,通过天然海域人工增殖放流有可能补充和恢复黄海海域太平洋鳕种群资源。目前,国内外学者对太平洋鳕的研究仅限于形态学、生物学和分子生物学等方面[2-6],对繁育生物学方面的研究较少[7],特别是针对太平洋鳕人工育苗的研究,仅有光照强度和温度胁迫对太平洋鳕仔稚鱼生长发育影响的报道[8-9]。
10.16535/j.cnki.dlhyxb.2017.03.012
2095-1388(2017)03-0329-05
2017-01-07
辽宁省自然科学基金资助项目(2014020149);辽宁省教育厅科学研究项目(L201603);辽宁省省级本科教学改革项目(UP-RP20160326);福建省新型污染物生态毒理效应与控制重点实验室开放课题(PY16005);大连市科技计划项目(2012B11NC049)
傅泽(1993—),男,本科生。E-mail:517976102@qq.com
王华(1973—),男,博士,副教授。E-mail:wanghua@dlou.edu.cn
