冷休克诱导红鳍东方鲀雄核发育单倍体的条件优化
2017-06-19周贺张蕊徐其征麻天宇江振华庄子昕高俊姜志强李雅娟大连海洋大学辽宁省省级高校海洋生物资源可持续利用重点实验室农业部北方海水增养殖重点实验室辽宁大连116023
周贺,张蕊,徐其征,麻天宇,江振华,庄子昕,高俊,姜志强,李雅娟(大连海洋大学辽宁省省级高校海洋生物资源可持续利用重点实验室,农业部北方海水增养殖重点实验室,辽宁大连116023)
冷休克诱导红鳍东方鲀雄核发育单倍体的条件优化
周贺,张蕊,徐其征,麻天宇,江振华,庄子昕,高俊,姜志强,李雅娟
(大连海洋大学辽宁省省级高校海洋生物资源可持续利用重点实验室,农业部北方海水增养殖重点实验室,辽宁大连116023)
为探索无需卵子失活仅用冷休克方法诱导雄核发育单倍体,以红鳍东方鲀Takifugu rubripes为研究对象,试验选用L9(34)设计,进行3因素3水平的正交试验,处理温度设为0、2、4益,处理持续时间设为30、45、60 min,处理起始时间设为2、5、8 min,共9个试验组,并对其后代采用单个胚胎染色体计数法进行染色体数目统计及微卫星分析。结果表明:冷休克诱导得到的单倍体率最高为第7试验组和第9试验组,分别为受精后8 min在4益下处理30 min和受精后5 min在4益下处理60 min,单倍体率分别为86.7%和80.0%;根据正交试验直观分析结果,得出冷休克诱导红鳍东方鲀雄核发育单倍体的3因素最优组合为处理温度4益、处理持续时间60 min、处理起始时间8min;影响冷休克诱导单倍体的3因素主次顺序为处理温度>处理起始时间>处理持续时间;微卫星分析结果表明,单倍体携带的遗传基因全部为父本的遗传基因。研究表明,仅用冷休克方法可以成功诱导红鳍东方鲀雄核发育单倍体,雄核发育单倍体率高达86.7%,为进一步研究诱导红鳍东方鲀雄核发育二倍体奠定了基础。
红鳍东方鲀;冷休克;雄核发育;单倍体;正交试验
红鳍东方鲀Takifugu rubripes是鲀形目中个体最大、毒性最小、经济价值最高的名贵海水鱼类。其肉质洁白、细嫩,肉味鲜美,享有“鱼中之王冶的美称。是中国北方海水养殖的首选和出口创汇的优势水产品。红鳍东方鲀雌雄生长速度虽然差异不大,但性成熟的雄鱼肉质好、精巢味美,所以成熟雄鱼价格是雌鱼的2倍[1]。因此,如能采用安心、安全、高效的冷休克诱导技术,即不使用紫外线照射,也不进行投喂性激素等方法,便能高效生产雄性红鳍东方鲀,从而提高经济效益,其研究成果具有一定的应用价值。
关于红鳍东方鲀遗传育种方面的研究,日本学者在红鳍东方鲀的遗传连锁图谱、抗虫、种间杂交、性别决定及控制技术等方面进行了系统研究[1]。Kikuchi等[2]根据基因组连锁分析,进一步确定红鳍东方鲀性别决定机制为XX/XY型,且性别决定基因位于19号连锁群的单一区域。Kamiya等[3]报道,采用单核苷酸多态性(Single Nucleo-tide Polymorphisms,SNP)标记得到红鳍东方鲀性别决定基因抗苗勒氏管激素域型受体Amhr2特异标记1个,即X染色体上为胞嘧啶(C),Y染色体上为鸟嘌呤(G),而且利用Amhr2基因中特异SNP位点鉴别遗传性别准确率几乎可达到100%。中国学者近几年的研究主要集中在杂交育种[4]、微卫星标记[5-8]、家系构建与早期标准化培育[9]和形态性状分析[10]等方面,而有关红鳍东方鲀雄性化鲜有报道,最近周贺等[11]报道了低温诱导红鳍东方鲀雄性化及早期性腺分化的组织学观察。但关于冷休克诱导红鳍东方鲀雄核发育国内外尚未见报道。为此,本试验中以红鳍东方鲀为研究对象,利用正交试验设计方法,筛选出诱导雄核发育单倍体的最佳条件,旨在为进一步研究诱导红鳍东方鲀雄核发育二倍体奠定理论基础。
1 材料与方法
1.1 材料
试验于2015年在大连市天正实业集团唐山嘴东养殖场进行,仅用1对亲本。鳍东方鲀父本体长为38.4 cm,体质量为2.4 kg;母本体长为41.7 cm,体质量为2.7 kg。
1.2 方法
1.2.1 催产及授精挑选性腺发育良好的个体为亲本,提前24 h注射绒毛膜促性腺激素(HCG)进行催产(雌鱼2500~3000 IU/kg,雄鱼用量减半),24 h后两手用力挤压腹部两侧,将卵收集于搪瓷盆中。将雄鱼生殖孔朝上,用毛巾擦干,轻压生殖孔前方两侧,将精液挤到卵上,顺时针晃动搪瓷盆使精卵充分接触,加入海水激活精子,进行人工授精。
1.2.2 正交试验设计正交试验表选用L9(34)[12]。试验设处理温度、处理持续时间、处理起始时间3因素3水平(表1)。用直观分析法获得决定红鳍东方鲀雄核发育单倍体率的主次顺序和最优组合。

表1 正交试验因素水平表Tab.1Factor and level table in an orthogonal test
1.2.3 单倍体诱导在受精后的2、5、8 min分别将受精卵放入0、2、4益低温水中,持续时间为30、45、60 min,冷休克解除后将受精卵放到常温水中进行孵化。
1.2.4 倍性鉴定采用染色体计数法进行倍性鉴定。当受精卵发育到眼点出现时,去除卵膜和卵黄,用0.0025%的秋水仙素处理45 min,用0.8%的柠檬酸低渗20 min,再用预冷的卡诺固定液(甲醇颐冰醋酸=3颐1)固定3次,每1次15~20 min,最后更换新的固定液于-20益下冷冻过夜。次日冷滴片,用10%的吉姆萨染色,风干,镜检,拍照。
1.2.5 微卫星分析在单倍体率最高的处理组(第7处理组)随机选取30个已固定好的样品。使用F0080与F0094两对微卫星引物[13]进行分析(表2),引物合成和微卫星分析委托上海生工生物工程有限公司完成。

表2 微卫星引物序列Tab.2Sequence of the m icrosatellite primers used in the expriment
1.2.6 数据统计当眼点出现后统计受精率,即受精卵数占总卵数的百分比。孵化前期时统计孵化率,即孵化苗数占受精卵数的百分比。开口摄食时统计成活率,即成活胚胎数占总受精卵数的百分比。使用SPSS 22.0软件进行Student蒺s-test显著性检验,著性水平设为0.05。
2 结果与分析
2.1 倍性分析
通过染色体计数法对正交试验1~9组(表3)单个胚胎(30个/组)的倍性进行了分析,结果表明,雄核发育单倍体染色体数目为n=22(图1-A),正常二倍体染色体数目为2n=44(图1-B)。雄核发育单倍体率最高的是第7和第9处理组,单倍体率分别为86.7%和80.0%(图2-H、J),同时在第1、2、3、4、5、6、8处理组发现频率不同的三倍体(图2-B~G、I)。
2.2 正交试验分析

图1 红鳍东方鲀胚胎染色体中期分裂相Fig.1The metaphase division phase of chromosomesin embryos in red fin puffer Takifugu rubripes

图2 正交试验各组胚胎染色体数目分布频率(n=30)Fig.2Distribution frequency of chromosome number in embryos in each group during the orthogonal test(n=30)
正交试验结果见表3。以单倍体率为指标,极差分析结果表明,雄核发育3因素的主次顺序为温度>起始时间>持续时间(表3)。由图3可知,A和C两图中,折线的陡度较大,也说明处理温度和处理起始时间两因素对雄核发育单倍体的效应较大,即为主要因素,其次为处理持续时间因素。根据表3分析,正交试验最优组合为A3B3C3,即获得的最优水平组合为温度4益、持续时间60 min、起始时间8 min。
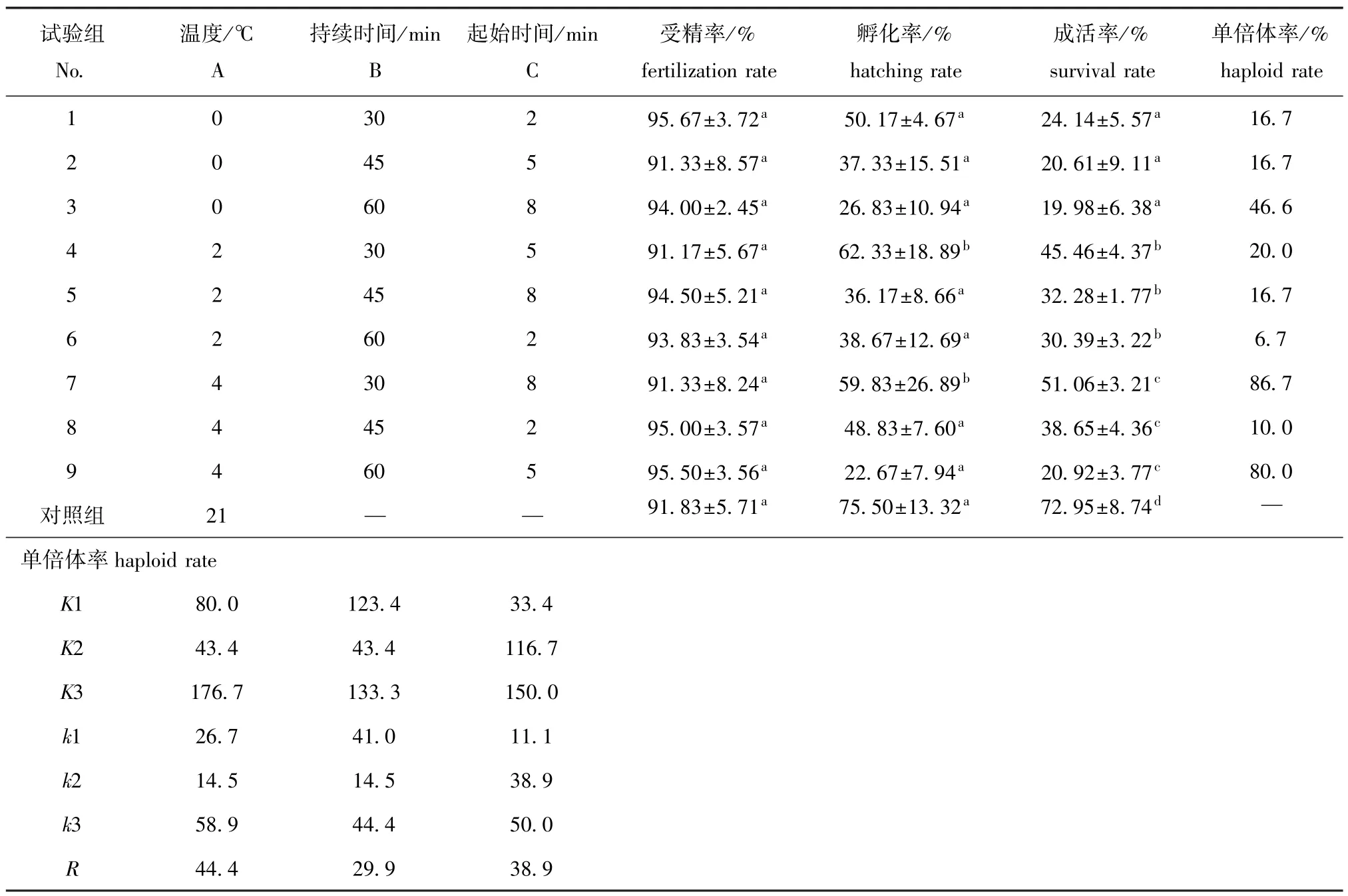
表3 正交试验设计及试验结果Tab.3Design and results in the orthogonal test
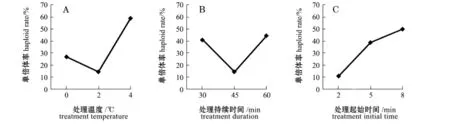
图33 因素不同水平对雄核发育单倍体诱导率的效应Fig.3Effects of the three factors and different levels on diploid rate
2.3 微卫星分析
采用筛选获得的两对多态性微卫星引物对雄核发育单倍体率较高的第7处理组(86.7%)、亲本和对照组进行了微卫星分析。结果显示(表4):引物F0080母本基因型为A型,父本基因型为B/ C型,雄核发育组后代基因型有二倍体A/B型、A/C型及单倍体B型、C型;在引物F0094的微卫星标记中,父本基因型为A型,母本基因型为B型,雄核发育后代基因型为二倍体A/B型、单倍体A型。说明雄核发育组单倍体个体所携带的基因全部来自父本,未有母本基因的表达。进一步从分子水平上说明雄核发育处理后遗传物质减半,后代与正常受精的对照组不同,是遗传物质来父本具有1套染色体组的单倍体。

表4 个体数量、父母本基因型及其雄核发育群体中的雄核发育子代Tab.4The individual number,genotype of parents and and rogenesis offsping in the androgenesis populations
3 讨论
3.1 冷休克诱导雄核发育
雄核发育是生产鱼类全雄苗种的重要途径。雄核发育(Androgenesis)是指遗传失活的卵子与精子受精,产生的后代仅含有父本遗传物质个体的繁殖方式[14]。鱼类诱导雄核发育的方法主要有两个步骤,首先卵细胞染色体遗传失活;然后精子染色体加倍。关键技术是卵细胞染色体的遗传失活。常用方法有紫外线(UV)、酌射线、胤射线等,虽然这些方法简单易行,但射线法不仅使卵子细胞核破坏,同时可使细胞质和一些细胞器也遭到破坏,从而使胚胎不能正常发育,导致成活率极低。因此,无需射线照射便能产生雄核发育个体已成为迫切需要解决的问题。
不用射线照射仅让受精卵在高温或低温环境刺激下产生雄核发育的方法目前国内外鲜有报道。最早Gervai等[15]利用冷休克方法除获得三倍体外,也获得大量的雄核发育单倍体胚胎。Ueda[16]研究发现,在虹鳟受精后30 s或3.5 h后用热休克(30益,7 min)可获得少量的雄核发育二倍体个体。近年来,日本学者Morishima等[17]报道了泥鳅Mis-gurnus anguillicaudatus受精后利用3益低温水处理受精卵60 min,能诱导产生雄核发育后代。Hou等[18]进行了人工四倍体泥鳅产生雄核发育二倍体的研究。王玉生等[19]报道了大鳞副泥鳅受精卵在3益冰水中处理60 min,可产生雄核发育单倍体,其细胞学机制与Morishima等[17]报道的相一致,即卵核与第二极体一同释放;林忠乔[20]等报道了自然四倍体泥鳅受精卵在3益冰水中处理60 min,可诱导雄核发育二倍体,这样可以省去精子染色体的加倍,从而提高成活率。Hou等[21]报道了斑马鱼受精卵在7益水中处理30 min时单倍率最高,并得到克隆二倍体个体。本研究中发现,红鳍东方鲀在受精后8 min,用4益低温水处理30 min,可高频率诱导雄核发育单倍体(单倍体率86.7%),受精后5 min,用4益低温水处理60 min也可高频率诱导雄核发育单倍体(单倍体率80.0%)。利用冷休克诱导雄核发育能否成功的关键因素是冷休克处理温度、处理起始时间和处理持续时间这三大要素。而这些要素水平最佳组合的筛选又是提高诱导率的关键。因此,本研究中利用正交试验,筛选出诱导红鳍东方鲀雄核发育单倍体最佳组合为受精后8 min、处理温度4益、处理时间60 min。与以往报道的受精后即刻放入低温水中处理有所不同,原因可能是红鳍东方鲀卵膜厚,胚胎发育缓慢所致,也就是说红鳍东方鲀在受精后8 min第二极体未释放。本研究中还发现,经低温处理后,一种情况是第二极体与卵核一同释放,这种情况可形成无核卵,精核继续发育形成雄核发育单倍体;另一种情况是第二极体被抑制,形成三倍体。关于何种情况下第二极体被抑制,何种情况与卵核一同释放,其机制是什么,都有待于今后继续研究。
3.2 雄核发育后代的性别
人工诱导雄核发育二倍体途径有以下几种。(1)通过抑制第一次卵裂的方法获得:Corley-Smith等[22]、赵振山等[23]、Nam等[24]、Brown等[25]和Kirankumar等[26]分别利用热休克法阻止了斑马鱼、大鳞副泥鳅、泥鳅、虹鳟和六带鲃的第一次卵裂,获得了雄核发育二倍体。Parsons等[27]、Scheerer等[28]利用静水压抑制第一次卵裂获得了虹鳟雄核二倍体个体。但是,通常这些雄核发育二倍体的成活率都很低;(2)通过融合两个精子与失活的卵子受精获得雄核发育二倍体:Araki等[29]用含有85 mmol/L CaCl2的人工精浆融合虹鳟精子,然后使其与用酌射线失活的卵子受精,孵化出0.11%的雄核发育二倍体;(3)利用四倍体得到的二倍体精子与遗传失活卵受精的方法获得雄核发育二倍,如Thorgaard等[30]和Arai等[31]使用从四倍体得到的二倍体精子与遗传失活卵受精,分别获得了虹鳟和泥鳅的雄核发育二倍体。林忠乔等[20]报道了利用自然四倍体泥鳅产生的二倍体精子与在3益冰水中处理60 min的卵子受精,可诱导雄核发育二倍体。对于雄性异型鱼类的雄核发育二倍体,理论上XX雌和YY雄(超雄)以1颐1的比例分离[32]。Kikuchi等[2]根据基因组连锁分析,进一步确定红鳍东方鲀性别决定机制为XX/XY型,且性别决定基因位于19号连锁群的单一区域。本研究中获得的红鳍东方鲀雄核发育单倍体一种是含有来源于父本的X染色体,经染色体加倍后形成雌性个体(XX),另一种是含有来源于父本的Y染色体,经染色体加倍后形成超雄个体(YY)。因此,对于红鳍东方鲀,雄核发育后代并非都是雄性后代,雌颐雄=1颐1。本研究结果显示,单倍体率最高可达86.7%,说明有43.4%的个体含有Y染色体。因为只有获得含有Y染色体的单倍体,加倍后才能获得YY超雄鱼。YY超雄鱼与正常雌鱼(XX)杂交可获得100%的雄鱼。
本研究结果表明,无需用射线使卵子失活,仅用冷休克方法,可以成功诱导红鳍东方鲀雄核发育单倍体,雄核发育单倍体率高达86.7%。本研究结果为进一步研究诱导红鳍东方鲀雄核发育二倍体奠定了理论基础。
[1]鈴木譲.植治粥育種账砧贞秩珠终职瘴新品種作出镇蔗斩展[J].生物機能開発研究所紀要,2010,10:9-23.
[2]Kikuchi K,KaiW,Hosokawa A,et al.The sex-determining locus in the tiger pufferfish,Takifugu rubripes[J].Genetics,2007,175 (4):2039-2042.
[3]Kamiya T,KaiW,Tasumi S,et al.A trans-speciesmissense SNP in Amhr2 is associated with sex determination in the tiger puffer-fish,Takifugu rubripes(fugu)[J].PLoS Genet,2012,8(7): e1002798.
[4]赵海涛,万玉美,张福崇,等.菊黄东方鲀(意)伊红鳍东方鲀(裔)F1代及其亲本肌肉营养成分的比较分析[J].大连海洋大学学报,2013,28(1):77-82.
[5]崔建洲,申雪艳,杨官品,等.红鳍东方鲀基因组微卫星特征分析[J].中国海洋大学学报:自然科学版,2006,36(2):249-254,272.
[6]郝君,孙效文,孟雪松.红鳍东方鲀微卫星DNA多态性初步分析[J].上海水产大学学报,2006,15(1):21-24.
[7]刘秀云,孙效文,李莉,等.利用微卫星标记对红鳍东方鲀进行杂种优势预测[J].大连水产学院学报,2008,23(S):23-27.
[8]陆丽君,马爱军,王新安,等.5个红鳍东方鲀养殖群体微卫星DNA遗传多态性分析[J].渔业科学进展,2013,34(4):27-33.
[9]李伟业,马爱军,王新安,等.红鳍东方鲀(Takifugu rubripes)选育家系构建与早期标准化培育[J].海洋与湖沼,2013,44(4): 944-952.
[10]王新安,马爱军,庄志猛,等.红鳍东方鲀Takifugu rubripes形态性状对体重的影响效果[J].海洋与湖沼,2013,44(1): 135-140.
[11]周贺,李佳奇,马海艳,等.低温诱导红鳍东方鲀雄性化及性腺分化的组织学观察[J].大连海洋大学学报,2015,30(1): 41-47.
[12]潘承毅,何迎晖.数理统计的原理与方法[M].上海:同济大学出版社,1993:292-293.
[13]康大海.微卫星DNA在红鳍东方鲀分子标记辅助育种中的应用[D].大连:大连海洋大学,2007.
[14]Purdom C E.Radiation-induced gynogenesis and androgenesis in fish[J].Heredity,1969,24:431-444.
[15]Gervai J,P佗ter S,Nagy A,etal.Induced triploid in carp,Cyprinus carpio L.[J].Journal of Fish Biology,1980,17(6):667-671.
[16]Ueda T.The possible induction of androgenetic diploid rainbow trout by an application of heat-shock[J].Chromosome Informa-tion Service,1996,61:12-13.
[17]Kagayaki M,Takafumi F,Mami S,et al.Cold-shock eliminates female nucleus in fertilized eggs to induce androgenesis in the loach(Misgurnus anguillicaudatus),a teleost fish[J].BioMed Central Biotechnology,2011,11:116.
[18]Hou JL,Fujimoto T,Yamaha E,et al.Production of androgenetic diploid loach by cold-shock of eggs fertilized with diploid sperm [J].Theriogenology,2013,80(2):125-130.
[19]王玉生,李雅娟,于长宁,等.冷休克诱导大鳞副泥鳅雄核发育单倍体[J].水产学报,2014,38(2):161-169.
[20]林忠乔,李雅娟,张赛赛,等.天然四倍体泥鳅雄核发育二倍体诱导条件优化[J].东北农业大学学报,2015,46(12):58-64.
[21]Hou JL,Fujimoto T,Saito T,et al.Generation of clonal zebrafish line by androgenesis without egg irradiation[J].Scientific Re-ports,2015,5:13346.
[22]Corley-Smith G E,Lim C J,Brandhorst B P.Production of an-drogenetic zebrafish(Danio rerio)[J].Genetics,1996,142(4): 1265-1276.
[23]赵振山,吴清江.人工诱导大鳞副泥鳅雄核发育二倍体克隆鱼的产生[J].遗传学报,1998,25(5):416-421.
[24]Nam Y K,Cho Y S,Cho H J,et al.Accelerated growth perform-ance and stable germ-line transmission in androgenetically de-rived homozygous transgenic mud loach,Misgurnusmizolepis[J]. Aquaculture,2002,209(1-4):257-270.
[25]Brown K H,Thorgaard G H.Mitochondrial and nuclear inherit-ance in an androgenetic line of rainbow trout,Oncorhynchus mykiss[J].Aquaculture,2002,204(3-4):323-335.
[26]Kirankumar S,Pandian T J.Production of androgenetic tiger barb,Puntius tetrazona[J].Aquaculture,2003,228(1-4):37-51.
[27]Parsons J E,Thorgaard G H.Production of androgenetic diploid rainbow trout[J].Journal of Heredity,1985,76(3):177-181.
[28]Scheerer PD,Thorgaard G H,Allendorf FW,et al.Androgenetic rainbow trout produced from inbred and outbred sperm sources show similar survival[J].Aquaculture,1986,57(1-4):289-298.
[29]Araki K,Shinma H,Nagoya H,et al.Androgenetic diploids of rainbow trout(Oncorhynchusmykiss)produced by fused sperm [J].Canadian Journal of Fisheries and Aquatic Sciences,1995, 52(5):892-896.
[30]Thorgaard G H,Scheerer P D,Hershberger W K,et al.Androge-netic rainbow trout produced using sperm from tetraploid males show improved survival[J].Aquaculture,1990,85(1-4):215-221.
[31]Arai K,Ikeno M,Suzuki R.Production of androgenetic diploid loach Misgurnus anguillicaudatus using spermatozoa of natural tetraploids[J].Aquaculture,1995,137(1-4):131-138.
[32]小野里坦.雄性発生[M]//鈴木亮編.水産増養殖杖染色体操作.東京:恒星社厚生閣,1989:60-69.
Optim ization of inducing conditions for cold shocked androgenetic haploid in red fin puffer Takifugu rubripes
ZHOU He,ZHANG Rui,XU Qi-zheng,MA Tian-yu,JIANG Zhen-hua, ZHUANG Zi-xin,GAO Jun,JIANG Zhi-qiang,LIYa-juan
(Key Laboratory ofMarine Bio-resources Sustainable Utilization in Liaoning Province蒺s University,Key Laboratory ofMariculture&Stock Enhancement in North China蒺s Sea,Ministry of Agriculture,Dalian Ocean University,Dalian 116023,China)
In a three factor and three level orthogonal experiment L9(34),fertilized eggs of redfin puffer Takifugu rubripes were exposed to water temperature of 0,2,and 4益(A)for 30,45,and 60 min(B),and initial treat-ment time of2,5,and 8 min(C)in order to explore amethod of inducing androgenetic haploid of redfin puffer by cold shocked without inactivation.Then the chromosome number was counted in one embryo and microsatellite a-nalysis was performed in the offspring.The results showed that themaximal haploid ratewas observed in the embry-os 8min after fertilization treated at4益for30min(86.7%)and 5min after fertilization treated at4益for60min (80.0%).The intuitive analysis revealed that the optimal inducing androgenetic haploid was conducted under con-ditions of 8 min after fertilization at4益for 60 min with initial treatment time of8 min.The order of three factors influencing androgenetic haploid was expressed as treatment temperature>treatment initial time>treatment duration. Themicrosatellite analysis showed that the genes of androgenetic offspringswere all derived from male redfin puffer. The findings indicate that the redfin puffer had androgenetic haploid rate of 86.7%by cold shock treatment,and that lay the foundation for the further study of redfin puffer androgenetic diploid.
Takifugu rubripes;cold shock;androgenetic;haploid;orthogonal experiment
S965.1
A
10.16535/j.cnki.dlhyxb.2017.03.010
2095-1388(2017)03-0316-07
2017-03-29
国家自然科学基金资助项目(41606178);辽宁省博士科研启动基金资助项目(201501185);辽宁省教育厅重点实验室基础研究项目(LZ2015010)
周贺(1985—),女,博士。E-mail:zhouhe@dlou.edu.cn
李雅娟(1961—),女,博士,教授。E-mail:liyajuan@dlou.edu.cn
