氟苯尼考对三疣梭子蟹不同组织中ABC转运蛋白基因(ABCG)表达量的影响
2017-06-19于旋,任宪云,李健等
氟苯尼考对三疣梭子蟹不同组织中ABC转运蛋白基因(ABCG)表达量的影响
于旋1、2,任宪云2,李健2,刘萍2,高保全2,刘九美1、2,窦全伟1、2
(1.大连海洋大学水产与生命学院,辽宁大连116023;2.中国水产科学研究院黄海水产研究所,山东青岛266071)
为研究氟苯尼考(FLR)对三疣梭子蟹Portunus trituberculatus不同组织中ABC转运蛋白基因(AB-CG)表达量的影响,采用RACE法进行了三疣梭子蟹ABCG基因克隆并对其生物学进行了分析,采用荧光定量PCR法进行了不同浓度(20、40、80 mg/kg)氟苯尼考对三疣梭子蟹肝胰腺、鳃和肌肉中ABCG相对表达量的影响研究。结果表明:三疣梭子蟹ABCG基因全长cDNA序列为2473 bp,共编码578个氨基酸;三疣梭子蟹ABCG不含信号肽,具ABC转运家族蛋白的典型结构域,包括1个高度保守的核苷酸结构域(NBD)和1个疏水性跨膜区(TMD),为半转运子;同源性及系统进化分析表明,三疣梭子蟹ABCG与中国对虾、凡纳滨对虾的ABCG聚为一支,具有较高的亲缘关系;不同浓度的氟苯尼考对三疣梭子蟹肝胰腺、鳃、肌肉中ABCG表达均具有诱导作用,且呈时间剂量效应,由此推测,三疣梭子蟹ABCG蛋白参与氟苯尼考的代谢转运过程。本研究结果可为揭示甲壳动物ABCG转运蛋白对抗生素的转运机制提供参考依据。
三疣梭子蟹;ABC转运蛋白;基因克隆;氟苯尼考;荧光定量PCR
腺苷三磷酸结合盒转运蛋白(ATP-binding cassette transporter,ABC转运蛋白)是一类重要的跨膜蛋白体系,广泛存在于真核和原核生物中,可通过水解ATP的能量对胞质中的外源化合物、代谢产物、离子、糖、氨基酸、脂类和固醇等物质进行跨膜转运[1-2]。目前,根据保守序列的同源性,将已知的ABC转运蛋白分为8个亚型(ABCA~ ABCH),其中ABCB、ABCC和ABCG与外源化学物质的代谢有关[3]。已有研究表明,ABCG转运蛋白通过减少体内毒素的累积成为抵抗外源物质的重要防线[4-5]。近年来,ABCG转运蛋白在水生动物中被发现和克隆,验证了ABCG作为外源物质转运体,将体内的有害物质及时转运出体外,证明ABCG具有减少机体损伤的功能[6-8]。
三疣梭子蟹Portunus trituberculatus生长迅速、养殖利润丰厚,已成为中国沿海地区重要的养殖品种之一。氟苯尼考(Florfenicol,FLR)是一种人工合成的新型抗菌药(氯霉素替代品),既能保持氯霉素抗菌活性又能减少氯霉素造成人类再生障碍性贫血的不良副作用,是世界水产养殖中最常用的抗菌药物。赵青松等[9]研究表明,氟苯尼考能有效预防和治疗三疣梭子蟹因弧菌引起的感染。氟苯尼考在病害防治方面起到积极作用的同时,也存在着潜在的危害,药物残留及细菌耐药性在施药过程中会不断产生,因此,对此药需要合理使用,以保障养殖水产品的质量安全。为探讨三疣梭子蟹ABCG对氟苯尼考的转运代谢作用,本研究中采用RACE技术首次成功获得了ABCG基因全长cDNA序列,对其生物学进行了分析,并采用实时荧光定量PCR法研究了氟苯尼考对ABCG基因在不同组织中表达量的影响,旨在为深入研究ABCG的结构、功能奠定基础,为揭示甲壳动物ABCG转运蛋白对抗生素的转运机制提供参考依据。
1 材料与方法
1.1 材料
试验用三疣梭子蟹体质量为(30依5)g,选择健康个体,暂养于黄海水产研究所实验基地潍坊昌邑海丰水产养殖有限公司,养殖水泥池面积为30 m3(4.0 m伊5.0 m伊1.5 m),养殖密度为30只/池,水深为(30~35)cm,水温为(25.0依0.5)益,溶解氧为5.5 mg/L,盐度为31,pH为8.2,暂养1周。每天定时换水,换水量为总池水的1/3,定时投喂新鲜蓝蛤,投喂量为蟹体质量的1/10。
1.2 方法
1.2.1 总RNA的提取及cDNA第一链的合成采用Trizol试剂法提取三疣梭子蟹各组织的总RNA,用核酸定量仪(Thermo,NANO DROP-2000)测定纯度,用10 g/L琼脂糖凝胶电泳检测浓度及完整性。以肝胰腺中提取的总RNA为模板,按照SM-ARTTMRACE Amplification Kit(Clontech)说明书进行3忆和5忆RACE的cDNA第一链的合成。
1.2.2 三疣梭子蟹ABCG基因全长cDNA的克隆从实验室获得三疣梭子蟹cDNA文库中ABCG基因的EST序列,经NCBI比对,此序列片段与其他物种的ABCG同源性较高,确定为三疣梭子蟹AB-CG基因序列片段。利用Primer Premier 5.0软件设计3忆和5忆末端特异性引物。试验中所用引物由北京睿博兴科生物技术有限公司合成(表1)。

表1 试验中所用引物序列Tab.1Sequence of primers used in this study
利用Advantage 2 PCR Kit(TaKaRa)进行末端扩增,5忆RACE用通用引物UPM和NUP分别与相应的特异性引物ABCG-R1和ABCG-R2进行巢式PCR扩增,3忆RACE用UPM和NUP与相应的特异性引物ABCG-F1和ABCG-F2进行巢式PCR扩增。扩增反应条件为:94益下预变性3min;94益下变性30 s,68益下退火30 s,72益下延伸3 min,共进行25个循环;最后在72益下延伸10 min。将获得的3忆和5忆RACE扩增产物经琼脂糖凝胶电泳检测后,使用NucleoSpin Gel and PCR Clean-Up Kit (TaKaRa)回收纯化并连接到PMD18-T载体中,重组质粒转化到大肠杆菌DH5琢感受态细胞中,在含AMP和IPTG、X-gal的LB固体培养基中于37益下培养过夜,挑取单一白斑菌落继续培养6 h,菌落经PCR鉴定后,将含有目的条带的菌液送北京睿博兴科生物技术有限公司进行测序。最后,在该基因的两端设计正反向引物yABCG-F和yABCGR,并对全长cDNA进行验证。
1.2.3 三疣梭子蟹ABCG基因的生物学分析使用DNAStar软件中的SeqMan程序对测序所得的ABCG cDNA中间片段和3忆、5忆末端序列进行拼接和载体序列去除,得到三疣梭子蟹ptABCG cDNA全序列。利用ExPASy(http://www.expasy.ch/ tools/)和Gene Tool软件预测开放阅读框(ORF)和翻译氨基酸。使用PredictProtein和SMART服务器进行蛋白质理化性质预测、蛋白质功能结构域分析。使用SignalP 4.0在线程序(http://www.cbs.dtu.dk/services/SignalP)进行蛋白信号肽预测。使用Clustal X和DNAMAN软件对三疣梭子蟹和其他物种的ABCG编码的氨基酸序列进行比对分析,并用MEGA 6.0软件以邻接法(Neighhour-Joining, NJ)构建系统进化树,1000次Bootstrap重复检验进化树的置信度。
1.2.4 三疣梭子蟹ABCG基因的本体表达及其在氟苯尼考代谢过程中的功能研究选取80日龄三疣梭子蟹从室外养殖池转移到室内水泥池暂养1周。氟苯尼考的注射剂量依据《新编渔药手册》[10]的推荐剂量和预试验结果决定。将暂养1周后的三疣梭子蟹随机分成4组,依次为对照组(生理盐水[11])、氟苯尼考低剂量组(20 mg/kg)、氟苯尼考中剂量组(40 mg/kg)和氟苯尼考高剂量组(80 mg/kg),每组70只个体。给药部位为三疣梭子蟹第四步足与体壁关节膜处的肌肉[12]。在注射氟苯尼考后的1、3、6、12、24、48、72 h,取肝胰腺、肌肉、鳃组织样品,每一时间点取9只蟹,每3只蟹的组织放入一个冻存管。重取3只不经处理的健康三疣梭子蟹的肝胰腺、鳃、胃、肌肉、肠、心脏、血细胞组织,用于检测三疣梭子蟹AB-CG基因的本体表达。
按照Trizol法提取三疣梭子蟹各个组织及氟苯尼考胁迫后不同时间点的肝胰腺、鳃、肌肉组织的总RNA,经质量检测后使用PrimeScriptTMRT rea-gent Kit反转录合成cDNA。以DEPC水稀释3倍作为模板,进行ABCG基因表达量检测。荧光定量PCR体系(共10滋L)为:cDNA模板1滋L,浓度为10 pmol/滋L的正反向引物q ABCG-F和q ABCGR各0.4滋L(表1),SYBR Premix Ex Taq域5滋L, ROX Reference dye域0.2滋L,DEPC水3滋L。反应程序为:95益下预变性35 s;95益下变性5 s,60益下退火34 s,70益下延伸30 s,共进行40个循环;最后在70益下再延伸5 min。本试验使用Ap-plied Biosystems 7500 Real-Time PCR仪,以三疣梭子蟹茁-actin基因作为内参(表1),样本和内参均设3个重复。采用2-吟吟Ct方法[12]计算各组织样品的ABCG相对表达量。
1.3 数据处理
试验数据采用平均值依标准差(mean依S.D.)表示,使用SPSS 19.0软件进行单因素方差分析,用Duncan蒺s法进行多重比较,显著性水平设为0.05。
2 结果与分析
2.1 三疣梭子蟹ABCG基因的全长cDNA序列
本试验中采用RACE技术首次成功获得三疣梭子蟹ABCG基因全长cDNA序列,命名为ptABCG (GenBank登录号:KY242401)。该基因全长为2473 bp,包括1747 bp的开放阅读框(ORF),25 bp的5忆非编码区(5忆UTR)和701 bp的3忆非编码区(3忆UTR)。3忆端存在多聚腺甘酸的加尾信号(AATAA)和Poly(A)尾。用Blast比对显示, ptABCG核苷酸序列与凡纳滨对虾ABCG一致性高达72.94%,说明该序列为三疣梭子蟹ABCG基因。
2.2ptABCG蛋白的生物信息学分析
采用PredictProtein软件预测,三疣梭子蟹AB-CG基因编码一个由578个氨基酸组成的多肽,相对分子质量为65 720,理论等电点为8.13。该蛋白包括53个酸性氨基酸(DE),56个碱性氨基酸(RK),217个疏水性氨基酸(AILFWV),157个极性氨基酸(NCQSTY),脂溶系数为94.57,亲水指数(GRAVY)为0.081。使用SignalP 4.0程序进行信号肽预测分析,结果显示,该蛋白序列不含有信号肽。用SMART在线软件对结构功能域分析,结果显示,该蛋白具有ABCG转运蛋白的基本结构特征,具有1个疏水性跨膜区(TMD)和1个核苷酸结合区(NBD)。使用TMpred工具对TMD进行跨膜性质预测,结果显示,存在由内向外和由外向内的两种跨膜螺旋,仅采用分值大于500的可信度高的跨膜模型有13个(表2),表明ptABCG基因是典型的跨膜结构。如图1所示, NBD包含了ABCG亚家族的保守序列:ATP结合位点、ABC转运体家族标记序列(ABC transporters family signature)、Walker A(P环)、Walker B、D环、H环和Q环等。

表2 三疣梭子蟹ABCG预测跨膜区位置Tab.2Sites of transmembrane domain in sw imm ing crab Portunus trituberculatus
2.3 ptABCG基因序列同源性及系统进化分析
使用Clustal X和DNAMAN软件分析ptABCG编码的氨基酸序列的同源性,发现其与凡纳滨对虾Litopenaeus vannamei、中国对虾Fenneropenaeus chinensis、家蚕Bombyx mori、切叶蚁Acromyrmex echinatior、果蝇Drosophila elegans的一致性分别为72.94%、66.54%、43.33%、39.31%、24.01% (图2)。使用MEGA 6.06软件进行系统进化分析,结果表明,三疣梭子蟹与凡纳滨对虾、中国对虾紧密聚为一支,亲缘关系较近,与节肢动物的昆虫纲聚为一大支,与斑马鱼Danio rerio和人Homo sapi-ens关系较远(图3)。
2.4 ptABCG基因的本体表达
根据获得的ptABCG基因全长cDNA序列设计荧光定量特异引物q ABCG-F和q ABCG-R(表1),并采用RT-PCR方法检测三疣梭子蟹7种组织中ABCG基因的本体表达情况。结果显示:ptABCG在7种组织中均有表达,表达量最高的是肝胰腺,其次是肠和心脏,血细胞中的表达量最低(图4)。

图1 三疣梭子蟹ABCG蛋白结构域分析图Fig.1SMART diagram of ABCG am ino acid sequences in sw imm ing crab Portunus trituberculatus

图2 三疣梭子蟹ABCG编码的氨基酸序列与其他物种氨基酸序列的比对Fig.2Comparison of am ino acid sequences coded by ABCG in sw imm ing crab Portunus trituberculatus w ith other animals
2.5 氟苯尼考对ptABCG基因组织表达量的影响
从图5可见,氟苯尼考对三疣梭子蟹3种组织ABCG的表达均具有诱导作用,呈现先升高后降低的趋势,且呈一定的剂量效应关系。在肝胰腺中,中、高剂量组ABCG表达量均被显著诱导(P< 0.05),高剂量组表达量于6 h时达最高值,随着时间的延长,中、高剂量组表达量在整个试验过程中均高于对照组,低剂量组则与对照组无显著性差异(P>0.05)。鳃中,ABCG在低、中、高剂量组的表达量,分别于给药后的6、6、12 h时达峰值。肌肉中,给药6 h内与对照组相比,低、中、高剂量组的氟苯尼考对ABCG在的表达呈显著的诱导作用(P<0.05),随后诱导作用逐渐降低。
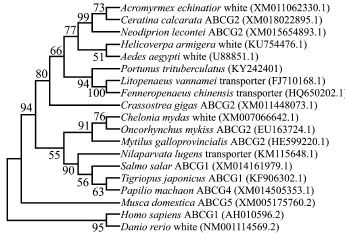
图3 采用邻接法构建的三疣梭子蟹与其他物种的AB-CG氨基酸序列的系统进化树Fig.3NJ phylogenetic tree of am ino acid sequences of ABCG in sw imm ing crab Portunus tritubercula-tus and other species

图4ABCG基因在三疣梭子蟹不同组织中的本体表达Fig.4Relative expression of ABCG in different tissues of sw imm ing crab Portunus trituberculatus

图5 氟苯尼考对三疣梭子蟹肝胰腺、鳃和肌肉组织中ABCG基因表达的影响Fig.5Effect of florfenicol on ABCG relative expression in the hepatopancreas,gill and muscle of sw im-m ing crab Portunus tritubercu latus
3 讨论
3.1 ABCG转运蛋白的结构与功能
ABC转运蛋白是膜整合蛋白,它利用水解ATP的能量对胞质中各种生物分子进行跨膜转运,并依据结构不同分为全转运子和半转运子[13],全转运子含2个TMD和2个NBD,而半转运子只含1个TMD和1个NBD[3]。已知的ABCG亚家族包括5个半转运子,其中ABCG2基因是一种多药耐药基因,而ABCG1、ABCG4、ABCG5和ABCG8与激素和胆固醇的转运相关[14-15]。生物学分析表明,三疣梭子蟹ABCG编码的蛋白质具有ABCG转运蛋白的基本结构特征:1个跨膜结构域,位于C端; 1个NBD(Walker A、Walker B、Q环、H环等),位于N端。跨膜结构域是药物转运的通道,核苷酸结合区是ATP的结合位点[16]。ptABCG具有由内向外和由外向内两种跨膜螺旋,是典型的跨膜转运特征,依赖水解ATP获得的能量进行物质运输、离子转运[17-19]。该基因编码的蛋白质氨基酸与甲壳动物中的中国对虾和凡纳滨对虾同源性最高,在系统进化树中也与对虾科聚为一支,亲缘关系最近。由此表明,本研究中克隆得到的ABCG基因属于三疣梭子蟹ABCG基因。
3.2 ABCG基因的表达情况及其在抗生素代谢转运方面的作用
对ABCG基因在不同物种各组织中表达情况的研究表明,ABCG表达不仅存在显著的种属差异性,还表现出组织器官差异性。在人和小鼠等哺乳动物中,ABCG基因在脑和眼睛中的分布相对比较集中[20-21];在昆虫中,中肠、脂肪体和表皮的AB-CG基因含量比较丰富[22-23];在鱼类中,肝和脑组织中表现出较高的转录水平[6,24]。本试验结果显示,三疣梭子蟹ABCG基因在各组织中表达量最高的是肝胰腺,依次为肠、心脏、鳃、胃、肌肉和血细胞。这与Zhou等[8]对凡纳滨对虾ABCG表达水平的研究结果相似,即表达量最高的为肝胰腺,其次为肠。三疣梭子蟹肝胰腺中含有药物解毒代谢的重要酶类,如氨基比林-N-脱甲基酶(APND)、谷胱甘肽S-转移酶(GST)等[25],ptABCG在肝胰腺中的高表达,也进一步证实了肝胰腺是三疣梭子蟹最主要的解毒代谢器官。
关于外源物质在生物体内代谢过程的研究表明,外源物质进入生物体后先经玉相代谢作用转化为玉相中间产物,在域相代谢酶(GST)作用下与内源物质分子谷胱甘肽(GSH)结合将其排出体外[26]。ABC转运蛋白在外源化合物代谢中具有非常重要的作用,但是关于ABC转运蛋白对渔用抗生素转运代谢方面的研究非常有限。胡鲲等[27]报道了尼罗罗非鱼Oreochomis niloticus Linn肝、肾组织中P-糖蛋白(P-gp)参与恩诺沙星的药物代谢过程。Chang等[7]研究表明,中国对虾ABCG蛋白对诺氟沙星具有转运代谢的功能。本研究中探讨了三疣梭子蟹ABCG转运蛋白在氟苯尼考的转运代谢过程中的作用,结果显示,不同浓度(20、40、80 mg/kg)氟苯尼考对三疣梭子蟹肝胰腺、鳃、肌肉中ABCG的表达均具有诱导作用,呈现先升高后降低的趋势,并有一定的时间剂量效应。其中,肝是主要的解毒场所,对药物具有生物转化功能, ABCG活性一直处于较高的表达状态。刘胜男[28]对氨氮胁迫下三疣梭子蟹解毒代谢机制的研究表明,鳃中相关解毒代谢酶和基因在胁迫下诱导表达。本试验中,三疣梭子蟹鳃中ABCG表达量在注射氟苯尼考后12 h不断提高,表明鳃在药物代谢过程中也发挥一定作用,但其表达量较肝胰腺低。氟苯尼考对肌肉ABCG活性的诱导作用在注射后立刻出现,可能与肌肉给药方式有关。本试验结果与陈玲珍等[29]对不同剂量氟苯尼考在中华绒螯蟹体内的药物代谢动力学研究结果相吻合。由此可以推断,三疣梭子蟹ABCG转运蛋白能及时将体内残留的氟苯尼考及代谢产物转运出体外,防止药物在体内不断累积造成损伤。
近年来,虽然对水生生物ABC转运蛋白的相关研究较多,但关于ABC转运蛋白的跨膜方式、ATP水解机制、TMD与NBD间的信号传递路径及转运机制等关键问题仍需深入研究[3]。对ABC蛋白的药物转运机制进行深入探讨,揭示药物作用和代谢机制,可提高药物疗效,对健康养殖及水产食品安全均具有重要的意义。
[1]Gottesman M M,Pastan I.Biochemistry ofmultidrug resistanceme-diated by the multidrug transporter[J].Annual Review of Bio-chemistry,1993,62(1):385-427.
[2]Thiebaut F,Tsuruo T,Hamada H,et al.Cellular localization of the multidrug-resistance gene product P-glycoprotein in normal hu-man tissues[J].Proceedings of the National Academy of Sciences of the United States of the America,1987,84(21):7735-7738.
[3]马云芳,梁国鲁,裴得胜,等.ABC转运蛋白研究的新进展[J].生物技术通报,2008(5):35-41.
[4]Ejendal K F,Hrycyna C A.Multidrug resistance and cancer:the role of the human ABC transporter ABCG2[J].Current Protein and Peptide Science,2002,3(5):503-511.
[5]Sarkadi B,Homolya L,Szakacs G,et al.Human multidrug resist-ance ABCB and ABCG transporters:participation in a chemoimmu-nity defense system[J].Physiological Reviews,2006,86(4): 1179-1236.
[6]Paetzold SC,Ross NW,Richards R C,etal.Up-regulation of he-patic ABCC2,ABCG2,CYP1A1 and GST inmultixenobiotic-resist-ant killifish(Fundulus heteroclitus)from the Sydney Tar Ponds, Nova Scotia,Canada[J].Marine Environmental Research,2009, 68(1):37-47.
[7]Chang Zhiqiang,Li Jian,Liu Ping,et al.cDNA cloning and expres-sion profile analysis of an ATP-binding cassette transporter in the hepatopancreas and intestine of shrimp Fenneropenaeus chinensis [J].Aquaculture,2012,356-357:250-255.
[8]Zhou Jun,He Wenyin,Wang Weina,et al.Molecular cloning and characterization of an ATP-binding cassette(ABC)transmem-brane transporter from the white shrimp Litopenaeus vannamei[J]. Comparative Biochemistry and Physiology Part C:Toxicology& Pharmacology,2009,150(4):450-458.
[9]赵青松,金珊,陈寅儿,等.氟苯尼考在三疣梭子蟹(Portunus trituberculatus)疾病模型内的代谢动力学[J].海洋与湖沼, 2014,45(3):568-573.
[10]杨先乐.新编渔药手册[M].北京:中国农业出版社,2005: 186-189.
[11]Terwilliger N B,Brown A C.Ontogeny of hemocyanin function in the Dungeness crab Cancermagister:the interactive effects of de-velopmental stage and divalent cationson hemocyanin oxygenation properties[J].Journal of Experimental Biology,1993,183(1):1-13.
[12]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-驻驻CTmethod [J].Methods,2001,25(4):402-408.
[13]吴光红,张静波,孟勇,等.不同水温下恩诺沙星在中华绒螯蟹体内药物代谢动力学[J].南京农业大学学报,2008,31 (2):105-110.
[14]Jones PM,George A M.Symmetry and structure in P-glycopro-tein and ABC transporters what goes around comes around[J]. European Journal of Biochemistry,2000,267(17):5298-5305.
[15]Sturm A,Cunningham P,Dean M.The ABC transporter gene fam-ily of Daphnia pulex[J].BMC Genomics,2009,10:170.
[16]Wang Nan,Lan Debin,Chen Wengen,et al.ATP-binding cas-sette transporters G1 and G4 mediate cellular cholesterol efflux to high-density lipoproteins[J].Proceedings of the National Acade-my of Sciences of the United States of the America,2004,101 (26):9774-9779.
[17]Jones PM,George AM.The ABC transporter structure andmech-anism:perspectives on recent research[J].Cellular and Molecular Life Sciences CMLS,2004,61(6):682-699.
[18]Dean M,Hamon Y,Chimini G.The human ATP-binding cassette (ABC)transporter superfamily[J].Journal of Lipid Research, 2001,42(7):1007-1017.
[19]Dean M,Rzhetsky A,Allikmets R.The human ATP-binding cas-sette(ABC)transporter superfamily[J].Genome Research, 2001,11(7):1156-1166.
[20]Ward A,Reyes C L,Yu J,etal.Flexibility in the ABC transporter MsbA:alternating access with a twist[J].Proceedings of the Na-tional Academy of Sciences of the United States of the America, 2007,104(48):19005-19010.
[21]Oldfield S,Lowry C A,Ruddick J,et al.ABCG4:a novel human white family ABC-transporter expressed in the brain and eye[J]. Biochimica et Biophysica Acta(BBA)-Molecular Cell Research, 2002,1591(1-3):175-179.
[22]王雪芳,吴金美.小鼠abcg4基因的克隆、组织表达及RNA干涉的研究[D].镇江:江苏科技大学,2010.
[23]闸雯俊,王芳芳,李三和,等.褐飞虱ABCG基因的克隆与表达分析[J].湖北农业科学,2014,53(23):5871-5874.
[24]康新乐,李玉婷,王康,等.禾谷缢管蚜ABC转运蛋白基因的克隆、分子特性及表达分析[J].昆虫学报,2015,58(6):593-602.
[25]譕aja R,Munic'V,Smital T.Cloning and mRNA expression analy-sis of an ABCG2(BCRP)efflux transporter in rainbow trout (Oncorhynchusmykiss)liver and primary hepatocytes[J].Marine Environmental Research,2008,66(1):77-79.
[26]冯艳艳.三疣梭子蟹CYP2和GST基因的cDNA克隆与表达分析[D].上海:上海海洋大学,2014.
[27]胡鲲,程钢,吕利群,等.基于P-糖蛋白基因表达评价尼罗罗非鱼体内恩诺沙星代谢“首过效应冶[J].中国水产科学, 2013,20(2):411-418.
[28]刘胜男.三疣梭子蟹(Portunus trituberculatus)在氨氮胁迫下解毒代谢机制的研究[D].青岛:中国海洋大学,2014.
[29]陈玲珍,杨洪生,吴光红,等.给药剂量对氟苯尼考在中华绒螯蟹体内的药物代谢动力学影响[J].动物学杂志,2010,45 (4):102-109.
Effects of florfenicol on relative expression of ATP-binding cassette transporter gene(ABCG)in different tissues of sw imm ing crab Portunus trituberculatus
YU Xuan1,2,REN Xian-yun2,LIJian2,LIU Ping2,GAO Bao-quan2,LIU Jiu-mei1,2,DOU Quan-wei1,2
(1.College of Fisheries and Life Science,Dalian Ocean University,Dalian 116023,China;2.Yellow Sea Fisheries Research Institute,Chinese Acad-emy of Fishery Sciences,Qingdao 266071,China)
ATP-binding cassette transporter genewas cloned in swimming crab Portunus trituberculatus by a RACE method and the gene expression of ABCG was in hepatopancreas,gill and muscle of swimming crab with intramus-cular injection of flofenicol ata dose of20,40 and 80mg/kg to evaluate effects of florfenicol on the gene expression of ABCG in different tissues of swimming crab by fluorescent quantitative PCR.Results showed the full-length of ABCG cDNA of swimming crab(ptABCG)was shown to be 2473 bp encoding a polypeptide of 578 amino acids. Bioinformatics analysis indicated that ptABCG,without signal peptide,sharedmany similaritieswith the ABC trans-membrane transporter,including two conserved regions:a highly conserved nucleotide binding domains(NDB) and a transmembrane domain(TMD).Homology and phylogenetic analysis revealed that the amino acid sequence of ptABCG shared a high similarity with Chinese shrimp Fenneropenaeus chinensis and Pacific white leg shrimp Litopenaeus vannamei.The gene expression of ptABCG was up-regulated in hepatopancreas,gill and muscle after intramuscular injection of different doses of florfenicol,showing time-dose effect.It is speculated that the ptABCG protein may involve in themetabolism of florfenicol in swimming crab.
Portunus trituberculatus;ATP-binding cassette transporter;gene cloning;florfenicol;fluorescent quantitative Real-time PCR
S968.25
A
10.16535/j.cnki.dlhyxb.2017.03.001
2095-1388(2017)03-0255-07
2016-12-08
国家自然科学基金青年基金资助项目(41506166);泰山领军人才工程高效生态农业创新类计划项目(LJNY2015002)
于旋(1991—),女,硕士研究生。E-mail:yuxuan114220@163.com
李健(1961—),男,研究员。E-mail:lijian@ysfri.ac.cn
