肺泡灌洗液中MicRNA表达谱分析在重症肺炎中的应用
2017-06-19王昭君刘勤富王晓红王妍柏周文杰杨晓军
王昭君,刘勤富,王晓红,王妍柏,张 珺,周文杰,杨晓军
·论 著·
肺泡灌洗液中MicRNA表达谱分析在重症肺炎中的应用
王昭君1,刘勤富1,王晓红1,王妍柏2,张 珺1,周文杰1,杨晓军1
目的 探讨ICU中重症肺炎患者肺泡灌洗液中微小RNA(MicRNA)表达与重症肺炎的关系。方法 采用MicRNA芯片技术对5例重症肺炎患者和5例非呼吸道感染术后患者的肺泡灌洗液MicRNA进行筛选,最终筛选出其中上调表达、下调表达的MicRNA;再通过RT-PCR的方法,验证上述芯片检测的结果。结果 建立重症肺炎患者肺泡灌洗液的MicRNA异常表达谱,从中筛选出40个上调表达的MicRNA和113个下调表达的MicRNA。通过与非呼吸道感染患者对比,重症肺炎组上调表达基因miR-3686、miR-4455及下调表达基因miR-1323、miR-127-5p差异有统计学意义(P<0.05)。结论 miR-3686、miR-4455、miR-1323、miR-127-5p在重症肺炎患者的肺泡灌洗液中明显表达,提示其与重症肺炎的发生有一定的相关性。
重症肺炎;肺泡灌洗液;MicRNA
重症肺炎是造成重症监护病房患者死亡的重要原因[1-2],虽然随着各种新型抗菌药物的不断研发,同时临床工作中的抗感染力度逐渐增强,重症肺炎发病率及死亡率并无明显下降[3]。近期有基础与临床研究表明,肺泡灌洗液中微小RNA(MicRNA)在肺部损伤机制中有重要的作用[4-5]。MicRNA 是一组广泛存在于真核细胞生物中,长度为21~25个,核苷酸内源性单链非编码RNA分子,是已知的最大基因家族中的一名成员,通过与信使RNA(mRNA)的3'非翻译区(UTR) 结合,可引起翻译抑制和(或)mRNA的降解,从而抑制了蛋白质合成,最终达到基因调控的目的[6]。有研究发现,MicRNA可以被释放到细胞外环境中,在多种人体的生物标本比如人血浆、血清、体液和各种组织中可以被检测到,从而这也使得MicRNA成为对临床疾病的诊断及预后有重要意义的生物学标志物。
1 资料与方法
1.1 一般资料:选取2015年1月-2015年12月入住宁夏医科大学总医院ICU的患者。依据美国感染疾病学会/美国胸科学会(IDSA/ATS)2007年修订版《成人CAP处理的共识指南》[7],其重症肺炎的临床诊断标准如下:符合1项主要标准或3项次要标准以上者。主要标准:①需要有创机械通气;②感染性休克需要血管收缩剂治疗。次要标准:①呼吸频率≥30 次/min;②氧合指数(PaO2/FiO2)≤250;③多肺叶浸润;④意识障碍/定向障碍;⑤氮质血症(BUN≥20 mg/dl);⑥白细胞减少(WBC<4.0×109/L);⑦血小板减少(<10.0×109/L);⑧低体温(<36 ℃);⑨低血压,需要强力的液体复苏。非呼吸道感染组纳入标准:ICU中非呼吸道感染(需要呼吸机辅助通气)的术后患者,需排除肿瘤、自身免疫性疾病等。
1.2 方法
1.2.1 肺泡灌洗液样本采集及运送:利用电子纤维支气管镜,对入选患者肺段和亚肺段进行盐水灌洗后,采集肺泡表面衬液,即BALF 20 mL(避免患者经口污染环节),分装到2支无菌集痰管中,放入-80 ℃冻存,一份进行基因芯片检测及PCR验证,一份送我院微生物室进行肺泡灌洗液的细菌学培养。采集和运送标本的过程严格按照无菌操作规程进行。
1.2.2 MicRNA测序
1.2.2.1 肺泡灌洗液中RNA的提取:使用TRIzol法提取肺泡灌洗液RNA,并用RNasey Mini Kit(QIAGEN)进行纯化。使用NanoDrop ND-1000测量纯化后的RNA浓度,电泳方法检测RNA的完整性。
1.2.2.2 肺泡灌洗液RNA的标记与芯片杂交:肺泡灌洗液RNA标记和杂交根据Exiqon提供的方法进行,即抽提的肺泡灌洗液RNA通过质检后,使用miRCURYTM Array Power Labeling kit (Cat #208032-A,Exiqon)对microRNA进行标记。具体步骤如下:①1 μg RNA加水至2 μl、加1 μl的CIP buffer and CIP酶(Exiqon),混合后置于37 ℃下30 min。② 样品置于95 ℃下5 min终止反应,加入3 μl labeling buffer、1.5 μl fluorescent label (Hy3TM)、2.0 μl DMSO、2.0 μl labeling enzyme,在16 ℃下反应1 h。③ 样品置于65 ℃下15 min终止反应。④标记完成以后,将样品与miRCURYTM LNA Array (v.19.0) (Exiqon)芯片杂交,根据Exiqon的实验方法进行。⑤25 μl 样品与25 μl 杂交缓冲液混合,95 ℃下变性2 min,然后置于冰上2 min。⑥与芯片在56 ℃下杂交16~20 h,杂交系统为Nimblegen Systems,Inc.,Madison,WI,USA。杂交完成以后,使用Wash buffer kit (Exiqon)清洗芯片,使用Axon GenePix 4000B芯片扫描仪进行扫描。
2 结果
2.1 重症肺炎患者肺泡灌洗液MicRNA异常表达谱的筛选:通过Fold change和P-value 2项指标筛选2组间的差异表达MicRNA谱(图1,目录后),具体筛选条件为Fold change>1.5倍变化且P<0.05。最终本实验筛选出40个上调表达的MicRNA和113个下调表达的MicRNA。
2.2 重症肺炎与非肺部MicRNA差异表达结果的比较:对5例重症肺炎和5例非肺部感染患者的肺泡灌洗液进行MicRNA基因芯片检测,用qRT-PCR技术,以验证芯片技术的结果。对其中miR-208b-3p、miR-1323、miR-4455、miR-4764-3p、miR-483-3p、miR-3686、miR-3124-3p、miR-127-5p采用定量PCR验证,内参选用U6。与非呼吸道感染患者相比,结果分析表明上调基因miR-3686、miR-4455及下调基因miR-127-5p、miR-1323的表达差异有统计学意义(图2-图3,目录后),miR-208b-3p、miR-4764-3p、miR-483-3p、miR-3124-3p的表达差异无统计学意义,见表1-表2。
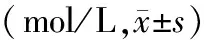
表1 上调表达MicRNA的对比分析
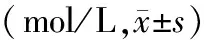
表2 下调表达MicRNA的对比分析
3 讨论
重症肺炎在重症监护室中具有高发病率、高死亡率的特点,特别是受到耐药细菌感染的患者。目前,大部分研究集中在细菌耐药机制方面,而对于感染后肺部损伤发病机制依然尚不清楚。现有研究认为,炎性细胞因子与局部微生态环境以及炎症免疫反应失衡,导致宿主呼吸道与全身免疫防御系统损害,从而加重肺部的损伤[8]。但是,针对上述有关炎症因子损伤给予相应的治疗后,并未改善预后,因而在感染患者基因水平变化方面引起了众多研究者的关注。随着第二代MicRNA测序技术的应用,快速预测已知的MicRNA和新的可能的MicRNA,已经成为研究感染性疾病发病机制的强有力工具[8-9]。
有关MicRNA在肺内炎症反应中的作用同样也受到很多研究者的关注,MicRNA可以通过转录后水平下调炎性因子和炎性因子信号通路的受体来调控失衡的炎症反应,在炎症反应中起了重要的调控作用[8-9],这也使得MicRNA 成为了对临床疾病诊断及预后有重要意义的生物标志物和多种疾病的治疗靶点[10-11]。Aganov 等[12]研究了病原体源性物质脂多糖刺激人单核系后 MicRNA的表达情况,发现细菌内毒素的刺激可以引起巨噬细胞中 miR132、miR146a、miR155 表达水平增加,细菌成分及TLR2 、TLR4、TLR5的配体可以明显刺激 miR146 的表达上调。而 miR146 通过调节TLR/IL1β信号通路 TRAF6及IRAK1 减少炎症因子的释放,对防止过度炎症有重要作用[13]。此外,鼠巨噬细胞经脂多糖刺激后 miR125 表达水平降低[14]。Rodriguez 等[15]研究了miR155在小鼠肺部炎症中的作用,提示缺乏 miR155 的小鼠肺支气管肺泡中白细胞数量增加,这证明了miR155在肺部炎症反应方面的重要作用。本研究通过生物芯片技术对重症肺炎患者肺泡灌洗液进行了MicRNA表达谱分析,结果发现重症肺炎患者MicRNA的表达谱与非呼吸道感染患者是有差异的,在众多差异表达MicRNA中,miR-3686、miR-4455表达上调,miR-127-5p、miR-1323表达下调;这与以往的研究发现不同[16-20],可能与留取的标本来源不同有关。本组样本均来源于肺泡灌洗液,其对肺损伤的机制可能有一定的研究价值,其可能参与了重症肺炎肺损伤的调控,但如何调控还需要后续进一步的研究。
[1] The Cancer Genme Altas Research Netuork.Comprehensive molecular characterization of gastric adenocarcinoma[J].Nature,2014,513:202.
[2] 郭琦,黎毅敏,农凌波,等.重症肺炎及感染性休克的集束治疗[J].中华急诊医学杂志,2009,18(3):286-292.
[3] 杨婉花,吴海英,张宏泽,等.MicroRNA-150联合脉搏指示连续性心输出量检测指标判断脓毒症休克患者预后的临床价值[J].浙江大学学报(医学版),2015,44(6):659-664.
[4] Goodwin AJ,Guo Changrun,Cook JA,et al.Plasma levels of microRNA are altered with the development of shock in human sepsis:an observational study[J].Critical Care,2015,19:440.
[5] Moschos SA,Williams AE,Perry MM,et al.Expression profiling in vivo demonstrates rapid changes in lung microRNA levels following lipopolysaccharide-induced inflammation but not in the anti-inflammatory action of glucocorticoids[J].BMC Genomics,2007,8:240.
[6] Monaci E,Mancini F,Lofano G,et al.MF59-and AL(OH)3-adjuvanted staphylococcus aureus(4C-Staph) vaccines induce sustained protective humoral and cellular immune responses,with a critical role for effector CK4 T cells at low antibody titers [J].Front Immunol,2015,6:439.
[7] Mandell LA,Wunderink RG,Anzueto A,et al.Infectious diseases society of America/American thoracic society consensus guidelines on the management of community-acquired pneumonia in adults[J].Clinical Infectious Diseases,2007,44(Suppl 2):27.
[8] Pedersen I,David M.MicroRNAs in the immune response[J].Cytokine,2008,43(3):391-394.
[9] 张泽信,王晓霞,杨湾湾,等.脓毒症分子机制及miRNA在脓毒症中的作用[J].现代生物医学进展,2014,14(22):4377-4381.
[10] 谢文群,谭诗云.循环miRNA作为结直肠癌生物标志物的研究进展[J].医学研究杂志,2015,44(5):5-8.
[11] 陈昊,范理宏.血清miRNA生物标志物对NSCLC的诊断价值[J].同济大学学报,2016,37(4):51-55.
[12] Taganov KD,Boldin MP,Chang KJ,et al.NF-kappaB-dependent induction of microRNA miR-146,an inhibitor targeted to signaling proteins of innate immune responses[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(33):12481-12486.
[13] Taganov KD,Boldin MP,Baltimore D.MicroRNAs and immunity:tiny players in a big field[J].Immunity,2007,26(2):133-137.
[14] Tili E,Michaille JJ,Cimino Amelia,et al.Modulation of miR-155 and miR-125b levels following lipopolysaccharide/TNF-alpha stimulation and their possible roles in regulating the response to endotoxin shock[J].Journal of Immunology,2007,179(8):5082-5089.
[15] Rodriguez A,Vigorito E,Clare S,et al.Requirement of Bic/microRNA-155 for normal immune function[J].Science,2007,316:608-611.
[16] Neudecker V,Brodsky KS,Kreth S,et al.Emerging roles for MicroRNAs in perioperative medicine[J].Anesthesiology,2016,124(2):489-506.
[17] Jiang Yinan,Zhou Hongmin,Ma Dandan,et al.MicroRNA-19a and CD22 comprise a feedback loop for B cell response in sepsis[J].Medical Science Monitor,2015,21:1548-1555.
[18] Wang Huijuan,Yu Bingxiang,Deng Jie,et al.Serum miR-122 correlates with short-term mortality in sepsis patients[J].Critical Care,2014,18(6):704.
[19] How CK,Hou Senkuang,Shih HC,et al.Expression profile of MicroRNAs in gram-negative bacterial sepsis[J].Shock,2015,43(2):121-127.
[20] 杨永丽,何静,肖志英.miRNA-499对脓毒症患者心肌损伤的诊断价值[J].中华危重病急救医学,2015,27(2):218-220.
Differential expressions of MicRNAs in bronchoalveolar lavage fluid of patients with severe
pneumonia and the function of MicRNA in severe pneumonia
WANGZhaojun1,LIUQinfu1,WANGXiaohong1,WANGYanbo2,ZHANGJun1,ZHOUWenjie1,YANGXiaojun1
1.IntensiveCareUnit,GeneralHospitalofNingxiaMedicalUniversity,Yinchuan750004,China;2.DepartmentofCerebrospinalFluidResearch,GeneralHospitalofNingxiaMedicalUniversity,Yinchuan750004,China
YANGXiaojun,Email:yxjicu@163.com
Objective To observe the expressions of MicRNA in bronchoalveolar lavage fluid of patients with severe pneumonia in Intensive Care Unit (ICU).Methods The differential expressions of MicRNA in BALF of patients with SP (n=5) and non-SP patients (5 cases who needed mechanical ventilation after surgery) were screened by MicRNA chip technique.Screen out the MicRNA which were up-regulated and down-regulated and the results were verified by RT-PCR chip.Results Abnormal expression spectrum of MicRNA in severe pneumonia patients was initially built,in which 40 MicRNA were up-regulated and 113 MicRNA were down-regulated.Compared with non-SP patients,the expressions of miR-3686,miR-4455,miR-1323 and miR-127-5p were significant difference in SP patients than those in non-SP patients (P<0.05).Conclusion The expressions of miR-3686,miR-4455,miR-1323 and miR-127-5p are significant difference in BALF of patients with severe pneumonia,which may relate to pulmonary injury.
Severepneumonia;Bronchoalveolarlavagefluid;MicRNA
国家自然科学基金项目(81450031);宁夏自然科学基金项目(NZ14142)
1.宁夏医科大学总医院重症医学科,宁夏 银川 750004 2.宁夏医科大学总医院脑脊液研究室,宁夏 银川 750004
王昭君(1987-),女,山西籍,硕士学位,治医医师,主要从事重症医学研究方向。
杨晓军,Email:yxjicu@163.com
http://kns.cnki.net/kcms/detail/64.1008.R.20170508.1147.004.html
10.13621/j.1001-5949.2017.05.0392
R373
A
2016-09-13 [责任编辑]李 洁
