4个枫香家系在不同环境下的叶色变化
2017-06-19王冬雪德永军史久西
王冬雪,德永军,施 翔,史久西*
(1.内蒙古农业大学,内蒙古 呼和浩特 010019; 2.中国林业科学研究院亚热带林业研究所,浙江 杭州 311400)
4个枫香家系在不同环境下的叶色变化
王冬雪1,2,德永军1*,施 翔2,史久西2*
(1.内蒙古农业大学,内蒙古 呼和浩特 010019; 2.中国林业科学研究院亚热带林业研究所,浙江 杭州 311400)
[目的]对不同遗传材料在不同环境条件下叶片色素含量变化及其呈色响应开展试验研究,从生理生化角度探寻影响秋季枫香叶片呈色的关键因素,为枫香叶色改良、新品种选育和应用环境选择提供理论依据。[方法]以4个不同家系的1年生枫香幼苗为试材,测定其在不同环境下叶片叶绿素、类胡萝卜素、花青素和可溶性糖含量并分析其相关性。[结果]结果表明:试验期间,枫香叶片逐渐由绿色变成红色、深红色。同时4个家系叶色变化差异显著,其中17号家系叶片主要为深红色,14号家系叶片颜色以黄绿色为主。叶片中的叶绿素、叶绿素a、叶绿素b 和类胡萝卜素含量变化呈下降趋势,特别在平均温度最低、平均昼夜温差大的3号试验点下降幅度最大。4个家系叶片花青素含量显著升高。同时4个家系叶片可溶性糖含量在各试验点均较试验前有不同程度增加。相关分析表明花青素含量与可溶性糖含量呈显著正相关,与叶绿素含量、平均温度和平均呈显著负相关。多因素方差分析表明家系和不同环境对叶片叶绿素、类胡萝卜素、花青素、可溶性糖和叶片红色面积比例变化产生极显著影响(p<0.01)。[结论]不同家系枫香叶片颜色在不同环境下有不同的变化趋势,同一环境下不同枫香家系叶片变化也显著不同,温度变化的差异和枫香叶片色素比例的改变是导致其颜色改变的主要原因。
枫香;家系;环境;叶色
森林色彩是森林景观的重要构成要素,也最能展现森林生态美学。秋色叶树种是彩叶树种最主要的类型,是实现森林景观从绿色向多彩色调转变和提高森林景观质量的重要材料。枫香(LiquidambarformosanaHance.)为金缕梅科(Hamamelidaceae)枫香属(LiquidambarL.)植物,树干高大,圆满通直,枝叶繁茂,适应性强,生长旺盛,春夏季叶色暗绿,秋季变为红色,广泛分布于我国南方各省区,是我国南方林区主要森林树种之一。枫香也可作行道树和遮阴树,或于草地孤植、丛植,或于山坡、池畔与其它树木混植,是优良的景观生态树种。枫香叶一般在每年10月下旬开始由绿变黄、变红,整个叶片衰老凋落过程持续到12月底,部分未落红叶持续到次年1月[1]。
彩叶植物秋季叶色变红是叶片中花色素苷大量合成积累的结果[2-5],其中花色素苷属于类黄酮类物质,主要存在于叶、花和果实等多种植物器官组织和细胞液泡中。同时研究表明植物叶片中叶绿素和类胡萝卜素对叶色的变化也起到重要作用[2]。近十几年来,国内学者以鲜红栎(QuercuscoccineaMuench.)[2]、纳塔栎(Quercus.nuttalliiPalmer.)[2]、沈氏栎(QuercusshumardiiBuckl.)[2]、针栎(QuercuspalustrisMünchhausen.)[2]、日本野漆树(Toxicodendronsuccedaneum(L.) Kuntze.)[6]、红枫(Acerpalmatum'Atropurpureum' Thunb.)[7]、火炬树(RhusTyphinaNutt.)[8-9]、红花檵木(Loropetalumchinensevar. rubrum Yieh.)[10]、银杏(GinkgobilobaL.)[8,9]、栾树(KoelreuteriapaniculataLaxm.)[9]等许多引进和本土的彩色树种为对象,对引种应用、生态适应性、呈色生理及其影响因子等作了大量研究,同时对色素合成的相关基因作了深入研究[11]。通常认为叶片呈色既受遗传因素又受环境因素的控制。然而陈秋夏等研究表明枫香叶色与遗传变异不存在显著相关[12],胡敬志等[13]的研究则表明,枫香叶片中叶绿素和类胡萝卜素含量与气温呈正相关,而花青素含量与气温表现为负相关关系。现有研究一般是对单一影响因素的探讨,综合两者对叶色变化的影响并进行比较研究则很少开展。目前,对枫香的研究也主要集中在控制条件下叶片色素含量的变化[12-14],本文尝试对不同遗传材料在不同环境条件下叶片色素含量变化及其呈色响应开展试验研究,对枫香秋叶着色遗传和环境因子的相关性进行初步探讨,进而为枫香育种和景观培育提供科学依据。
1 材料与方法
1.1 试验材料与试验地点
试验所用枫香种子分别采集自湖北武汉(6号家系)、贵州惠水(10号家系)、贵州南明(14号家系)和湖南慈利(17号家系)。4个种源的地里位置由图1所示。种子于2015年2月育苗,基质为珍珠岩∶泥炭=1∶3,采用自动喷雾浇水,待幼苗出土后,适量喷洒营养液以供给生长。2015年12月7日,选取生长一致(苗高30 cm)的无纺布容器幼苗进行试验。

图1 枫香种源地理位置示意图Fig.1 Map of the provenances of L. formosana in China
试验在杭州市富阳区中国林科院亚热带林业研究所内进行,选择温度、湿度、光照等环境条件不同的4个地点布置试验,其具体情况见表1。其中4个试验点试验期的平均温度、最低温度、最高温度、平均昼夜温差和最低湿度差异显著(p<0.05)。
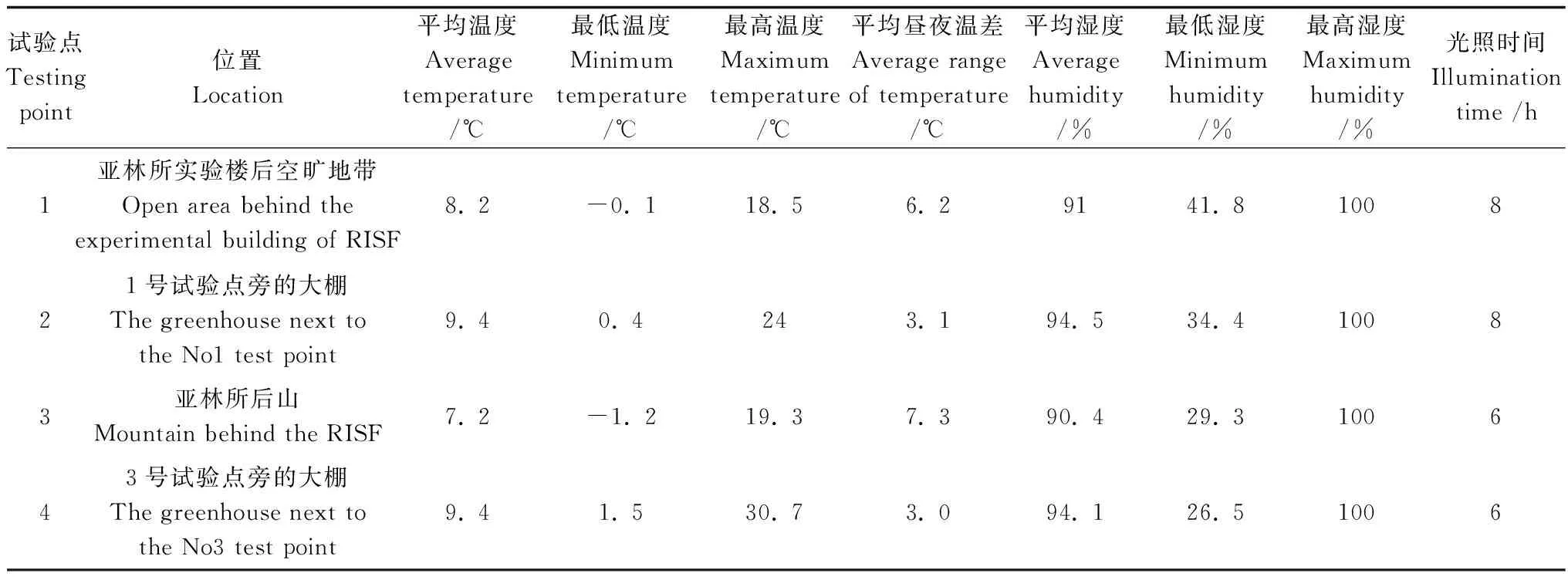
表1 各试验点位置及试验期温湿度、光照情况
1.2 试验方法
试验采用盆栽法,每个圆形的塑料盆(直径15 cm×高15 cm)盆底设置通气孔,通气孔周围覆盖包裹有尼龙纱布的细砾石和粗砂,以防止土粒塞满砂砾空隙。装土时分层压实,并使各盆的紧实度保持一致,装土量为每盆2 kg。土体表面距盆口保持一定距离,以便浇水。供试红壤采集自富阳,取自表土层(0~30 cm)。
试验采用完全随机设计。每个试验点包含4个家系,每个家系设置3个重复,每个重复包括10株枫香幼苗,每个家系共30株苗。采样时间为2015年12月7日至28日,每7 d取样1次,共取样4次,叶片采集后进行各项参数的测定。
1.3 试验点温湿度记录
在所观测的试验点,悬置DL-WS211温湿度记录仪(杭州尽享科技有限公司),仪器设置为每隔30 min自动记录1次,24 h不间断记录整个试验过程中试验点的环境温湿度。
1.4 测定方法
从每株苗同等部位同一朝向釆集2片功能叶片,每个重复共20片叶片。叶绿素含量采用丙酮法测定。擦净叶片表面污物,并剪成宽度小于1 mm细丝,称取0.2 g样品放入试管中。向试管中加入10 mL 80%丙酮混匀。试管置室温避光处浸泡24 h。将叶绿素提取液置玻璃比色皿中,80%丙酮作参比,用TU-1810型分光光度计(北京普析通用仪器公司)分别在470、645、663 nm处测定吸光度。采用Lichtenthaler等[15]的公式分别计算叶绿素 a、叶绿素 b 及类胡萝卜素含量。
花青素含量采用1%盐酸甲醇法测定。擦净叶片表面污物,并剪成宽度小于1 mm细丝,称取0.2 g样品放入试管中。向试管中加入10 mL 1%盐酸甲醇溶液浸泡,置室温避光处浸提2 h,至肉眼观察叶组织完全变白。将花青素提取液置玻璃比色皿中,1%盐酸甲醇作参比,用TU-1810型分光光度计(北京普析通用仪器公司)分别在530 nm处测定吸光度。
可溶性糖含量采用蒽酮法测定[16]。
1.5 叶色面积测定
采集的所有枫香叶片去离子水洗净后,用双光源扫描仪扫描,图片用WinRHIZO Pro 2005b(加拿大Regent公司)分析软件统计分析叶片变色区域面积,计算叶片变色率(叶片变色部分面积占叶片总面积的百分比)。
1.6 数据分析
试验数据采用统计软件SPSS V19.0进行方差分析和差异显著性分析。采用OriginPro 7.5软件作图,数据采用平均值±标准误。
2 结果与分析
2.1 枫香叶片色素与可溶性糖含量变化
2.1.1 叶绿素含量的变化 在秋冬季叶片转色期,4个枫香家系叶片叶绿素含量变化趋势由图2所示。4个家系叶片叶绿素含量在不同试验点基本呈下降趋势。叶片叶绿素含量在4个试验点差异显著(p<0.05)。由于3号试验点在整个试验期间平均温度最低,同时其平均昼夜温差达到7.5℃,因此枫香各家系叶片叶绿素含量在3号试验点下降幅度最大,为31.7%,显著高于其它3个试验点(p<0.05)。4号试验点枫香家系叶绿素含量平均下降21.9%。每个试验点的家系叶绿素含量同样表现出显著差异(p<0.05)。其中17号家系叶绿素含量在各试验点下降幅度均在40%以上,显著高于其它家系(p<0.05)。同时6号家系叶绿素含量下降明显,平均为29.7%。而14号家系叶绿素含量下降幅度在4个试验点均小于其它3个家系。在试验期间,叶绿素a和叶绿素b具有相同的表现趋势。叶绿素含量与平均温度及平均湿度的相关性不显著(表2)。

图2 4个枫香家系叶绿素浓度时间变化趋势Fig. 2 Temporal change of concentration of chlorophyll of 4 L. formosana families

项目Item叶绿素Chlorophyll类胡萝卜素Carotenoid花青素Anthocyanidin可溶性糖Solublesugar叶片变色率Discolorationratiooftheleaves平均温度Averagetemperature平均湿度Averagehumidity叶绿素Chlorophyll1.000类胡萝卜素Carotenoid0.0551.000花青素Anthocyanidin-0.497**-0.2211.000可溶性糖Solublesugar0.009-0.1340.333*1.000叶片变色率Discolorationratiooftheleaves-0.619**-0.2300.635**0.1911.000平均温度Averagetemperature-0.0260.293*-0.532**-0.762**-0.366*1.000平均湿度Averagehumidity-0.0390.134-0.297*-0.143-0.0870.489**1.000
注:*、**分别表示显著水平p<0.05、p< 0.01。
Note: *, **, ***represent significant difference levelp< 0.05,p< 0.01,p< 0.001, respectively.
2.1.2 类胡萝卜素含量的变化 4个枫香家系叶片类胡萝卜素含量变化趋势由图3所示。4个家系叶片类胡萝卜素含量在4个试验点有显著差异(p<0.05)。相同家系类胡萝卜素含量在不同试验点的变化趋势也存在显著差异(p<0.05),其中6号家系类胡萝卜素含量在1号试验点随着时间推移呈上升趋势,而在其它3个试验点则有相反的表现。同时不同家系类胡萝卜素含量在同一试验点的变化趋势也显著不同。其中3号试验点的4个家系叶片类胡萝卜素含量均呈下降趋势,下降幅度均在2.9%以上(p<0.05)。类胡萝卜素含量与平均温度(Pearsonr=0.293,p<0.03,N= 48)呈显著正相关,与平均湿度呈正相关但不显著(表2)。
2.1.3 花青素含量的变化 在秋冬季叶片转色期,4个枫香家系叶片花青素含量变化趋势由图4所示。随着时间推移4个家系叶片花青素含量在4个试验点呈上升趋势并表现出显著差异(p<0.05)。其中枫香家系花青素含量在2号试验点平均上升幅度最大,为249.8%,显著高于其它3个试验点(p<0.05)。4号试验点枫香家系花青素含量平均上升幅度最低,为169.3%。由于1号试验点和3号试验点在试验期间平均温度较高且昼夜温差相对较小,因此4个家系花青素平均含量较其余2个试验点低。相同试验点枫香家系叶片花青素含量同样表现出显著差异(p<0.05)。其中6号家系和17号家系花青素含量显著增加,上升幅度均在200%以上,显著高于其它家系(p<0.05)。而14号家系花青素含量上升幅度在4个试验点均小于其它3个家系。花青素含量与叶绿素含量(Pearsonr=-0.497,p< 0.01,N= 48)、平均温度(Pearsonr=-0.532,p< 0.01,N= 48)呈极显著负相关,与平均湿度呈显著负相关(Pearsonr=-0.297,p< 0.05,N= 48),而与可溶性糖含量呈显著正相关 (Pearsonr=0.333,p<0.05,N= 48)(表2)。

图3 4个枫香家系类胡萝卜素浓度时间变化趋势Fig. 3 Temporal change of concentration of carotenoid of 4 L. formosana families
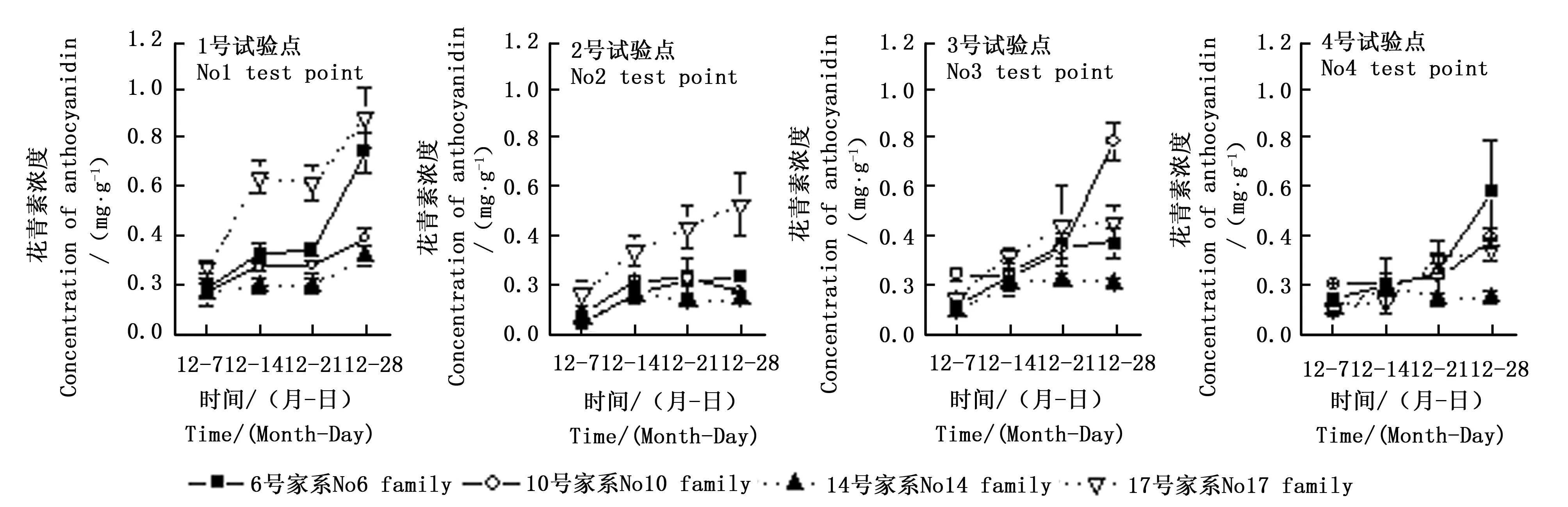
图4 4个枫香家系花青素浓度时间变化趋势Fig. 4 Temporal change of concentration of anthocyanidin of 4 L. formosana families
2.1.4 可溶性糖含量的变化 4个枫香家系叶片可溶性糖含量变化趋势由图5所示。试验结束后,4个家系叶片可溶性糖含量在各试验点均较试验前有不同程度增加(6号家系和10号家系在2号试验点除外)。枫香家系叶片可溶性糖含量在4个试验点的变化趋势有显著差异(p<0.05),其中3号试验点的4个家系叶片可溶性糖含量显著增加,增加幅度均在50%以上,显著高于其它3个试验点(p<0.05),其中17号家系叶片可溶性糖含量由6.8 mg·g-1增加到13.8 mg·g-1。可溶性糖含量与平均温度呈极显著负相关(Pearsonr=-0.762,p< 0.01,N= 48),与平均湿度呈负相关但不显著(表2)。
2.2 枫香叶片呈色变化
试验期间枫香叶片由绿色逐渐转变为黄色或红色,4个家系叶片变色率变化趋势由图5所示。随着时间推移,枫香叶片变色率基本呈上升趋势。试验结束后,枫香各家系叶片变色率较试验前有显著增加,但各家系的增加幅度有显著差异(p<0.05)。试验结束后,17号家系叶片基本呈红色,甚至鲜红色;14号家系叶片则主要为黄绿色,部分为紫红色,这与叶绿素和花青素含量的变化一致。同时叶片变色率在各试验点也有显著差异(p<0.05)。叶片变色率与叶绿素含量(Pearsonr=-0.619,p< 0.01,N= 48)呈极显著负相关,与平均温度(Pearsonr=-0.366,p< 0.05,N= 48)呈显著负相关,与花青素含量呈极显著正相关(Pearsonr= 0.635,p< 0.01,N= 48),与可溶性糖含量呈正相关但不显著。
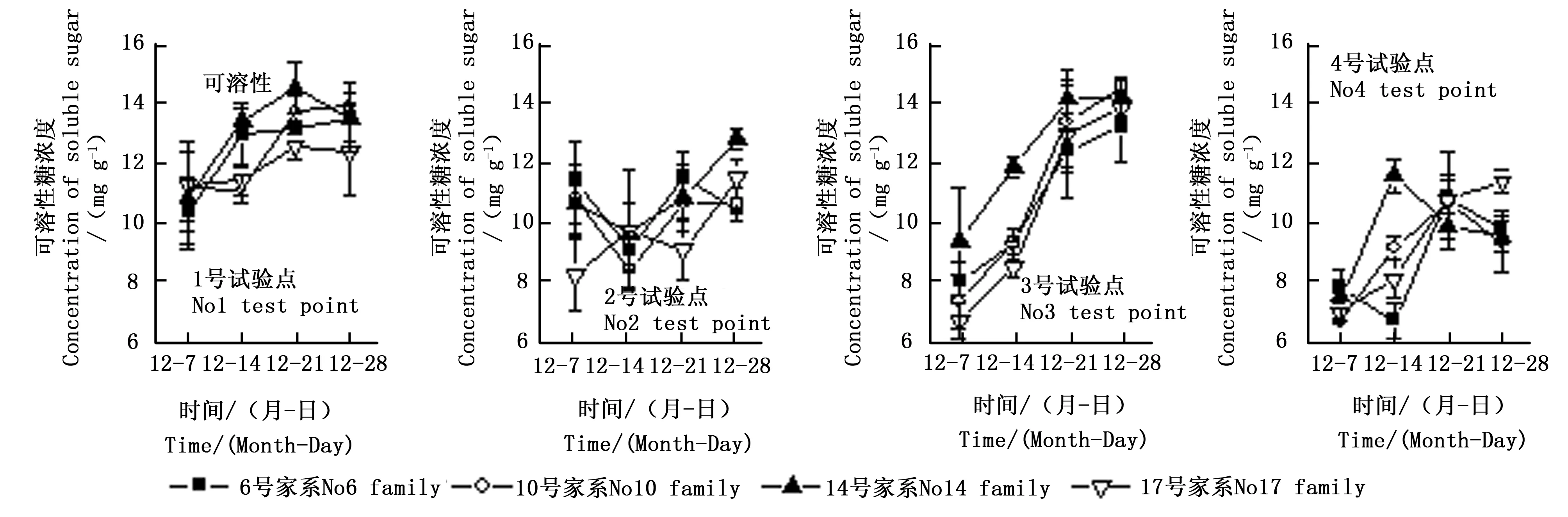
图5 4个枫香家系可溶性糖浓度时间变化趋势Fig. 5 Temporal change of concentration of soluble sugar of 4 L. formosana families
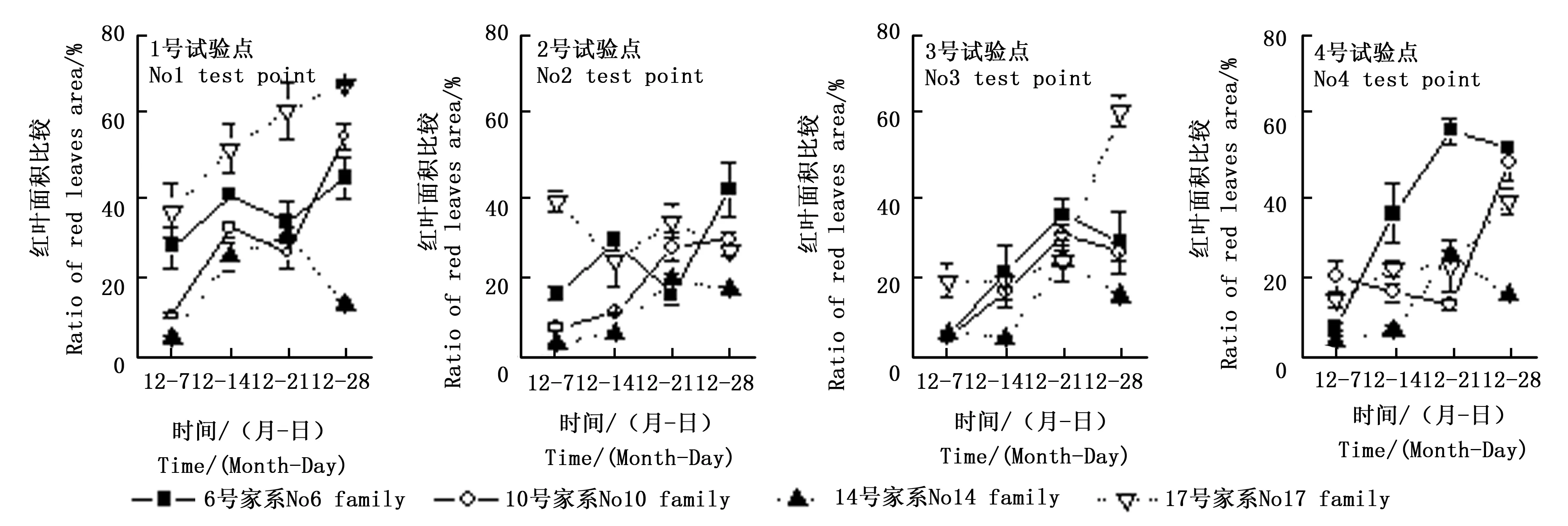
图6 4个枫香家系红叶面积比例时间变化趋势Fig. 6 Temporal change of ratio of red leaves area of 4 L. formosana families
2.3 色素、可溶性糖含量多因素方差分析
表3为家系、试验点和时间及其交互效应对枫香叶片色素、可溶性糖及叶片变色率等5个指标的三因素影响方差分析。结果显示,家系、试验点和采样时间三因素对各指标均产生极显著影响(p< 0.01)。家系、试验点和采样时间的交互效应对叶绿素和可溶性糖均没有显著影响。除类胡萝卜素外,其它4个指标均以采样时间为主要影响因素。叶绿素、花青素、叶片变色率受3因素的影响有相似趋势,均为时间>家系>试验点,其中因素间的交互效应均对花青素和叶片变色率有显著影响(p<0.01)。可溶性糖主要受时间和试验点的影响,家系间差异小。

表3 枫香4个家系、4个试验点在叶片转色期5个指标的三因素方差分析
注:*、**、***分别表示显著水平p< 0.05、p< 0.01、p<0.001。
Note: *, **, ***represent significant difference levelp< 0.05,p< 0.01,p< 0.001, respectively.
3 讨论
3.1 呈色与色素的关系
在枫香转色期,家系之间叶色变化程度有显著差异,其中14号家系叶片红叶面积较少,且叶片主要呈暗紫红色,而17号家系试验后期大部分叶片呈鲜红色,这与叶绿素含量和花青素含量时间变化趋势一致。研究结果显示,花青素与叶绿素含量比值随着时间推移逐渐上升,特别是在试验后期比值显著上升,而类胡萝卜素与叶绿素含量的比值基本无显著变化。同时叶绿素含量与花青素含量呈显著负相关,因此,枫香叶片变色的直接原因是受叶片中3种色素比值变化的综合影响,这也与前人的研究相似[8,17-20]。
3.2 可溶性糖的作用
研究表明,花色素苷的合成与碳水化合物的代谢有关[8,21],特别是与可溶性糖显著正相关[22]。可溶性糖是花色素苷的前体物质或信号分子,也是花色素苷结构的组分之一,可以显著促进植物花色素苷的积累[2]。本试验前期可溶性糖含量显著上升,之后可溶性糖含量趋于平稳甚至开始下降。试验前期是4个枫香家系变色前期,花青素含量缓慢增加,因此对可溶性糖的需求和消耗均较少,从而为花青素的大量合成提供了原料。枫香叶片开始大面积变红时,可溶性糖浓度也呈下降趋势,这可能是因为可溶性糖主要是为花青苷的合成提供碳骨架[23],从而导致了叶片中可溶性糖的减少。因此,可采取一定措施促进枫香秋冬季叶色的表现。陈继卫等[7]也认为在秋冬季落叶树木叶片衰老过程中,可溶性糖含量逐渐增加,这与本研究的结果一致。
3.3 色素与环境因子
叶绿素合成的最低温度是2~4℃,最适温度是30℃左右,最高温度是40℃[24]。本研究中4个试验点的平均温度低于10℃,因此不利于叶绿素的合成。同时低温可诱导一些植物体内花色素苷的合成,但Christie等[24]认为过低的低温破坏花色素苷的合成。而在本试验条件下,低温适合花青素的合成。随着日照时间缩短以及温度下降,植物开始自然衰老,叶绿素开始分解,这种不利的环境会促进花色素的合成和积累。本试验中枫香家系的叶绿素含量在1号试验点和3号试验点下降幅度最大,而花青素含量显著上升,这主要是因为这2个试验点平均温度较低,同时其昼夜温差较大。在试验大棚内温度较高,且昼夜温差较小,因此4个家系在2号试验点和4号试验点叶绿素含量下降和花青素含量上升幅度较1号试验点和3号试验点小,表明枫香叶片变红需要一定的低温和温差,这与前人的研究相似[13,21, 25]。
3.4 种源差异
研究表明枫香的遗传差异和地理分布存在较大的相关性[12]。本研究表明4个家系叶色变化差异较大,其中采集自贵州且地理分布相近的10号家系和14号家系在整个试验期间叶片颜色变化不大,特别是14号家系在试验后期叶片仍然主要为黄绿色。尽管如此2个家系叶片呈色变化仍表现出一定的差异性。而6号家系和17号家系在转色期叶色变化显著,特别是17号家系后期叶色鲜红。17号家系种子采集自湖南慈利山区,在枫香转色期,当地温度较低,同时昼夜温差较大。而14号家系采集自贵州南明的平坦地区,转色期温度适中,且昼夜温差较小。多因素方差分析表明家系和试验点对叶片叶绿素、类胡萝卜素、花青素、可溶性糖和叶片红色面积比例变化产生极显著影响(p<0.01),反映了叶色差异既取决于遗传因素,也受外部环境影响[26],实践中可通过选择呈色差异较大的家系和合适的小气候生境进行景观配置。同时试验后期17号家系可溶性糖含量也显著高于14号家系,推测这2个家系的花色素苷代谢合成途径有差异。造成这种差异的原因是因为家系本身遗传特性差异所致,还是基因对于环境变化的不同响应所致还需通过分子生物学试验进一步研究。
4 结论
4个枫香家系叶片颜色在不同环境下有不同的变化趋势,同一环境下不同枫香家系叶片变化也显著不同。其中17号家系在转色期大部分叶片由绿色变为深红色,而14号家系叶片颜色变化不显著。4个家系叶片中的色素以及可溶性糖含量有显著差异。总之,秋冬季枫香叶色变化是多种因素的综合作用的结果,最直接的原因是色素成分和比例的改变,而糖分、温度、湿度等是叶片呈色重要的内外因子。
[1]罗紫东, 关华德, 章新平, 等. 枫香叶片衰老过程中光合能力的变化[J]. 应用生态学报, 2016, 27(10): 3129-3136.
[2]姜 琳, 杨 暖, 姜官恒, 等. 栎属4 个树种秋冬叶色与生理变化的关系[J]. 中国农学通报, 2015, 31(19): 13-18.
[3]胡静静, 沈 向, 李雪飞, 等. 黄连木秋季叶色变化与可溶性糖和矿质元素的关系[J]. 林业科学, 2010, 46(2): 80-86.
[4]张 敏, 黄利斌, 周 鹏, 等. 榉树秋季转色期叶色变化的生理生化[J]. 林业科学, 2015, 51(8): 44-51.
[5]刘雪梅. 三种色系榉树叶色表达期叶片结构和叶色稳定性研究[D]. 长沙: 中南林业科技大学, 2014.
[6]谢庭生, 谢树春, 赵 玲. 湖南红壤紫色土地区日本野漆树引种试验[J]. 经济林研究, 2013, 31(1):110-114.
[7]陈继卫, 沈朝栋, 贾玉芳, 等.红枫秋冬转色期叶色变化的生理特性[J]. 浙江大学学报: 农业与生命科学版, 2010, 36(2): 181-186.
[8]魏 嫒, 闫 伟, 杨 瑞.4 种秋色叶树种转色期叶色变化的生理特性[J]. 现代园艺, 2014, (7): 17-19.
[9]楚爱香, 张要战, 田永芳. 几种秋色叶树种秋冬转色期叶色变化的生理特性[J]. 东北林业大学学报, 2012, 40(11): 40-43.
[10] 袁 明, 万兴智, 杜 蕾, 等. 红花檵木叶色变化机理的初步研究[J]. 园艺学报, 2010, 37(6): 949-956.
[11] 王小青, 韩 键, 文 杨, 等. 呈色机制不同的桃叶片花色素苷积累及合成相关基因表达的季节性差异[J]. 南京农业大学学报, 2016, 39(6): 924-931.
[12] 陈秋夏, 李效文, 施娟娟, 等. 枫香秋季叶色与其遗传间相关性的研究[J]. 林业科技, 2014, 39(5): 20-23.
[13] 胡敬志, 田 旗, 鲁心安. 枫香叶片色素含量变化及其与叶色变化的关系[J]. 西北农林科技大学学报, 2007, 35(10): 219-223.
[14] 王 荣, 郭志华. 不同光环境下枫香幼苗的叶片解剖结构[J]. 生态学杂志, 2007, 26(1): 1719-1724.
[15] Lichtenthaler F W, Cuny E, Weprek S. Eine einfache und leistungsfähige Synthese acylierter Glyculosylbromide aus Hydroxyglycal-estern[J]. AngewandteChemie, 1983, 95(11): 906-908.
[16] 赵世杰, 史国安, 董新纯. 植物生理学实验指导[M]. 北京: 中国农业科学技术出版社, 2002: 84-99.
[17] 赵昶灵, 郭华春. 植物花色苷生物合成酶类的亚细胞组织研究进展[J]. 西北植物学报, 2007, 27(8): 1695-1701.
[18] 李效文, 陈秋夏, 郑 坚. 枫香秋叶色素变化及与环境因子关系研究[J]. 浙江亚热带作物通讯, 2011, 33(1): 29-33.
[19] 洪 丽, 王金刚, 龚束芳. 彩叶植物叶色变化及相关影响因子研究进展[J]. 东北农业大学学报, 2010, 41(6): 152-156.
[20] Keskitalo J, Bergquist G, Gardeström P,etal. A cellular timetable of autumn senescence[J].Plant Physiology, 2005, 139(4) 1635-1648.
[21] Schaberg P G, Van den Berg A K, Murakami P F,etal. Factors influencing red expression in autumn foliage of sugar maple trees[J]. Tree Physiology, 2003, 23(5): 325-333.
[22] Pallardy S G. Physiology of Woody Plants[M]. Burlington, MA: Academic Press, USA, 2010.
[23] 郭卫珍, 张亚利, 王 荷, 等. 5个山茶品种的叶色变化及相关生理研究[J]. 浙江农林大学学报, 2015, 32(5): 729-735.
[24] Christie P J, Alfenito M R, Walbot V. Impact of low-temperature stress on general phenylpropanoid and anthocyanin pathways: Enhancement of transcript abundance and anthocyanin pigmentation in maize seedlings[J]. Planta,1994, 194(4): 541-549.
[25] 陈建芳. 温湿度及外源蔗糖对元宝枫秋叶变色的影响研究[D]. 北京: 北京林业大学, 2014.
[26] Chalker-Scott L. Environmental significance of anthocyanins in plant stress responses[J]. Photochemistry and Photobiology, 1999, 70 (1): 1-9.
(责任编辑:金立新)
Change of Leaf Color of FourLiquidambarformosanaFamilies under Different Environmental Conditions
WANG Dong-xue1,2, DE Yong-jun1, SHI Xiang2, SHI Jiu-xi2
(1. Inner Mongolia Agricultural University, Huhhot 010019, Inner Mongolia, China; 2. Research Institute of Subtropical Forestry, Chinese Academy of Forestry, Hangzhou 311400, Zhejiang, China)
[Objective]To investigated the physiological and biochemical mechanisms of leaf colorization of fourLiquidambarformosanafamilies under different environmental conditions in order to provide guidance for the breeding of L.formosana. [Method] The change of the chlorophyll, carotenoid, anthocyanin and soluble sugar content in L.formosanaleaf were assessed. The relationship between meteorological factors and the contents was also discussed. [Result] The results showed that the leaf of L.formosanawas gradually changed from green to red or dark red during the experiment. In addition, the change of leaf color of 4 L.formosanafamilies showed significant difference. Some was dark red, whereas, another was yellow green. The chlorophyll content of L.formosanadecreased during the experiment in a whole. The changing trend of chlorophyll a, chlorophyll b and carotenoid were similar to the total chlorophyll content. The anthocyanin content increased significantly. The content of soluble sugar in L.formosanaincreased to different degrees. Correlation analysis showed that the anthocyanin content was positive correlated to the soluble sugar content. However, the anthocyanin content was negative correlated to the chlorophyll content, average temperature, and average humidity. Significant differences in the changes of chlorophyll content, carotenoid, anthocyanin, soluble sugar and red area of the leaf were found among families under different environmental conditions. [Conclusion] The change of leaf color of L.formosanafamilies showed different tendency under different environmental conditions, while significant difference of the change of leaf color under the same condition was also observed. The difference of temperature and the change of pigment ratio in the leaf resulted in the change of leaf color.
Liquidambarformosana; family; environmental conditions; leaf color
10.13275/j.cnki.lykxyj.2017.03.020
2016-07-21
浙江省省院合作林业科技项目(2013SY03);国家林业公益性行业科研专项经费项目“美丽城镇森林景观的构建技术研究与示范”(201404301);中央级公益性科研院所基本科研业务费专项资金资助项目“生态风景林色彩量化分析与配置技术研究”(RISF2014009)
王冬雪(1990—),女,内蒙古呼伦贝尔人,硕士研究生,主要从事森林培育研究.
* 通讯作者:德永军,教授,博士,主要从事森林培育研究.E-mail:dean6928@sohu.com;史久西,副研究员,博士,主要从事城市林业研究.E-mail:shijiuxi@126.com
S687.9
A
1001-1498(2017)03-0503-08
