抗褐化剂对天女木兰芽外植体褐化与酚酸氧化的影响
2017-06-19高红兵杜凤国
高红兵,杜凤国,王 欢
(北华大学林业与生态环境省重点实验室,吉林 吉林 132013)
抗褐化剂对天女木兰芽外植体褐化与酚酸氧化的影响
高红兵,杜凤国,王 欢
(北华大学林业与生态环境省重点实验室,吉林 吉林 132013)
[目的]确定引起天女木兰褐化现象的酚酸种类,筛选出最佳抗褐化剂及使用最适浓度。[方法]在B5培养基中分别添加各种抗褐化剂,芽外植体培养30 d后计算出褐化率,对褐化率结果进行统计分析,并比较三种抗褐化剂的抗褐化效果;另外,在组培过程中定期取样,利用HPLC测定芽外植体中咖啡酸、绿原酸和对香豆酸含量变化。[结果]表明:天女木兰芽外植体褐化过程中咖啡酸和绿原酸含量下降幅度较大,而对香豆酸含量下降幅度较小,说明咖啡酸和绿原酸容易被氧化,而对香豆酸较为稳定;三种抗褐化剂控制褐化现象发生的最佳效果排序为VC>PVP>CA;尽管PVP控制酚酸氧化效果不如CA,但是预防褐化效果确强于CA,其原因是由于二者抗褐化机理不同所致;VC使用的最适浓度为500 mg·L-1,如果超过此浓度会导致外植体褐化率增加; PVP最适浓度为1 000~1 500 mg·L-1, CA最适浓度为300 mg·L-1。[结论]天女木兰芽外植体褐化底物是咖啡酸和绿原酸,而与对香豆酸无关;VC、PVP和CA三种抗褐化剂抗褐化机理各不相同,综合比较VC抗褐化效果最好,其次是PVP,CA排在最后。
天女木兰,外植体,抗褐化剂,酚酸氧化
天女木兰(MagnoliasieboldiiK. Koch)又名小花木兰,为木兰科(Magnoliaceae)木兰属(Magnolia)的落叶小乔木,是国家三级濒危植物。天女木兰在组培过程中外植体褐化非常严重,严重影响了其组培成功率。木本植物与草本植物相比褐化现象更为严重,其原因是木本植物含较多的酚类化合物。多酚氧化酶(PPO)是末端氧化酶,在正常情况下植物体酚类物质与醌类分布在细胞内不同区域,酚类物质分布在液泡内,PPO分布在质体和细胞质中与膜结合呈潜伏状态,当外植体被切割后膜结构遭到破坏,PPO与酚类物质接触,在外植体伤口处发生氧化作用,酚类物质被氧化成醌类物质,醌类物质再经非酶促反应聚合形成褐色物质,并对植物产生毒害作用[1-5]。为了控制外植体褐化,人们在培养基中添加抗褐化剂达到预防褐化目的,比如:维生素C、柠檬酸、半胱氨酸、聚乙烯吡咯烷酮和活性炭等。目前,有少量使用抗褐化剂抑制天女木兰组培褐化方法的研究报道[6-7],而关于抗褐化剂控制天女木兰外植体褐化机理的研究还未见报道。本文以天女木兰芽作为外植体,在培养基中分别添加维生素C、柠檬酸和聚乙烯吡咯烷酮三种类型抗褐化剂,在组织培养过程中定期取样,利用高效液相色谱仪测定芽外植体中主要酚酸含量动态变化,确定引起天女木兰褐化现象的主要酚酸种类,从外植体褐化率及外植体主要酚酸含量动态变化两方面,比较三种抗褐化剂的抗褐化效果,确定酚酸种类与褐化的关系,为解决天女木兰组培褐化问题及揭示不同类型抗褐化剂的作用机理提供一定理论依据。
1 材料与方法
1.1 培养材料与培养方法
于4月初采集天女木兰成年树上一年生枝条,放置在实验室进行水培8~10 d,待芽萌动膨大时剪取顶芽和侧芽,芽长0.5~1.0 cm,用洗洁精浸泡20 min,流水冲洗2 h。在超净工作台内将芽放入质量分数为75%的乙醇溶液中消毒30 s,用无菌水冲洗3次,然后用0.1%氯化汞处理7 min,无菌水冲洗5次,接种。
1.2 培养基配制、培养条件及褐化率计算、统计分析方法
在B5培养基中分别添加不同浓度维生素C(以下简称VC)、柠檬酸(以下简称CA)和聚乙烯吡咯烷酮(以下简称PVP)三种抗褐化剂,其余添加成份相同,分别添加0.5 mg·L-1六苄基腺嘌呤(6-BA)、0.3 mg·L-1吲哚丁酸(IBA)、蔗糖30 g·L-1,调pH 5.6~5.8。试验设一个对照(CK)和三个不同浓度(T1、T2和T3)处理,每个处理培养30瓶,重复3次。各处理添加抗褐化剂浓度详见表1。培养温度25℃,光照1 500~2 000 lx,培养30 d统计外植体褐化率。褐化率计算方法为:褐化率=褐化瓶数/培养瓶数×100%。试验采用单因素方差分析及多重比较,利用Spass 18.0版软件对褐化率进行统计分析。
1.3 取样与酚酸测定方法
1.3.1 取样 接种10 d后开始取样,取样时间为10 d、20 d 和30 d,选取具有代表的芽外植体,液氮冷冻,存放于-80℃超低温冰柜中保存备用。
1.3.2 酚酸提取及测定方法 参考 Rosa等[8]发表的方法略加改动。称取冷冻样品 2.0 g,加液氮研磨,用 16 mL 60% 乙醇超声波提取 30 min,重复提取3次,过滤,滤液合并。用旋转蒸发仪 35℃低压蒸出乙醇剩水相,用 6 mol·L-1盐酸溶液调水相 pH至 2.0,用 30 mL 乙酸乙酯萃取 3次,合并酯相。在35℃下浓缩至干,残渣用 60%甲醇溶解,定容至 5 mL,用 0.45μm 滤膜过滤,上样检测。
1.3.3 HPLC测定酚酸的条件及方法 高效液相色谱仪(型号LC-20A,岛津公司生产);二极管阵列检测器(型号SPD-M20A);InertSustainC18色谱柱(规格4.6 mm ×250 mm,5 μm)。使用A和B双泵系统,流速0.8 mL·min-1, 柱温30℃。流动相A为1%(体积分数)乙酸水溶液,流动相B为1%乙酸甲醇溶液;采用梯度洗脱,洗脱梯度:起始浓度10% B;0~15 min,18% B;15~35 min,25% B;35~45 min,35% B;45~60 min,50% B;60~65 min,95% B。甲醇和乙酸均为色谱纯,咖啡酸、绿原酸和对香豆酸纯度>99%(Sigma公司生产)。定量方法采用孙洪圳[9]等介绍的方法进行,每个样品重复三次进样测定,测定结果取平均值。
2 结果与分析
2.1 抗褐化剂对芽外植体褐化的影响
三种抗褐化剂对外植体褐化率的影响见表1。从表1得出,除VC(T3)处理之外,其余各处理褐化率与对照相比差异均极显著。三种抗褐化剂处理褐化率最低的前三名排序为VC (T2)、VC (T1)和PVP(T3)处理,VC表现出良好的抗褐化效果,但是其三个不同浓度处理褐化率差异较大,VC(T2)处理褐化率最低为12.2%,其次是VC(T1)处理16.7%,二者差异不显著,但是VC(T3)处理褐化率高达48.9%,与T1、T2处理相比差异极其显著,而与CK处理褐化率差异不显著,其原因在后面讨论中进行。PVP抗褐化效果仅次于VC(T1和T2)处理,PVP处理褐化率变化比较有规律性,随着添加PVP浓度增加,外植体褐化率下降,T1、T2和T3处理褐化率分别为26.7%、18.9%和17.8%。CA处理的褐化率最高,其T1、T2和T3处理的褐化率分别为 36.7%、26.7%和27.8%,T2和T3处理抗褐化效果明显好于T1处理,差异十分显著,但是T2和T3处理之间差异不显著。
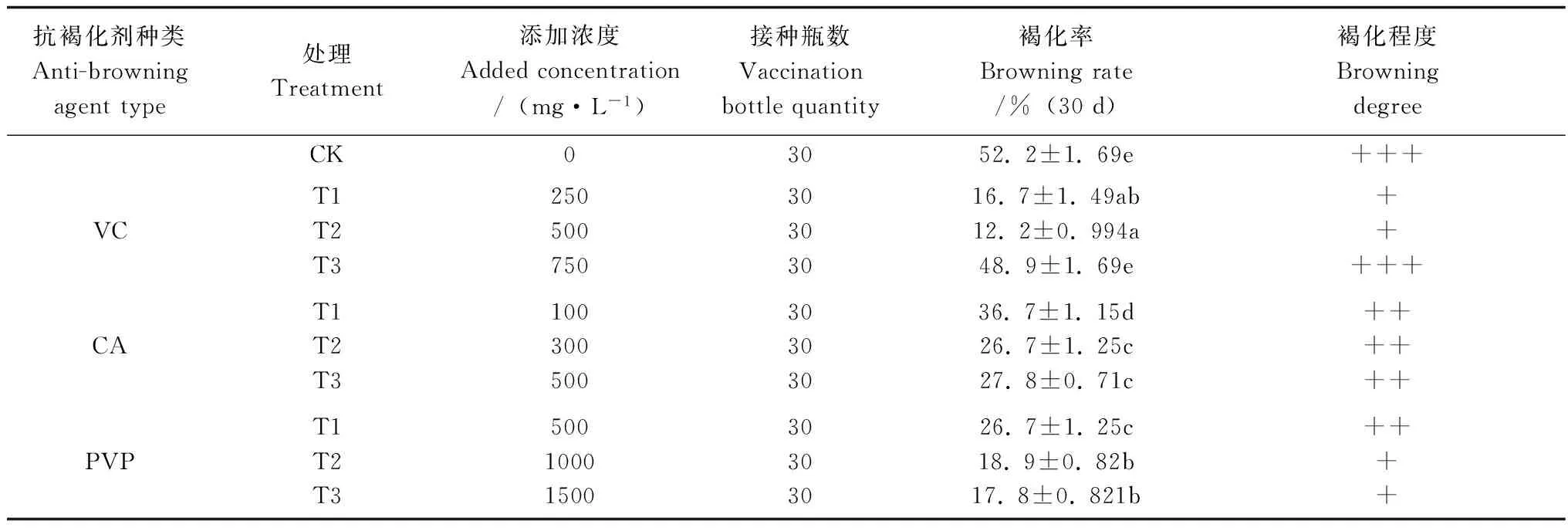
表1 不同浓度抗褐化剂处理对外植体褐化的影响
表中褐化率一栏数据为褐化率平均值±标准误,不同小写字母表示差异极显著(α=0.01)。
褐化程度分轻、中和重度三级,分别用“+”、“++”和“+++”表示。
Values represent the means ±SE,and different small letters within the column indicated significance atα=0.01 level.
Browning degree is categorized into light, moderate, and severe levels, represented by +”, “++”and “+++”, respectively.
2.2 VC处理对芽外植体中酚酸含量变化影响
不同浓度VC处理对天女木兰芽中咖啡酸含量变化影响见图1A。在培养第10~30 d,各处理咖啡酸含量均呈下降趋势,其中CK处理咖啡酸含量下降幅度高达66.4%,而T1、T2和T3分别下降43.4%、12.8%和66.7%,T2处理咖啡酸下降幅度最小,其次是T1处理,T3处理咖啡酸下降幅度最大,其下降幅度还略高于CK处理下降幅度;在培养初期第10 d时,T1和 T2处理与CK处理相比咖啡酸含量高出8.21%和15.56%,而T3处理咖啡酸含量比CK处理低28.3%。外植体中咖啡酸的下降幅度越大,说明咖啡酸氧化程度高。试验结果显示T2处理预防咖啡酸氧化效果最好,其次是T1处理,T3处理从结果看似乎是咖啡酸氧化加剧,但是其原因比较复杂,这一现象在后面讨论中进行。
图1B显示VC处理对绿原酸含量变化的影响。各处理绿原酸含量均呈下降趋势,第10~30 d,CK处理绿原酸含量下降70.9%,而T1、T2和T3处理绿原酸下降幅度分别为32.9%、24.5%和67.4%,其中T2处理下降幅度最小,其次是T1处理,T3处理下降幅度最大;在第10 d,CK处理绿原酸含量分别比T1和T2处理下降4.9%和7.6%,而与T3处理相比绿原酸含量还高16.7%;在第10~30 d,CK处理绿原酸含量一直低于T1和T2处理,但高于T3处理,绿原酸与咖啡酸含量变化具有相同规律。
图1C显示VC处理对对香豆酸含量变化的影响。在第10 ~30 d,对香豆酸含量整体呈下降趋势,其中CK处理对香豆酸含量下降仅为7.4%,远远低于咖啡酸和绿原酸CK处理66.4%和70.9%的下降幅度。T1、T2和T3处理对香豆酸含量下降幅度分别是7.4%、6.1%和13.8%,T1和T2处理与CK处理相差不大,而T3处理与CK处理相比下降幅度相对较大。
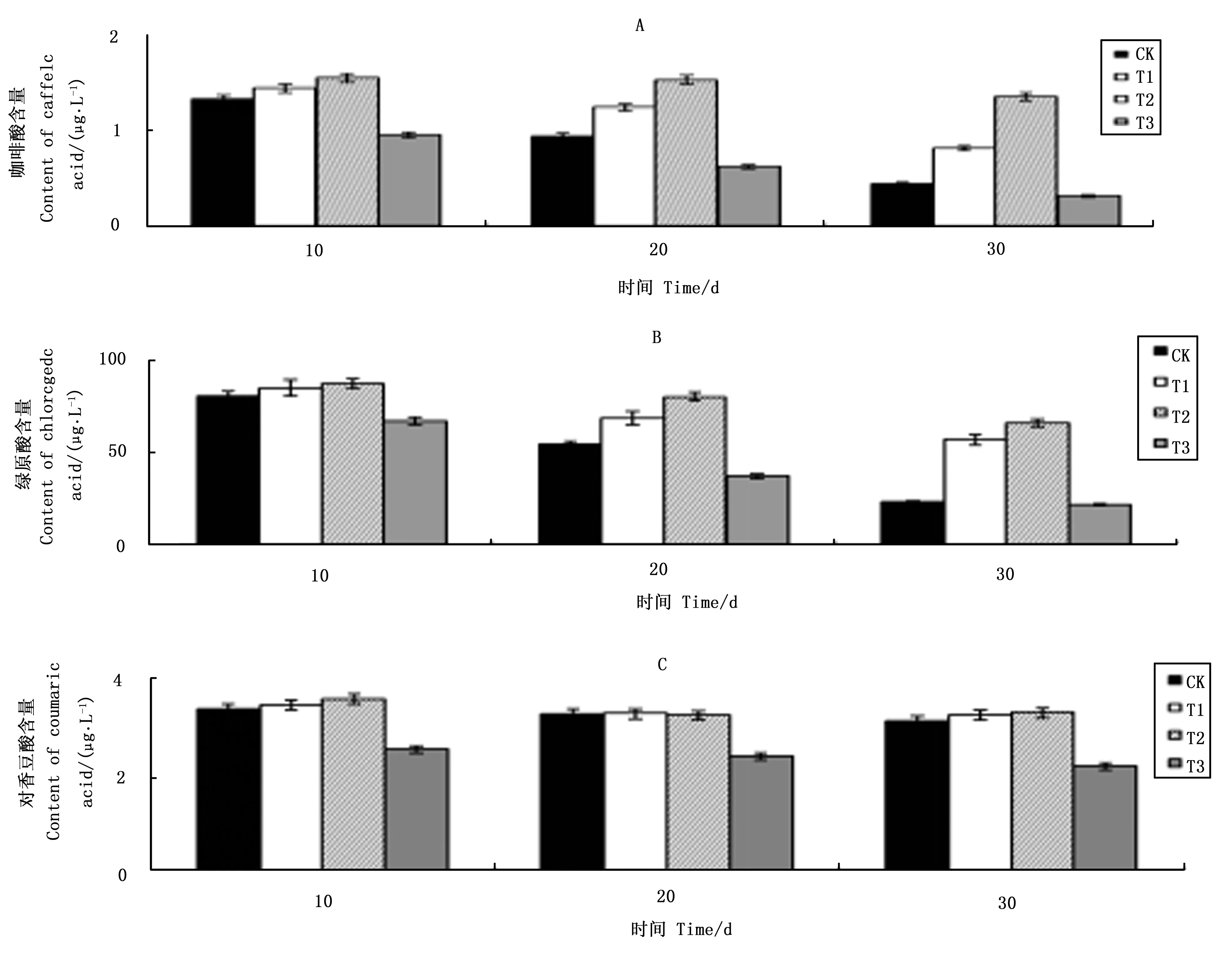
图1 不同浓度VC处理对芽中咖啡酸(A)、绿原酸(B)和对香豆酸(C)含量变化的影响 Fig.1 Effects of different VC levels on content changes of caffeic acid (A), chlorogenic acid (B), and p-coumaric acid (C) in buds
从图1(A、B和C)的试验结果可以看出,天女木兰外植体芽中咖啡酸和绿原酸化学性质非常活跃易被氧化。在培养初期,外植体中咖啡酸和绿原酸含量下降幅度较大,VC可以阻止二者含量大幅下降的趋势,即具有预防咖啡酸和绿原酸被氧化的功能。培养基中添加VC浓度在250~500 mg·L-1范围时,随着VC浓度增加预防酚酸氧化效果越好,当培养基中VC浓度达750 mg·L-1时,VC起到加速咖啡酸和绿原酸下跌作用,即失去了保护酚酸的功效。对香豆酸含量在芽组培过程中变化幅度不大,说明其较为稳定,不易被氧化。培养基中添加VC浓度250~500 mg·L-1时,对其含量变化无太大影响,但VC浓度达到750 mg·L-1时,对香豆酸含量亦会快速下降。
2.3 CA处理对芽外植体中酚酸含量变化影响
CA对咖啡酸含量变化影响见图2A,在第10~30 d,各处理咖啡酸含量整体均呈下降趋势,其中T2处理咖啡酸含量下降44.8%,下降幅度最小,其次是T3处理下降47.2%,T1处理下降幅度最大为63.1%。三处理咖啡酸含量下降幅度均低于CK处理66.4%下降幅度;在第10 d时,CK处理与T1、T2和T3处理相比,咖啡酸含量分别下降4.9%、6.3%和6.9%,至第20 d,下降幅度加大,分别为13.4%、43.0%、40.7%。
图2B显示CA对绿原酸含量变化的影响。绿原酸含量变化规律与咖啡酸很相似,整体呈现下降趋势。在第10~30 d,T1、T2和T3处理绿原酸含量下降幅度分别为50.5%、34.2%和36.2%,均低于CK处理 70.9%下降幅度;在第10 d时,CK处理绿原酸含量与T1、T2和T3处理相比分别低4.8%、6.5%和6.6%,至第20 d时下降幅度加大,分别低 30.8%,23.4%和 22.0%。
对香豆酸含量变化见图2C,在第10~30 d,各处理对香豆酸含量均小幅呈下降趋势, T1、T2和T3处理对香豆酸含量下降幅度分别为6.2%、8.1%和5.2%,与CK组7.4%的下降幅度相比,差别不大。

图2 不同浓度CA对咖啡酸(A)、绿原酸(B)和对香豆酸(C)含量变化的影响Fig.2 Effects of different CA levels on content changes of caffeic acid (A), chlorogenic acid (B), and p-coumaric acid (C) in buds
从图2(A、B和C图)可以得出,CA对咖啡酸和绿原酸具有显著的保护作用,在100~300 mg·L-1范围内随着CA浓度增加,二者含量下降幅度减小,即CA预防酚酸氧化能力增强;当CA浓度达到500 mg·L-1时,预防酚酸氧化效果并未增强。CA与VC均具有防止咖啡酸和绿原酸被氧化的功能,不同之处在于,高浓度VC会导致咖啡酸和绿原酸含量大幅下降,而CA则未出现此现象。在培养过程中对香豆酸含量变化幅度不大,CA对其保护作用不显著。
2.4 PVP对酚酸含量变化的影响
不同浓度PVP对咖啡酸含量变化的影响见图3A。 在第10~30 d,各处理咖啡酸含量均呈下降趋势, T1、T2和T3处理咖啡酸含量分别下降63.3%、59.1%和49.3%,均低于CK组66.4%的下降幅度;第10 d时,CK处理咖啡酸含量与T1、T2和T3处理相比变化幅度不大,变化在5%范围内,至20 d时,下降幅度分别为11.7%、19.6%和34.8%,下降幅度开始加大。
PVP对绿原酸含量变化影响见图3B,各处理绿原酸含量整体呈下降趋势,在第10~30 d,T1、T2和T3处理绿原酸含量下降幅度分别为60.7%、57.1%和55.2%,低于CK对照 66.4%的下降幅度;第10 d时,各处理处理绿原酸含量与CK处理相比相差不大,CK处理咖啡酸含量略高于T1和T2处理,低于T3处理,至第20 d时,CK组绿原酸含量与T1、T2和T3处理相比下降幅度加大,分别为26.0%、32.9%和35.9%。
PVP处理与对香豆酸含量变化关系见图3C,在培养第10~30d,各处理香豆酸含量均呈小幅下降趋势,T1、T2和T3处理对香豆酸含量下降幅度分别为5.6%,5.6%和5.3%,略低于CK处理7.4%的下降幅度,PVP处理对对香豆酸含量变化影响不大。
从图3(A、B和C)可以得出,PVP亦具有预防咖啡酸和绿原酸含量下降作用,即对外植体内咖啡酸和绿原酸具有保护功能,但是通过与VC和CA处理咖啡酸和绿原酸含量变化比较,PVP对咖啡酸和绿原酸的保护效果不如VC和CA处理。对香豆酸化学性质相对稳定,PVP处理与VC和CA处理对其含量变化影响不大。
图3 不同浓度PVP处理对咖啡酸(A)、绿原酸(B)和对香豆酸(C)含量变化的影响Fig.3 Effects of different PVP levels on content changes of caffeic acid (A), chlorogenic acid (B), and p-coumaric acid (C) in buds
3 结果与讨论
3.1 主要酚酸与外植体褐化之间关系
酚类物质是植物体内次生物质,其种类繁多,主要包括酚酸、黄酮、单宁和木质素。植物组培褐化现象产生经常由于不同种酚类物质造成,如板栗与蝴蝶兰褐化主要是由于单宁氧化引起[10-12],绿原酸是造成苹果、油橄榄和甜菜褐化的主要底物[13-15]。印芳等对蝴蝶兰研究发现蝴蝶兰褐化与总酚含量有关,其中绿原酸、咖啡酸、儿茶酚和对香豆酸等可能是褐化底物[16-17]。天女木兰组培褐机理研究尚未见报道,我们曾利用HPLC仪对天女木兰芽中咖啡酸、绿原酸、对香豆酸、没食子酸、儿茶素、表儿茶素、槲皮素、阿魏酸、香豆素和芦丁等十种酚酸进行了定性定量测定,仅检测到了对香豆酸、咖啡酸和绿原酸三种酚酸,其中对香豆酸含量最高,其次是咖啡酸,绿原酸含量最低。
综合本文研究结果分析,CK处理与抗褐化剂处理相比褐化率最高,而其外植体中咖啡酸和绿原酸下降幅度亦最大,说明二者被氧化程度高,外植体中大量咖啡酸和绿原酸被氧化成醌类物质导致其含量大幅下降,CK处理结果显示咖啡酸和绿原酸氧化与褐化率密切相关;另外,从抗褐化剂处理试验结果亦可以得出相同结论,抗褐化剂各处理外植体褐化率均低于CK处理,证明抗褐化剂对咖啡酸和绿原酸具有保护作用,具有预防酚酸氧化功能,在抗褐化剂理中VC(T3处理除外)处理褐化率最低,而其外植体在培养过程中咖啡酸和绿原酸的下降幅度最小,说明二种酚酸被氧化程度低,外植体褐化率与咖啡酸和绿原酸氧化程度呈正相关。试验结果表明,咖啡酸和绿原酸是天女木兰组培褐化底物,尽管在天女木兰芽外植体中对香豆酸含量高于咖啡酸和绿原酸,但是在组培期间,CK处理对香豆酸含量下降幅度仅为7.4%,抗褐化剂处理(VC T3处理除外)对其含量变化影响也不大,说明对香豆酸化学性质稳定不易被氧化,与外植体褐化关系不大,因此我们认为对香豆酸不是天女木兰褐化底物。
3.2 三种抗褐化剂抗褐化效果比较
植物中酚酸类物质由于具有活跃的羟基,其化学性质非常活跃。酚酸根据结构分为苯甲酸型和肉桂酸型两种类型,常见的苯甲酸型有没食子酸、香草酸、原儿茶素等,咖啡酸、芥子酸、阿魏酸属于肉桂酸型, Sroka[18]和RiceEvans[19]等人认为酚酸的活性与结构密切相关,羟基的数量和位置都会影响到酚酸活性,羟基越多越活跃,羟基数量相同时,取代位置不同活性不同,如果取代位置相同时,肉桂酸型活性强于苯甲酸型酚酸。咖啡酸和对香豆酸属于肉桂酸型酚酸,绿原酸是咖啡酸与奎宁酸的脂化物,所以它们的化学活性非常强易被氧化。
VC作为一种强抗氧化剂,因其具有较好抗褐化效果而被广泛使用,现有研究资料表明,人们使用VC作为抗褐化剂的方法性研究较多,而关于VC抗褐化机理研究报道相对较少。本试验结果发现,在组培期间,CK处理外植体中咖啡酸和绿原酸含量大幅下降,说明二者化学性质活跃容易被氧化。VC具有显著预防咖啡酸和绿原酸氧化的作用,培养基添加VC浓度不超过500 mg·L-1时,随着VC浓度增加抑制酚酸氧化效果增强,但是培养基中添加VC浓度超过500 mg·L-1会导致外植体中咖啡酸和绿原酸含量大幅下降,褐化现象加剧。VC抗褐化机理很复杂,它可以作为醌类物质还原剂,将醌类物质还原,同时又具有PPO抑制剂功能,螯合PPO的辅基铜离子起到抗褐化作用[20]。VC作为还原剂还原醌类物质时,其使用浓度非常重要,浓度低还原效果不显著,浓度过高时氧化形成的酮化合物与氨化合物发生非酶褐变使外植体褐变加重[21],本实验结果也证明该观点。所以,使用VC作为抗褐化剂要根据培养植物材料不同,选用不同浓度,因为不同植物材料酚类物质含量不同。
CA属于多酚氧化酶抑制剂,经常被用作抗褐化剂使用。从试验结果可以看出,CA对天女木兰外植体中的咖啡酸和绿原酸氧化具有一定的预防作用,培养基中添加浓度CA浓度不超过300 mg·L-1时,随着CA浓度的增加预防酚酸氧化效果越显著。与VC相比,无论是外植体褐化率还是预防酚酸氧化,CA均不如VC效果显著,刘均伟等对紫薯PPO活性的研究发现,VC对PPO活性的抑制作用强于CA[21];彭思佳等对荻外植体褐化研究结果显示,VC处理抑制外植体褐化效果好于CA处理[22],本试验结果他们的研究结论基本一致。
PVP是酚类物质吸附剂,可以用来吸附外植体释放的酚类物质,阻止酚类物质被氧化成醌类物质,从而达到预防外植体褐化的目的[23]。试验结果表明PVP对预防咖啡酸和绿原酸氧化亦具有一定效果,随着添加PVP浓度的增加,抑制酚酸氧化效果增强。在抑制酚酸氧化效果方面,三种抗褐化剂排序为VC(T3处理除外)效果最好,其次为CA,PVP排在最后;在控制外植体褐化率方面,VC处理(T3处理除外)褐化率最低,其次是PVP处理,CA处理褐化率最高。在外植体褐化率排序与控制酚酸氧化效果排序上CA和PVP的位置略有不同,其原因可能是PVP抗褐化机理与CA不同所致,PVP属于吸附剂,能吸附外植体由于切割释放的酚类物质,以及酚类物质氧化形成的醌类物质,从而达到预防褐化的目的,而CA主要通过抑制PPO氧化酶活性角度来达到抗褐化的目的,所以在防止酚酸氧化方面强于PVP。
VC、PVP和CA三种抗褐化剂在预防天女木兰外植体褐化均具有一定效果,综合比较VC抗褐化效果最好。培养基中添加抗褐化剂时还应考虑外植体细胞的生长、分裂和分化,培养基中添加抗褐化剂浓度应该控制在即具有显著抗褐化效果,又不影响外植体的生长、分裂和分化,所以在使用时尽量减小使用浓度。
4 结论
本文在培养基中添加三种类型抗褐化剂进行天女木兰芽外植体的培养,并定期取样,利用HPLC定量测定芽外植体中咖啡酸、绿原酸和对香豆酸含量的动态变化,初步确定天女木兰褐化底物是咖啡酸和绿原酸,尽管外植体中对香豆酸含量高于咖啡酸和绿原酸,但它并不是褐化底物。通过褐化率和三种酚酸的含量变化比较得出:VC处理外植体褐化率最低,其次是PVP,CA处理褐化率最高;VC在预防酚酸氧化方面也表现出良好效果,但是应注意使用浓度,使用浓度不易过高,PVP在预防酚酸氧化效果不如CA处理,但是在控制外植体褐化率方面强于CA处理,可能是其抗褐化机理与CA不同所致。
[1] Tang W,Newton RJ. Increase of polyphenol oxidase and decrease of polyarnines correlate with tissue browning in Virginia pine (PinusvirginianaMill.)[J]. Plant Science,2004,167 (3) : 621-628.
[2] 黄烈健,王 鸿. 林木植物组织培养及存在问题的研究进展[J]. 林业科学研究,2016,29(3): 464-470.
[3] Campos Vargas R,Nonogaki H,Suslow T,etal. Heat shock treatments delay the increase in wound-induced phenylalanine ammonia-lyase activity by altering its expression,not its induction in romaine lettuce (Lactucasativa) tissue[J]. Physiologia Plantarum,2005,123 (1) : 82-91.
[4] Peiser G,López-G lvez G,Cantwell M,etal. Phenylalanine ammonia lyase inhibitors control browning of cut lettuce[J].Postharvest Biology and Technology,1998,14 (2) :171-177
[5] Xu CJ,Sun XZ,Chen DY,etal. Cloning and characterization of peroxidase gene in Phalaenopsis[J].Pakistan Journal Botany,2011,43 (4) : 2161-2167.
[6] 杜凤国,刁少启,王 欢,等.天女木兰组织培养[J].东北林业大学学报,2006,34(2):42-43.
[7] 王 欢,杜凤国,张志翔,等.天女木兰组织培养的抗褐化研究[J]. 湖北农业科学,2012, 51(14) : 3107-3109.
[8] Rosa M, Alejandero B, Edurne C,etal.A validated solid-liquid extraction method for the HPLC determination of polyphenols in apple tissues Comparison with pressurised liquid extraction[J]. Talanta,2005(65): 654-662.
[9] 孙洪圳,吕海涛,柏素花,等.苹果树皮中 12 种酚类化合物的 HPLC 测定方法[J]. 果 树 学 报 2012,29(5): 929-935.
[10] 许传俊,李 玲,李 红,等. 蝴蝶兰褐变外植体的显微结构观察以及褐变成分的初步分析[J]. 园艺学报,2005,32(6) : 1111-1113.
[11] 谭汝芳,周文灵,许传俊,等. 儿茶素对蝴蝶兰叶片离体培养褐变发生的影响[J]. 北方园艺,2009,(3) : 65-68.
[12] 黄品湖,郭秀珠,叶茂宗,等. 板栗果肉褐变原因初探[J]. 植物生理学通讯,2001,37(5) : 413-414.
[13] Awad M A, Jager A.Flavonoid and chlorogenic acid concentrationsin skin of‘Jonagold’and‘Elstar’apples during and after regular and ultra low oxygen storage[J]. Postharvest Biology and Technology,2000,20(1) : 15-24.
[14] Ruigni E. In vitro propagation of some olive (OleaeuropaenL.)cultivars with different root ability and medium development using analytical data from developing shoots and embryos[J]. Scientia Horticulturae,1984,2(2) : 123-134.
[15] 吴永英,张喜林,高兴武.甜菜组织培养中外植体褐变影响因素的研究[J].中国甜菜糖业,2004,(1) : 17-20.
[16] 印 芳,葛 红,彭克勤,等. 蝴蝶兰组培褐变与酚酸类物质及相关酶活性的关系[J]. 中国农业科学,2008,41(7) : 2197-2203.
[17] 印 芳,葛 红,彭克勤,等. 酚类物质与蝴蝶兰褐变关系初探[J]. 园艺学报,2006,33(5) : 1137-1140.
[18] Sroka Z.,Cisowski W. Hydrogen peroxide scavenging,antioxidant and anti-radical activity of some phenolic acids[J]. Food and Chemical Toxicology,2003,41(6): 753-758.
[19] RiceEvans C.A.,Miller N.J.,Paganga G. Structure-antioxidant activity relationships of flavonoids and phenolic acids[J]. Free Radical Biology and Medicine,1996,21(3):417-417.
[20] 姜绍通, 罗志刚, 潘丽军, 等. 甘薯中多酚氧化酶活性的测定及褐变控制[J]. 食品科学, 2001, 22(3): 19-22.
[21] 刘军伟,胡志和 ,苏 莹. 紫薯中多酚氧化酶活性的研究及褐变控制[J]. 食品科学,2012,33(17): 207-211.
[22] 彭思佳,丁 力,刘清波,等. 抗褐化剂对荻外植体褐化和愈伤组织生长的影响[J].草原与草坪,2015,35(5):7-11.
[23] Babbar S,Gupta S.Induction of androgenesis and callus formation in vitro cultured anthers of a myrtaceous fruit tree (PsidiumguajiavaL.)[J]. Journal of Plant Research, 1986, 99: 75-83.
(责任编辑:张 研)
Effects of Browning Inhibitors on Bud Explants Browning and Phenolic Acids Oxidation ofMagnoliasieboldiiK. Koch
GAO Hong-bing , DU Feng-guo, WANG Huan
(The Provincial Key Laboratory on Forestry and Ecological Environment, Beihua University, Jilin 132013, Jilin, China)
[Objective]To identify the types of phenolic acids that result in bud explants browning ofMagnoliasieboldiiand determine the most effective anti-browning agent at an optimum concentration. [Method] Bud explants were cultured in B5 medium for 30 days. At the beginning, three kinds of anti-browning agents were added separately to the B5 medium. The browning rates were calculated and analyzed. Then the effects of the three inhibitors on anti-browning were compared on the basis of the browning rates. In addition, the content variations of caffeic acid, chlorogenic acid, and p-coumaric acid in the bud explants were measured with HPLC using samples regularly selected during tissue culturing. [Result] The results showed that the contents of caffeic acid and chlorogenic acid decreased sharply while the content of p-coumaric acid experienced a slight decrease, proving that caffeic acid and chlorogenic acid were more likely to be oxidized than p-coumaric acid. Moreover, the effects of the three inhibitors on anti-browning were sorted in a decreasing order of VC, PVP, and CA. Although PVP was inferior to CA with respect to controlling phenolic acid oxidation, its anti-browning effect was more efficient than CA. This result was explained by their different mechanisms for anti-browning. Lastly, the optimal concentration for VC was 500 mg·L-1, and a higher concentration would result in a greater browning rate of the bud explants. Respective optimal concentrations for PVP and CA were 1 000~1 500 mg·L-1and 300 mg·L-1. [Conclusion] The browning substrates in bud explants of M. sieboldii are caffeic acid and chlorogenic acid rather than p-coumaric acid. VC, PVP, and CA have distinguishable anti-browning mechanisms and the anti-browning effects of them will decrease gradually.
Magnoliasieboldii, explant, browning inhibitor, phenolic acid oxidation
10.13275/j.cnki.lykxyj.2017.03.023
2016-08-31
吉林省科技厅项目(20140101016JC);吉林省教育厅项目(吉教合字2014第172号)。
高红兵(1962—),教授,主要研究方向:植物组织培养与逆境生理。电话:18604498160,邮箱:gao-hongbing@163.com.
S763.7
A
1001-1498(2017)03-0525-08
