新型携载人胰岛素样生长因子-1纤维屏障膜的制备及其理化和生物性能
2017-06-19杨少华常语宸何苗苗吕晓琴余占海
杨少华, 常语宸, 何苗苗, 孙 睿, 吕晓琴, 余占海
(兰州大学 口腔医学院,甘肃 兰州 730000)
·研究论文·
新型携载人胰岛素样生长因子-1纤维屏障膜的制备及其理化和生物性能
杨少华, 常语宸, 何苗苗, 孙 睿, 吕晓琴, 余占海*
(兰州大学 口腔医学院,甘肃 兰州 730000)
通过同轴静电纺丝技术制备携载人胰岛素样生长因子-1(IGF-1)的纤维屏障膜(IGF-1/SF/PLLACL),其结构和性能经SEM, TEM和XRD表征。与非载药同轴静电纺丝纤维膜在表观形貌、理化性能、生物学性能和膜屏障功能等方面进行对比,研究了其在引导性骨组织再生中的可应用性。结果显示:纤维膜呈网状结构,IGF-1/SF/PLLACL形成芯壳双层结构;非载药纤维膜的接触角和机械强度均略高于载药组纤维,差异具有统计学意义(P<0.05);载药组与非载药组纤维膜的衍射趋势与聚左旋乳酸聚己内酯晶体相似,丝素蛋白和胰岛素样生长因子-1的加入并未改变其相组成。3 d内IGF-1突释现象严重,之后曲线逐渐平缓,呈缓释状态;载药组细胞活性和碱性磷酸酶活性较非载药组高,略低于IGF-1对照组,差异有统计学意义(P<0.05),而且两组纤维膜均具有阻挡成纤维细胞长入的屏障功能。
人胰岛素样生长因子; 同轴静电纺丝; 屏障膜; 引导性骨组织再生; 制备; 性能
随着急慢性牙周病患病率的上升,牙周支持组织缺损已成为口腔疾病治疗领域的重点和难点[1]。虽然骨组织具有一定的自愈能力,但软组织长上皮结合的形成阻碍了成骨相关细胞黏附和生长,不利于骨组织修复[2]。引导性骨组织再生技术(GBR)能通过屏障膜阻止软组织细胞的黏附,为骨组织生长提供有利空间,是解决这一问题的有效方法[3],膜的存在是GBR得以实现的基础[4]。相比同种异体或异种膜材料,以同轴静电纺丝技术制造的纳米级或亚微米级的纤维膜具有独特的芯壳微观结构,适宜的力学性能和良好的生物相容性[5]。
以天然生物大分子丝素蛋白(SF)为骨架的生物膜用于GBR,取得了较Bio-Gide胶原膜更好的骨修复效果。将SF与机械性能和降解性能良好的聚左旋乳酸聚己内酯(PLLACL)结合用于组织工程,以达到优势互补的效果,后者是由组织工程常用原材料[6-7]聚左旋乳酸(PLLA)和聚己内酯(PCL)开环聚合而成。
在骨代谢过程中,胰岛素样生长因子-1(IGF-1)发挥着重要作用[8],通过生长激素(GH)-IGF轴,IGF-1受到GH和相关结合蛋白的直接或间接作用,调节成骨相关细胞有丝分裂和骨骺生长板软骨细胞的合成代谢,刺激软骨细胞合成基质大分子,包括蛋白多糖和胶原,从而影响骨细胞分化,增加胶原的形成,促进骨原细胞增殖和骨钙素增加,进而影响骨组织的生长和吸收[9-10]。
本研究通过同轴静电纺丝技术制备携载人胰岛素样生长因子-1的纤维屏障膜(IGF-1/SF/PLLACL),其结构和性能经SEM, TEM和XRD表征。与非载药同轴静电纺丝纤维膜(SF/PLLACL)在表观形貌,理化性能,生物学性能和膜屏障功能等方面进行对比,研究了其在引导性骨组织再生中的可应用性。
1 实验部分
1.1 仪器与试剂
42BYB47-AG26型同轴静电纺丝仪;MIRA3和S-3400N型扫描电子显微镜;TECNAI G2型透射电子显微镜;XG-CAMB型接触角测量仪;TR316型万能拉伸试验机;D/Max 2400型X-ray衍射分析仪;ELx800型酶标仪;Echo Revolve FL型正倒置一体显微镜。
家蚕蚕茧,浙江嘉欣丝绸股份有限公司;PLLACL(50 ∶50),济南岱罡生物工程有限公司;重组人胰岛素样生长因子(rhIGF-1),以色列Prospec公司;IGF-1酶联免疫分析(ELISA)试剂盒,美国R&D公司;24孔细胞冠(cell-crown),美国Sigma-Aldrich公司;SD大鼠BMMSCs和牙周膜成纤维细胞,兰州大学口腔医院;其余所用试剂均为分析纯。
1.2 制备
(1) IGF-1/SF/PLLACL的制备
在煮沸的去离子水(3 L)中加入碳酸氢钠15 g和蚕茧30 g进行脱胶;烘干后以 LiBr溶液(100 mL)中可溶解15~20 g丝素的比例溶胶6 h;负压过滤后放入去离子水(5 L)中透析,每3 h更换新鲜去离子水;3 d后盛入容器中冻干48 h待用[11]。根据前期研究结果[12],将丝素蛋白0.24 g和PLLACL晶体0.56 g 以30 ∶70的质量比溶于六氟异丙醇(10 mL)中,震荡搅拌12 h,配成浓度为8%的壳层溶液。通过对比不同浓度IGF-1对成骨相关细胞的影响效果[13-14],结合纤维膜药物释放规律,将IGF-1溶于无菌磷酸盐缓冲溶液(PBS)配制浓度为10 μg·mL-1的IGF-1作为芯层溶液。利用同轴静电纺丝装置(内层针头内径0.8 mm,外径1.0 mm,外层针头内径1.8 mm),按照表1参数,制备IGF-1/SF/PLLACL和SF/PLLACL两组纤维膜,纺丝期间温度控制在22~25℃,湿度控制在40%~60%。最后将制备的纤维膜置于密闭容器中,使用25%戊二醛水溶液蒸汽交联72 h后置于真空干燥器中干燥1 w待用。
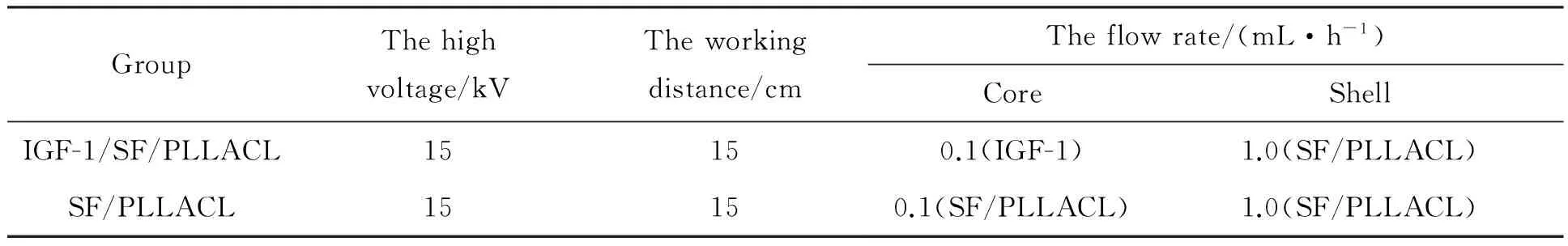
表1 同轴静电纺丝参数Table 1 The parameters forcoaxialelectrospinning
1.3 性能测试
(1) 纤维形貌与结构观察
制备过程中用铜网收集少量纤维丝,干燥后于120 kV的加速电压下使用透射电子显微镜观察纤维丝内部微观结构。待纤维膜制备完成后切取1.5 cm×1.5 cm的样品,喷金60 s,于15 kV加速电压下,使用扫描电子显微镜观察。使用分析软件Iamge J 1.49V统计SEM图像中不少于100根纤维,计算其纤维直径及纤维孔径。
(2) 纤维膜的理化性能检测
接触角(CA)是用来评价样品表面润湿性的手段之一。将去离子水25 μL滴到1.5 cm×1.5 cm的两组纤维膜样品上,室温下通过接触角测量仪记录数值,每组样品至少测试三次。
拉伸试验(TT)是通过万能材料试验机描绘应力-应变曲线来评估材料的机械性能。首先将交联后两组纤维膜裁剪成10 mm×50 mm的矩形样品并测量各样品两端及中心的厚度,然后将样品垂直固定于万能试验机上,以5 mm·min-1的拉伸速率测试,每组测试至少3个样品。
X射线衍射分析是利用X射线在晶体物质中的衍射效应进行物质结构分析。将1.0 cm×1.0 cm的两组纤维膜样品,冻干的丝素蛋白,PLLACL晶体依次固定于观察台上,使用X射线衍射分析仪以6°/min的扫描速率检测,检测范围为5°~60°。
(3) 纤维膜内IGF-1的释放
在培养皿中称取一定质量(约100 mg)的载有IGF-1的纤维膜,加入20 mL无菌PBS后置于恒温摇床(37 ℃, 5%CO2)中培养12 h, 1 d, 2 d, 3 d, 5 d, 7 d, 14 d, 28 d,每次吸取4 mL浸提体并置换等量无菌PBS。按照说明书使用IGF-1 Elisa试剂盒测试不同时间点浸提液中IGF-1的含量,并绘制IGF-1体外释放曲线。
(4) 细胞接种与活力检测
将约14 mm直径的两组纤维膜样品进行无菌处理后(紫外灯灭菌1 h,无水乙醇消毒30 min,无菌PBS冲洗后自然风干)固定在24孔板中,另设两组对照组,分别为IGF-1组和空白组,四组培养孔中分别接种2×104/孔SD大鼠BMMSCs,其中膜实验组和空白组均使用普通低糖DMEM培养液,IGF-1组使用含IGF-1(浓度为10 μg·mL-1)的DMEM培养液。培养7 d和14 d后,PBS冲洗并吸出孔中培养液,加入100 μL 4-甲基偶氮四唑蓝(MTT)溶液(5 mg·mL-1),孵育4 h后加入750 μL二甲基亚砜,室温震荡15 min后取出150 μL溶液转移至96孔板中,在490 nm波长下使用酶标仪检测样品吸光度。
(5) 碱性磷酸酶活性检测
以同样方法设立两组纤维膜组和两组对照组,2×104/孔BMMSCs接种于纤维膜样品和组织培养板上,培养7 d和14 d,无菌PBS冲洗并吸出培养液以去除悬浮细胞,然后用500 μL的0.1%Triton-X100裂解30 min,收集裂解液至离心管中冻存,在波长520 nm和562 nm处使用ALP测试盒和BCA蛋白浓度测定试剂盒计算样品ALP活性。
(6) 屏障功能检测
两组(直径约为3.0 cm)纤维膜经上述无菌处理后固定在细胞冠上,使膜悬空于24孔板中。先从冠外向孔内加入1 mL完全培养液,待膜浸湿后,再从冠内小心加入1 mL含有5×104个牙周膜成纤维细胞的细胞悬液。孵育72 h后,取出纤维膜,常规固定,脱水,冻干,喷金后,使用S-4800型SEM和Echo Revolve FL型显微镜观察纤维膜接种面和孔板底部细胞情况,评估膜屏障功能[15]。
(7) 统计学分析
所有数据以平均值±标准差的方式统计,使用SPSS 19.0分析数据,并采用单因素方差分析(one-way ANOVA)和Studengt-Newman-Keul(SNK)检验P<0.05被认为差异具有统计学意义。
2 结果与讨论
2.1 表征
(1) SEM和TEM
图1为两组纤维膜的SEM、 TEM和纤维直径分布图。

图1 两组纤维膜的SEM(a, b), TEM(c, d)和直 径分布图(e, f)*Figure 1 SEM(a, b) and TEM (c, d) images of comparison and diameter distribution (e, f)*(a, c, e)表示IGF-1/SF/PLLACL组, (b, d, f)表示SF/PLLACL组

图 2 IGF-1/SF/PLLACL(a)和SF/PLLACL(b)的接触角Figure 2 The contact angle results of IGF-1/SF/ PLLACL(a) and SF/PLLACL (b)
由图1可见,SEM(a,b)中两组纤维膜均表现出丝状或交叉网状结构,纤维表面光滑,连续,无粘连现象。纤维直径分布图(e,f)显示两组纤维膜内直径较均一,IGF-1/SF/PLLACL组直径为532±72 nm,孔隙大小为3.56±2.40 μm; SF/PLLACL组直径为564±64 nm,孔隙大小为3.15±2.10 μm。TEM结果(c,d)显示IGF-1/SF/PLLACL组纤维内形成芯层结构,且芯壳结构稳定,界限较清晰;SF/PLLACL组纤维内呈均匀结构,无芯壳结构形成。
(2) CA
纤维膜的表面润湿性是液体在固体表面铺展的能力或倾向性,通过测量液滴与材料平面所形成的角度计算评估的,由图2可以看出,IGF-1/SF/PLLACL接触角为123.8±0.63°, SF/PLLACL接触角为130.2±0.93°,均大于90°且后者大于前者,差异具有统计学意义(P<0.05)。疏水性的膜表面有利于降低软组织相关细胞的黏附,从而降低了屏障膜穿通的可能性,增加其屏障稳定性[16]。
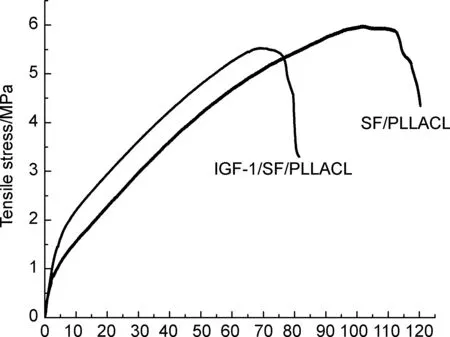
Tensile strain/%图3 IGF-1/SF/PLLACL和SF/PLLACL的应力- 应变曲线Figure 3 The stress-strain curves of IGF-1/SF /PLLACL and SF/PLLACL
(3) TT
纤维膜的应力-应变曲线如图3所示,两组纤维膜均先发生短暂的弹性形变后转为塑形形变,达到最大应力后断裂。详细参数如表2所示,SF/PLLACL组纤维的最大应力,弹性模量和最大断裂伸长率均大于IGF/SF/PLLACL组,差异具有统计学意义(P<0.05)。其原因可能是具有良好机械强度的PLLACL均匀分布在前者纤维中[17],而后者内部的中空结构降低了材料的抗拉伸性能。
(4) XRD
两组纤维膜及其原材料的XRD图如图4所示,水平方向上,两组纤维膜的较强衍射峰均集中在2θ约为16.7°, 18.9°, 22.4°处,这与PLLACL晶体[18]的衍射趋势基本相同。衍射峰16.7°主要是由PLLA链段造成的,衍射峰18.9°和22.4°则主要源自PCL的链段[19],而SF的衍射曲线呈宽大波浪形波峰,无明显衍射高尖峰,与其他研究一致[18,20]。因此SF和IGF-1的加入对纤维膜的相组成未造成明显改变。

表2 两组纤维膜机械性能参数比较Table 2 Mechanical performance parameters of the fibrous mats
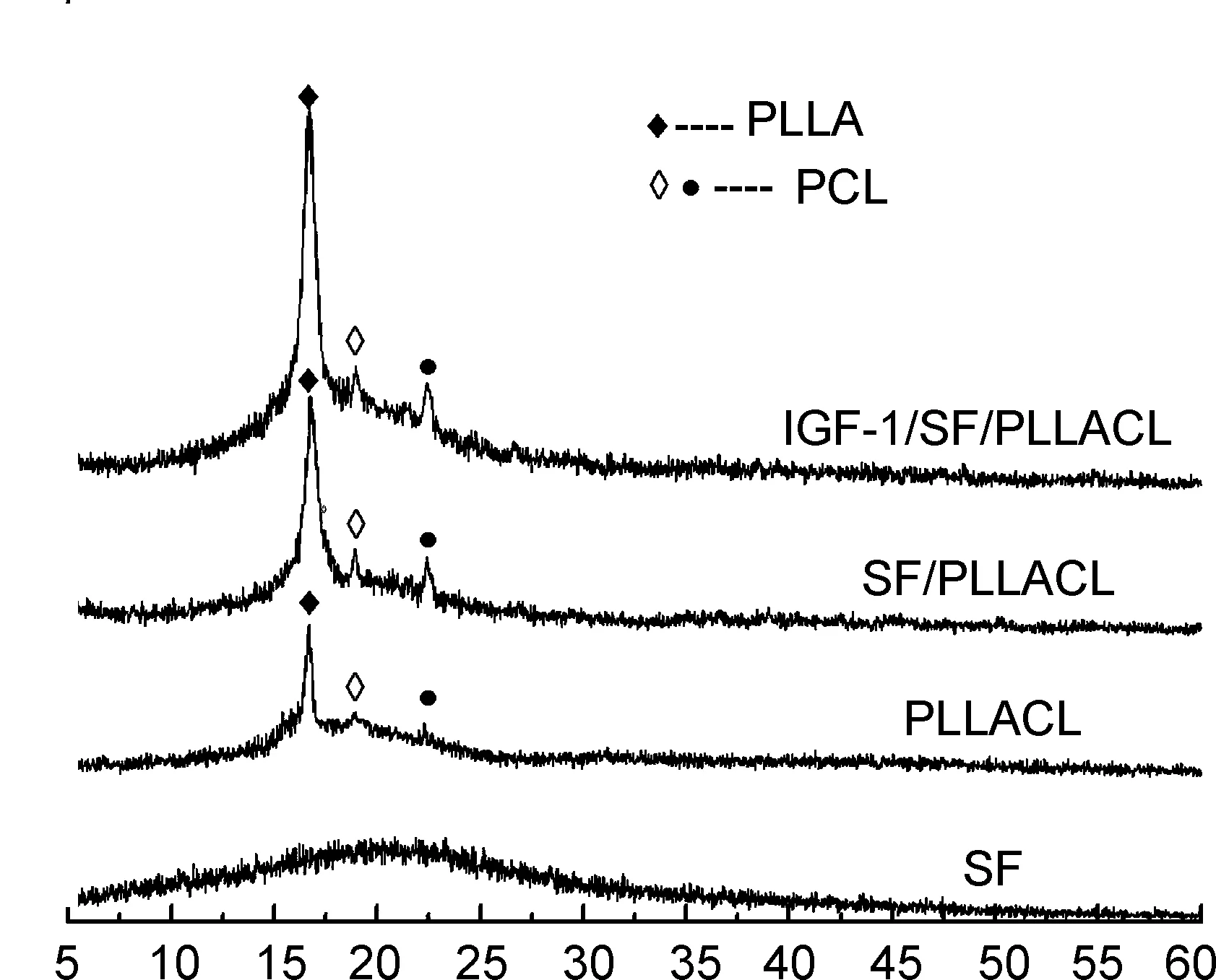
2θ/(°)图4 两组纤维膜及其原材料的XRD图Figure 4 X-ray diffraction patterns of two fiber membranes and their raw materials
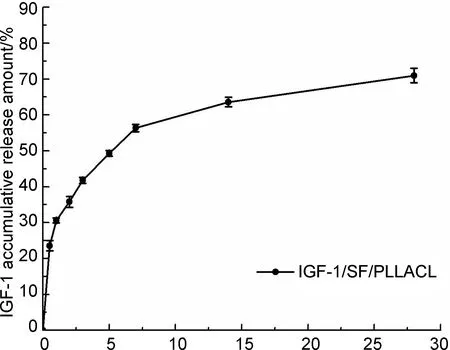
Time/d图 5 28 d内IGF-1/SF/PLLACL中IGF-1的释放曲线Figure 5 IGF-1 release profile in IGF-1/SF /PLLACL over a 28 day period
2.2 IGF-1的释放曲线
IGF-1/SF/PLLACL内IGF-1的体外释放情况如图5所示,药物突释阶段主要集中在前5 d,以12 h最为严重,达到23.56±1.43%, 5 d后释放曲线逐渐变缓,进入药物缓释阶段,直至第28 d,IGF-1的累积释放百分比为70.97±2.02%。从释药曲线的趋势推测28 d后IGF-1仍能缓慢持续的释放,而造成芯层药物缓释的原因与壳层结构的包绕,有效阻止芯层溶液的突释有关。
2.3 细胞活力检测
图6为细胞接种14 d的MTT结果。如图6所示,7 d时纤维膜组和对照组的BMMSCs数量均随时间增长而增长,IGF-1组明显大于两组纤维膜组和空白对照组,说明材料具有良好的生物相容性,而IGF-1能有效地促进细胞黏附和繁殖;14 d时,IGF-1/SF/PLLACL组增长较快,而SF/PLLACL和空白对照组仍处于较低水平,后者明显低于前者,差异具有统计学意义(P<0.05),这可能与7 d以后IGF-1/SF/PLLACL组仍能缓慢释放IGF-1刺激细胞生长有关。
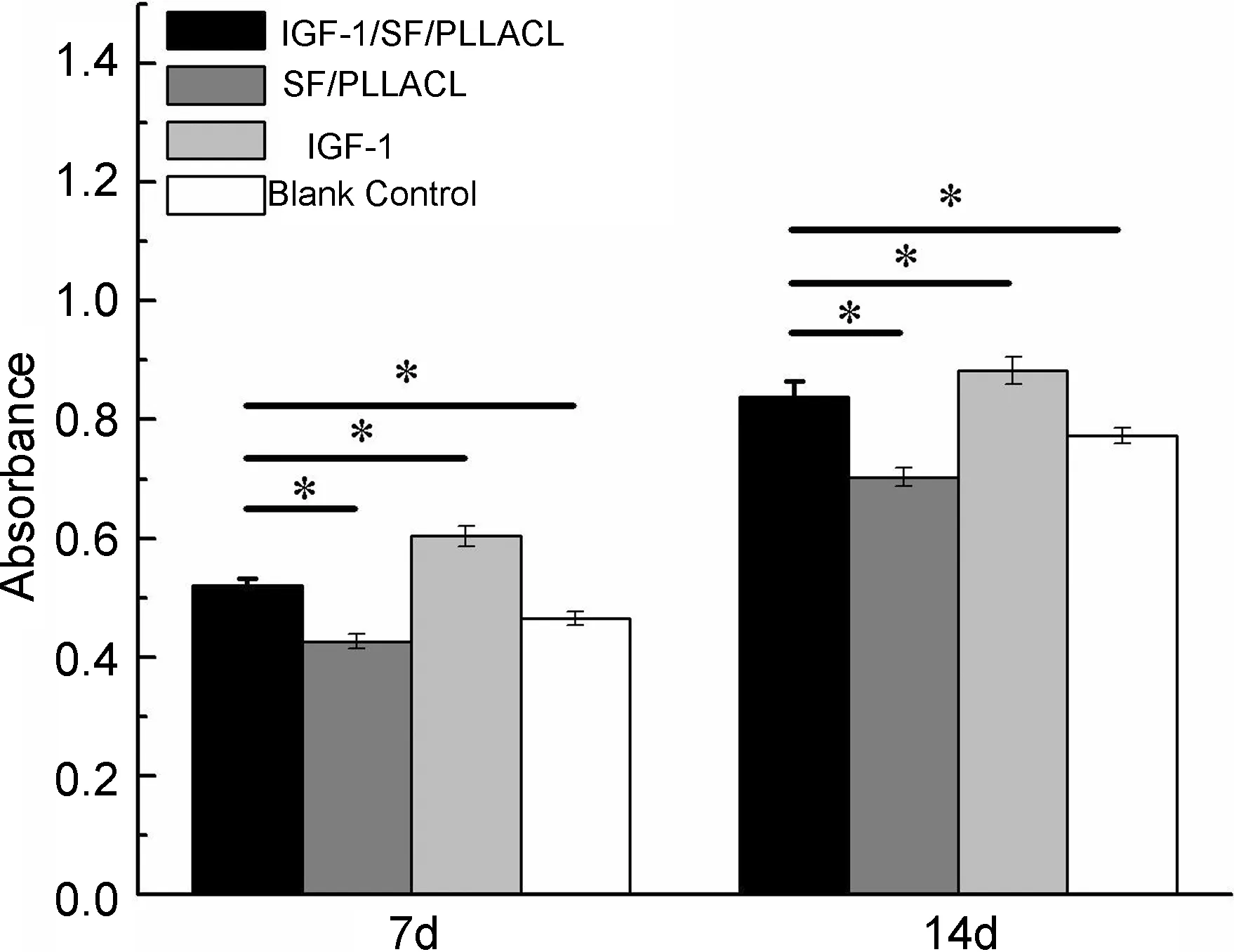
Time/d图 6 14 d内纤维膜组与对照组细胞活性的比较*Figure 6 Comparison of cell viability between two fibrous membranes and two control groups within 14 days*表示P<0.05,差异有统计学意义。
2.4 碱性磷酸酶检测
ALP活性可在一定程度上反映成骨相关细胞的分化情况,是评价早期成骨的有效方法之一。图7为14 d内纤维膜组与对照组ALP活性的比较图。如图7所示,7 d和14 d内各样品中ALP活性呈上升趋势,IGF-1/SF/PLLACL组明显大于SF/PLLACL组和空白对照组,而低于IGF-1组,差异具有统计学意义(p<0.05),这与细胞换液后减少了IGF-1的浓度,降低了IGF-1刺激细胞成骨分化的作用有关。
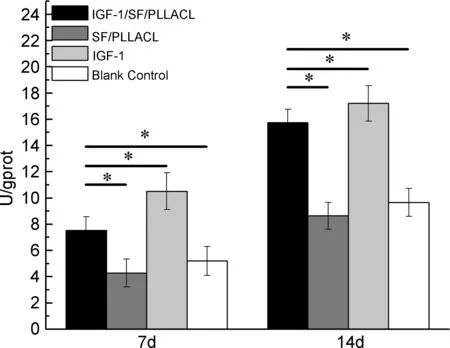
Time/d图7 14 d内纤维膜组与对照组ALP活性的比较*Figure 7 The ALP activities of two fibrous membranes and two control groups within 14 days*表示P<0.05,差异有统计学意义。
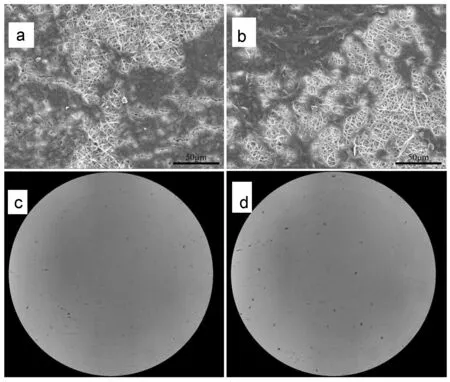
图8 IGF-1/SF/PLLACL(a, c)和SF/PLLACL(b, d) 细胞接种面SEM图与孔板底部显微镜图Figure 8 SEM images of cell seeded surface and plate bottom micrograph of IGF-1/SF/PLLACL(a, c) and SF/ PLLACL(b, d)
2.5 膜屏障功能
图8为牙周膜成纤维细胞接种后,细胞接种面SEM图与孔板底面显微镜图。由图8(a, b)可见,牙周膜成纤维细胞均可以有效地黏附在两组纤维膜表面,细胞与细胞或细胞与纤维粘连,生长状态良好,与MTT结果一致佐证了纤维膜的良好生物相容性。而在图8(c,d)中仅见极少量牙周膜成纤维细胞结构和少量杂质,提示纤维膜阻止了大部分细胞的穿通,这可能是因为纤维膜内的孔径(分别为3.56±2.40 μm和3.15±2.10 μm)明显小于成纤维细胞的直径(约10~15 μm)[21],从而具备良好的屏障功能,有效阻止牙周膜成纤维细胞的穿通和长入。
通过同轴静电纺丝技术制备携载人胰岛素样生长因子-1的SF/PLLACL纤维屏障膜,与非载药同轴静电纺丝纤维膜SF/PLLACL在表观形貌,理化性能,生物学性能和膜屏障功能等方面进行对比,研究了其在引导性骨组织再生中的可应用性。结果显示:纤维膜呈网状结构,IGF-1/SF/PLLACL形成芯壳双层结构;非载药纤维膜的接触角和机械强度均略高于载药组纤维,差异具有统计学意义(P<0.05);载药组与非载药组纤维膜的衍射趋势与聚左旋乳酸聚己内酯晶体相似,丝素蛋白和胰岛素样生长因子-1的加入未改变其相组成。IGF-1/SF/PLLACL能够有效地满足GBR生物膜的屏障要求,同时其内部缓释的IGF-1能够有效地促进大鼠BMMSCs的增殖和早期成骨分化,有望作为新型屏障膜材料应用于GBR技术中。
[1] 赵静仁,释栋,张立,等. 牙周专科门诊34677例患者的疾病种类及严重程度分析[J].中华口腔医学杂志,2016,51(1):25-29.
[2] Lee Y J, Lee J H, Cho H J,etal. Electrospun fibers immobilized with bone forming peptide-1 derived from BMP7 for guided bone regeneration[J].Biomaterials,2013,34(21):5059-5069.
[3] Liu J, Kerns D G. Mechanisms of guided bone regeneration: A review[J].Open Dentistry Journal,2014,8(1):56-65.
[4] Pountos I, Panteli M, Jones E,etal. How the induced membrane contributes to bone repair:A scientific-based analysis[J].Techniques in Orthopaedics,2016,31(1):9-13.
[5] Wang X, Ding B, Li B. Biomimetic electrospunnanofibrous structures for tissue engineering[J].Materials today,2013,16(6):229-241.
[6] Haghjooy J S, Anari J, Zargar K A,etal.Invitrohemocompatibility and cytocompatibility of a three-layered vascular scaffold fabricated by sequential electrospinning of PCL, collagen, and PLLA nanofibers[J].Journal of Biomaterials Applications,2016,31(3):438-449.
[7] Qi H, Ye Z, Ren H,etal. Bioactivity assessment of PLLA/PCL/HAP electrospunnanofibrous scaffolds for bone tissue engineering[J].Life Sciences,2016,148:139-144.
[8] Crane J L, Cao X. Function of matrix IGF-1 in coupling bone resorption and formation[J].Journal of molecular medicine,2014,92(2):107-115.
[9] Locatelli V, Bianchi V E. Effect of GH/IGF-1 on bone metabolism and osteoporsosis[J].International journal of endocrinology,2014,2014:235060.
[10] Govoni K E. Insulin-like growth factor-I molecular pathways in osteoblasts:Potential targets for pharmacological manipulation[J]. Current Molecular Pharmacology,2012,5(2):143-152.
[11] Kuihua Z, Chunyang W, Cunyi F,etal. Aligned SF/P(LLA-CL)-blended nanofibers encapsulating nerve growth factor for peripheral nerve regeneration[J]. Journal of Biomedical Materials Research Part A,2014,102(8):2680-2691.
[12] 刘琪,张忠芮,殷丽华,等. SF/COL/PLCL 和 SF/COL/PLLA 静电纺丝三维纳米纤维支架材料的性能研究[J]. 功能材料,2014,45(3): 141-144.
[13] 徐萍,张克勤,刘超,等. 重组人胰岛素样生长因子 I 对成骨细胞的影响[J]. 中国组织工程研究与临床康复,2011,15(11):1901-1904.
[14] 魏波,布林,白乙,等. 重组胰岛素生长因子 1 对成骨细胞增殖和分化的影响: 量效与时效作用[J]. 中国临床康复,2005,9(22):84-86.
[15] Xue J, Min H, Niu Y,etal. Preparation andinvivoefficient anti-infection property of GTR/GBR implant made by metronidazole loaded electrospunpolycaprolactonenanofibermembrane[J].International Journal of Pharmaceutics,2014,475(1-2):566-577.
[16] Lee J B, Ko Y G, Cho D,etal. Modification of PLGA nanofibrous mats by electron beam irradiation for soft tissue regeneration[J].Journal of Nanomaterials,2015,16(1):136.
[17] Basu A, Haim-Zada M, Domb A J. Biodegradable inflatable balloons for tissue separation[J].Biomaterials,2016,105:109-116.
[18] Yin L, Yang S, He M,etal. Physicochemical and biological characteristics of BMP-2/IGF-1-loaded three-dimensional coaxial electrospun fibrous membranes for bone defect repair[J].Journal of Materials Science:Materials in Medicine,2017, 28(6):94.
[19] Lian Y, Zhan J C, Zhang K H,etal. Fabrication and characterization of curcumin-loaded silk fibroin/P(LLA-CL) nanofibrousscaffold[J].Frontiers of Materials Science,2014,8(4):354-362.
[20] Moraes M A D, Nogueira G M, Weska R F,etal. Preparation and characterization of insoluble silkfibroin/chitosan blend films[J].Polymers,2010,2(4):719-727.
[21] Norman J J, Desai T A. Control of cellular organization in three dimensions using a microfabricatedpolydimethylsiloxane-collagen composite tissue scaffold[J].Tissue Engineering,2005,11(3-4):378-386.
The Physicochemical and Biological Properties of Fabricated Novel Insulin-like Growth Factor-1 Loaded Fiber Barrier Membrane
YANG Shao-hua, CHANG Yu-chen, HE Miao-miao,SUN Rui, LÜ Xiao-qin, YU Zhan-hai*
(School of Stomatology, Lanzhou University, Lanzhou 730000, China)
The fibrous barrier membrane(IGF-1/SF/PLLACL) with the human insulin-like growth factor-1(IGF-I) were synthesized by coaxial electrospinning. The structures and properties were characterized by SEM, TEM and XRD. To evaluate its applicability in guided bone regeneration, drug loaded membrane was compared with the non-drug loaded coaxial electrospun fiber membrane in the aspect of morphology, physicochemical properties, biological properties and barrier function. The results showed that the fibrous membrane had reticular structure and IGF-1/SF/PLLACL formed a core-shell double layer structure. The contact angle and mechanical strength of the non-drug loaded fiber membrane was slightly higher than those of the drug loaded group, and the difference was statistically significant(P<0.05). The X-ray diffraction trend of fibrous membrane in drug-loaded group and non-drug-loaded group was similar to that of PLLACL crystal, and the addition of silk fibroin and insulin-like growth factor-1 did not change their phase composition. The burst release of IGF-1 was severe in 3 days, then the curve was gradual and tuned sustained release. The cell activity and alkaline phosphatase in the drug loaded group was much higher than that of the non-drug-loaded group and the IGF-1 control group(P<0.05), and both of the membranes had the barrier function to block the growth of fibroblasts.
human insulin-like growth factor-1; coaxial electrospinning; barrier membrane; guided bone regeneration; preparation; property
2016-12-26;
2017-03-27
兰州市人才创新创业项目(2014-RC-79)
杨少华(1988-),男,汉族,河南郑州人,硕士研究生,主要从事生物材料的研究。E-mail: zzyangshaohua@163.com
余占海,博士,教授, Tel.0931-8915062, E-mail: yuzhanhai@lzu.edu.cn
O63; R318.08
A
10.15952/j.cnki.cjsc.1005-1511.2017.06.16328
