含萘三氮唑甲烷骨架的硫代乙酸类尿酸转运体1(URAT1)抑制剂的合成及其构效关系
2017-06-19谢亚非刘长鹰汤立达徐为人赵桂龙
辛 晓, 刘 巍, 谢亚非, 刘长鹰, 汤立达, 徐为人*, 赵桂龙*
(1. 天津中医药大学 研究生院, 天津 300193; 2. 天津药物研究院 天津市新药设计与发现重点实验室, 天津 300193)
·研究论文·
含萘三氮唑甲烷骨架的硫代乙酸类尿酸转运体1(URAT1)抑制剂的合成及其构效关系
辛 晓1,2, 刘 巍2, 谢亚非2, 刘长鹰2, 汤立达2, 徐为人1,2*, 赵桂龙2*
(1. 天津中医药大学 研究生院, 天津 300193; 2. 天津药物研究院 天津市新药设计与发现重点实验室, 天津 300193)
分别以1-溴萘和酮或1-萘甲醛及有机金属试剂为原料,经12步反应合成了8个含萘三氮唑甲烷骨架的硫代乙酸类尿酸转运体1(URAT1)抑制剂(1h~1o),其结构经1H NMR,13C NMR和MS(ESI)表征。体外活性测试结果显示:对URAT1的抑制活性最强的是1k,是阳性对照药lesinurad的133倍[IC50=0.054 μmol·L-1(1k), 7.18 μmol·L-1(lesinurad)]。
1-溴萘; 1-萘甲醛; 痛风; 高尿酸血症; 尿酸转运体1(URAT1); 合成; lesinurad; 构效关系
痛风是困扰人类最古老的疾病之一[1],是由于尿酸单钠盐(MSU)在关节和关节周围的组织等部位沉积引起的,是最常见的类风性关节炎。MSU形成和沉积的前提是血尿酸(sUA)水平高于尿酸在血液中的溶解度饱和点(6.8 mg·dL-1, 404 μmol·L-1)[2-3],即高尿酸血症。在最近几十年里痛风和高尿酸血症的患病率呈现上升趋势[4],已经成为影响人们健康和生活质量的重要代谢性疾病之一[5]。尿酸是饮食和内源性来源的嘌呤代谢的最终产物[6]。高尿酸血症通常是由于尿酸产生过多和/或尿酸排泄减少引起的,而90%的高尿酸血症都是由于尿酸排泄减少引起的[7],因此通过排泄尿酸的途径来降低sUA是一条非常有前景的降尿酸治疗(urate-lowering therapy, ULT)的途径[8]。
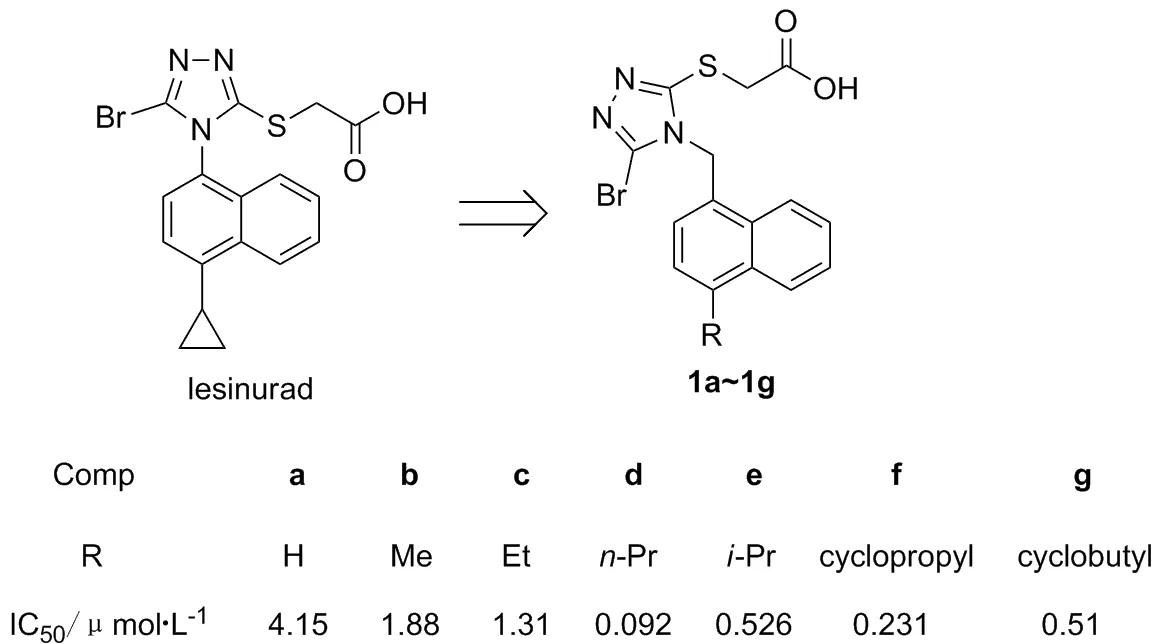
Chart 1
大多数尿酸是通过肾脏排泄的[1],尿酸盐在肾小球被滤过后在肾近端小管又会被重吸收,这个重吸收过程主要是通过尿酸转运体1 (uric acid transporter 1, URAT1)进行的。URAT1于2002年首次被确认,位于肾脏的近曲小管的表皮细胞上,后来经研究发现目前市场上的许多促进尿酸排泄的药物都是URAT1抑制剂[9],但是这些药物存在较为严重的副作用,比如苯溴马隆有严重的肝毒性,在欧洲和美国等是被禁用的[10]。由Ardea Biosciences研制的新型URAT1抑制剂lesinurad已于2015年底被FDA批准上市[11],该公司开发的第二代URAT1抑制剂verinurad具有药效更强、选择性更好的特点,目前处于II期临床研究。
本课题组在前期工作中对lesinurad的分子结构做了很多衍生研究,发现了一种含萘三氮唑甲烷骨架的硫代乙酸类URAT1抑制剂(1a~1g),该类抑制剂普遍具有比母体结构lesinurad更强的活性,显示了萘三氮唑甲烷骨架是一类设计URAT1抑制剂非常有前景的骨架(Chart 1)[12-13]。深入的构效关系分析发现,URAT1的抑制活性基本上呈现出随着分子中萘环上4-位烷基/环烷基R的体积增大而增强的趋势:在R=
H→n-Pr的范围内遵循这一规律,且在n-Pr时达最强(1d>1c>1b>1a);尽管在R=i-Pr、环丙基和环丁基时活性比n-Pr略微减弱,但是IC50仍然维持在1 μmol·L-1以下,因此继续增加R的多样性来探索该位置的构效关系具有重要的意义。
本文在上述工作的基础上,分别以1-溴萘(4)和酮(5d~5h)或1-萘甲醛(2)及有机金属试剂(3a~3c)为原料,对R的构效关系做了进一步的探索,设计、合成并测试了8个含萘三氮唑甲烷骨架的硫代乙酸类尿酸转运体1(URAT1)抑制剂(1h~1o, Scheme 1),其结构经1H NMR,13C NMR和MS(ESI)表征。发现了一个比1d更强的URAT1抑制剂1k [IC50=0.054 μmol·L-1(1k), 0.092 μmol·L-1(1d)],并系统地阐述了该位置的构效关系。
1 实验部分
1.1 仪器与试剂
RY-2型显微熔点仪(温度未校正);Bruker AV 400型核磁共振仪(DMSO-d6为溶剂,TMS为内标); Thermo Finnigan LCQ Advantage MAX型质谱仪; Perkin Elmer Tri-Carb 2910 TR型放射性液体闪烁仪。
THF以二苯甲酮作指示剂在金属钠存在下在N2中蒸馏获得;其余所用试剂均为分析纯或化学纯。
1.2 合成
(1) 1-(萘-1-基)烷基醇(6a~6c)的合成通法
在干燥的三口圆底烧瓶中加入2 49.98 g(320 mmol)和THF 500 mL,置换氮气,冷却至0 ℃,缓慢滴加格氏试剂(3a~3c) 384 mmol,滴毕,升至室温反应30 min。搅拌下将反应液缓慢倾至冰水(2 L)中,用CH2Cl2(3×300 mL)萃取,合并有机相,用饱和食盐水(2×300 mL)洗涤,经无水Na2SO4干燥,蒸除溶剂,残余物经硅胶柱层析(洗脱剂:A=乙酸乙酯/石油醚=1/10,V/V)纯化得化合物6a~6c。
Scheme 1
1-(萘-1-基)丁醇(6a): 无色油状液体46.15 g,产率72%;1H NMRδ: 8.13(d,J=8.0 Hz, 1H), 7.92~7.89(m, 1H), 7.78(d,J=8.0 Hz, 1H), 7.61(d,J=7.2 Hz, 1H), 7.53~7.45(m, 3H), 5.29~5.24(m, 2H), 1.74~1.66(m, 2H), 1.46~1.38(m, 2H), 0.88(t,J=7.4 Hz, 3H)。
1-(萘-1-基)戊醇(6b): 白色固体57.61 g,产率84%, m.p.65.5~67 ℃;1H NMRδ: 8.13(d,J=8.0 Hz, 1H), 7.92~7.89(m, 1H), 7.78(d,J=8.0 Hz, 1H), 7.61(d,J=6.4 Hz, 1H), 7.53~7.45(m, 3H), 5.28~5.25(m, 2H), 1.77~1.67(m, 2H), 1.41~1.24(m, 4H), 0.83(t,J=7.2 Hz, 3H)。
1-(萘-1-基)己醇(6c): 无色油状液体56.99 g,产率78%;1H NMRδ: 8.12(d,J=8.0 Hz, 1H), 7.91~7.89(m, 1H), 7.78(d,J=8.0 Hz, 1H), 7.61(d,J=6.8 Hz, 1H), 7.53~7.45(m, 3H), 5.28~5.24(m, 2H), 1.77~1.66(m, 2H), 1.44~1.34(m, 2H), 1.30~1.20(m, 4H), 0.82(t,J=6.8 Hz, 3H)。
(2) (萘-1-基)烷基/环烷基醇(6d~6h)的合成通法
在干燥的三口圆底烧瓶中加入1-溴萘(4) 49.70 g(240 mmol)和THF 746 mL,氮气置换,冷却至-78 ℃,缓慢滴加1.6 mol·L-1n-BuLi的正己烷溶液165.0 mL(264 mmol),滴毕,于-78 ℃反应30 min;滴加烷基酮(5d~5h) 240 mmol,滴毕,升至室温反应30 min。搅拌下反应液缓慢倾至冰水(3 L)中,用CH2Cl2(3×300 mL)萃取,合并有机相,用饱和食盐水(2×300 mL)洗涤,经无水Na2SO4干燥,蒸除溶剂,残余物经硅胶柱层析(洗脱剂:石油醚)纯化得化合物6d~6h。
3-(萘-1-基)-3-戊醇(6d): 无色油状液体48.35 g,产率94%;1H NMRδ: 8.66~8.64(m, 1H), 7.89~7.87(m, 1H), 7.76(d,J=8.0 Hz, 1H), 7.63(d,J=7.2 Hz, 1H), 7.45~7.41(m, 3H), 4.81(s, 1H), 2.18~2.10(m, 2H), 2.03~1.94(m, 2H), 0.63(t,J=7.4 Hz, 6H)。
1-(萘-1-基)环戊醇(6e): 白色固体38.21 g,产率75%, m.p.77 ℃;1H NMRδ: 8.64~8.62(m, 1H), 7.89~7.87(m, 1H), 7.78(d,J=8.4 Hz, 1H), 7.58(d,J=7.6 Hz, 1H), 7.50~7.43(m, 2H), 7.40(t,J=7.8 Hz, 1H), 5.01(s, 1H), 2.21~2.08(m, 4H), 1.97~1.87(m, 2H), 1.77~1.68(m, 2H)。
1-(萘-1-基)环己醇(6f): 无色油状液体51.06 g,产率80%;1H NMRδ: 8.98~8.96(m, 1H), 7.89~7.86(m, 1H), 7.77(d,J=8.0 Hz, 1H), 7.56(d,J=7.2 Hz, 1H), 7.47~7.39(m, 3H), 4.94(s, 1H), 2.14~2.11(m, 2H), 1.96~1.83(m, 4H), 1.70~1.67(m, 1H), 1.57~1.54(m, 2H), 1.32~1.24(m, 1H)。
1-(萘-1-基)环庚醇(6g): 白色固体40.96 g,产率71%, m.p.29~29.5 ℃;1H NMRδ: 8.87~8.85(m, 1H), 7.88~7.86(m, 1H), 7.75(d,J=8.0 Hz, 1H), 7.58(d,J=7.2 Hz, 1H), 7.48~7.38(m, 3H), 5.02(s, 1H), 2.29~2.23(m, 2H), 2.12~2.07(m, 2H), 1.92~1.83(m, 2H), 1.69~1.64(m, 2H), 1.62~1.56(m, 2H), 1.53~1.47(m, 2H)。
1-(萘-1-基)环辛醇(6h): 白色固体48.23 g,产率79%, m.p.94~95 ℃;1H NMRδ: 9.05~9.02(m, 1H), 7.88~7.86(m, 1H), 7.76(d,J=8.0 Hz, 1H), 7.56(d,J=7.2 Hz, 1H), 7.47~7.38(m, 3H), 4.98(s, 1H), 2.42~2.36(m, 2H), 2.03~1.98(m, 2H), 1.83~1.78(m, 2H), 1.60~1.58(m, 6H), 1.36~1.31(m, 2H)。
(3) (萘-1-基)烯烃(7a~7h)的合成通法
在圆底烧瓶中加入6a~6h 160 mmol和20倍体积(w/v)的2%H2SO4水溶液,升温至回流(内温约100 ℃),反应12 h(TLC检测);冷却至室温,搅拌下将反应液倾至冰水(500 mL)中,用CH2Cl2(3×300 mL)萃取,合并有机相,用饱和食盐水(2×300 mL)洗涤,经无水Na2SO4干燥,蒸除溶剂,残余物经硅胶柱层析(洗脱剂:石油醚)纯化得化合物7a~7h。
(E)-1-(萘-1-基)丁烯(7a): 无色油状液体21.87 g,产率75%;1H NMRδ: 8.18~8.15(m, 1H), 7.91~7.89(m, 1H), 7.80(d,J=8.0 Hz, 1H), 7.60(d,J=7.2 Hz, 1H), 7.55~7.49(m, 2H), 7.46(t,J=7.6 Hz, 1H), 7.17(d,J=15.6 Hz, 1H), 6.34(dt,J=6.6 Hz, 15.6 Hz, 1H), 2.34~2.30(m, 2H), 1.13(t,J=7.4 Hz, 3H)。
(E)-1-(萘-1-基)戊烯(7b): 无色油状液体30.46 g,产率97%;1H NMRδ: 8.17~8.15(m, 1H), 7.91~7.89(m, 1H), 7.80(d,J=8.0 Hz, 1H), 7.61(d,J=7.2 Hz, 1H), 7.55~7.49(m, 2H), 7.46(t,J=7.6 Hz, 1H), 7.18(d,J=15.6 Hz, 1H), 6.32~6.24(m, 1H), 2.32~2.26(m, 2H), 1.56~1.50(m, 2H), 0.97(t,J=7.4 Hz, 3H)。
(E)-1-(萘-1-基)己烯(7c): 无色油状液体26.25 g,产率78%;1H NMRδ: 8.16~8.14(m, 1H), 7.91~7.89(m, 1H), 7.80(d,J=8.0 Hz, 1H), 7.60(d,J=7.2 Hz, 1H), 7.55~7.49(m, 2H), 7.46(t,J=7.8 Hz, 1H), 7.18(d,J=15.6 Hz, 1H), 6.32~6.25(m, 1H), 2.34~2.29(m, 2H), 1.53~1.46(m, 2H), 1.43~1.34(m, 2H), 0.93(t,J=7.2 Hz, 3H)。
(E/Z)-3-(萘-1-基)-2-戊烯(7d): 无色油状液体28.27 g,产率90%;1H NMRδ:E/Z异构体大约1 ∶1的混合物。
(E)-1-(萘-1-基)环戊烯(7e): 无色油状液体30.77 g,产率99%;1H NMRδ: 8.12~8.09(m, 1H), 7.93~7.90(m, 1H), 7.81(d,J=8.0 Hz, 1H), 7.53~7.44(m, 3H), 7.38~7.36(m, 1H), 5.94~5.92(m, 1H), 2.79~2.74(m, 2H), 2.63~2.57(m, 2H), 2.09~2.02(m, 2H)。
(E)-1-(萘-1-基)环己烯(7f): 白色固体32.00 g,产率96%, m.p.45.0~45.5 ℃;1H NMRδ: 7.95~7.93(m, 1H), 7.91~7.88(m, 1H), 7.79(d,J=7.6 Hz, 1H), 7.51~7.42(m, 3H), 7.25(dd,J=0.8 Hz, 6.8 Hz, 1H), 5.70~5.68(m, 1H), 2.32~2.29(m, 2H), 2.25~2.21(m, 2H), 1.83~1.77(m, 2H), 1.75~1.69(m, 2H)。
(E)-1-(萘-1-基)环庚烯(7g): 无色油状液体34.51 g,产率97%;1H NMRδ: 7.91~7.86(m, 2H), 7.78(d,J=8.4 Hz, 1H), 7.52~7.46(m, 2H), 7.42(dd,J=7.2 Hz, 8.0 Hz, 1H), 7.23~7.21(m, 1H), 5.87(t,J=6.6 Hz, 1H), 2.54~2.51(m, 2H), 2.35~2.30(m, 2H), 1.87~1.82(m, 2H), 1.69~1.60(m, 4H)。
(E)-1-(萘-1-基)环辛烯(7h): 无色油状液体30.25 g,产率80%;1H NMRδ: 7.92~7.85(m, 2H), 7.80(d,J=8.0 Hz, 1H), 7.51~7.47(m, 2H), 7.46~7.42(m, 1H), 7.24~7.22(m, 1H), 5.67(t,J=8.2 Hz, 1H), 2.59~2.56(m, 2H), 2.34(s, 2H), 1.62(s, 6H), 1.44(s, 2H)。
(4) 1-烷基/环烷基萘(8a~8h)的合成通法
在干燥的圆底烧瓶中加入7a~7h 109 mmol, Pd(OH)21.53 g和THF 300 mL,先氮气置换,再氢气置换,于室温反应24 h(TLC检测)。抽滤,蒸除溶剂得8a~8h。
1-正丁基萘(8a): 无色油状液体19.89 g,产率99%;1H NMRδ: 8.05(d,J=8.4 Hz, 1H), 7.91~7.88(m, 1H), 7.74(d,J=8.4 Hz, 1H), 7.55~7.47(m, 2H), 7.41(t,J=7.6 Hz, 1H), 7.34(d,J=6.8 Hz, 1H), 3.03(t,J=7.8 Hz, 2H), 1.68~1.61(m, 2H), 1.44~1.35(m, 2H), 0.92(t,J=7.4 Hz, 3H)。
1-正戊基萘(8b): 无色油状液体21.40 g,产率99%;1H NMRδ: 8.00(d,J=8.0 Hz, 1H), 7.87~7.84(m, 1H), 7.70(d,J=8.0 Hz, 1H), 7.51~7.43(m, 2H), 7.36(t,J=7.4 Hz, 1H), 7.28(d,J=6.8 Hz, 1H), 2.97(t,J=7.8 Hz, 2H), 1.65~1.58(m, 2H), 1.33~1.25(m, 4H), 0.81(t,J=7.0 Hz, 3H)。
1-正己基萘(8c): 无色油状液体22.91 g,产率99%;1H NMRδ: 8.02(d,J=8.4 Hz, 1H), 7.89~7.86(m, 1H), 7.72(d,J=8.0 Hz, 1H), 7.53~7.45(m, 2H), 7.38(t,J=7.6 Hz, 1H), 7.30(d,J=6.8 Hz, 1H), 2.99(t,J=7.8 Hz, 2H), 1.66~1.59(m, 2H), 1.38~1.31(m, 2H), 1.29~1.21(m, 4H), 0.82(t,J=7.0 Hz, 3H)。
1-(1-乙基丙基)萘(8d): 无色油状液体21.40 g,产率99%;1H NMRδ: 8.17(d,J=8.0 Hz, 1H), 7.91~7.88(m, 1H), 7.74(d,J=8.0 Hz, 1H), 7.53~7.45(m, 3H), 7.37(d,J=6.8 Hz, 1H), 3.35~3.33(m, 1H), 1.81~1.74(m, 2H), 1.72~1.65(m, 2H), 0.72(t,J=7.4 Hz, 6H)。
1-环戊基萘(8e): 无色油状液体20.76 g,产率97%;1H NMRδ: 8.16(d,J=8.0 Hz, 1H), 7.89(d,J=7.6 Hz, 1H), 7.74(t,J=4.8 Hz, 1H), 7.54~7.46(m, 2H), 7.44~7.43(m, 2H), 3.80~3.74(m, 1H), 2.15~2.09(m, 2H), 1.81~1.63(m, 6H)。
1-环己基萘(8f): 无色油状液体20.18 g,产率88%;1H NMRδ: 8.13(d,J=8.0 Hz, 1H), 7.91~7.89(m, 1H), 7.74(d,J=8.0 Hz, 1H), 7.56~7.39(m, 4H), 3.35~3.30(m, 1H), 1.92~1.77(m, 6H), 1.61~1.47(m, 4H), 1.35~1.28(m, 1H)。
1-环庚基萘(8g): 无色油状液体22.01 g,产率90%;1H NMRδ: 8.10(d,J=8.4 Hz, 1H), 7.88(d,J=8.0 Hz, 1H), 7.70(d,J=8.0 Hz, 1H), 7.54~7.45(m, 2H), 7.42(t,J=7.6 Hz, 1H), 7.35(d,J=7.2 Hz, 1H), 3.48~3.43(m, 1H), 1.93~1.90(m, 2H), 1.77~1.58(m, 10H)。
1-环辛基萘(8h): 无色油状液体25.72 g,产率99%;1H NMRδ: 8.08(d,J=8.4 Hz, 1H), 7.87(d,J=8.0 Hz, 1H), 7.70(d,J=8.0 Hz, 1H), 7.53~7.44(m, 2H), 7.40(t,J=7.6 Hz, 1H), 7.34(d,J=7.2 Hz, 1H), 3.56~3.53(m, 1H), 1.83~1.81(m, 4H), 1.73~1.57(m, 10H)。
(5) 1-溴-4-烷基/环烷基萘(9a~9h)的合成通法
在反应瓶中加入8a~8h 95 mmol,N-溴代丁二酰亚胺(NBS) 18.60 g(105 mmol)和MeCN 200 mL(8b用CH2Cl2代替MeCN),于30~40 ℃反应过夜(TLC检测)。搅拌下将反应液倾至水(300 mL)中,用CH2Cl2(3×150 mL)萃取,合并有机相,依次用饱和Na2CO3溶液(5×300 mL)和饱和食盐水(300 mL)洗涤,无水Na2SO4干燥,蒸除溶剂,残余物经硅胶柱层析(洗脱剂:石油醚)纯化得9a~9h。
1-溴-4-正丁基萘(9a): 无色油状液体21.50 g,产率86%;1H NMRδ: 8.17~8.12(m, 2H), 7.78(d,J=7.6 Hz, 1H), 7.70~7.62(m, 2H), 7.28(d,J=7.6 Hz, 1H), 3.03(t,J=7.6 Hz, 2H), 1.66~1.59(m, 2H), 1.43~1.34(m, 2H), 0.91(t,J=7.4 Hz, 3H)。
1-溴-4-正戊基萘(9b): 无色油状液体25.81 g,产率98%;1H NMRδ: 8.17~8.10(m, 2H), 7.77(d,J=7.6 Hz, 1H), 7.69~7.62(m, 2H), 7.27(d,J=7.6 Hz, 1H), 3.01(t,J=7.6 Hz, 2H), 1.68~1.60(m, 2H), 1.37~1.27(m, 4H), 0.85(t,J=7.0 Hz, 3H)。
1-溴-4-正己基萘(9c): 无色油状液体21.03 g,产率76%;1H NMRδ: 8.17~8.11(m, 2H), 7.78(d,J=7.6 Hz, 1H), 7.69~7.62(m, 2H), 7.28(d,J=7.6 Hz, 1H), 3.02(t,J=7.8 Hz, 2H), 1.67~1.60(m, 2H), 1.40~1.32(m, 2H), 1.28~1.24(m, 4H), 0.84(t,J=7.0 Hz, 3H)。
1-溴-4-(1-乙基丙基)萘(9d): 无色油状液体19.49 g,产率74%;1H NMRδ: 8.28(d,J=8.0 Hz, 1H), 8.19~8.17(m, 1H), 7.85(d,J=7.6 Hz, 1H), 7.69~7.61(m, 2H), 7.31(d,J=7.6 Hz, 1H), 3.38(brs, 1H), 1.82~1.64(m, 4H), 0.72(t,J=7.4 Hz, 6H)。
1-溴-4-环戊基萘(9e): 无色油状液体23.53 g,产率90%;1H NMRδ: 8.27~8.24(m, 1H), 8.17~8.15(m, 1H), 7.80(d,J=8.0 Hz, 1H), 7.69~7.62(m, 2H), 7.35(d,J=7.6 Hz, 1H), 3.80~3.72(m, 1H), 2.16~2.09(m, 2H), 1.82~1.61(m, 6H)。
1-溴-4-环己基萘(9f): 无色油状液体26.93 g,产率98%;1H NMRδ: 8.23~8.21(m, 1H), 8.18~8.16(m, 1H), 7.82(d,J=8.0 Hz, 1H), 7.69~7.63(m, 2H), 7.32(d,J=7.6 Hz, 1H), 3.36~3.31(m, 1H), 1.90~1.76(m, 5H), 1.61~1.46(m, 4H), 1.34~1.27(m, 1H)。
1-溴-4-环庚基萘(9g): 无色油状液体28.28 g,产率98%;1H NMRδ: 8.21~8.15(m, 2H), 7.80(d,J=8.0 Hz, 1H), 7.68~7.63(m, 2H), 7.30(d,J=8.0 Hz, 1H), 3.50~3.46(m, 1H), 1.93~1.89(m, 2H), 1.82~1.60(m, 10H)。
1-溴-4-环辛基萘(9h): 无色油状液体28.03 g,产率93%;1H NMRδ: 8.21~8.16(m, 2H), 7.80(d,J=8.0 Hz, 1H), 7.69~7.65(m, 2H), 7.32(d,J=8.0 Hz, 1H), 3.58(s, 1H), 1.84~1.61(m, 14H)。
(6) 4-烷基/环烷基-1-萘甲腈(10a~10h)的合成通法
在圆底烧瓶中加入9a~9h 68 mmol、 CuCN 17.54 g(204 mmol)和DMF 200 mL,氮气保护,于130 ℃反应12 h(TLC检测)。冷却至室温,将反应液倾至CH2Cl2(600 mL)中,搅拌30 min;抽滤,滤液依次用水(5×200 mL)和饱和食盐水(200 mL)洗涤,无水Na2SO4干燥,蒸除溶剂,残余物经硅胶柱层析(洗脱剂:A=1/20)纯化得10a~10h。
4-正丁基-1-萘甲腈(10a): 无色油状液体12.67 g,产率89%;1H NMRδ: 8.24(d,J=8.4 Hz, 1H), 8.13~8.11(m, 1H), 8.05(d,J=7.6 Hz, 1H), 7.80~7.71(m, 2H), 7.51(d,J=7.6 Hz, 1H), 3.12(t,J=7.8 Hz, 2H), 1.68~1.60(m, 2H), 1.43~1.34(m, 2H), 0.91(t,J=7.2 Hz, 3H)。
4-正戊基-1-萘甲腈(10b): 白色固体10.78 g,产率71%, m.p.47~49 ℃;1H NMRδ: 8.22(d,J=8.4 Hz, 1H), 8.12~8.10(m, 1H), 8.04(d,J=7.2 Hz, 1H), 7.79~7.69(m, 2H), 7.49(d,J=7.2 Hz, 1H), 3.08(t,J=7.8 Hz, 2H), 1.65~1.60(m, 2H), 1.35~1.27(m, 4H), 0.83(t,J=7.0 Hz, 3H)。
4-正己基-1-萘甲腈(10c): 白色固体15.82 g,产率98%, m.p.36.0~37.5 ℃;1H NMRδ: 8.23(d,J=8.4 Hz, 1H), 8.11(d,J=8.0 Hz, 1H), 8.05(d,J=7.2 Hz, 1H), 7.80~7.70(m, 2H), 7.51(d,J=7.2 Hz, 1H), 3.11(t,J=7.8 Hz, 2H), 1.68~1.61(m, 2H), 1.40~1.33(m, 2H), 1.31~1.21(m, 4H), 0.83(t,J=7.0 Hz, 3H)。
4-(1-乙基丙基)-1-萘甲腈(10d): 无色油状液体11.90 g,产率75%;1H NMRδ: 8.40(d,J=8.4 Hz, 1H), 8.13(t,J=7.0 Hz, 2H), 7.81~7.77(m, 1H), 7.74~7.70(m, 1H), 7.56(d,J=7.6 Hz, 1H), 3.50~3.47(m, 1H), 1.85~1.64(m, 4H), 0.71(t,J=7.2 Hz, 6H)。
4-环戊基-1-萘甲腈(10e): 白色固体11.59 g,产率77%, m.p.81~82 ℃;1H NMRδ: 8.37(d,J=8.4 Hz, 1H), 8.12(d,J=8.4 Hz, 1H), 8.08(d,J=7.6 Hz, 1H), 7.78(t,J=7.4 Hz, 1H), 7.72(t,J=7.4 Hz, 1H), 7.59(d,J=8.0 Hz, 1H), 3.90~3.82(m, 1H), 2.18~2.11(m, 2H), 1.83~1.64(m, 6H)。
4-环己基-1-萘甲腈(10f): 白色固体15.68 g,产率98%, m.p.101~102 ℃;1H NMRδ: 8.34(d,J=8.4 Hz, 1H), 8.14~8.08(m, 2H), 7.80~7.71(m, 2H), 7.55(d,J=7.6 Hz, 1H), 3.46~3.40(m, 1H), 1.89~1.76(m, 5H), 1.61~1.47(m, 4H), 1.34~1.27(m, 1H)。
4-环庚基-1-萘甲腈(10g): 无色油状液体11.68 g,产率73%;1H NMRδ: 8.33(d,J=8.4 Hz, 1H), 8.13(d,J=7.6 Hz, 1H), 8.09(d,J=7.6 Hz, 1H), 7.80~7.72(m, 2H), 7.55(d,J=7.6 Hz, 1H), 3.62~3.57(m, 1H), 1.93~1.89(m, 2H), 1.84~1.60(m, 10H)。
4-环辛基-1-萘甲腈(10h): 无色油状液体12.54 g,产率70%;1H NMRδ: 8.31(d,J=8.0 Hz, 1H), 8.14~8.12(m, 1H), 8.08(d,J=8.0 Hz, 1H), 7.80~7.72(m, 2H), 7.55(d,J=7.6 Hz, 1H), 3.66(s, 1H), 1.84~1.61(m, 14H)。
(7) (4-烷基/环烷基萘-1-基)甲胺(11a~11h)的合成通法
在干燥的圆底烧瓶中加入10a~10h 47 mmol和THF 120 mL,冰水浴降温至0 ℃左右,将LiAlH43.87 g(102 mmol)分多次缓慢加入反应体系,加毕,升至室温反应0.5~1 h;于50 ℃反应12 h。降温至0 ℃,向体系滴加水至不再产生气泡。反应液倾至CH2Cl2(300 mL)中,搅拌30 min;抽滤,滤液用饱和食盐水(3×200 mL)洗涤,经无水Na2SO4干燥,蒸除溶剂得11a~11h粗品,直接投入下一步反应。
(8) (4-烷基/环烷基萘-1-基)-甲基异硫氰酸酯(12a~12h)的合成通法
将粗品11a~11h(47 mmol)和二异丙基乙基胺(DIPEA) 12.15 g (94 mmol)溶于CH2Cl2(100 mL)中,氮气保护,冰水浴降温至0 ℃左右,向体系中滴加硫光气6.63 mL(87 mmol),滴毕,升至室温反应0.5 h。反应液倾至水(200 mL)中,用稀盐酸调pH至7,分液,水相用CH2Cl2150 mL萃取,合并有机相,用饱和食盐水(2×200 mL)洗涤,经无水Na2SO4干燥,蒸除溶剂,残余物经硅胶柱层析(洗脱剂:石油醚)纯化得12a~12h。
(4-正丁基萘-1-基)甲基异硫氰酸酯(12a): 无色油状液体6.00 g,产率50%;1H NMRδ: 8.15~8.13(m, 1H), 8.07~8.05(m, 1H), 7.65~7.59(m, 2H), 7.49(d,J=7.2 Hz, 1H), 7.36(d,J=7.2 Hz, 1H), 5.34(s, 2H), 3.04(t,J=7.8 Hz, 2H), 1.68~1.60(m, 2H), 1.44~1.36(m, 2H), 0.92(t,J=7.4 Hz, 3H)。
(4-正戊基萘-1-基)甲基异硫氰酸酯(12b): 无色油状液体7.09 g,产率56%;1H NMRδ: 8.15~8.13(m, 1H), 8.08~8.05(m, 1H), 7.66~7.59(m, 2H), 7.50(d,J=7.2 Hz, 1H), 7.37(d,J=7.2 Hz, 1H), 5.35(s, 2H), 3.04(t,J=7.8 Hz, 2H), 1.70~1.63(m, 2H), 1.39~1.31(m, 4H), 0.86(t,J=7.0 Hz, 3H)。
(4-正己基萘-1-基)甲基异硫氰酸酯(12c): 无色油状液体8.13 g,产率61%;1H NMRδ: 8.15~8.12(m, 1H), 8.08~8.05(m, 1H), 7.65~7.61(m, 2H), 7.50(d,J=7.2 Hz, 1H), 7.36(d,J=7.2 Hz, 1H), 5.34(s, 2H), 3.04(t,J=7.6 Hz, 2H), 1.67~1.61(m, 2H), 1.40~1.35(m, 2H), 1.31~1.24(m, 4H), 0.85(t,J=7.0 Hz, 3H)。
[4-(1-乙基丙基)萘-1-基]甲基异硫氰酸酯(12d): 无色油状液体6.46 g,产率51%;1H NMRδ: 8.29~8.27(m, 1H), 8.08~8.05(m, 1H), 7.65~7.60(m, 2H), 7.58(d,J=7.6 Hz, 1H), 7.41(d,J=7.6 Hz, 1H), 5.37(s, 2H), 3.41~3.39(m, 1H), 1.82~1.66(m, 4H), 0.73(t,J=7.2 Hz, 6H)。
(4-环戊基萘-1-基)甲基异硫氰酸酯(12e): 无色油状液体6.29 g,产率50%;1H NMRδ: 8.28~8.26(m, 1H), 8.08~8.05(m, 1H), 7.66~7.59(m, 2H), 7.53(d,J=7.2 Hz, 1H), 7.45(d,J=7.6 Hz, 1H), 5.34(s, 2H), 3.82~3.74(m, 1H), 2.15~2.10(m, 2H), 1.83~1.64(m, 6H)。
(4-环己基萘-1-基)甲基异硫氰酸酯(12f): 白色固体6.75 g,产率51%; m.p.74~75 ℃;1H NMRδ: 8.24~8.21(m, 1H), 8.08~8.06(m, 1H), 7.65~7.60(m, 2H), 7.54(d,J=7.6 Hz, 1H), 7.41(d,J=7.6 Hz, 1H), 5.34(s, 2H), 3.37~3.32(m, 1H), 1.91~1.76(m, 5H), 1.61~1.47(m, 4H), 1.34~1.27(m, 1H)。
(4-环庚基萘-1-基)甲基异硫氰酸酯(12g): 无色油状液体6.95 g,产率50%;1H NMRδ: 8.23~8.20(m, 1H), 8.07~8.05(m, 1H), 7.65~7.60(m, 2H), 7.53(d,J=7.2 Hz, 1H), 7.41(d,J=7.2 Hz, 1H), 5.34(s, 2H), 3.53~3.48(m, 1H), 1.95~1.91(m, 2H), 1.84~1.62(m, 10H)。
(4-环辛基萘-1-基)甲基异硫氰酸酯(12h): 无色油状液体8.73 g,产率60%;1H NMRδ: 8.22~8.19(m, 1H), 8.09~8.05(m, 1H), 7.65~7.61(m, 2H), 7.53(d,J=7.6 Hz, 1H), 7.42(d,J=7.6 Hz, 1H), 5.34(s, 2H), 3.60(s, 1H), 1.87~1.62(m, 14H)。
(9) 13a~13h的合成通法
将12a~12h 22 mmol和甲酰肼1.59 g(27 mmol)溶于THF(70 mL)中,于室温反应过夜(TLC检测)。反应液倾至40倍(V/V)的石油醚中,搅拌1 h;抽滤得13a~13h粗品,直接投入下一反应。
(10) 4-[(4-烷基/环烷基萘-1-基)甲基]-2,3-二氢-4H-1,2,4-三唑-3-硫酮(14a~14h)的合成通法
将粗品13a~13h(按22 mmol计)溶于DMF 80 mL,搅拌下滴加K2CO33.04 g(22 mmol)的水溶液10 mL,滴毕,于50 ℃反应3 h(TLC检测)。反应液倾至水(200 mL)中,用稀盐酸调pH 2~3,析出白色沉淀,抽滤,滤饼晾干后在70 mL石油醚中打浆,抽滤,干燥得14a~14h。
4-[(4-正丁基萘-1-基)甲基]-2,3-二氢-4H-1,2,4-三唑-3-硫酮(14a): 白色固体5.89 g,产率90%, m.p.159.5~160 ℃;1H NMRδ: 13.84(brs, 1H), 8.29(s, 1H), 8.16~8.12(m, 2H), 7.60~7.57(m, 2H), 7.34(d,J=7.2 Hz, 1H), 7.20(d,J=7.2 Hz, 1H), 5.56(s, 2H), 3.04(t,J=7.8 Hz, 2H), 1.66~1.62(m, 2H), 1.42~1.37(m, 2H), 0.92(t,J=7.2 Hz, 3H)。
4-[(4-正戊基萘-1-基)甲基]-2,3-二氢-4H-1,2,4-三唑-3-硫酮(14b): 白色固体6.24 g,产率91%, m.p.147~148 ℃;1H NMRδ: 13.83(brs, 1H), 8.29(s, 1H), 8.16~8.11(m, 2H), 7.61~7.55(m, 2H), 7.34(d,J=7.2 Hz, 1H), 7.20(d,J=7.2 Hz, 1H), 5.57(s, 2H), 3.03(t,J=7.8 Hz, 2H), 1.69~1.62(m, 2H), 1.40~1.30(m, 4H), 0.86(t,J=6.8 Hz, 3H)。
4-[(4-正己基萘-1-基)甲基]-2,3-二氢-4H-1,2,4-三唑-3-硫酮(14c): 白色固体6.52 g,产率91%, m.p.146~148 ℃;1H NMRδ: 13.83(brs, 1H), 8.29(s, 1H), 8.16~8.11(m, 2H), 7.61~7.55(m, 2H), 7.34(d,J=7.2 Hz, 1H), 7.20(d,J=7.2 Hz, 1H), 5.57(s, 2H), 3.03(t,J=7.6 Hz, 2H), 1.69~1.61(m, 2H), 1.41~1.25(m, 6H), 0.85(t,J=7.0 Hz, 3H)。
4-{[4-(1-乙基丙基)萘-1-基]甲基}-2,3-二氢-4H-1,2,4-三唑-3-硫酮(14d): 白色固体6.10 g,产率89%, m.p.162~164 ℃;1H NMRδ: 13.85(brs, 1H), 8.33(s, 1H), 8.28~8.26(m, 1H), 8.18~8.15(m, 1H), 7.59~7.57(m, 2H), 7.39(d,J=7.2 Hz, 1H), 7.23(d,J=7.6 Hz, 1H), 5.59(s, 2H), 3.38(s, 1H), 1.81~1.65(m, 4H), 0.73(t,J=7.4 Hz, 6H)。
4-[(4-环戊基萘-1-基)甲基]-2,3-二氢-4H-1,2,4-三唑-3-硫酮(14e): 白色固体6.24 g,产率92%, m.p.158~159 ℃;1H NMRδ: 13.84(brs, 1H), 8.30(s, 1H), 8.26~8.24(m, 1H), 8.16~8.13(m, 1H), 7.61~7.55(m, 2H), 7.43(d,J=7.6 Hz, 1H), 7.21(d,J=7.6 Hz, 1H), 5.57(s, 2H), 3.81~3.73(m, 1H), 2.12~2.08(m, 2H), 1.82~1.64(m, 6H)。
4-[(4-环己基萘-1-基)甲基]-2,3-二氢-4H-1,2,4-三唑-3-硫酮(14f): 白色固体5.86 g,产率86%, m.p.198~200 ℃;1H NMRδ: 13.84(brs, 1H), 8.32(s, 1H), 8.22(d,J=7.6 Hz, 1H), 8.17~8.15(m, 1H), 7.62~7.55(m, 2H), 7.39(d,J=7.2 Hz, 1H), 7.20(d,J=7.6 Hz, 1H), 5.57(s, 2H), 3.36~3.30(m, 1H), 1.91~1.76(m, 5H), 1.61~1.46(m, 4H), 1.33~1.28(m, 1H)。
4-[(4-环庚基萘-1-基)甲基]-2,3-二氢-4H-1,2,4-三唑-3-硫酮(14g): 白色固体5.87 g,产率79%, m.p.166~167 ℃;1H NMRδ: 13.84(brs, 1H), 8.31(s, 1H), 8.20(d,J=8.0 Hz, 1H), 8.15(d,J=8.0 Hz, 1H), 7.62~7.55(m, 2H), 7.39(d,J=7.6 Hz, 1H), 7.20(d,J=7.2 Hz, 1H), 5.56(s, 2H), 3.52~3.47(m, 1H), 1.94~1.91(m, 2H), 1.80~1.62(m, 10H)。
4-[(4-环辛基萘-1-基)甲基]-2,3-二氢-4H-1,2,4-三唑-3-硫酮(14h): 白色固体6.88 g,产率89%, m.p.179~180 ℃;1H NMRδ: 13.85(brs, 1H), 8.31(s, 1H), 8.31~8.14(m, 2H), 7.62~7.55(m, 2H), 7.39(d,J=7.2 Hz, 1H), 7.20(d,J=7.6 Hz, 1H), 5.56(s, 2H), 3.58(s, 1H), 1.85~1.61(m, 14H)。
(11) 2-【{4-[(4-烷基/环烷基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸甲酯(15a~15h)的合成通法
将14a~14h 14 mmol和K2CO33.87 g(28 mmol)溶于DMF(50 mL)中,搅拌下向体系滴加溴乙酸甲酯2.36 g(15 mmol),滴毕,于室温反应2 h(TLC检测)。反应液倾至水(100 mL)中,调至pH 5~6,用CH2Cl2(3×50 mL)萃取,合并有机相,依次用水(5×100 mL)和饱和食盐水(100 mL)洗涤,经无水Na2SO4干燥,蒸除溶剂,残余物经柱层析(洗脱剂:乙酸乙酯)纯化得15a~15h。
2-【{4-[(4-正丁基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸甲酯(15a): 白色固体3.67 g,产率71%, m.p.80~81.5 ℃;1H NMRδ: 8.63(s, 1H), 8.15~8.13(m, 1H), 8.10~8.08(m, 1H), 7.62~7.60(m, 2H), 7.33(d,J=7.2 Hz, 1H), 6.95(d,J=7.2 Hz, 1H), 5.67(s, 2H), 4.06(s, 2H), 3.62(s, 3H), 3.03(t,J=7.6 Hz, 2H), 1.67~1.59(m, 2H), 1.41~1.34(m, 2H), 0.91(t,J=7.2 Hz, 3H)。
2-【{4-[(4-正戊基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸甲酯(15b): 白色固体3.33 g,产率62%, m.p.88~89 ℃;1H NMRδ: 8.63(s, 1H), 8.15~8.12(m, 1H), 8.10~8.07(m, 1H), 7.62~7.59(m, 2H), 7.33(d,J=7.6 Hz, 1H), 6.95(d,J=7.2 Hz, 1H), 5.67(s, 2H), 4.06(s, 2H), 3.62(s, 3H), 3.02(t,J=7.8 Hz, 2H), 1.69~1.62(m, 2H), 1.37~1.30(m, 4H), 0.85(t,J=7.0 Hz, 3H)。
2-【{4-[(4-正己基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸甲酯(15c): 白色固体3.62 g,产率65%, m.p.76~77 ℃;1H NMRδ: 8.63(s, 1H), 8.15~8.11(m, 1H), 8.10~8.06(m, 1H), 7.63~7.58(m, 2H), 7.32(d,J=7.6 Hz, 1H), 6.95(d,J=7.6 Hz, 1H), 5.67(s, 2H), 4.06(s, 2H), 3.62(s, 3H), 3.02(t,J=7.8 Hz, 2H), 1.68~1.60(m, 2H), 1.41~1.24(m, 6H), 0.84(t,J=7.0 Hz, 3H)。
2-【【4-{[4-(1-乙基丙基)萘-1-基]甲基}-4H-1,2,4-三唑-3-基】硫代】乙酸甲酯(15d): 无色油状液体3.60 g,产率67%;1H NMRδ: 8.65(s, 1H), 8.29~8.26(m, 1H), 8.12~8.08(m, 1H), 7.62~7.58(m, 2H), 7.37(d,J=7.6 Hz, 1H), 7.00(d,J=7.6 Hz, 1H), 5.69(s, 2H), 4.05(s, 2H), 3.61(s, 3H), 3.38(s, 1H), 1.81~1.64(m, 4H), 0.72(t,J=7.2 Hz, 6H)。
2-【{4-[(4-环戊基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸甲酯(15e): 白色固体4.59 g,产率86%, m.p.114~115 ℃;1H NMRδ: 8.63(s, 1H), 8.28~8.25(m, 1H), 8.10~8.07(m, 1H), 7.63~7.59(m, 2H), 7.41(d,J=7.6 Hz, 1H), 6.97(d,J=7.6 Hz, 1H), 5.67(s, 2H), 4.07(s, 2H), 3.80~3.74(m, 1H), 3.62(s, 3H), 2.13~2.08(m, 2H), 1.81~1.63(m, 6H)。
2-【{4-[(4-环己基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸甲酯(15f): 无色油状液体3.32 g,产率60%;1H NMRδ: 8.64(s, 1H), 8.24~8.22(m, 1H), 8.11~8.08(m, 1H), 7.64~7.59(m, 2H), 7.37(d,J=7.6 Hz, 1H), 6.95(d,J=7.6 Hz, 1H), 5.67(s, 2H), 4.06(s, 2H), 3.62(s, 3H), 3.36~3.30(m, 1H), 1.90~1.76(m, 5H), 1.61~1.46(m, 4H), 1.33~1.27(m, 1H)。
2-【{4-[(4-环庚基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸甲酯(15g): 无色油状液体4.01 g,产率70%;1H NMRδ: 8.63(s, 1H), 8.23~8.20(m, 1H), 8.10~8.08(m, 1H), 7.64~7.58(m, 2H), 7.37(d,J=7.2 Hz, 1H), 6.95(d,J=7.6 Hz, 1H), 5.66(s, 2H), 4.06(s, 2H), 3.62(s, 3H), 3.52~3.47(m, 1H), 1.94~1.90(m, 2H), 1.83~1.61(m, 10H)。
2-【{4-[(4-环辛基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸甲酯(15h): 无色油状液体5.57 g,产率94%;1H NMRδ: 8.63(s, 1H), 8.22~8.19(m, 1H), 8.11~8.08(m, 1H), 7.63~7.60(m, 1H), 7.37(d,J=7.2 Hz, 1H), 6.95(d,J=7.6 Hz, 1H), 5.66(s, 2H), 4.07(s, 2H), 3.62(s, 3H), 3.58(s, 1H), 1.85~1.61(m, 14H)。
(12) 2-【{5-溴-4-[(4-烷基/环烷基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸甲酯(16a~16h)的合成通法
将15a~15h 7 mmol和NBS 1.42 g(8 mmol)溶于MeCN(30 mL)中,于30~40 ℃反应过夜(TLC检测)。搅拌下将反应液缓慢倾至水(100 mL)中,用CH2Cl2(3×30 mL)萃取,合并有机相,依次用饱和Na2CO3溶液(5×80 mL)和饱和食盐水洗涤,无水Na2SO4干燥,蒸除溶剂,残余物经硅胶柱层析(洗脱剂:A=1/2)纯化得16a~16h。
2-【{5-溴-4-[(4-正丁基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸甲酯(16a): 无色油状液体1.95 g,产率62%;1H NMRδ: 8.17~8.13(m, 2H), 7.67~7.63(m, 2H), 7.29(d,J=7.2 Hz, 1H), 6.46(d,J=7.6 Hz, 1H), 5.69(s, 2H), 4.06(s, 2H), 3.61(s, 3H), 3.02(t,J=7.6 Hz, 2H), 1.67~1.59(m, 2H), 1.43~1.34(m, 2H), 0.91(t,J=7.4 Hz, 3H)。
2-【{5-溴-4-[(4-正戊基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸甲酯(16b): 无色油状液体1.98 g,产率61%;1H NMRδ: 8.16~8.13(m, 2H), 7.66~7.64(m, 2H), 7.29(d,J=7.2 Hz, 1H), 6.46(d,J=7.2 Hz, 1H), 5.69(s, 2H), 4.06(s, 2H), 3.61(s, 3H), 3.01(t,J=7.6 Hz, 2H), 1.66~1.63(m, 2H), 1.35~1.32(m, 4H), 0.86(t,J=6.8 Hz, 3H)。
2-【{5-溴-4-[(4-正己基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸甲酯(16c): 无色油状液体1.93 g,产率58%;1H NMRδ: 8.16~8.12(m, 2H), 7.67~7.63(m, 2H), 7.28(d,J=7.6 Hz, 1H), 6.46(d,J=7.6 Hz, 1H), 5.69(s, 2H), 4.06(s, 2H), 3.61(s, 3H), 3.01(t,J=7.6 Hz, 2H), 1.67~1.60(m, 2H), 1.41~1.22(m, 6H), 0.84(t,J=7.0 Hz, 3H)。
2-【【5-溴-4-{[4-(1-乙基丙基)萘-1-基]甲基}-4H-1,2,4-三唑-3-基】硫代】乙酸甲酯(16d): 白色固体1.91 g,产率59%, m.p.101~103 ℃;1H NMRδ: 8.30~8.28(m, 1H), 8.15~8.13(m, 1H), 7.67~7.61(m, 2H), 7.33(d,J=7.6 Hz, 1H), 6.55(d,J=7.6 Hz, 1H), 5.70(s, 2H), 4.06(s, 2H), 3.61(s, 3H), 3.37(s, 1H), 1.80~1.63(m, 4H), 0.72(t,J=7.4 Hz, 3H)。
2-【{5-溴-4-[(4-环戊基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸甲酯(16e): 白色固体1.93 g,产率60%, m.p.109~110 ℃;1H NMRδ: 8.29~8.26(m, 1H), 8.15~8.12(m, 1H), 7.67~7.63(m, 2H), 7.37(d,J=7.6 Hz, 1H), 6.47(d,J=7.6 Hz, 1H), 5.69(s, 2H), 4.07(s, 2H), 3.79~3.71(m, 1H), 3.61(s, 3H), 2.13~2.09(m, 2H), 1.80~1.60(m, 6H)。
2-【{5-溴-4-[(4-环己基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸甲酯(16f): 白色泡沫状固体1.93 g,产率58%;1H NMRδ: 8.26~8.23(m, 1H), 8.16~8.13(m, 1H), 7.68~7.63(m, 2H), 7.34(d,J=7.6 Hz, 1H), 6.47(d,J=7.2 Hz, 1H), 5.69(s, 2H), 4.07(s, 2H), 3.61(s, 3H), 3.35~3.30(m, 1H), 1.90~1.75(m, 5H), 1.60~1.39(m, 4H), 1.29~1.23(m, 1H)。
2-【{5-溴-4-[(4-环庚基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸甲酯(16g): 无色油状液体2.09 g,产率61%;1H NMRδ: 8.24~8.21(m, 1H), 8.15~8.13(m, 1H), 7.67~7.64(m, 2H), 7.33(d,J=7.6 Hz, 1H), 6.47(d,J=7.6 Hz, 1H), 5.68(s, 2H), 4.07(s, 2H), 3.61(s, 3H), 3.48~3.46(m, 1H), 1.93~1.89(m, 2H), 1.80~1.60(m, 10H)。
2-【{5-溴-4-[(4-环辛基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸甲酯(16h): 白色泡沫状固体2.25 g,产率64%;1H NMRδ: 8.23~8.21(m, 1H), 8.15~8.13(m, 1H), 7.68~7.63(m, 2H), 7.34(d,J=7.6 Hz, 1H), 6.47(d,J=7.6 Hz, 1H), 5.68(s, 2H), 4.07(s, 2H), 3.61(s, 3H), 3.58(s, 1H), 1.83~1.61(m, 14H)。
(13) 2-【{5-溴-4-[(4-烷基/环烷基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸(17a~17h)的合成通法
将16a~16h 1 mmol溶于MeOH(10 mL)中,搅拌下向体系滴加LiOH·H2O 0.08 g(2 mmol)的水(1 mL)溶液,于室温反应5 h(TLC检测)。搅拌下将反应液倾至水(50 mL)中,用稀盐酸调pH至2~3,用乙酸乙酯(3×50 mL)萃取,合并有机相,用水50 mL洗涤,经无水Na2SO4干燥,蒸除溶剂,用乙酸乙酯5 mL打浆,抽滤,滤饼于室温真空干燥得17a~17h。
2-【{5-溴-4-[(4-正丁基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸(17a): 白色固体0.36 g,产率82%, m.p.161~161.5 ℃;1H NMRδ: 12.95(brs, 1H), 8.17~8.13(m, 2H), 7.67~7.63(m, 2H), 7.28(d,J=7.2 Hz, 1H), 6.47(d,J=7.6 Hz, 1H), 5.68(s, 2H), 4.00(s, 2H), 3.02(t,J=7.8 Hz, 2H), 1.67~1.59(m, 2H), 1.43~1.34(m, 2H), 0.91(t,J=7.4 Hz, 3H)。
2-【{5-溴-4-[(4-正戊基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸(17b): 白色固体0.37 g,产率82%, m.p.163~165 ℃;1H NMRδ: 12.96(brs, 1H), 8.16~8.13(m, 2H), 7.66~7.64(m, 2H), 7.28(d,J=7.6 Hz, 1H), 6.48(d,J=7.2 Hz, 1H), 5.68(s, 2H), 3.99(s, 2H), 3.01(t,J=7.8 Hz, 2H), 1.67~1.61(m, 2H), 1.37~1.30(m, 4H), 0.86(t,J=6.8 Hz, 3H)。
2-【{5-溴-4-[(4-正己基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸(17c): 白色固体0.38 g,产率83%, m.p.163 ℃;1H NMRδ: 12.98(brs, 1H), 8.16~8.13(m, 2H), 7.67~7.63(m, 2H), 7.28(d,J=7.2 Hz, 1H), 6.47(d,J=7.2 Hz, 1H), 5.68(s, 2H), 3.99(s, 2H), 3.01(t,J=7.8 Hz, 2H), 1.67~1.60(m, 2H), 1.41~1.24(m, 6H), 0.84(t,J=7.0 Hz, 3H)。
2-【【5-溴-4-{[4-(1-乙基丙基)萘-1-基]甲基}-4H-1,2,4-三唑-3-基】硫代】乙酸(17d): 白色固体0.34 g,产率75%, m.p.145~146 ℃;1H NMRδ: 12.96(brs, 1H), 8.30~8.28(m, 1H), 8.16~8.13(m, 1H), 7.66~7.61(m, 2H), 7.33(d,J=8.0 Hz, 1H), 6.57(d,J=7.6 Hz, 1H), 5.70(s, 2H), 3.99(s, 2H), 3.37(s, 1H), 1.82~1.61(m, 4H), 0.72(t,J=7.4 Hz, 6H)。
2-【{5-溴-4-[(4-环戊基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸(17e): 白色固体0.34 g,产率76%, m.p.165~167 ℃;1H NMRδ: 13.01(brs, 1H), 8.29~8.26(m, 1H), 8.15~8.13(m, 1H), 7.67~7.62(m, 2H), 7.37(d,J=7.6 Hz, 1H), 6.48(d,J=7.6 Hz, 1H), 5.68(s, 2H), 4.00(s, 2H), 3.79~3.71(m, 1H), 2.14~2.09(m, 2H), 1.80~1.60(m, 6H)。
2-【{5-溴-4-[(4-环己基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸(17f): 白色固体0.36 g,产率77%, m.p.176 ℃(dec.);1H NMRδ: 8.25~8.23(m, 1H), 8.16~8.14(m, 1H), 7.67~7.63(m, 2H), 7.33(d,J=7.6 Hz, 1H), 6.47(d,J=7.6 Hz, 1H), 5.67(s, 2H), 3.94(s, 2H), 3.35~3.29(m, 1H), 1.90~1.75(m, 5H), 1.57~1.46(m, 4H), 1.29~1.27(m, 1H)。
2-【{5-溴-4-[(4-环庚基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸(17g): 白色固体0.37 g,产率78%, m.p.149~151 ℃;1H NMRδ: 12.95(brs, 1H), 8.24~8.21(m, 1H), 8.15~8.13(m, 1H), 7.67~7.63(m, 2H), 7.32(d,J=7.6 Hz, 1H), 6.49(d,J=7.6 Hz, 1H), 5.67(s, 2H), 4.00(s, 2H), 3.50~3.45(m, 1H), 1.93~1.89(m, 2H), 1.82~1.60(m, 10H)。
2-【{5-溴-4-[(4-环辛基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸(17h): 白色固体0.36 g,产率74%, m.p.160~162 ℃;1H NMRδ: 12.97(brs, 1H), 8.23~8.20(m, 1H), 8.15~8.13(m, 1H), 7.68~7.63(m, 2H), 7.33(d,J=7.2 Hz, 1H), 6.49(d,J=7.6 Hz, 1H), 5.67(s, 2H), 4.00(s, 2H), 3.57~3.56(m, 1H), 1.83~1.60(m, 14H)。
(14) 2-【{5-溴-4-[(4-烷基/环烷基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸钠(1h~1o)的合成通法
将17a~17h 0.001 g(0.7 mmol)溶于MeOH(10 mL)中,搅拌下滴加NaOH 0.028 g(0.7 mmol)的水(0.5 mL)溶液,滴毕,于室温反应0.5 h。抽滤,蒸除溶剂,残余物经干燥得化合物1h~1o。
2-【{5-溴-4-[(4-正丁基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸钠(1h): 白色固体0.32 g,产率99%, m.p.105 ℃(dec.);1H NMRδ: 8.17~8.13(m, 2H), 7.65~7.63(m, 2H), 7.27(d,J=7.2 Hz, 1H), 6.39(d,J=7.2 Hz, 1H), 5.67(s, 2H), 3.73(s, 2H), 3.01(t,J=7.6 Hz, 2H), 1.67~1.59(m, 2H), 1.41~1.36(m, 2H), 0.91(t,J=7.2 Hz, 3H);13C NMRδ: 169.06, 154.07, 138.70, 131.50, 130.29, 129.98, 128.31, 126.30, 126.24, 125.28, 124.60, 123.27, 121.60, 46.06, 39.44, 32.55, 31.89, 22.18, 13.76; MSm/z: 432.16([M(79Br)-Na]-), 434.15([M(81Br)-Na]-)。
2-【{5-溴-4-[(4-正戊基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸钠(1i): 白色固体0.33 g,产率100%, m.p.130~132 ℃;1H NMRδ: 8.17~8.13(m, 2H), 7.65~7.63(m, 2H), 7.27(d,J=7.2 Hz, 1H), 6.39(d,J=7.2 Hz, 1H), 5.66(s, 2H), 3.71(s, 2H), 3.00(t,J=7.6 Hz, 2H), 1.68~1.61(m, 2H), 1.40~1.28(m, 4H), 0.86(t,J=7.0 Hz, 3H);13C NMRδ: 169.33, 154.13, 138.75, 131.52, 130.26, 129.99, 128.33, 126.30, 126.25, 125.26, 124.58, 123.28, 121.62, 46.07, 39.56, 32.18, 31.31, 30.09, 21.95, 13.87; MSm/z: 446.54([M(79Br)-Na]-), 448.44([M(81Br)-Na]-)。
2-【{5-溴-4-[(4-正己基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸钠(1j): 白色固体0.34 g,产率99%, m.p.135~136 ℃;1H NMRδ: 8.17~8.13(m, 2H), 7.65~7.63(m, 2H), 7.27(d,J=7.6 Hz, 1H), 6.38(d,J=7.2 Hz, 1H), 5.66(s, 2H), 3.71(s, 2H), 3.00(t,J=7.6 Hz, 2H), 1.67~1.60(m, 2H), 1.40~1.32(m, 2H), 1.28~1.22(m, 4H), 0.84(t,J=7.0 Hz, 3H);13C NMRδ: 169.30, 154.17, 138.74, 131.51, 130.24, 129.99, 128.33, 126.30, 126.24, 125.25, 124.57, 123.28, 121.60, 46.06, 39.65, 32.24, 31.09, 30.40, 28.80, 22.06, 13.90; MSm/z: 460.36([M(79Br)-Na]-), 462.27([M(81Br)-Na]-)。
2-【【5-溴-4-{[4-(1-乙基丙基)萘-1-基]甲基}-4H-1,2,4-三唑-3-基】硫代】乙酸钠(1k): 白色固体0.33 g,产率100%, m.p.153~155 ℃;1H NMRδ: 8.29~8.27(m, 1H), 8.17~8.15(m, 1H), 7.66~7.60(m, 2H), 7.32(d,J=7.6 Hz, 1H), 6.47(d,J=7.6 Hz, 1H), 5.68(s, 2H), 3.73(s, 2H), 3.36(s, 1H), 1.79~1.63(m, 4H), 0.72(t,J=7.4 Hz, 6H);13C NMRδ: 169.24, 154.07, 141.73, 132.39, 130.32, 129.99, 127.87, 126.12, 124.11, 123.32, 122.60, 121.70, 46.14, 41.20, 39.37, 28.05, 11.82; MSm/z: 446.34([M(79Br)-Na]-), 448.27([M(81Br)-Na]-)。
2-【{5-溴-4-[(4-环戊基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸钠(1l): 白色固体0.33 g,产率99%, m.p.156~158 ℃;1H NMRδ: 8.28~8.26(m, 1H), 8.16~8.14(m, 1H), 7.66~7.62(m, 2H), 7.36(d,J=7.6 Hz, 1H), 6.40(d,J=7.6 Hz, 1H), 5.66(s, 2H), 3.78~3.74(m, 1H), 3.71(s, 2H), 2.12~2.08(m, 2H), 1.80~1.62(m, 6H);13C NMRδ: 168.80, 154.34, 141.80, 131.85, 130.21, 129.95, 128.10, 126.22, 126.16, 124.68, 123.19, 121.57, 121.49, 46.04, 40.40, 39.94, 33.08, 24.80; MSm/z: 444.35([M(79Br)-Na]-), 446.23([M(81Br)-Na]-)。
2-【{5-溴-4-[(4-环己基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸钠(1m): 白色固体0.34 g,产率100%, m.p.200 ℃(dec.);1H NMRδ: 8.25~8.22(m, 1H), 8.17~8.15(m, 1H), 7.66~7.63(m, 2H), 7.33(d,J=7.6 Hz, 1H), 6.40(d,J=7.6 Hz, 1H), 5.65(s, 2H), 3.68(s, 2H), 3.33~3.29(m, 1H), 1.90~1.75(m, 5H), 1.60~1.43(m, 4H), 1.32~1.22(m, 1H);13C NMRδ: 168.98, 154.58, 143.45, 130.94, 130.18, 129.98, 128.09, 126.29, 126.24, 123.96, 123.37, 121.83, 121.55, 46.05, 40.40, 38.34, 33.68, 26.54, 25.93; MSm/z: 458.16([M(79Br)-Na]-), 460.11 ([M(81Br)-Na]-)。
2-【{5-溴-4-[(4-环庚基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸钠(1n): 白色固体0.35 g,产率100%, m.p.168~170 ℃;1H NMRδ: 8.23~8.20(m, 1H), 8.17~8.13(m, 1H), 7.67~7.62(m, 2H), 7.32(d,J=7.6 Hz, 1H), 6.39(d,J=7.6 Hz, 1H), 5.65(s, 2H), 3.68(s, 2H), 3.47~3.45(m, 1H), 1.94~1.90(m, 2H), 1.82~1.60(m, 10H);13C NMRδ: 169.24, 154.37, 145.38, 130.63, 130.18, 129.97, 127.83, 126.25, 126.17, 124.02, 123.35, 122.04, 121.63, 46.05, 40.01, 35.80, 27.29, 26.89; MSm/z: 472.55([M(79Br)-Na]-), 474.48([M(81Br)-Na]-)。
2-【{5-溴-4-[(4-环辛基萘-1-基)甲基]-4H-1,2,4-三唑-3-基}硫代】乙酸钠(1o): 白色固体0.36 g,产率100%, m.p.155~157 ℃;1H NMRδ: 8.22~8.20(m, 1H), 8.17~8.15(m, 1H), 7.67~7.62(m, 2H), 7.33(d,J=7.6 Hz, 1H), 6.39(d,J=7.6 Hz, 1H), 5.66(s, 2H), 3.72(s, 2H), 3.57(m, 1H), 1.82~1.60(m, 14H);13C NMRδ: 169.10, 154.21, 145.65, 130.59, 130.23, 130.06, 127.83, 126.26, 126.14, 124.02, 123.40, 122.61, 121.57, 46.06, 39.91, 37.90, 33.47, 26.42, 25.93, 25.61; MSm/z: 486.75([M(79Br)-Na]-), 488.50([M(81Br)-Na]-)。
2 结果与讨论
2.1 活性
使用待测化合物1h~1o抑制稳定表达了URAT1的HEK293细胞对[8-14C]尿酸的摄取的方法来评价待测化合物对URAT1的体外抑制强度,利用lesinurad作为阳性对照[8]。1h~1o体外对URAT1抑制的IC50值见表1。
为了系统研究含萘三氮唑骨架的硫代乙酸类URAT1抑制剂分子中萘环4-位的烷基/环烷基R的构效关系,我们将本研究和前期研究的所有活性结果[12-13]进行了汇总(表1)和绘图比较(图1)。如图1所示,当R从H(1a)逐渐增加体积至n-Pr(1d)时,活性随着R的体积增大而逐渐增强,甚至对于R=i-Pr(1e)也基本可以认为符合该规律,尽管1e的活性比1d略微下降;对于R=环丙基(1f)、环丁基(1g)和环戊基(1h)等较小体积的环烷基,活性仍然较好;活性最好的化合物是当R=(1-乙基)丙基(1k)时,其IC50=0.054 μmol·L-1,为lesinurad活性的133倍,1k的活性不仅超过了前期研究中发现的最强的1d(IC50=0.092 μmol·L-1),也成为1a~1o中活性最强的化合物。相反,当R为其他较大的线性烷基或者环烷基时,如正丁基(1h)、正戊基(1i)、正己基(1j)、环己基(1m)、环庚基(1n)和环辛基(1o),活性大幅度下降。因此,该类抑制剂的活性不随R增加而无限增强,其拐点大约出现在3个碳的线性取代基(正丙基)或5个碳的环烷基(环戊基)及体积相当的支链烷基[(1-乙基)丙基],进一步研究发现,这些取代基的共同特征为在沿碳链方向有大约3个碳原子的长度,在垂直碳链方向上可以有一定的宽度。

表1 1a~1o对人URAT1体外抑制活性的结果Table 1 Summary of in vitro inhibitory activities(IC50) of 1a~1o against human URAT1
aIC50of 1a~1f and 1g[12-13];bReported IC50of lesinurad was 7.3 μmol·L-1[11]。
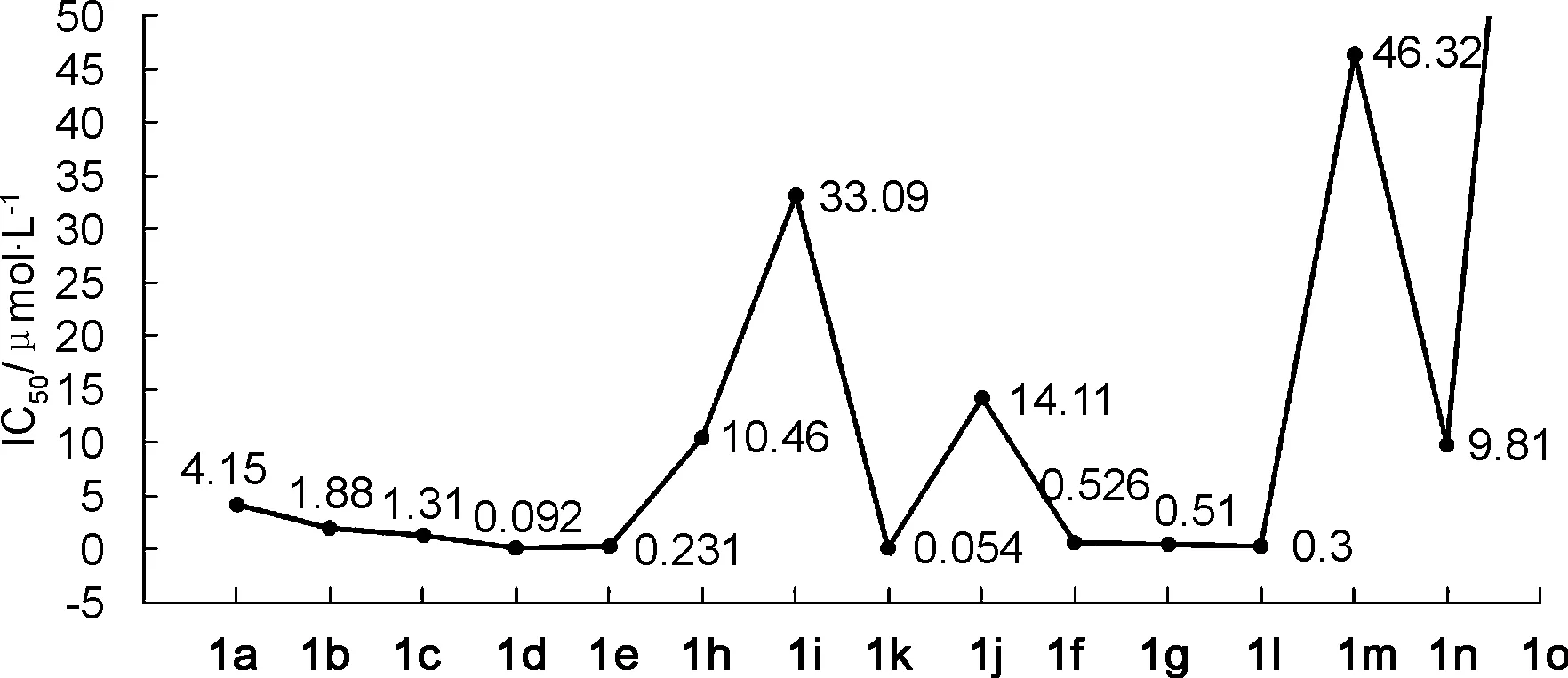
图1 1a~1o体外对人URAT1抑制剂活性(IC50) 随萘环4-位取代基的变化趋势Figure 1 Trend of in vitro inhibitory activities(IC50) of 1a~1o against human URAT1 vs the (cyclo)alkyl group at the 4-position of naphthalene ring
本文合成了8个含萘三氮唑甲烷骨架的硫代乙酸类尿酸转运体1(URAT1)抑制剂(1h~1o),体外活性测试结果显示:对URAT1的抑制活性最强的是1k,其活性是阳性对照药lesinurad的133倍[IC50=0.054 μmol·L-1(1k), 7.18 μmol·L-1(lesinurad)]。并在此基础上系统研究了该类结构(1a~1o)萘环上4-位烷基取代基的构效关系(SAR)。
[1] Richette P, Bardin T. Gout[J].Lancet, 2010,375(9711):318-328.
[2] Neogi T. Gout[J].N Engl J Med, 2011,364(5):443-452.
[3] Shahid H, Singh J A. Investigational drugs for hyperuricemia[J].Expert Opin Investing Drugs,2015,24(8):1013-1030.
[4] Liu H, Zhang X M, Wang Y L,etal.Prevalence of hyperuricemia among Chinese adult:A national cross-sectional survey using multistage,stratified sampling[J].J Nephrol,2014,27(6):653-658.
[5] Singh J A. Emerging therapies for gout[J].Expert Opin Emerging Drugs,2012,17(4):511-518.
[6] 尧贵林,王海勇,陆涛. 促尿酸排泄药物研究进展[J].中国药科大学学报,2013,144(12):1903-1910.
[7] Wood R, Fermer S, Ramachandran S,etal. Patients with gout treated with conventional urate-lowering therapy:Association with disease control,health-related quality of life,and work productivity[J].J Rheumatol, 2016,43(10):1897-1903.
[8] 辛晓,刘钰强,李川,等. 吡啶-4-丙酸类尿酸转运体1(URAT1)抑制剂的设计、合成和生物活性研究[J].中国药物化学杂志,2016,6(39):437-488.
[9] Enomoto A, Kimura H, Chairoungdua A,etal. Molecular identification of a renal urate anion exchanger that regulates blood urate levels[J].Nature,2002,417(6887):447-452.
[10] Pan Y, Kong L D. Urate transporter URAT1 inhibitors:A patent review (2012-2015)[J].Expert Opin Ther Pat,2016,26(10):1129-1138.
[11] Hoy S M. Lesinurad:First global approval[J].Drugs,2016,76(4):509-516.
[12] Zhang X S, Wu J W, Liu W,etal. Discovery of flexible naphthyltriazolylmethane-based thioacetic acids as highly active uric acid transporter 1 (URAT1) inhibitors for the treatment of hyperuricemia of gout[J].Med Chem,2017,13(3):260-281.
[13] Zhang X S, Xin X, Liu W,etal. Synthesis,crystal structure and URAT1 inhibitory activity of 2-((5-bromo-4-((4-cyclobutylnaphth-1-yl)methyl)-4H-1,2,4-triazol-3-yl)thio)acetic acid[J].Chinese J Struct Chem,in press.
Synthesis and The Structure-activity Relationship(SAR) of Naphthyltriazolylmethane-based Thioacetic Acids as Uric Acid Transporter 1(URAT1) Inhibitors
XIN Xiao1,2, LIU Wei2, XIE Ya-fei2, LIU Chang-ying2,TANG Li-da2, XU Wei-ren1,2*, ZHAO Gui-long2*
(1. Graduate School, Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China; 2. Tianjin Key Laboratory of Molecular Design and Drug Discovery, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China)
Eight naphthyltriazolylmethane-based thioacetic acids(1h~1o) were synthesized as uric acid transporter 1(URAT1) inhibitors by 12 steps using 1-bromonaphthalene and ketones or 1-naphthaldehyde and alkyl organometallic reagents as starting materials. The structures were characterized by1H NMR,13C NMR and MS(ESI).InvitroURAT1 inhibitory assay showed that 1k was the most potent URAT1 inhibitor among target compounds, which was 133-fold more potent than positive control lesinurad(IC50=0.054 μmol·L-1for 1k against human URAT1vs7.18 μmol·L-1for lesinurad).
1-bromonaphthalene; 1-naphthaldehyde; gout; hyperuricemia; uric acid transporter 1(URAT1); synthesis; lesinurad; structure-activity relationship
2017-02-22;
2017-03-23
天津市科技支撑计划重点资助项目(16YFZCSY00910)
辛晓(1991-),女,汉族,山东海阳人,硕士研究生,主要从事药物化学方面的研究。
徐为人, E-mail: xuwr@tjipr.com; 赵桂龙, E-mail: zhao_guilong@126.com
O623.626; O621.3
A
10.15952/j.cnki.cjsc.1005-1511.2017.06.17032
