重组蛋白AdipoR1-EGFP真核表达质粒的构建和表达
2017-06-19李霓王潇许艳妮韩小婉刘鹏司书毅
李霓,王潇,许艳妮,韩小婉,刘鹏,司书毅
重组蛋白AdipoR1-EGFP真核表达质粒的构建和表达
李霓,王潇,许艳妮,韩小婉,刘鹏,司书毅
目的构建重组 pEGFP-N1-AdipoR1 真核表达质粒并于HEK293T 细胞中瞬时表达。
方法提取 HepG2 细胞总 RNA,逆转录合成 cDNA,以其为模板,PCR 扩增 AdipoR1 基因,将其插入到 pEGFP-N1质粒中,构建重组真核表达质粒 pEGFP-N1-AdipoR1,通过脂质体法转染 HEK293T 细胞,采用酶标仪测定荧光强度,Western blot 方法鉴定融合蛋白 AdipoR1-EGFP 的表达情况。
结果Western blot 结果显示,融合蛋白 AdipoR1-EGFP在分子量约 70 kD 处可见明显的目的条带;同时,与未转染质粒的空白对照组相比,转染 pEGFP-N1 和pEGFP-N1-AdipoR1 的细胞中荧光强度都有明显升高,表明融合蛋白 AdipoR1-EGFP 在 HEK293T 细胞中成功表达,并且 EGFP 的荧光强度测定能很好地反映细胞中融合蛋白的表达水平。
结论构建并表达 AdipoR1-EGFP 融合蛋白,所采用的EGFP 融合蛋白表达方法简单高效,重复性好,为今后AdipoR1 蛋白的表达及功能研究提供了重要参考。
受体,脂联素; 绿色荧光蛋白质类; 膜融合蛋白质类
脂联素是一种由脂肪组织分泌的脂肪因子,具有抗动脉粥样硬化以及降低血糖等作用[1-3]。已有研究表明,在肥胖、胰岛素抵抗和 2 型糖尿病等人群中,血浆中脂联素水平呈显著降低[4]。脂联素受体(adiponectin receptors,AdipoR)是机体内脂联素的主要受体,包括 AdipoRl 和 AdipoR2 两个亚型,是含有 7 个跨膜结构域的受体蛋白。Yamauchi等[5]于 2003 年首次克隆出人和小鼠的脂联素受体基因,为今后研究其结构和功能提供了重要基础。随后的研究发现,AdipoRl 的表达涉及激活腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)通路,而 AdipoR2 的表达与过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptor,PPAR)信号通路的激活相关,从而它们参与葡萄糖代谢、脂质代谢、炎症反应及氧化应激反应等生理过程的调控。
随着研究内容不断丰富,有研究人员发现,AdipoR1 主要在骨骼肌细胞中表达,与 AMPK 和PPARγ 的共激活因子(PGC)-1α 以及 Ca2+信号通路密切相关,并且能够明显降低与肥胖直接相关的 2 型糖尿病的发生[6-7]。为了进一步探讨 AdipoRl的分子生物学特性,本实验通过构建人 AdipoR1全基因与增强型绿色荧光蛋白(enhanced green flourence protein,EGFP)融合的真核表达质粒,成功在 HEK293T 细胞中进行表达,得到带有 EGFP标签的融合蛋白,为探讨 AdipoR1 蛋白的生物学功能及参与机体代谢机制的研究奠定重要基础。
1 材料与方法
1.1 主要材料
1.1.1 质粒、菌株及细胞株 pEGFP-N1 真核表达质粒,人肝癌细胞 HepG2 细胞株和人胚肾细胞HEK293T 细胞株均由本实验室保存;大肠杆菌E coli. DH5α 感受态细胞购自北京全式金公司。
1.1.2 试剂 DNA marker、胶回收试剂盒和反转录试剂盒购自北京全式金公司;各种限制性内切酶购自日本 Takara 公司;DNA 连接酶购自美国Promega 公司;DNA 聚合酶 2 × Es Taq MasterMix和无内毒素质粒提取试剂盒购自北京康为世纪公司;胎牛血清购自美国 Gibco BRL 公司;转染试剂 Lipofectamine2000、细胞培养基 DMEM 和转染用 opti-MEM 培养基均购自美国 Invitrogen 公司;小鼠抗 GFP 单克隆抗体购自美国 Abmart 公
司;小鼠抗 Actin 单克隆抗体和化合物罗格列酮(rosiglitazone)购自美国 Sigma 公司;HRP 标记的山羊抗小鼠 IgG 购自北京中杉金桥公司;RIPA裂解液、电转移缓冲液以及其他 Western blot 实验相关试剂均购自北京普利来公司;细胞培养板购自美国 Corning 公司;BCA 蛋白浓度测定试剂盒购自美国 ThermoFisher 公司。
1.1.3 主要仪器 EnVision 2104 型酶标仪为美国 PerkinElmer 公司产品;Tanon5200 型 ECL 发光仪为北京天能公司产品。
1.2 方法
1.2.1 引物设计及合成 我们在 NCBI 数据库中查到 AdipoRl(NM_015999.5)基因全长为1128 bp,共编码 375 个氨基酸,蛋白分子量约为43 kD。根据其编码序列设计引物,上游引物:5' TC CGCTCGAG ATGTCTTCCCACAAAGGAT 3'(下划线部分为 Xho I 酶切位点);下游引物:5' TCGGG ATCCCAGAGAAGGGTGTCATCAGTAC 3'(下划线部分为 BamH I 酶切位点),扩增全长片段,引物由北京睿博兴科生物技术有限公司合成。
1.2.2 AdipoRl 基因的扩增 提取 HepG2 细胞总 RNA,逆转录合成总 cDNA,以该 cDNA 为模板,进行 PCR 扩增 AdipoRl 基因。反应体系为:模板 cDNA(100 ng/ml)2 μl,上下游引物(10 μmol/L)各 2 μl,DNA 聚合酶 2 × Es Taq MasterMix 25 μl,补足 ddH2O 至总体系为 50 μl。反应条件为:94 ℃ 5 min;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 50 s,共 35 个循环;72 ℃ 10 min。PCR 产物经 1% 琼脂糖凝胶电泳鉴定。
1.2.3 重组真核表达质粒 pEGFP-N1-AdipoR1的构建 将 AdipoRl 的 PCR 产物及质粒pEGFP-N1 分别进行 Xho I 和 BamH I 双酶切反应,经琼脂糖凝胶电泳后,回收目的基因片段及载体片段,经 T4 DNA 连接酶于 25 ℃ 连接 3 h,之后转化至大肠杆菌 E.coli DH5α 感受态细胞,经菌落 PCR 鉴定为阳性克隆后,提取质粒。将重组质粒进行双酶切鉴定,并送至北京睿博兴科生物技术有限公司合成测序,测序正确的质粒命名为pEGFP-N1-AdipoR1。
1.2.4 重组真核表达质粒的转染和细胞给药处理 HEK293T 细胞用含 10% 胎牛血清的DMEM 培养基,于 5% CO2孵箱中 37 ℃ 恒温培养。转染前一天,消化细胞,按 2.5 × 105个/ ml 接种至 6 孔板中。待第二天细胞贴壁后,需要转染组的每个孔按照如下方法进行转染:将 4 μg 的pEGFP-N1-AdipoR1 质粒溶于 250 μl opti-MEM 培养液中,之后将 10 μl 转染试剂 Lipofectamine2000与 240 μl opti-MEM 培养基混合,室温孵育 5 min,再将上述两种溶液混合,并室温孵育 20 min,之后每孔再补加 2 ml 含 10% 胎牛血清的 DMEM完全培养基。同时设置未转染质粒组作为空白对照组,与 pEGFP-N1 质粒转染组都于 37 ℃ 培养6 h。之后,加药组的细胞在转染 6 h 后,更换为含有终浓度为 10 μmol/L 罗格列酮的 DMEM 培养基;不加药组细胞更换为完全培养基,继续培养18 h。
1.2.5 Western blot 法对融合蛋白进行鉴定 收集上述转染后 18 h 的细胞,用RIPA 裂解液于冰上裂解 30 min,提取细胞内总蛋白,并采用 BCA蛋白定量试剂盒对蛋白浓度进行检测。按照每孔7.5 μg 总蛋白量上样,经 10% SDS-PAGE 电泳分离后,电转移至 PVDF 膜上,用含有 5% 脱脂奶粉的封闭液于室温振荡,封闭 1 h,相应蛋白分别加入各自对应抗体,小鼠抗 GFP 单克隆抗体(1∶2000 稀释),小鼠抗 β-actin 单克隆抗体(1∶5000 稀释),4 ℃ 孵育过夜。第二天,用 TBST溶液洗膜 3 次,每次 15 min,随后加入 HRP 标记的山羊抗小鼠 IgG 二抗(1∶2000 稀释),室温振荡 2 h,用 TBST 溶液洗膜 3 次,每次 15 min,之后利用 ECL 发光仪进行成像检测。
1.2.6 利用酶标仪检测融合蛋白的表达 收集上述转染后 18 h 的细胞,用 RIPA 裂解液冰上裂解30 min,提取细胞总蛋白,并采用 BCA 蛋白定量试剂盒对蛋白浓度进行检测。将蛋白样品按照每孔20 μl 加入 384 孔板黑板中,避光,利用酶标仪检测其荧光密度,激发波长为 480 nm,发射波长为535 nm。读取数值,并根据蛋白浓度得到其相对强度,鉴定细胞内 AdipoR1-EGFP 重组蛋白表达情况。
1.3 统计学处理
数据用 GraphPad Prism 5 统计软件分析,采用表示,计量组间比较用 one-way ANOVA 检验,P < 0.05 为差异有统计学意义。
2 结果
2.1 人 AdipoRl 全长基因的扩增
以 HepG2 的 cDNA 为模板,扩增 AdipoRl全长基因片段,PCR 产物经 1% 琼脂糖凝胶电泳检测。结果表明,在 800 ~ 1500 bp 之间有一特异性明亮条带,其大小与预期值 1128 bp 相符,如图 1 所示。
2.2 重组表达质粒 pEGFP-N1-AdipoR1 的构建
对 pEGFP-N1 载体和回收的 AdipoR1 PCR产物进行 Xho I 和 BamH I 双酶切反应,切胶回收酶切后的载体及目的基因片段,经 T4 DNA 连接酶进行连接,转化入 E.coli DH5α 感受态细胞内,挑取阳性克隆进行菌落 PCR 验证(图 2),菌株 1 ~ 4 号均扩增出与预期大小一致的目的基因条带。挑取其中菌株 1 和 2 保菌并且提取质粒,将重组质粒 pEGFP-N1-AdipoR1 进行 Xho I 和BamH I 双酶切验证,结果见图 3。空载体pEGFP-N1 并未见有目的条带被切下,而阳性克隆的质粒 1 和 2 号的酶切结果中均有与目的基因大小一致的条带。同时,将这两个阳性克隆测序,结果与目标基因片段完全一致,我们将此重组表达质粒命名为 pEGFP-N1-AdipoR1。
2.3 融合蛋白 AdipoR1-EGFP 在 HEK293T 细胞中的表达
我们将重组表达质粒 pEGFP-N1-AdipoR1 转染至 HEK293T 细胞后,提取蛋白进行 Western blot 检测。结果显示,在分子量约 70 kD 大小处可见明显的目的蛋白条带,与融合蛋白 AdipoR1-EGFP预期值相符;而只转染了 pEGFP-N1 对照质粒的细胞中,EGFP 荧光蛋白大小为 27 kD(图 4A),说明重组质粒 pEGFP-N1-AdipoR1 成功在HEK293T 细胞中表达。
同时,分别提取细胞中蛋白,进行相对荧光强度检测。结果如图 4B 所示,与未转染质粒的空白对照组相比,转染 pEGFP-N1 和 pEGFP-N1-AdipoR1的细胞中荧光强度都有明显升高(P < 0.001),说明带有荧光标记的 EGFP 和融合蛋白 AdipoR1-EGFP均在 HEK293T 细胞中成功表达。
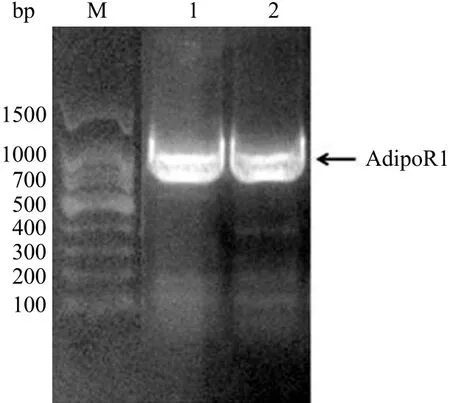
图 1 AdipoR1 PCR 扩增产物结果Figure 1 PCR product of human AdipoR1 gene
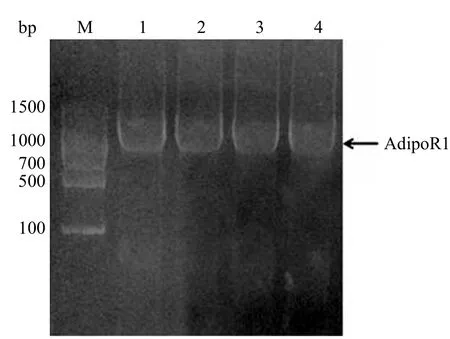
图 2 重组质粒 pEGFP-N1-AdipoR1 的菌落 PCR 电泳结果Figure 2 PCR product of pEGFP-N1-AdipoR1 in E.coli DH5α
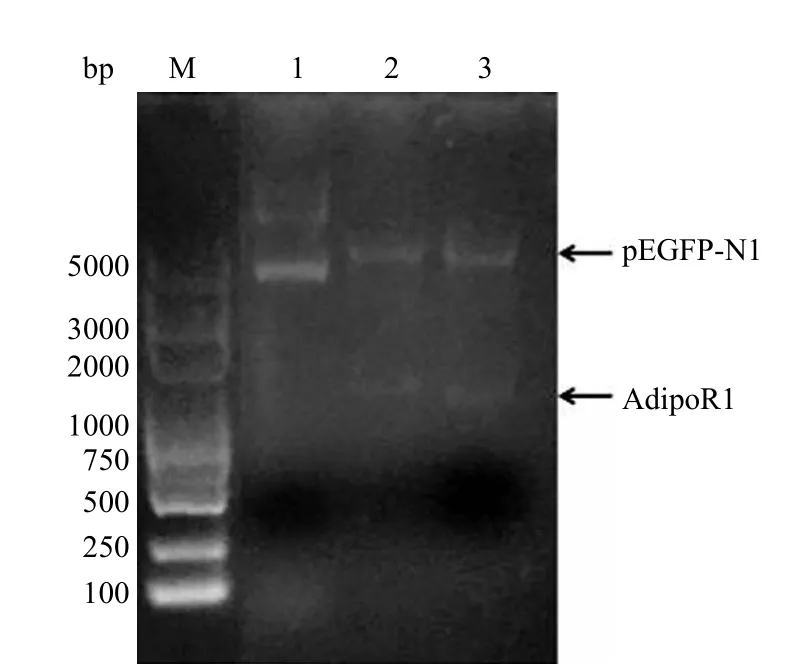
图 3 重组质粒 pEGFP-N1-AdipoR1 的酶切结果Figure 3 Product of pEGFP-N1-AdipoR1 digested with Xho I /BamH I
2.4 罗格列酮对融合蛋白 AdipoR1-EGFP 表达的影响
AdipoR1 在参与糖代谢和脂代谢等生理过程中起到重要作用,但目前研究尚未发现其与核受体PPARγ 之间是否存在直接关联。罗格列酮是目前公认的 PPARγ 激动剂,在我们实验中,分别加入不同浓度的罗格列酮处理转染的细胞,通过对细胞中荧光值的检测,判断是否能够上调 AdipoR1-EGFP融合蛋白的表达。结果表明,与未加入化合物的对照组相比,1 或 10 μmol/L 罗格列酮处理后的细胞中荧光强度并没有发生明显改变(P > 0.05),说明罗格列酮不会上调 AdipoR1-EGFP 的表达,因此初步推测 PPARγ 与 AdipoR1 并不直接相关(图 5)。
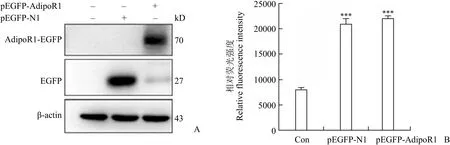
图 4 融合蛋白 AdipoR1-EGFP 表达的检测结果[A:HEK293T 细胞中,融合蛋白 AdipoR1-EGFP 表达的 Western blot 结果;B:HEK293T 细胞中,融合蛋白 AdipoR1-EGFP 表达的荧光强度检测结果(***P < 0.001 vs.对照组)]Figure 4 The expression of AdipoR1-EGFP [A: Western blot result of AdipoR1-EGFP in HEK293T cells; B: Relative flourescence intensity of AdipoR1-EGFP in HEK293T cells (***P < 0.001vs. control)]
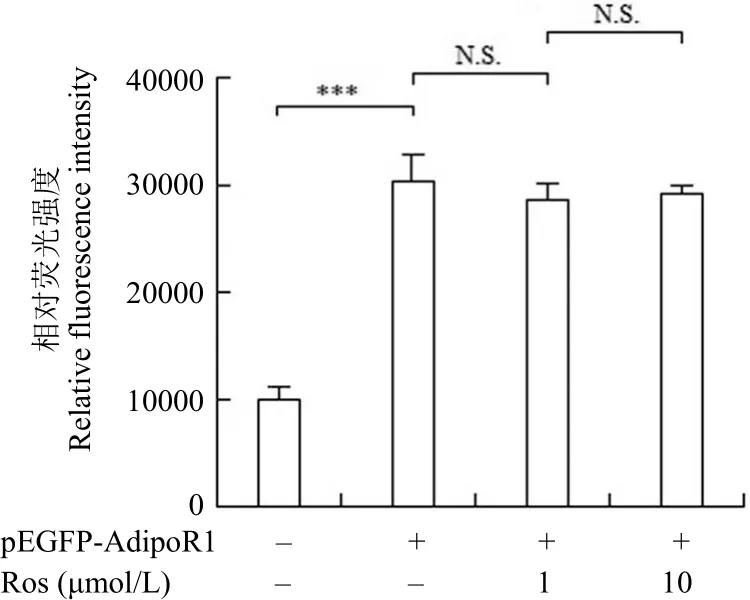
图 5 罗格列酮对 AdipoR1-EGFP 蛋白表达的影响(***P <0.001;N.S. 无显著差异)Figure 5 The influence of AdipoR1-EGFP expression treating with rosiglitazone (***P < 0.001;N.S. no significance)
3 讨论
脂联素作为机体中重要的脂肪细胞因子,对机体能量代谢有着重要调节作用,尤其在胰岛素抵抗、肥胖和 2 型糖尿病中,其表达量明显降低。脂联素受体能够与脂联素结合,通过一系列生物机制介导后,具有调节糖脂代谢和改善胰岛素敏感性的作用,以及抗炎、抗动脉粥样硬化等特性[8]。2015年,Tanabe 等[9]将 AdipoR1 及 AdipoR2 的全新晶体结构破译。AdipoR1/R2 由 N 端胞内结构域、7 次跨膜结构域以及 C 端胞外结构域组成,其跨膜部分包含锌离子结合位点和脂联素结合面,其结构和功能均区别于经典的受体蛋白 G-蛋白偶联受体,该结构的揭示为新的脂联素受体激动剂的发现及优化提供了新的途径。
EGFP 作为一种新型荧光报告分子,具有表达稳定、便捷、直观、易操作等优点。本实验围绕 AdipoR1 的相关功能,基于人的 AdipoR1 全长基因,构建了带有 EGFP 荧光标记的真核表达质粒,并转染到哺乳动物细胞中,成功表达了AdipoR1-EGFP 融合蛋白,其表达既可通过 EGFP的抗体检测,同时也可以通过酶标仪测定荧光值确定细胞内蛋白表达量,具有灵敏度高、操作简便等优点。
脂联素受体的表达调控还与胰岛素水平及胰岛素抵抗、核受体 PPARγ、肿瘤坏死因子-α 等密切相关。Tsuchida 等[10]和 Felder 等[11]认为链脲佐菌素诱导的糖尿病鼠和肥胖鼠的骨骼肌和脂肪组织中,体内胰岛素水平与 AdipoR1 和 AdipoR2 呈负相关。目前对于参与糖代谢过程中,PPARγ 与AdipoR1 是否直接相关仍有待研究。在本实验中,我们加入罗格列酮处理细胞,发现细胞中的AdipoR1-EGFP 蛋白表达并无明显上调,这与部分研究结果相符合,但仍需要进一步研究及深入探讨[12-13]。但 Tan 等[14]研究发现,罗格列酮治疗2 型糖尿病的受试者 12 周后与安慰剂对照组比较,AdipoR1 表达上调,AdipoR2 表达无改变,推测可能是由于罗格列酮降低了高胰岛素血症受试者胰岛素的浓度,从而削弱体内由胰岛素下调所引起的 AdipoR1 表达的作用。同时,也有研究者发现,吡格列酮可上调 2 型糖尿病大鼠血清脂联素及骨骼肌 AdipoR1 的表达,从而调节糖脂代谢,改善胰岛素抵抗[15]。
目前,针对 AdipoR1 表达的研究主要集中在不同受体类激动剂对于 AdipoR1 内源表达水平的影响,因此本实验中构建的带有 EGFP 标记的融合蛋白将为 AdipoR1 在细胞中表达及相关通路研究提供新的途径。综上所述,本实验将 EGFP作为报告基因,成功构建并表达真核重组质粒pEGFP-N1-AdipoR1,该方法的建立为 AdipoR1 相关通路的机制研究提供了新方法,为以 AdipoR1为靶点的新型筛选模型建立以及 AdipoR1 小分子上调剂的筛选奠定了基础,同时为糖尿病等代谢性疾病药物的研发提供了新的手段和思路。
[1] Scherer PE, Williams S, Fogliano M, et al. A novel serum protein similar to C1q, produced exclusively in adipocytes. J Biol Chem, 1995, 270(45):26746-26749.
[2] Yamauchi T, Kamon J, Waki H, et al. The fat-derived hormone adiponectin reverses insulin resistance associated with both lipoatrophy and obesity. Nat Med, 2001, 7(8):941-946.
[3] Kubota N, Terauchi Y, Yamauchi T, et al. Disruption of adiponectin causes insulin resistance and neointimal formation. J Biol Chem, 2002, 277(29):25863-25866.
[4] Hotta K, Funahashi T, Arita Y, et al. Plasma concentrations of a novel, adipose-specific protein, adiponectin, in type 2 diabetic patients. Arterioscler Thromb Vasc Biol, 2000, 20(6):1595-1599.
[5] Yamauchi T, Nio Y, Maki T, et al. Targeted disruption of AdipoR1 and AdipoR2 causes abrogation of adiponectin binding and metabolic actions. Nat Med, 2007, 13(3):332-339.
[6] Handschin C, Spiegelman BM. The role of exercise and PGC1alpha in inflammation and chronic disease. Nature, 2008, 454(7203):463-469.
[7] Cantó C, Gerhart-Hines Z, Feige JN, et al. AMPK regulates energy expenditure by modulating NAD+ metabolism and SIRT1 activity. Nature, 2009, 458(7241):1056-1060.
[8] Matsuzawa Y. Adipocytokines: emerging therapeutic targets. Curr Atheroscler Rep, 2005, 7(1):58-62.
[9] Tanabe H, Fujii Y, Okada-Iwabu M, et al. Crystal structures of the human adiponectin receptors. Nature, 2015, 520(7547):312-316.
[10] Tsuchida A, Yamauchi T, Ito Y, et al. Insulin/Foxo1 pathway regulates expression levels of adiponectin receptors and adiponectin sensitivity. J Biol Chem, 2004, 279(29):30817-30822.
[11] Felder TK, Hahne P, Soyal SM, et al. Hepatic adiponectin receptors (ADIPOR) 1 and 2 mRNA and their relation to insulin resistance in obese humans. Int J Obes (Lond), 2010, 34(5):846-851.
[12] Kaltenbach S, Staiger H, Weisser M, et al. Adiponectin receptor gene expression in human skeletal muscle cells is not regulated by fibrates and thiazolidinediones. Int J Obes (Lond), 2005, 29(7):760-765.
[13] Sun X, Han R, Wang Z, et al. Regulation of adiponectin receptors in hepatocytes by the peroxisome proliferator-activated receptor-gamma agonist rosiglitazone. Diabetologia, 2006, 49(6):1303-1310.
[14] Tan GD, Debard C, Funahashi T, et al. Changes in adiponectin receptor expression in muscle and adipose tissue of type 2 diabetic patients during rosiglitazone therapy. Diabetologia, 2005, 48(8):1585-1589.
[15] Liu J, Liu KZ, Liu Q. Effect of pioglitazone on expression of AdipoR1 in skeletal muscle of type 2 diabetic rats. Chin J Arterioscler, 2012, 20(3):226-230. (in Chinese)刘洁, 刘宽芝, 刘琼. 吡格列酮对2型糖尿病大鼠骨骼肌脂联素受体1表达的影响. 中国动脉硬化杂志, 2012, 20(3):226-230.
Construction and expression of eukaryotic expression vector for AdipoR1-EGFP recombinant protein
LI Ni, WANG Xiao, XU Yan-ni, HAN Xiao-wan, LIU Peng, SI Shu-yi
ObjectiveTo construct an eukaryotic recombinant expression vector for AdipoR1 gene and express it in human HEK293T cells.
MethodsTotal RNA was extracted from HepG2 cells and reversely transcribed to cDNA, which was used as a template for amplification of AdipoR1 gene by RT-PCR. The amplified AdipoR1 gene was inserted to vector pEGFP-N1, then the constructed recombinant vector pEGFP-N1-AdipoR1 was transfected to HEK293T cells using Lipofectamine. The expression of fusion protein AdipoR1-EGFP was determined by Western blot and the fluorescence intensity was measured by a microplate reader.
ResultsIn Western blot assay, the fusion protein AdipoR1-EGFP was expressed with the 70 kD molecular weight. Furthermore, compared to the blank group without transfection, the relative fluorescence intensity of pEGFP-N1 and pEGFP-N1-AdipoR1 group increased significantly. These indicated that the fusion protein AdipoR1-EGFP was successfully expressed in HEK293T cells, and the expression level of fusion protein could be determined by measuring the fluorescence intensity of EGFP.
ConclusionRecombinant eukaryotic expression vector pEGFP-N1-AdipoR1 is constructed and the fusion protein is successfully expressed in HEK293T cells. This method is simple, efficient and reproducible, which provides a reference for further study on the expression and function of AdipoR1.
Receptors, adiponectin; Green fluorescent proteins; Membrane fusion proteins
: SI Shu-yi, Email: sisyimb@hotmail.com
国家自然科学基金(81503065)
100050 北京,中国医学科学院北京协和医学院药物研究所天然药物活性物质与功能国家重点实验室(李霓),医药生物技术研究所国家新药(微生物)筛选实验室(李霓、王潇、许艳妮、韩小婉、刘鹏、司书毅)
司书毅,Email:sisyimb@hotmail.com
2017-02-22
10.3969/j.issn.1673-713X.2017.03.004
www.cmbp.net.cn Chin Med Biotechnol, 2017, 12(3):215-220
www.cmbp.net.cn 中国医药生物技术, 2017, 12(3):215-220
Author Affiliations: State Key Laboratory of Bioactive Substance and Function of Natural Medicines, Institute of Materia Medica
(LI Ni), National Center for Microbial Drug Screening, Institute of Medicinal Biotechnology (LI Ni, WANG Xiao, XU Yan-ni, HAN Xiao-wan, LIU Peng, SI Shu-yi), Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China
