人肝细胞核因子4基因II型启动子的双向转录调控的特性
2017-06-19赵琼蒋建东张靖溥
赵琼,蒋建东,张靖溥
人肝细胞核因子4基因II型启动子的双向转录调控的特性
赵琼,蒋建东,张靖溥
目的探讨人肝细胞核因子 4α 基因 II 型启动子(hHNF4α-P2)双向调控基因表达的作用。
方法克隆 hHNF4α-P2 –23 ~ –1291(1268 bp)序列;构建由该段正、反序列驱动的荧光蛋白真核表达载体;将其通过细胞转染和显微注射导入细胞或斑马鱼体内,考察其表达的时空特性。通过 DNA 缺失实验和序列预测分析寻找hHNF4α-P2 的正、反向核心启动序列。
结果hHNF4α-P2 的正向和反向 DNA 序列(–23 ~ –1291)均可驱动其下游报告基因在人正常肝细胞 L02 及肝癌细胞 Huh7 中表达;在斑马鱼体内正向启动子驱动的红色荧光蛋白基因可在耳石、嗅泡和神经丘等感觉器官中高表达,在肝区可见较弱的红色荧光。反向启动子驱动的绿色荧光蛋白基因可在血细胞、神经细胞、体节及脊索等组织表达。该启动子正链存在一段核心序列,反链存在两段核心序列。
结论首次发现 hHNF4α-P2 的 –23 ~ –1291 序列具有双向调控基因在不同组织表达的功能。
肝细胞核因子 4α; 基因表达; 斑马鱼;双向启动子
肝细胞核因子 4α(hepatocyte nuclear factor 4α,HNF4α)位于人基因组第 20 号染色体上,是一类高度保守的核受体超家族成员,对于肝细胞分化和功能[1]、胰腺 β 细胞功能的维持[2]等发挥重要的调控作用。HNF4α 基因座含有相距约 46 kb 的两个启动子区域 P1 和 P2,其转录调控具有明显的时空差异性。在小鼠胚胎肝脏中,P2 转录的 HNF4α亚型水平远高于 P1 的产物[3-4],而成年肝细胞中则以 P1 表达的 HNF4α 为主[3-5],两者在胃、肾脏、小肠、胰脏 β 细胞等组织的表达也有差异[4]。这两种启动子的差异性调控还表现在诸多的肿瘤中[6-7]。因此,研究 HNF4α 启动子转录调控的复杂性对于全面了解该蛋白在胚胎发育及病理过程中的作用具有重要意义。另外,双向启动子是基因调控多样性和协调性的重要机制,这种基因现象在脊椎动物中普遍存在[8],但实验证据相对较少。本文报道了人 HNF4α II 型启动子(HNF4α-P2)区域约 1.3 kb序列在斑马鱼胚胎中的双向启动子功能。
1 材料与方法
1.1 试剂及材料
胰蛋白胨及酵母提取物购自英国 Oxoid 公司;琼脂糖和转染试剂 Lipofectamine2000 购自美国 Invitrogen 公司;DNA 片段凝胶回收试剂盒、Taq DNA 聚合酶、限制性内切酶、DTT、dNTP、T4 DNA 连接酶、pMD19-T 载体均购自日本Takara 公司;质粒中提试剂盒及细胞基因组提取试剂盒购自天根生化科技(北京)有限公司;细胞培养所需的 DMEM 培养基及胎牛血清购自美国Gibco 公司;细胞培养瓶购自德国 Nunc 公司;人肝细胞系 HepG2 细胞、L02 细胞和缺失了 CMV启动子序列的 pdCMVP-EGFP-N1 由本实验室保存;pIRES2-DsRed 由杭州师范大学张亮惠赠;斑马鱼(Daniorerio)AB 系由清华大学生命科学院孟安明教授惠赠。
1.2 方法
1.2.1 引物设计与合成 根据 GenBank 中hHNF4α-P2 启动子序列设计相关引物,由生工生物工程(上海)股份有限公司北京合成部合成,序列如表 1 所示。所克隆的 hHNF4α-P2 启动子序列约为 1.3 kb。
1.2.2 hHNF4α-P2 启动子的克隆与表达载体的连接 按基因组 DNA 提取试剂盒说明书提取HepG2 细胞基因组 DNA。以 HepG2 细胞基因组DNA 为模板,以 hHNF4α-P2-F 和 hHNF4α-P2-R为引物(表 1),通过 touch down PCR 方法扩增得到约 1.3 kb 的目的片段。PCR 条件为 95 ℃ 30 s,68 ~ 50 ℃ 30 s,72 ℃ 2 min,每两个循环退火温度降低 2 ℃;然后 95 ℃ 30 s,50 ℃ 30 s,72 ℃ 2 min,循环 30 次。将获得的目的片段连入 pMD-19T 载体,经测序确认得到目的启动子序列。利用pMD-19T 载体酶切位点 Hind III、BamH I 和pdCMVP-EGFP-N1 上相同酶切位点构建反向表达载体;利用 pMD-19T 载体 Hind III、BamH I 两个酶切位点和 pdCMVP-EGFP-N1 上 Hind III 和Bgl II 两个酶切位点,构建正向表达载体。通过PCR 方法,以 pIRES2-DsRed 为模板扩增 DsRed基因片段,并通过 Hind III 和 Bgl II 两个酶切位点连入已构建的反向表达载体,构建双向表达载体(图 1)。用去内毒素质粒提取试剂盒提取无内毒素的重组质粒备用。用带 BamH I 酶切位点及其保护碱基的正向引物及带 Hind III 酶切位点及其保护碱基的反向引物,以 pMD-19T-hHNF4α-P2 重组质粒为模板,通过 PCR 方法扩增截短的目的片段,并以与克隆的 1.3 kb 启动子区域相同的酶切位点将截短片段连入相应的表达载体,获得 P2 DNA 系列缺失的报告基因表达构件。

表 1 引物序列Table 1 Sequences of primers
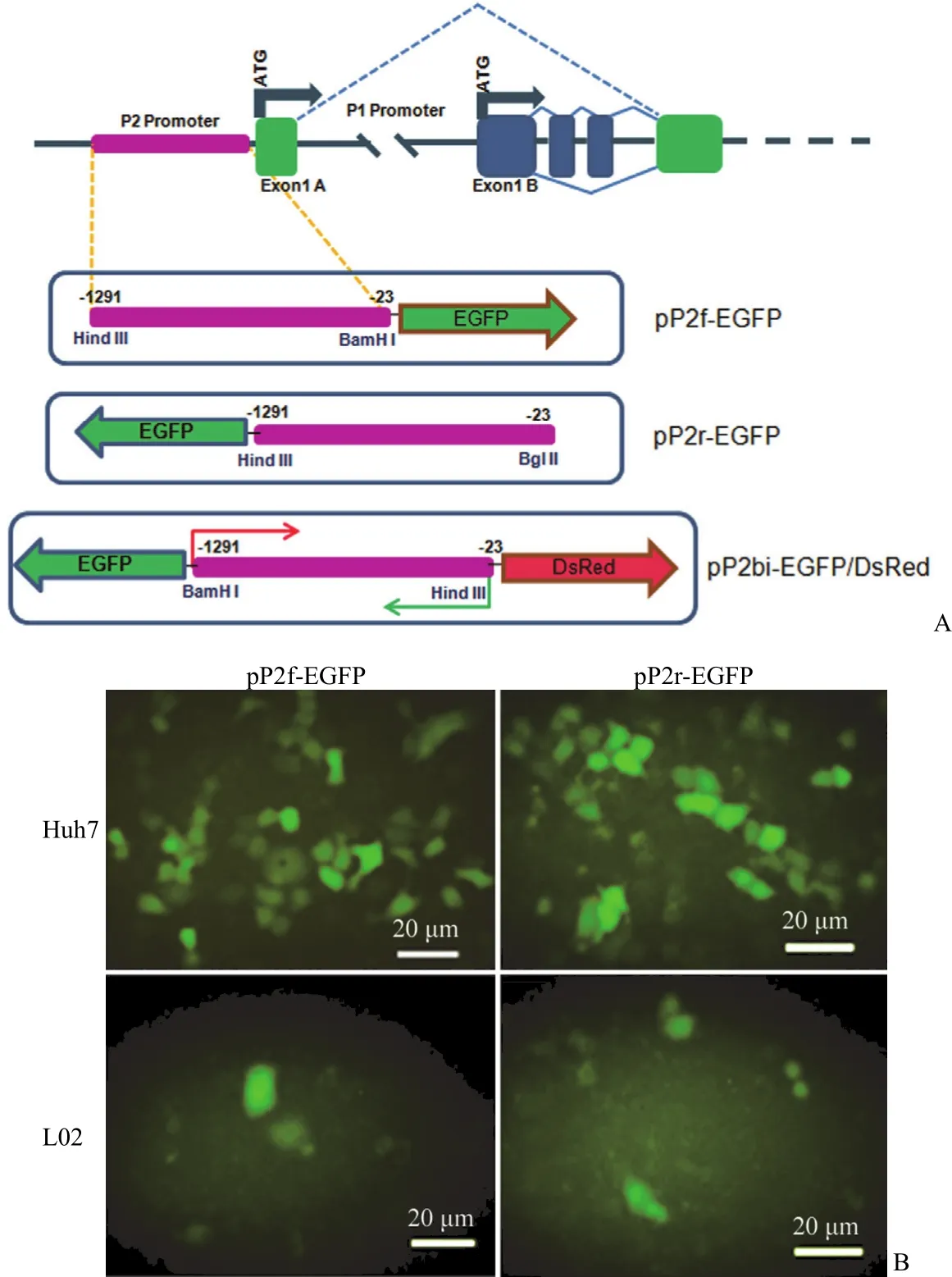
图 1 hHNF4α-P2 启动子双向转录基因构件示意图及其细胞转染结果[A:hHNF4α 基因座结构及 hHNF4α-P2 双向启动子基因构件示意图;B:分别转染正向(pP2f-EGFP)或反向(pP2r-EGFP)hHNF4α-P2 驱动的真核表达基因构件到 L02 细胞和 Huh7 细胞中,培养 24 h 后的荧光显微图片]Figure 1 Schemes of bidirectional expression constructs of hHNF4α-P2 promoter with EGFP or/and DsRed reporter genes and their expression in cell lines [A: Schemes of hHNF4α gene locus structure and constructs of fluorescent reporter gene expression driven by hHNF4α-P2 bidirectional promoter; B: Fluorescence microscope images of L02 and Huh7 cells transfected with pP2f-EGFP or pP2r-EGFP for 24 h, respectively]
1.2.3 启动子活性检测 在含 10% 胎牛血清的DMEM 培养基,37 ℃,5% CO2条件下培养 L02和 Huh7 细胞。传至 48 孔板培养 24 h,用转染试剂 Lipofectamine2000 推荐的方法瞬时转染 6 h,其中构建的单向启动子表达质粒转染量为 100 ng/孔。转染 24 h 后,用荧光显微镜观察绿色荧光蛋白(EGFP)表达情况。
1.2.4 启动子表达图谱检测 将 hHNF4α-P2 启动子双向表达构件注射到 0 ~ 4 细胞期的斑马鱼胚胎,并从受精后 12 h(12 hpf)开始观察红色荧光蛋白和绿色荧光蛋白表达情况至受精后 10 d(10 dpf)。用荧光显微镜或激光共聚焦显微镜进行拍照。
1.2.5 核心启动子区域预测 在 http://www. fruitfly.org/ 上输入目标启动区域序列进行核心启动子区域预测。
2 结果
2.1 hHNF4α-P2 启动子的克隆及表达载体的构建
根据 NCBI 上 hHNF4α 基因座序列(Homo sapiens chromosome 20, GRCh37.p5 Primary Assembly)设计引物,如表 1,以人肝癌细胞系HepG2 基因组为模板,克隆得到 hHNF4α-P2 启动子区域 –23 ~ –1291(1268 bp)。分别以BamH I 和Hind III 两个酶切位点分别以正向(5' → 3')和反向(3' → 5')连入经实验室改造启动区域缺失的pdCMVP-EGFP-N1,基于 hHNF4α 基因转录方向,将同 hHNF4α 方向(5 '→ 3')插入 EGFP 报告基因的基因表达构件命名为 pP2f/hnf4-EGFP(pP2f-EGFP),将在 hHNF4α 方向的上游反向(3' → 5')插入 EGFP 的基因表达构件命名为pP2r/hnf4-EGFP(pP2r-EGFP)。将 EGFP 和 DsRed(编码红色荧光蛋白基因)分别插入到 P2 序列的上游和下游,构成双向报告基因表达构件,命名为 pP2bi/hnf4-EGFP/DsRed(pP2bi-EGFP/DsRed)(图 1A)。将上述两个单向表达构件分别转染肝细胞 L02 及肝癌细胞 Huh7,均可见报告基因 EGFP有效表达(图 1B),证明了这段序列的双向启动转录的功能。
2.2 hHNF4α-P2 启动子驱动的报告基因在斑马鱼胚胎中的表达
将 hHNF4α-P2 双向报告基因表达构件pP2bi-EGFP/DsRed 注射到 0 ~ 4 细胞期的斑马鱼受精卵中并观察 DsRed 和 EGFP 两种荧光蛋白表达情况。正向启动子驱动红色荧光蛋白 DsRed的表达,在 3 dpf 可见耳石(听觉和体位感受器前体)处有明显的红色荧光信号,如图 2A 白色箭头所示。斑马鱼发育 5 dpf 时,嗅泡(嗅觉器官前体)和侧线神经丘(含丰富的毛细胞,感受水流和听觉)可见明显红色荧光;在肝芽区也可见红色荧光(图 2B 和 2C)。直至 10 dpf,在耳石、嗅泡和侧线神经丘仍可观察到明显的红色荧光信号。
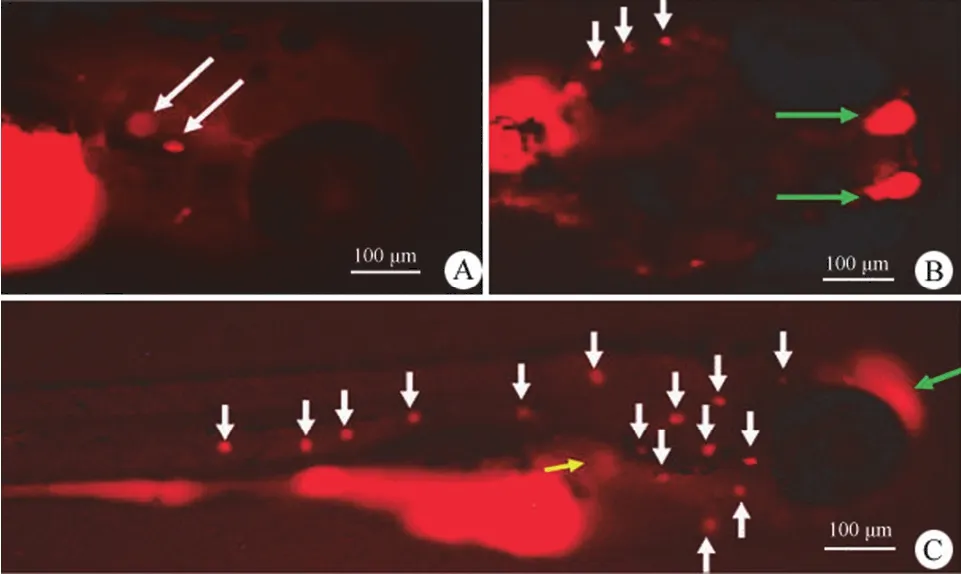
图 2 hHNF4α-P2 启动子在斑马鱼胚胎中正向表达的图谱[A:3 dpf 幼体的耳石(白色箭头,右侧面观);B:5 dpf 幼体的嗅泡(绿色箭头)和侧线神经丘(白色箭头)(背面观);C:5 dpf 幼体的嗅泡(绿色箭头)、肝芽(黄色箭头)和侧线神经丘毛细胞(白色箭头)(右侧面观)]Figure 2 Expression patterns of hHNF4α-P2 promoter in the forward transcriptional direction in zebrafish larvae [A: Otoliths (3 dpf, white arrows, right lateral view); B: Olfactory bulbs (green arrows) and neuromasts (white arrows) (5 dpf, dorsal view); C: Olfactory bulb (green arrow), liver bud (yellow arrow) and neuromasts of hair cells (white arrows) (5 dpf, right lateral view)]
斑马鱼胚胎注射 pP2r-EGFP(P2 启动子上游反向插入的绿色荧光蛋白编码序列的表达构件)后,于 16 hpf 开始在胚胎的脑部、心脏、脊索和表皮等部位表达。随着斑马鱼胚胎发育,绿色荧光信号明显出现在多个组织器官:表皮细胞、神经管、脑神经细胞、体节(肌节为主)、脊索细胞和血液细胞(图 3)。这些部位的绿色荧光信号可以持续至 10 dpf。此结果提示,反向启动子所驱动的基因可能主要在中胚层和外胚层来源的早期组织器官表达。
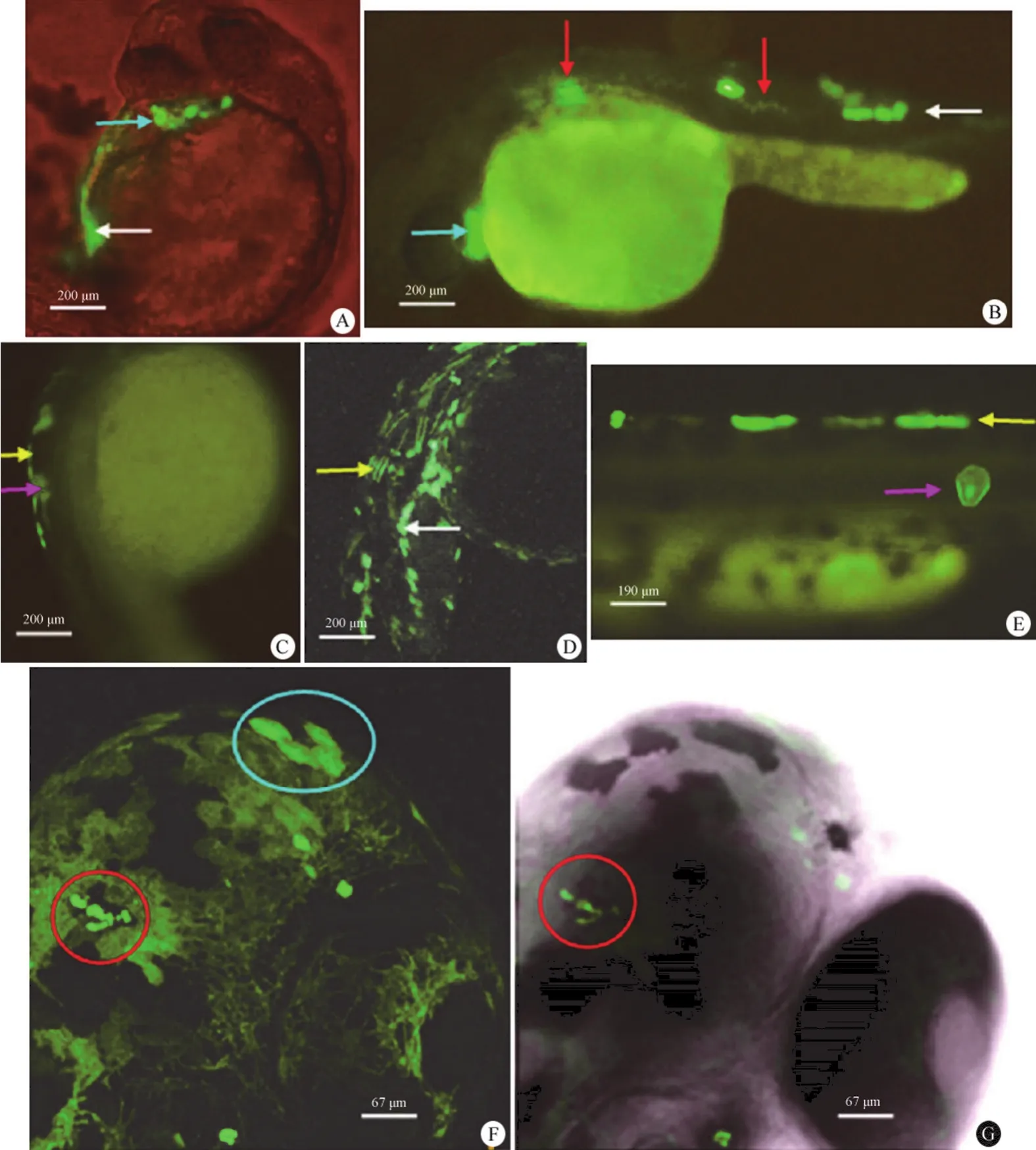
图 3 hHNF4α-P2 启动子在斑马鱼胚胎中反向表达的图谱[A:24 hpf 的血细胞(白色箭头)和心脏(浅蓝色箭头);B:24 hpf 的心脏(浅蓝色箭头)、神经管(红色箭头)和脊索(白色箭头);C:24 hpf 的表皮(黄色箭头)和脊索细胞(粉红色箭头);D:24 hpf 的体节(黄色箭头)和血细胞(白色箭头);E:48 hpf 的表皮(黄色箭头)和脊索细胞(粉红色箭头);F:48 hpf 脑部神经元(红圈)和表皮细胞(浅蓝色圈);G:48 hpf 脑部神经元(红圈);F 与 G 分别为同一视野的荧光图像(激发光波长:488 nm)和可见光图像]Figure 3 Expression patterns of hHNF4α-P2 promoter in the reverse transcriptional direction [A: Haemocytes (white arrow) and heart (light-blue arrow), 24 hpf; B: Neural tube (red arrows), notochordal cells (white arrow) and heart (light-blue arrow), 24 hpf; C: Epiderm cells (yellow arrow) and notochordal cells (pink arrow), 24 hpf; D: Somites (yellow arrow) and haemocytes (white arrow), 24 hpf; E: Epiderm (yellow arrow) and notochordal cells (pink arrow), 48 hpf; F: Brain cells (red circle) and epiderm cells (light-blue circle), 48 hpf; G: Brain cells (red circle), 48 hpf; G is the same view of the fluorescent (Ex: 488 nm) image with F under the white light]
2.3 hHNF4α-P2 正向启动子核心启动序列分析
为寻找 P2 启动子的核心启动序列,我们对P2 序列进行了系列缺失突变,并将截短的启动子序列以相同的酶切位点连入双向表达载体中。通过斑马鱼体内暂态基因表达实验发现 P2 DNA –529~ –587 序列(仅 58 个碱基)的正向序列具有转录功能。对此段正向启动区域进行转录元件分析,发现该段启动区域无典型的 TATA box 元件,但存在典型的转录起始元件(initiator element,INR)[9],推测此段序列可能是正向转录的核心序列,将此基因表达构件命名为 pP2bi/f.Core-EGFP/DsRed(图 4)。进一步连续观察此基因构件在斑马鱼 1 ~5 dpf 的表达情况,可观察到 4 dpf 在胚胎的耳石、肝芽区(图 4B)和嗅泡(图 4C)有明显的红色荧光信号,且表达持续时间与 1.3 kb 正向启动子表达构件相当,可持续至10 dpf。
对该基因构件反向表达情况的观察,未发现GFP 表达现象。说明此段反向序列不具有独立转录功能。
2.4 hHNF4α-P2 反向启动子核心启动序列分析
同样,我们进一步通过序列缺失实验和序列预测软件分析寻找反向 P2 的核心启动序列,发现P2 反向启动子序列存在两段核心启动区域,分别命名为 hnf4α-r-Core1 和 hnf4α-r-Core2;随后分别构建了以这两段序列为启动子序列,指导 GFP 基因表达的载体(图 5A 和 5D),并检测了其在斑马鱼幼体内的表达分布。如图 5C 所示,位于 –797~–976 反向 DNA 序列中存在 179 bp 的反向核心启动区域 1,其表达图谱与克隆的 P2 反向启动子表达图谱类似,GFP 可在表皮、中枢神经系统、血液细胞、体节和脊索细胞表达(图 5B)。就表达时间而言,该核心启动序列可驱动 GFP 在器官发育的早期表达(12 ~ 16 hpf 开始表达)。进一步分析发现,该核心区域并没有典型的核心启动子序列,但存在 TFII B 识别元件[10]、INR 及下游启动子元件(图 5C)[11]。
如图 5F 所示,P2 –355 ~ –529 序列之间存在175 bp 的反向核心启动区域 2;其驱动的绿色荧光信号也主要出现在血液细胞、脑部神经元、表皮、体节和脊索细胞等中胚层来源的组织(图 5E),且仅在 2 dpf 的斑马鱼胚胎中可以观察到绿色荧光信号,提示其转录活性主要在胚胎发育的中后期。对该段序列的启动子结构域预测显示该段序列具有典型的核心启动子序列,并存在两个 BRE 位点(图 5F)。上述结果提示,这两段反向转录核心序列均具有独立启动转录的作用,且其表达部位或组织靶向性类似。
对这两个基因构件以及其他 P2 系列缺失基因构件的正向表达报告蛋白 DsRed 的观察,斑马鱼胚胎到幼体阶段未见红色荧光出现的现象。说明这些正向序列不具有独立转录功能。

图 4 hHNF4α-P2 正向核心启动子区域(–587 ~ –529)的转录功能[A:hHNF4α-P2 正向核心启动域(–587 ~ –529)双向表达构件(pP2bi/f.Core-EGFP/DsRed)示意图;B:hHNF4α-P2 正向核心启动域(–587 ~ –529)介导的红色荧光蛋白 DsRed 在 4 dpf 斑马鱼幼体的耳石(白色箭头)和肝芽区(黄色箭头)处表达;C:hHNF4α-P2 正向核心启动域(–587 ~ –529)介导的红色荧光蛋白 DsRed 在 4 dpf斑马鱼幼体的嗅泡(白色箭头)处表达;D:P2 正向启动子核心启动区域(–587 ~ –529)的 DNA 序列和 INR 位点图]Figure 4 Transcription action of hHNF4α-P2 forward core region sequence (–587 - –529) [A: Construct scheme of bidirectional fluorescent reporter gene expression driven by hHNF4α-P2 promoter core region (pP2bi/f.Core-EGFP/DsRed); B: DsRed protein driven by the truncated P2 sequence (–587 -–529) in the forward transcriptional direction expressed at otolith (white arrows), liver bud (yellow arrow) in zebrafish embryos at 4 dpf; C: DsRed protein driven by the truncated P2 sequence (–587 - –529) in the forward transcriptional direction expressed at olfactory bulb (white arrows) in zebrafish embryos at 4 dpf; D: Sequence of promoter core region and INR site in P2 forward DNA sequence]
3 讨论
HNF4α 作为转录调控因子,可激活上百个基因的转录和表达,不仅参与糖、脂肪和胆汁酸等物质的代谢,还对组织器官的早期分化和功能具有重要的调节作用[12]。在胚胎发育过程中,HNF4α 的P1 和 P2 启动子所介导的 HNF4α 不同亚型具有时间和组织表达特异性[13],例如由 P2 启动子介导的亚型 HNF4α7 在胚胎发育早期在肝脏中具有较高的表达量,而在成年的肝脏中却难以检测到。但该亚型在成年的胃、小肠和胰腺等器官中有稳定的表达。由 HNF4α-P1 启动的 HNF4α1 则具有较强的成体肝组织表达的特异性[5,14-15]。然而,对于HNF-4α 两个启动子在早期胚胎中的表达图谱尚无系统的研究。本文对 HNF4α-P2 1.3 kb 的启动序列在早期胚胎中的表达图谱进行分析,发现该段序列具有显著的组织特异性,主要在斑马鱼外胚层来源的感官神经细胞有较强的表达,提示 P2 启动子所介导表达的 HNF4α 亚型可能对外胚层来源的神经感觉器的早期发育和分化具有重要的调控功能。
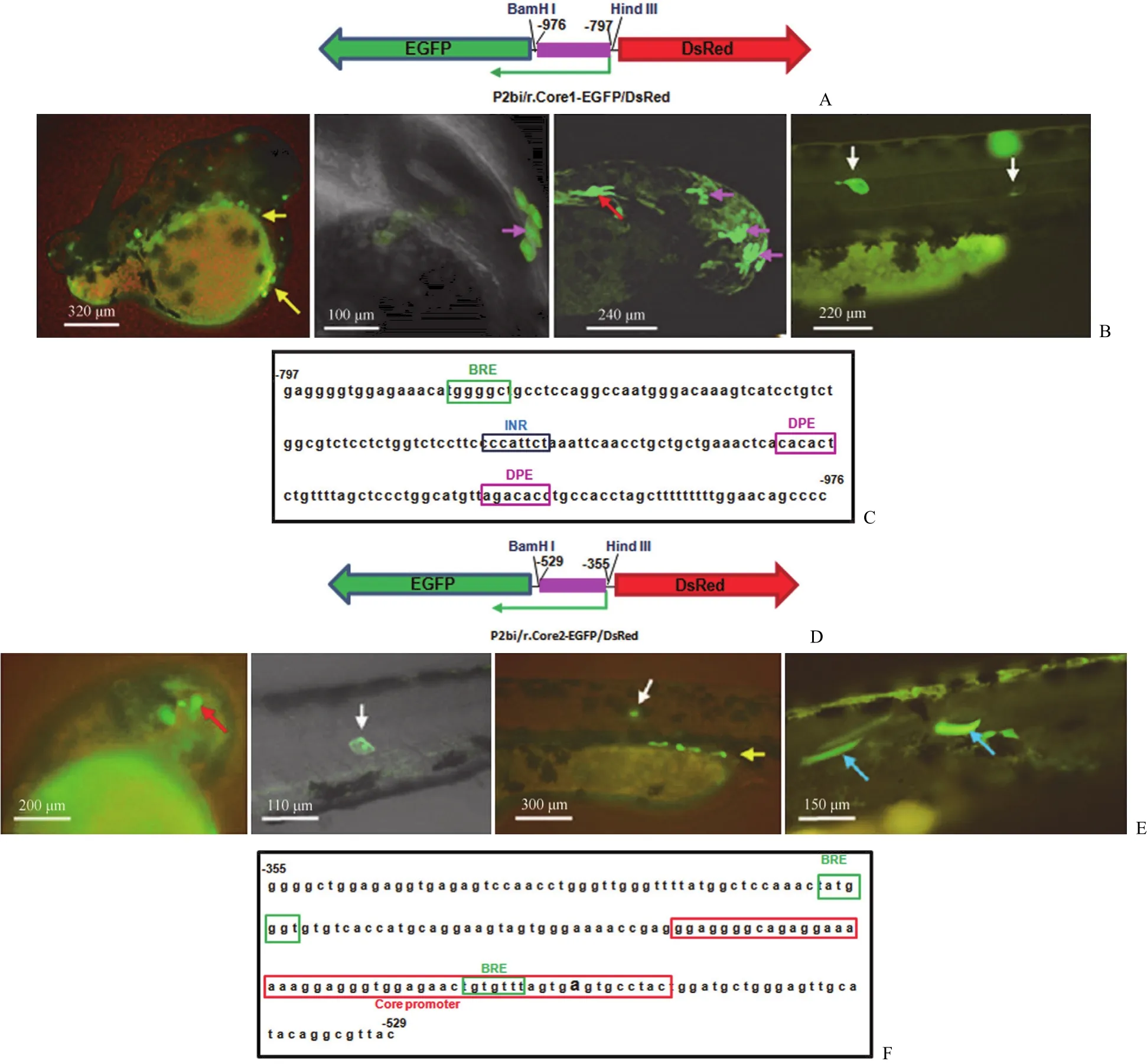
图 5 hHNF4α-P2 反向核心启动子区域的转录功能[A:hHNF4α-P2 反向核心启动域 1(–797 ~ –976)双向表达构件(pP2bi/r.Core1-EGFP/DsRed)示意图;B:hHNF4α-P2 反向核心启动域 1 介导的绿色荧光蛋白 EGFP 在 2dpf 斑马鱼胚胎的血细胞(黄色箭头)、表皮(粉色箭头)、神经管细胞(红色箭头)以及在 3 dpf 胚胎的脊索细胞(白色箭头)中的表达;C:hHNF4α-P2 反向核心启动域 1(–797 ~ –976)的序列和 BRE、INR 及 DPE位点;D:hHNF4α-P2 反向核心启动域 2(–355 ~ –529)双向表达构件(pP2bi/r.Core2-EGFP/DsRed)示意图;E:hHNF4α-P2 反向核心启动域 2 介导的绿色荧光蛋白 EGFP 在 2 dpf 斑马鱼胚胎的脑神经元(红色箭头)、脊索细胞(白色箭头)、血细胞(黄色箭头)和 3 dpf 胚胎的体节细胞(浅蓝色箭头)中的表达;F:P2 反向核心启动域 2(–355 ~ –529)的序列和BRE及核心启动子位点]Figure 5 Transcription action of hHNF4α-P2 promoter reverse core region sequences [A: The scheme of bidirectional expression driven by hHNF4α-P2 promoter reverse core region 1 (–797 - –976) (pP2bi/r.Core1-EGFP/DsRed); B: EGFP driven by the P2 core promoter region 1 in the reverse transcriptional direction expressed at haemocytes (yellow arrows), epidermis (pink arrows), neural tube (red arrow) in zebrafish embryos at 2 dpf, and expressed at notochord (white arrows) in zebrafish embryos at 3 dpf; C: Sequence of the reverse core promoter core region 1 (–797 - –976) in P2 reverse-directional DNA and sites of BRE, INR and DPE; D: The scheme of bidirectional fluorescent reporter gene expression driven by hHNF4α-P2 promoter reverse core region 2 (–355 - –529) (pP2bi/r.Core2-EGFP/DsRed); E: EGFP driven by the P2 core promoter region 2 (–355 - –529) in reverse transcriptional direction expressed at brain cells (red arrows), notochordal cells (white arrows), haemocytes (yellow arrow) at 2 dpf, and expressed at somites (myotomes) (light-blue arrows) in zebrafish embryos at 3 dpf; F: Sequence of the reverse promoter core region 2 (–355 - –529) in P2 reverse-directional DNA and sites of BRE and core promoter]
双向启动子是位于两个相邻基因之间的具有转录调控活性的 DNA 序列。在一定条件下,双向启动子可以分别驱动或指导其下游基因的转录,这两个相邻基因编码序列分别位于对方编码链(正义链)的互补链上,因而它们的转录方向相反。双向启动子在哺乳动物基因组中并不少见,约有 10%的蛋白编码基因的启动子具有双向启动活性[11],且大多数双向启动区序列小于 500 bp[16]。在人类基因组中,约有 76% 的启动子核心序列缺少典型的TATA box 样元件,并且这一类启动子所启动的基因通常为管家基因;而仅有 10% 的启动序列具有典型的 TATA box,该类启动子启动的表达通常受到严格的调控[9]。本研究第一次发现了人的 HNF4α II 型启动子序列的双向转录调控功能。我们的研究结果提示,该双向启动子调控功能有明确的分工,或者说这段启动子 DNA 序列的正、反向作用靶位具有明显的组织特异性/靶向性的差异。该正向启动子调控转录的基因可能参与了神经感官组织受器官和肝脏的发育和分化相关的基因表达,而其反向启动子则活化与表皮、脊索和血液等发育相关基因的表达。通过对所克隆的 P2 正、反链 DNA 序列进行核心启动序列预测和体内缺失实验,证明该P2 正、反向序列具有双向启动子的序列特征。P2启动序列所显示的双向时空表达的差异性,也提示P2 双向驱动功能对于胚胎阶段的不同器官的同时发生和发育具有协调作用。
虽然在斑马鱼胚胎中的这段 hHNF4α-P2 序列的表达图谱并不一定完全反映该段启动序列在人胚胎发育中的情况,但是就基因结构与功能的保守性而言,可能存在一些相似的转录调控元件和转录调控机制。本文在一定程度上丰富了对 hHNF4α-P2启动子的理解,也为该基因功能的研究提供了新的思路。
志谢 感谢孟杰技师在实验动物斑马鱼的提供和管理方面的有力保障。
[1] Parviz F, Matullo C, Garrison WD, et al. Hepatocyte nuclear factor 4alpha controls the development of a hepatic epithelium and liver morphogenesis. Nature genetics, 2003, 34(3):292-296.
[2] Moore BD, Jin RU, Lo H, et al. Transcriptional regulation of X-box-binding protein one (XBP1) by hepatocyte nuclear factor 4alpha (HNF4Alpha) is vital to beta-cell function. J Biol Chem, 2016, 291(12):6146-6157.
[3] Dean S, Tang JI, Seckl JR, et al. Developmental and tissue-specific regulation of hepatocyte nuclear factor 4-alpha (HNF4-alpha) isoforms in rodents. Gene Expr, 2010, 14(6):337-344.
[4] Kanazawa T, Konno A, Hashimoto Y, et al. Expression of hepatocyte nuclear factor 4alpha in developing mice. Anat Histol Embryol, 2009, 38(1):34-41.
[5] Torres-Padilla ME, Fougère-Deschatrette C, Weiss MC. Expression of HNF4alpha isoforms in mouse liver development is regulated by sequential promoter usage and constitutive 3' end splicing. Mech Dev, 2001, 109(2):183-193.
[6] Saha SK, Parachoniak CA, Ghanta KS, et al. Mutant IDH inhibits HNF-4α to block hepatocyte differentiation and promote biliary cancer. Nature, 2014, 513(7516):110-114.
[7] Tanaka T, Jiang S, Hotta H, et al. Dysregulated expression of P1 and P2 promoter-driven hepatocyte nuclear factor-4alpha in the pathogenesis of human cancer. J Pathol, 2006, 208(5):662-672.
[8] Yang M, Elnitski L. Orthology-driven mapping of bidirectional promoters in human and mouse genomes. BMC bioinformatics, 2014, 15 Suppl 17:S1.
[9] Yang C, Bolotin E, Jiang T, et al. Prevalence of the initiator over the TATA box in human and yeast genes and identification of DNA motifs enriched in human TATA-less core promoters. Gene, 2007, 389(1): 52-65.
[10] Deng W, Roberts SG. A core promoter element downstream of the TATA box that is recognized by TFIIB. Genes Dev, 2005, 19(20): 2418-2423.
[11] Orekhova AS, Rubtsov PM. Bidirectional promoters in the transcription of mammalian genomes. Biochemistry (Mosc), 2013, 78(4):335-341.
[12] Lussier CR, Babeu JP, Auclair BA, et al. Hepatocyte nuclear factor-4alpha promotes differentiation of intestinal epithelial cells in a coculture system. Am J Physiol Gastrointest Liver Physiol, 2008, 294(2):G418-G428.
[13] Eeckhoute J, Moerman E, Bouckenooghe T, et al. Hepatocyte nuclear factor 4 alpha isoforms originated from the P1 promoter are expressed in human pancreatic beta-cells and exhibit stronger transcriptional potentials than P2 promoter-driven isoforms. Endocrinology, 2003, 144(5):1686-1694.
[14] Briancon N, Bailly A, Clotman F, et al. Expression of the alpha7 isoform of hepatocyte nuclear factor (HNF) 4 is activated by HNF6/OC-2 and HNF1 and repressed by HNF4alpha1 in the liver. J Biol Chem, 2004, 279(32):33398-33408.
[15] Nakhei H, Lingott A, Lemm I, et al. An alternative splice variant of the tissue specific transcription factor HNF4alpha predominates in undifferentiated murine cell types. Nucleic Acids Res, 1998, 26(2): 497-504.
[16] Wakano C, Byun JS, Di LJ, et al. The dual lives of bidirectional promoters. Biochim Biophys Acta, 2012, 1819(7):688-693.
Characterization of bidirectional transcription of human hepatocyte nuclear factor 4 alpha P2 promoter
ZHAO Qiong, JIANG Jian-dong, ZHANG Jing-pu
ObjectiveTo explore the bidirectional transcriptional function of human hepatocyte nuclear factor 4 alpha (hHNF4α) P2 promoter.MethodsThe P2 promoter partial sequence of hHNF4α from –23 to –1291, totally 1268 bp was cloned. Bidirectional transcription vectors were constructed in eukaryotic expression vectors via linking the fluorescent protein genes, EGFP and DsRed, to both the upstream or/and downstream of the P2 DNA sequence, respectively. They were named pP2f/hnf4-EGFP (pP2f-EGFP) for the forward transcription, pP2r/hnf4-EGFP (pP2r-EGFP) for the reverse transcription and pP2bi/hnf4-EGFP/DsRed (pP2bi-EGFP/DsRed) for the bidirectional transcription. Then, pP2f-EGFP and pP2r-EGFP were separately transfected into L02 and Huh7 cells, and pP2bi-EGFP/DsRed was microinjected into zebrafish embryos to profile the time- and tissue-specific expression patterns of P2 promoter at both transcriptional directions in zebrafish embryonic development. Core promoter regions were identified by a series of P2 sequence deletion experiments and combining with sequence prediction of promoter core regions by http://www. fruitfly.org/ online.
ResultsFluorescent reporters was expressed driven by either the forward or the reverse directional transcription of hHNF4α-P2 promoter in human normal hepatocyte cell line L02 and hepatoma cell line Huh7. Furthermore, transcriptional patterns in the forward and reverse directional transcription of the P2 promoter were examined in zebrafish embryos by the P2 bidirectional transcription construct pP2bi-EGFP/DsRed. The results showed that EGFP, as the reverse-directional reporter, started to express at the stage of 16 hpf in embryonic organs derived from mesoderm and ectoderm, such as blood cells, neurons, epidermis, somites and notochord cells; meanwhile, DsRed, as the forward-directional reporter, expressed intensively in otolith, olfactory bulb and hair cells of neuromasts in the lateral lines which developed from ectoderm, and also expressed moderately in liver bud which originated from endoderm. The expressions of both forward- and reverse-directional transcriptions sustained to at least 10 dpf. Only one core promoter region (–529 - –587) was found in the P2 sequence of forward transcriptional direction, and its expression pattern was as same as that of pP2f-DsRed construct. Also, two core promoter regions existed in the complementary strand sequence of P2 promoter (–23 - –1291), and one of them (–797 - –976) showed the same expression pattern as pP2r-EGFP pattern, while the other one (–355 -–529) lacked signal in neurons and showed relatively delayed expression compared to pP2r-EGFP pattern.
ConclusionThis is the first report on the bidirectional transcription of hHNF4α-P2 promoter (–23 - –1291) in developmental stageand tissue-specific manner in zebrafish.
Human hepatocyte nuclear factor 4 alpha; Gene expression; Zebrafish; Bidirectional promoter
ZHANG Jing-pu, Email: zhangjingpu@imb.pumc.edu.cn
10.3969/j.issn.1673-713X.2017.03.001
国家自然科学基金创新研究群体科学基金(81321004);国家自然科学基金面上项目(81373453)
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所(赵琼、张靖溥),药物研究所(蒋建东)
张靖溥,Email:zhangjingpu@imb.pumc.edu.cn
2017-03-16
www.cmbp.net.cn 中国医药生物技术, 2017, 12(3):193-200
Author Affiliations: Institute of Medicinal Biotechnology (ZHAO Qiong, ZHANG Jing-pu), Institute of Materia Medica (JIANG Jian-dong), Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China
www.cmbp.net.cn Chin Med Biotechnol, 2017, 12(3):193-200
