新型siRNA抗流感病毒活性的研究
2017-06-19张永欣赵斐王宇佳张瑞欣岑山
张永欣,赵斐,王宇佳,张瑞欣,岑山
新型siRNA抗流感病毒活性的研究
张永欣*,赵斐*,王宇佳,张瑞欣,岑山
目的设计合成具有广谱性抗流感病毒活性的 siRNA,分别在细胞内和小鼠体内进行活性评价。
方法从甲型流感病毒毒株 A/WSN/33 的基因(PB2、PB1、PA、M、NS)中提取高度保守的序列设计合成 siRNA。通过 293T-Gluc 系统和单轮感染流感病毒系统对 siRNA 进行活性筛选。然后在细胞水平检测 siRNA 对流感病毒复制的抑制作用,并且经雾化给药途径对 siRNA 的体内抗流感活性进行评价。
结果活性筛选得到 4 条具有 50% 以上抑制活性的siRNA(siPB2-1、siPB2-2、siPB1-2 和 siNS-1),EC50值在0.4 ~ 1.3 nmol/L 之间。4 条 siRNA 对另外两株 A/PR/8/34和 B/Beijinghaidian/1386/2013(Victoria 系)流感病毒均表现出较好的抑制活性。动物实验表明,siPB2-1 经雾化给药途径可以对流感病毒感染的小鼠产生一定的保护作用。
结论新合成的 siRNA 在细胞水平和小鼠体内均具有良好的抗流感病毒活性。
流感病毒,A 型; RNA,小分子干扰; 动物实验
流感病毒是引起人类急性呼吸道传染病最主要的病原,主要通过空气飞沫传播,具有传播速度快、发病率高和常伴有严重并发症等特点。流感每年在温带的秋冬季节大量流行,造成相当高的发病率和死亡率,严重威胁人类健康。据估计,全世界每年会有 25 万 ~ 50 万人因此丧生[1]。流感病毒可以在不同宿主之间直接或间接传播,易发生基因重配产生新的亚型,从而带来灾难性的后果。如人类历史上的几次流感大爆发,已导致全球数百万人丧生。而 2013 年在我国出现的 H7N9 禽流感病毒更是以相当高的死亡率再次引起人们对流感病毒的高度关注。
流感病毒属于正黏病毒科,分为甲、乙、丙三型。其中甲型流感病毒危害最大,至今为止的流感大流行都是由甲型流感病毒引发。甲型流感病毒的基因组由 8 条单股负链 RNA 组成,在病毒自身编码的 RNA 聚合酶和宿主因子的共同作用下转录形成互补的正链 mRNA,共编码 10 种病毒蛋白。其中 PB2、PB1 和 PA 三个蛋白组成流感病毒的 RNA 聚合酶(RdRP),负责催化病毒基因组的转录和复制[2]。M 基因编码 M1 和 M2 两种蛋白,流感病毒进入细胞后,H+经由 M2 离子通道进入病毒颗粒内部,引起病毒脱衣壳,进而病毒基因组(vRNPs)从 M1 蛋白上解离并释放到胞质中。NS 基因也编码两种蛋白,即非结构蛋白 NS1 和NS2。NS1 蛋白可以调节病毒 RNA 的合成、剪切及 mRNA 的翻译过程[3]。NS2 蛋白通过与 M1 蛋白作用,负责将 vRNPs 从核内输送到胞浆。这些结构蛋白和非结构蛋白在流感病毒的复制周期中发挥重要作用。
目前流感的防治主要依靠药物和疫苗。常见的药物有 M2 离子通道阻断剂(金刚烷胺、金刚乙胺等)和 NA 抑制剂(扎那米韦、奥司他韦等)[4],以及一些其他的新型药物。流感疫苗主要有三种类型:灭活疫苗、减毒活疫苗和 DNA 疫苗。但是由于药物频发的耐药性[5-6]以及疫苗作用的局限性,使得药物和疫苗的研发成了一个永无止境的过程。因此,探寻一种新型、有效的流感防治方法迫在眉睫。
RNA 干扰(RNAi)技术,作为一种新型的生物技术,已广泛应用于基因功能探索以及传染性疾病和恶性肿瘤的防治,同时在抗病毒研究领域也表现出独特的优势[7]。RNAi 作用通过一类较稳定的作用分子实现,主要包括小干扰 RNA(siRNAs)、核糖核酸酶 Dicer、RNA 诱导沉默复合体(RISC)[8]。siRNA 是大小 21 ~ 25 nt 的双链RNA 分子。RnaseIII 型核酸酶 Dicer 具有解旋酶活性,含有 dsRNA 结合区,可将细胞中的 dsRNA裂解为 siRNAs[9]。RISC 包含 Dcr-2 蛋白、R2D2蛋白以及 Argonaute 蛋白。研究表明,Argonaute 家族蛋白具有 RNA 内切酶活性,能够降解与 siRNA互补的 mRNA,从而在转录后水平抑制基因的表达[10]。
与药物和疫苗作用于蛋白不同,RNAi 通过向细胞中导入与病毒 mRNA 编码区同源的短双链siRNA 使该 mRNA 发生降解,从而沉默病毒基因的表达。目前 RNAi 技术在抗流感中的应用主要包括两个方面:一方面是寻求有效的针对病毒蛋白基因的 siRNA,从而阻断流感病毒的转录和复制;另一方面则是通过 RNAi 技术沉默宿主靶蛋白的表达,从而筛选出与流感病毒复制相关的宿主因子。2003 年,Ge 等[11]发现,用靶向 NP(1496-1514)或者 PA(2087-2106)的特异性 siRNA 处理MDCK 细胞后再感染流感病毒,两条 siRNAs 均能阻断病毒的复制。进一步的动物实验结果表明,这些 siRNAs 能够在小鼠体内减弱流感病毒的致病性,并且对其他高致病性毒株同样具有抑制作用[12-13]。
由于传统抗流感治疗的局限性,RNAi 已经逐渐成为一种新兴的抗流感病毒手段。本文中,我们自主设计了 10 条全新序列的 siRNA,并在动物实验中尝试了雾化给药的方式,为促进 siRNA 抗流感病毒的应用提供了理论支持。
1 材料与方法
1.1 材料
1.1.1 细胞株和动物 动物犬肾上皮细胞(MDCK)获赠于北京协和医学院医学生物学研究所;人胚肾上皮细胞 293T、293T 衍生细胞系293T-Gluc 克隆 6、A549 衍生细胞系 A549-5ps克隆 10 均为本室自有;BALB/c 小鼠购自中国人民解放军军事医学科学院实验动物中心。
1.1.2 质粒 质粒和 siRNA 甲型流感病毒(IAV)8 质粒反向遗传系统 pHW181-PB2、pHW182-PB1、pHW183-PA、pHW184-HA、pHW185-NP、pHW186-NA、pHW187-M、pHW188-NS 获赠于美国圣裘德儿童研究医院的Robert G Webster 博士;siRNA 序列由广州锐博生物科技有限公司合成。
1.1.3 主要试剂 Gaussia 荧光素酶(Gluc)底物腔肠素 h(coelenterazine-h)购自美国 Promega 公司;TPCK 处理的胰蛋白酶、氨苄青霉素(Amp)、Tween-20、TEMED 购自美国 Sigma-Aldrich 公司;杀稻瘟菌素(Bsd)、蛋白分子量 marker PageRulerTMplus prestained protein ladder 购自美国 Life Technologies 公司;Flu-NP 鼠单克隆抗体(货号:SC-101352)、β-actin 鼠单克隆抗体(货号:SC-47778)购自美国 Santa Cruz 公司;辣根过氧化物酶(HRP)标记山羊抗小鼠 IgG 二抗购自北京中杉金桥生物技术有限公司;RIPA 裂解液购自碧云天生物技术有限公司。DNA 片段回收和纯化试剂盒、质粒小提试剂盒、PCR 产物纯化试剂盒均购自北京康为世纪生物科技有限公司;质粒大提试剂盒 Hi-speed plasmid maxi kit 购自德国 Qiagen公司。
1.1.4 仪器 Centro XS3LB 960 酶标仪购自德国Berthold 公司;Victor X5 多功能酶标仪购自美国PerkinElmer 公司;Molecular imager Gel DocTMXR凝胶成像仪、MJ MiniTMGradient Thermal Cycler PCR 仪购自美国 Bio-Rad 公司;Nanodrop 2000分光光度计购自美国 Thermo Scientific 公司;小鼠雾化给药装置购自上海晟廷生物科技有限公司。
1.2 方法
1.2.1 siRNA 的设计 我们通过比对甲型流感病毒毒株 A/WSN/33 的基因序列(PB2、PB1、PA、M、NS),从头逐个提取符合 siRNA 设计要求的片段,并且 BLAST 确定片段的同源性,从中选择在不同型别的流感毒株中高度保守的序列。排除文献已报道的 siRNA 序列后,最终选取了 10 条siRNA 进行抗流感活性的检测。新设计的各条siRNA 序列详见表 1,序列名称表示该条 siRNA靶向的病毒基因。

表 1 siRNA 序列Table 1 siRNA sequences
1.2.2 细胞培养及 siRNA 转染 293T、293T-Gluc、MDCK 和 A549-5ps 细胞均培养于含10% 胎牛血清(FBS)的 DMEM 培养基中。其中293T-Gluc 和 A549-5ps 的培养基中需要加入终浓度为 10 μg/ml 的 Bsd。细胞维持液为含 2% 胎牛血清的 DMEM 培养基。将 293T-Gluc 细胞接种于 6 孔板中,每孔接种 4 × 105个细胞,细胞接种 12 h 后使用 Lipofectamine RNAi Max 转染siRNA,12 h 后进行二次转染,在初次转染后 24 h接种流感病毒。
1.2.3 流感病毒的制备 在直径为 10 cm 的细胞培养皿中以 3∶1 比例接种 1.8 × 106个 293T细胞和 0.6 × 106个 MDCK 细胞。培养 24 h 后,使用 Lipofectamine2000 转染流感病毒 8 质粒,每种质粒的转染量为 1.2 μg。转染后 6 h,将培养液更换为新鲜的 DMEM 培养基。转染后 24 h 在培养基中加入终浓度为 1 μg/ml 的 TPCK-trypsin。培养 48 h 后收上清,1000 r/min 离心 5 min 去掉细胞碎片,上清用 0.45 μm 滤膜过滤,分装成小份,保存于 –80 ℃ 冰箱。
1.2.4 流感病毒滴度(TCID50)测定 参照文献[14]的方法进行检测。将 MDCK 细胞接种到96 孔板,每孔接种 104个细胞。培养 24 h 细胞长成单层后,吸出上清,用 PBS 清洗 2 遍,每孔加入 100 μl 用维持液 10 倍系列稀释的病毒稀释液;同时设细胞对照组(只加 100 μl 维持液)。置于 35 ℃ 孵箱中培养,逐日观察细胞病变效应(CPE)并记录结果,一般于 3 ~ 5 d 后终止观察,按照 Reed-Muench 两氏法计算病毒的滴度。
1.2.5 Western blot 检测 收集 6 孔板中的细胞,加入 RIPA 裂解液在冰上裂解 30 min 后,于4 ℃、12 000 r/min 离心 10 min,收集上清制备细胞裂解液蛋白样品。样品经 10% SDS-PAGE 分离后,进行转膜、封闭和抗体孵育。抗体的使用浓度分别为:Flu-NP(1∶5000)、β-actin(1∶5000)、山羊抗小鼠二抗(1∶5000)。最后用 ECL 发光液进行显色。
1.2.6 Gluc 活性检测 Gluc 活性检测依照Tannous[15]提供的方法操作。首先,在 PBS 溶液中溶解腔肠素 h,配制浓度为 16.7 μmol/L 的底物工作液,室温避光孵育 30 min。取 10 μl 待测上清到白色不透明 96 孔板中,使用酶标仪自动进样器将避光孵育的底物工作液按每孔 60 μl 的进样量逐孔加入,持续收集信号 0.5 s,测量结果以相对光单位(RLU)表示。
1.2.7 实时荧光定量 PCR 根据 Invitrogen 公司的 TRIzol 使用说明书,提取细胞总 RNA。使用一步法荧光定量 PCR 反应试剂盒以管家基因gapdh 为内参,用 2-ΔΔCt法对待测基因 mRNA 水平进行相对定量。RT-PCR 引物序列如表 2 所示。反应条件为:42 ℃ 逆转录 5 min;95 ℃,10 s;95 ℃,5 s 和 60 ℃,34 s;共 40 次循环。
1.2.8 siRNA 抗病毒活性检测 应用 293T-Gluc细胞系对 siRNA 抗流感病毒活性进行初步筛选。流感病毒感染 293T-Gluc 细胞后能够特异性启动分泌型 Gluc 的表达,从而可以通过检测上清中Gluc 蛋白的活性来测定病毒的感染性。接种293T-Gluc 细胞于 6 孔板中,每孔接种 6 × 105个细胞。细胞接种 24 h 后使用 Lipofectamine RNAi MAX 转染试剂转染终浓度为 30 nmol/L 的siRNA 进入细胞,转染 12 h 后进行第二次转染。二次转染 siRNA 后 12 h 感染流感病毒(MOI = 2.5),细胞继续培养 24 h 后取上清液检测 Gluc蛋白活性。

表 2 实时定量 RT-PCR 引物序列Table 2 Primer sequences for real-time RT-PCR
应用单轮感染流感病毒对 siRNA 的抗流感病毒活性进行复筛。单轮感染流感病毒是将野生型WSN 株流感病毒的 HA 基因编码序列替换为Gluc 报告基因的编码序列,只能进行单轮复制的流感假病毒。细胞上清中 Gluc 的活性可以间接反映病毒的增殖活性,从而能够用于抗病毒活性的筛选。接种 293T 细胞于 6 孔板中,每孔接种 6 × 105个细胞。细胞接种 24 h 后按照上述方法转染siRNA 进入细胞。二次转染 siRNA 后 12 h 感染单轮流感病毒(MOI = 0.5),细胞继续培养 12 h 后取上清液检测 Gluc 蛋白活性。
1.2.9 siRNA EC50测定 接种 293T-Gluc mono6细胞于 24 孔板,每孔接种 1 × 105个细胞。细胞接种 24 h 后使用 Lipofectamine RNAi MAX 转染不同浓度梯度的 siRNA 进入细胞,转染 12 h 后进行第二次转染。二次转染后 12 h 感染流感病毒(MOI = 2.5),细胞继续培养 24 h 后取上清液检测 Gluc 蛋白活性。
1.2.10 空斑实验 接种 MDCK 细胞于 12 孔板,每孔接种 3 × 105个细胞,细胞接种后 24 h,吸弃培养基上清,用 PBS 清洗细胞 2 ~ 3 次。每孔加入 400 μl 用 DMEM 培养基稀释的病毒液,每个稀释度设 2 个复孔,置 37 ℃、5% CO2培养箱吸附 2 h。吸附完成后吸去上清,用 37 ℃ 预热的 PBS 清洗 1 次,每孔加入 1 ml 含有 0.3% BSA 和 1.5 μg/ml TPCK-trypsin 的 1% 低熔点琼脂。待琼脂层凝固后,将细胞板倒置于 35 ℃,5% CO2培养箱中培养 3 ~ 4 d。当有肉眼可见的白色斑点出现后,每孔加入 1 ml 浓度为 0.16 mg/ml 的中性红溶液进行染色,37 ℃ 避光作用 4 h 后吸去染液,计数空斑。
1.2.11 siRNA 小鼠体内抗病毒实验 取三组4 ~ 5 周龄的 BALB/c 小鼠,每组 10 只。每只小鼠分两次雾化给入 1 nmol 的脂质体包裹的 siRNA(siPB2-1),阴性对照组雾化给入相同剂量的脂质体包裹的对照 siRNA(siNC)或相同体积的 PBS。两次雾化给入 siRNA 的时间间隔为 24 h,然后每只小鼠滴鼻接种 40 μl 滴度为 7 lgTCID50/ml 的WSN 株流感病毒,连续观察并记录小鼠的存活率和体重变化情况。
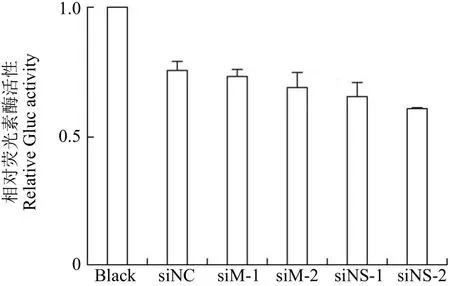
图 1 siNC 的验证(A549-5ps 细胞二次转染 siRNA 后60 h 换液,继续培养 24 h 后收集上清检测 Gluc 蛋白活性)Figure 1 Validation of negative control siNC (The supernatants were replaced 60 h after second round transfection of siRNA into A549-5ps cells, and then the activity of Gluc in the supernatants was measured after 24 h cultivation)

图 2 siRNA 抗流感活性的初步筛选(293T-Gluc 细胞二次转染 siRNA 后 24 h接种甲型流感病毒,继续培养 24 h 后收集上清检测 Gluc 蛋白活性)Figure 2 Preliminary validation of siRNA anti-influenza virus activity (293T-Gluc cells were inoculated with IAV 24 h after second round transfection of siRNA, and then the activity of Gluc in the supernatants was measured after 24 h cultivation)
2 结果
2.1 阴性对照 siRNA 的验证
首先借助实验室之前构建的 A549-5ps 细胞系验证阴性对照 siRNA 的可靠性,保证其不会对后续的活性检测工作产生干扰。A549-5ps 细胞系可以模拟流感病毒的转录复制系统,表达依赖病毒RNA 聚合酶特异性启动的分泌型 Gluc 蛋白。首先通过 RT-PCR 检测证实了该细胞系中 PB2、PB1、PA 以及 NP 蛋白 mRNA 水平的表达及模拟的 vRNA 的存在。由于 A549-5ps 细胞系中不存在 M 和 NS 蛋白的 mRNA,那么阴性对照siRNA 和靶向 M 和 NS 基因的 siRNA 都不会对 Gluc 信号产生明显的影响。图 1 结果显示,在转染了 siNC、siM 和 siNS 的实验组中,Gluc信号没有明显的差异,证明实验中所使用的阴性对照 siNC 不会对验证工作产生干扰。
2.2 siRNA 抗流感病毒活性的初步筛选
我们借助实验室已构建的 293T-Gluc 细胞系对 siRNA 在细胞水平上的抗流感病毒活性进行初步筛选。流感病毒感染 293T-Gluc 细胞后能够特异性启动分泌型 Gluc 的表达,从而可以通过检测上清中 Gluc 蛋白的活性来测定病毒的感染性。通过2 次转染的方式对新合成的 10 条 siRNA 的抗病毒作用进行了初步检测(图 2),结果发现,其中7 条 siRNA 具有 50% 左右的抗病毒活性。
2.3 siRNA 抗流感病毒活性的二次筛选
为了避免初次筛选过程中出现的假阳性结果,我们又借助单轮感染流感病毒系统在 293T 细胞中对 siRNA 的抗流感活性进行了再次验证(图 3)。单轮感染流感病毒是一种带有 Gluc 报告系统的只能进行单轮复制的流感假病毒,其基因组的 HA基因被 Gluc 序列替代,可以用来进行抗流感活性筛选。结果发现,初步筛选得到的 7 条 siRNA 中,只有 4 条 siRNA 抑制病毒的活性达到 50% 以上。最终,我们选取了 siPB2-1、siPB2-2、siPB1-2和 siNS-1 这 4 条 siRNA 进行下一步的验证工作。
2.4 siRNA 在 mRNA 转录水平和蛋白翻译水平对流感病毒的抑制作用
为了验证转染进入 293T 细胞的 siRNA 抑制流感病毒复制的作用,我们分别收集样品进行病毒mRNA 水平和蛋白水平的检测。对于不同的siRNA,我们统一采用了流感病毒标志性的 NP 基因作为检测对象。免疫印迹(图 4A)和qRT-PCR(图 4B)结果显示,在分别转染了 4 条 siRNA 的实验组中,NP 蛋白的表达量和 mRNA 水平与阴性对照组相比都有明显的降低,抑制转录活性均达60% 以上。这一结果与之前的筛选结果相吻合,证明我们设计合成的 siRNA 可以在转录水平和翻译水平有效地抑制流感病毒的复制。

图 3 siRNA 抗流感活性的二次筛选(293T 细胞二次转染siRNA 后 24 h 接种单轮感染流感病毒,继续培养 12 h 后收集上清检测 Gluc 蛋白活性)Figure 3 Re-validation of siRNA anti-virus activity (293T cells were inoculated with single-cycle infectious influenza virus 24 h after second round transfection of siRNA, and then the activity of Gluc in the supernatants was measured after 12 h cultivation)
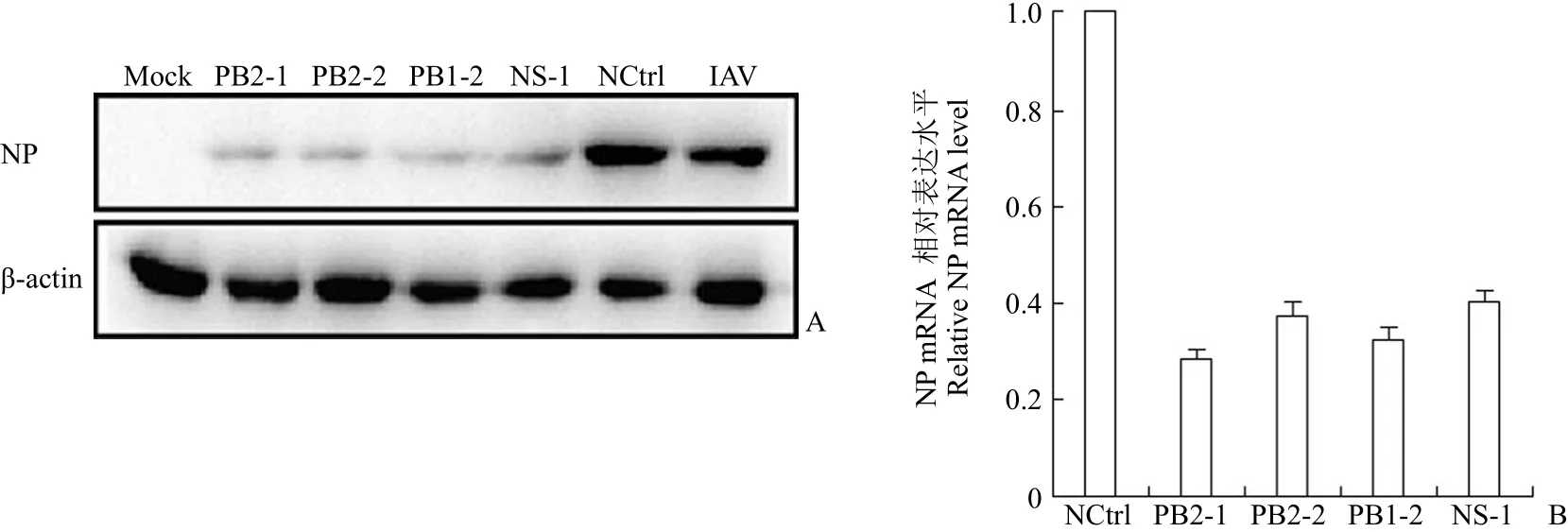
图 4 siRNA 在转录水平和翻译水平对流感病毒的抑制作用(A:免疫印迹检测 NP 蛋白的表达;B:qRT-PCR 检测 NP 蛋白的 mRNA 水平)Figure 4 Inhibitory effect of siRNA on IAV at both transcription and translation level (A: Detection of NP protein by Western blot; B: Detection of NP mRNA by qRT-PCR)
2.5 siRNA EC50测定
在明确了 siRNA 的抗流感病毒活性后,为了评估新设计的 siRNA 是否具有成药的潜力,我们通过测定不同浓度梯度 siRNA 的抑制活性,借助Graphpad Prism5 软件对 4 条 siRNA 的 EC50值进行了计算和评估(图 5)。4 条 siRNA 的 EC50值在 0.4 ~ 1.3 nmol/L 之间,与已发表的 siRNA 序列相比,我们自行设计的 siRNA 具有更好的抗病毒活性。
2.6 siRNA 对不同流感毒株的抑制作用
siRNA 在最初设计时选择了高度保守的区域,以期能够对多种流感毒株都有抑制作用。为了验证siRNA 是否具有广谱的抗流感病毒作用,我们通过空斑实验,分别对 A/PR/8/34 和 B/Beijinghaidian/ 1386/2013(Victoria 系)两株流感病毒进行了siRNA 抑制活性的检测。图 6 显示 4 条 siRNA对两种不同型别的流感病毒均具有一定的抑制作用,其中对 A/PR/8/34 株的抑制作用较强,抑制活性达 70% 以上,说明新设计的 siRNA 具有广谱的抗流感病毒作用。
2.7 siRNA 小鼠体内抗流感病毒活性的初步观察
为了明确 siRNA 是否在动物体内也具有抗流感病毒活性,我们选取了其中抗流感活性较高的一条 siRNA(siPB2-1)进行体内活性的检测。取三组 4 ~ 5 周龄的 BALB/c 小鼠,经雾化给药途径,分别给入脂质体包裹的 PBS、siPB2-1 和 siNC。二次雾化给入 siRNA 后每只小鼠滴鼻接种 WSN株流感病毒并观察记录小鼠的存活率和体重变化情况(图 7)。实验结果显示,雾化给入 siPB2-1 的实验组与 PBS 及 siNC 的对照组相比,流感病毒感染小鼠的存活率明显升高(66.7%),小鼠体重的变化也呈相对平稳的趋势,证明 siPB2-1 在动物体内具有一定的抗流感活性,可以作为预防给药抵抗流感病毒的侵袭。

图 5 siRNA EC50测定(分别向 293T-Gluc 细胞中转染不同浓度的 siRNA,二次转染后 24 h 接种流感病毒,继续培养 24 h 后收集上清检测 Gluc 蛋白活性)(A:PB2-1,EC50= 0.69 nmol/L;B:PB2-2,EC50= 0.4 nmol/L;C:PB1-2,EC50= 0.88 nmol/L;D:NS-1,EC50= 1.3 nmol/L)Figure 5 EC50measurement of siRNAs (293T-Gluc cells were transfected with different concentrations of siRNA. 24 h after second round transfection of siRNA, cells were inoculated with IAV and then the activity of Gluc in the supernatants was measured after 24 h cultivation) (A: PB2-1, EC50= 0.69 nmol/L; B: PB2-2, EC50= 0.4 nmol/L; C: PB1-2, EC50= 0.88 nmol/L; D: NS-1, EC50= 1.3 nmol/L)

图 6 siRNA 对不同流感毒株的抑制作用(A:A/PR/8/34 株;B:B/Beijinghaidian/1386/2013)Figure 6 Inhibitory effect of siRNAs on other influenza virus strains (A: A/PR/8/34 strain; B: B/Beijinghaidian/1386/2013 strain)
3 讨论
RNAi 是在研究秀丽新小杆线虫反义 RNA 的过程中被发现的,为双链 RNA(dsRNA)介导的同源 RNA 降解过程[16]。此后,dsRNA 介导的 RNAi现象陆续发现于真菌、果蝇、锥虫、水螅、斑马鱼等大多数真核生物中,并证实植物中的转录后基因沉默、共抑制及 RNA 介导的病毒抗性、真菌的抑制现象均属于 RNAi 在不同物种的表现形式。
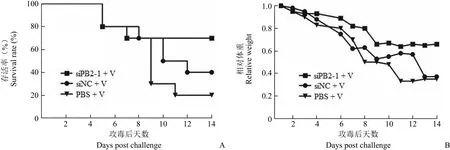
图 7 siRNA 小鼠体内抗流感病毒活性(A:小鼠存活率;B:小鼠相对体重变化,死亡小鼠体重记为零)Figure 7 The anti-virus activity of siRNA in vivo (A: Survival rate of IAV-infected mice; B: Relative weight of mice)
2001 年,Bitko 和 Barik[17]利用合成的 siRNA成功抑制了呼吸道合胞病毒的增殖,首次证明了合成的 siRNA 具有抗病毒作用。随后 siRNA 治疗在抗流感病毒的研究中逐渐兴起。除了 Ge 等[11]最初发现的 NP(1496-1514)和 PA(2087-2106)之外,还有靶向流感病毒其他蛋白的 PB1(1632-1652)[18],PA(ps-PA496)[19],M2、(psM-950)[20]和 M(331-351)[21]等。但是随着流感病毒的不断变异以及高致病性禽流感的出现,已知的 siRNA 已经无法满足人们防治流感病毒的需求。因此,我们旨在借助小分子 RNA 干扰技术,设计合成新型的抗流感病毒 siRNA,以期能够应对日益严峻的高致病性流感疫情。
在本研究中,我们设计了 10 条新型 siRNA序列,并从中筛选到 4 条具有 50% 以上抑制活性的序列,其 EC50值在 0.4 ~ 1.3 nmol/L 之间。4 条 siRNA 对另外两株 A/PR/8/34 和B/Beijinghaidian/1386/2013(Victoria 系)流感病毒均表现出较好的抑制活性。动物实验也表明,siPB2-1 经雾化给药途径可以对流感病毒感染的小鼠产生一定的保护作用。与已报道的抗流感 siRNA序列相比,这些 siRNA 具有以下优点:①自主设计:从流感病毒基因组(PB2、PB1、PA、M、NS)所有符合 siRNA 设计要求的序列中进行筛选,从中选择了未报道,高度匹配,高度保守的序列;②成本低:EC50的测定结果和小鼠体内实验的用量小于文献报道,作为潜在的抗流感病毒药物可以降低使用成本;③适用范围广:不仅针对 A 型流感病毒,对于 B 型流感病毒同样具有抑制作用,其靶向的流感病毒 RNA 聚合酶基因(PB2-1、PB2-2、PB1-2)变异率低,保守度较高,在流感大爆发的时候,可以作为一种广谱的预防和治疗药物;④可靠性高:该 siRNA 未采用任何修饰,避免了siRNA 在给药过程中出现的不兼容问题。
采用 siRNA 抗流感较常规的药物研发有明显的优势。例如,siRNA 的设计仅需依据病毒基因序列,在季节性流感爆发时,可以根据流行株的基因序列,迅速大量地合成 siRNA。同时,可以针对同一毒株的不同靶点合成多条 siRNA 实现多靶点抗病毒治疗。目前的 siRNA 动物实验中,通常采用滴鼻给药的方式,费时且影响效果。为了解决这一问题,我们设计了一套雾化给药系统,将包裹脂质体的 siRNA 以雾化颗粒的形式吸入式给药。这样一方面避免了传统滴鼻给药的复杂过程以及麻醉过程对小鼠呼吸系统的抑制;另一方面也为推动siRNA 作为一种有效的,便捷的常规治疗方式做出有益的尝试。
[1] Tsai KN, Chen GW. Influenza genome diversity and evolution. Microbes Infect, 2011, 13(5):479-488.
[2] Fodor E. The RNA polymerase of influenza a virus: mechanisms of viral transcription and replication. Acta Virol, 2013, 57(2):113-122.
[3] García-Sastre A, Egorov A, Matassov D, et al. Influenza A virus lacking the NS1 gene replicates in interferon-deficient systems. Virology, 1998, 252(2):324-330.
[4] De Clercq E. Antiviral agents active against influenza A viruses. Nat Rev Drug Discov, 2006, 5(12):1015-1025.
[5] Bright RA, Shay DK, Shu B, et al. Adamantane resistance among influenza A viruses isolated early during the 2005-2006 influenza season in the United States. JAMA, 2006, 295(8):891-894.
[6] Kiso M, Mitamura K, Sakai-Tagawa Y, et al. Resistant influenza A viruses in children treated with oseltamivir: descriptive study. Lancet, 2004, 364(9436):759-765.
[7] Dave RS, Pomerantz RJ. RNA interference: on the road to an alternate therapeutic strategy! Rev Med Virol, 2003, 13(6):373-385.
[8] Meliopoulos VA, Andersen LE, Birrer KF, et al. Host gene targets for novel influenza therapies elucidated by high-throughput RNA interference screens. FASEB J, 2012, 26(4):1372-1386.
[9] Doi N, Zenno S, Ueda R, et al. Short-interfering-RNA-mediated gene silencing in mammalian cells requires Dicer and eIF2C translation initiation factors. Curr Biol, 2003, 13(1):41-46.
[10] Song JJ, Smith SK, Hannon GJ, et al. Crystal structure of Argonaute and its implications for RISC slicer activity. Science, 2004, 305(5689):1434-1437.
[11] Ge Q, McManus MT, Nguyen T, et al. RNA interference of influenza virus production by directly targeting mRNA for degradation and indirectly inhibiting all viral RNA transcription. Proc Natl Acad Sci U S A, 2003, 100(5):2718-2723.
[12] Tompkins SM, Lo CY, Tumpey TM, et al. Protection against lethal influenza virus challenge by RNA interference in vivo. Proc Natl Acad Sci U S A, 2004, 101(23):8682-8686.
[13] Suzuki H, Saitoh H, Suzuki T, et al. Inhibition of influenza virus by baculovirus-mediated shRNA. Nucleic Acids Symp Ser (Oxf), 2009, (53):287-288.
[14] LaBarre DD, Lowy RJ. Improvements in methods for calculating virus titer estimates from TCID50 and plaque assays. J Virol Methods, 2001, 96(2):107-126.
[15] Tannous BA. Gaussia luciferase reporter assay for monitoring biological processes in culture and in vivo. Nat Protoc, 2009, 4(4):582-591.
[16] Guo S, Kemphues KJ. Par-1, a gene required for establishing polarity in C. elegans embryos, encodes a putative Ser/Thr kinase that is asymmetrically distributed. Cell, 1995, 81(4):611-620.
[17] Bitko V, Barik S. Phenotypic silencing of cytoplasmic genes using sequence-specific double-stranded short interfering RNA and its application in the reverse genetics of wild type negative-strand RNA viruses. BMC Microbiol, 2001, 1:34.
[18] Li W, Yang X, Jiang Y, et al. Inhibition of influenza A virus replication by RNA interference targeted against the PB1 subunit of the RNA polymerase gene. Arch Virol, 2011, 156(11):1979-1987.
[19] Zhang W, Wang CY, Yang ST, et al. Inhibition of highly pathogenic avian influenza virus H5N1 replication by the small interfering RNA targeting polymerase A gene. Biochem Biophys Res Commun, 2009, 390(3):421-426.
[20] Sui HY, Zhao GY, Huang JD, et al. Small interfering RNA targeting m2 gene induces effective and long term inhibition of influenza A virus replication. PLoS One, 2009, 4(5):e5671.
[21] Hui EK, Yap EM, An DS, et al. Inhibition of influenza virus matrix (M1) protein expression and virus replication by U6 promoter-driven and lentivirus-mediated delivery of siRNA. J Gen Virol, 2004, 85(Pt 7):1877-1884.
Study on the activity of novel siRNAs against influenza virus
ZHANG Yong-xin, ZHAO Fei, WANG Yu-jia, ZHANG Rui-xin, CEN Shan
ObjectiveTo design and synthesize the novel siRNAs with universal anti-influenza virus activity which was measured both in vitro and in vivo.
MethodsThe siRNAs were designed targeting at the highly conserved fragments of PB2, PB1, PA, M and NS gene of A/WSN/33 strain. The anti-virus activity screening of siRNAs was carried out with 293T-Gluc system and single-infectious influenza virus sequentially. And the inhibitory effect of siRNAs on influenza virus replication was detected in vitro. Then the in vivo activity of siRNAs was valued in mice by aerosolization delivery.
Results4 siRNAs of siPB2-1, siPB2-2, siPB1-2 and siNS-1 were screened out with above 50% inhibitory activity. The EC50values of siRNAs are between 0.4 to 1.3 nmol/L. The siRNAs also inhibited the replication of another two strains of A/PR/8/34 and B/Beijinghaidian/1386/2013 (Victoria lineage). The animal experiment showed that siPB2-1 protected mice from influenza virus infection via aerosolization delivery.
ConclusionThe independent designed siRNAs possess high anti-influenza virus activity both in vitro and in vivo.
Influenzavirus A; RNA small interfering; Animal experimentation
CEN Shan, Email: shancen@hotmail.com
10.3969/j.issn.1673-713X.2017.03.003
国家自然科学基金(81401675、31470076)
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所免疫生物学室
岑山,Email:shancen@hotmail.com
2017-03-10
*同为第一作者
www.cmbp.net.cn 中国医药生物技术, 2017, 12(3):207-214
Author Affiliation: Department of Immunology, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Union Medical College, Beijing 100050, China
www.cmbp.net.cn Chin Med Biotechnol, 2017, 12(3):207-214
