新型酰腙席夫碱类化合物的设计、合成及抗结核活性研究
2017-06-19任金凤蒙建州赵跃王菊仙
任金凤,蒙建州,赵跃,王菊仙
新型酰腙席夫碱类化合物的设计、合成及抗结核活性研究
任金凤,蒙建州,赵跃,王菊仙
目的设计合成新型酰腙席夫碱类化合物,并评价其体外抗结核分枝杆菌活性。
方法以羟基苯甲醛为起始原料,经酰肼化、脱水缩合反应制备目标化合物,其结构均经 MS 和1H-NMR 分析确证。采用平皿二倍稀释法测定目标化合物体外抗结核杆菌标准株(H37Rv)的最小抑菌浓度(MIC)。
结果合成 20 个新型酰腙席夫碱类化合物,部分化合物具有一定的抗结核活性,其中化合物 b1 ~ b5 具有较好的体外抗结核分枝杆菌活性,化合物 b2、b3 和 b5 体外抗结核分枝杆菌活性(MIC < 0.125 μg/ml)是先导化合物 IMB-HC109(MIC = 0.25 μg/ml)的 2 倍以上。
结论目标化合物结构中 A 部分含有 2-吡啶羰基或 4-吡啶羰基片段,B 部分含有 3-苯甲醚或 4-苯甲醚片段,C 部分含有吡啶基片段有利于提高该类化合物体外抗结核活性,其中化合物 b2、b3 和 b5 的体内抗结核分枝杆菌活性值得进一步研究。
化学技术,合成; 抗结核药; 酰腙席夫碱
结核病(tuberculosis,TB),又被称为“白色瘟疫”,是一种由结核分枝杆菌(mycobacterium tuberculosis,MTB)引起的传染性疾病。结核病的主要传播途径为空气-呼吸道,故肺结核病例占据了临床 TB 的 80% 以上。自二十世纪八十年代开始,由于耐药结核病的流行,尤其是耐多药结核病(multidrug-resistant tuberculosis,MDR-TB)的发病率不断上升,使结核疫情再度上升,同时随着艾滋病(AIDS)的流行,MTB 与 HIV 合并感染使这种疾病雪上加霜[1-2]。据世界卫生组织(WHO)2016 年全球肺结核数据报告显示,2015 年,全球共有 1040 万人罹患结核病,死亡人数达到 140 万人,其中耐多药结核病例多达 48 万人,结核病已成为全球关注的重大公共卫生问题[3]。在过去的五十年中,虽然抗结核病药物研究取得了一些新的进展,遗憾的是,几乎没有新的抗结核药物批准上市。现阶段,临床上使用的一线和二线抗结核药物已使用长达半个多世纪,在临床应用过程中存在着治疗周期长,对耐药结核无效等诸多问题[4-5]。我国是全球结核病高投入高负担国家之一,耐药结核病疫情不容乐观,形势依旧严峻。因此,迫切需要开发新型的抗结核药物。
酰腙席夫碱类化合物的分子中含有酰腙活性基团(-CONHN=CH-),酰腙基团中的氮原子与氧原子可以在生物体内形成氢键,有助于增加化合物与受体之间的亲和性,从而表现出诸如抗菌、消炎、镇痛等生理活性[6-10]。为了寻找新型抗结核药物,我们以天冬氨酸半醛脱氢酶(aspartic acid semialdehyde dehydrogenase,ASADH)筛选模型通过高通量筛选(HTS),获得了一个 ASADH 抑制剂 IMB-HC109(图 1)[11]。IMB-HC109 是酰腙席夫碱类化合物,其对结核杆菌标准菌株 H37Rv 的最低抑菌浓度(MIC)为 0.25 μg/ml。为了获得抗结核活性更强的化合物,我们以化合物 IMB-HC109为先导化合物,利用生物电子等排和拼合原理,拟对其分子结构(图 1)的 A、B、C 三个部分进行结构修饰和优化,设计合成一系列新型的酰腙席夫碱类化合物并测定其体外抗结核分枝杆菌活性。
1 材料与方法
1.1 材料
1.1.1 主要仪器和试剂 Bruker-400 MHz 和Bruker-500 MHz 型核磁共振仪为德国 Bruker 公司产品;梅特勒 MP-70 熔点仪为瑞士梅特勒-托利多公司产品,温度计未经校正;Agilent-1100 型四级杆液质联用仪为美国 Agilent 公司产品;所用试剂均为市售分析纯或化学纯。
1.2 方法
1.2.1 目标化合物(b1 ~ b20)的合成 以不同取代的苯甲醛为起始原料,在无水乙醇中与异烟肼或乙酰肼经回流反应得化合物 a1 ~ a7,化合物 a1 ~ a7 在无水 N,N-二甲基甲酰胺(DMF)中,经1-羟基苯并三唑,1-(3-二甲胺基丙基)-3-乙基碳二亚胺活化,最后与吡啶甲酸/烟酸/异烟酸脱水缩合得目标化合物 b1 ~ b20(图 2)。
1.2.2 体外抗结核分枝杆菌活性 采用美国临床实验室标准化协会(CLSI)推荐的平皿二倍稀释法测定目标化合物 b1 ~ b20 的最低抑菌浓度(MIC),阳性对照药为 IMB-HC109。于无菌平皿内加入1 ml 药液,再加入融化的 50 ℃ MH 培养基 14 ml,混匀,使其每皿内所含药物终浓度依次为 128、64、32、16、8、4、2、1、0.5、0.25、0.125、0.06、 0.03 mg/L;待冷却后用 Denlay 多点接种仪接种细菌,接种菌量约为 105cfu/ml。置于 35 ~ 37 ℃ 培养箱内培养 24 h,观察记录结果,无菌生长的平皿中所含药物最小的浓度即为最低抑菌浓度。

图 1 先导化合物 IMB-HC109 的结构及分子设计策略Figure 1 The structure of compound IMB-HC109 and the strategy of design
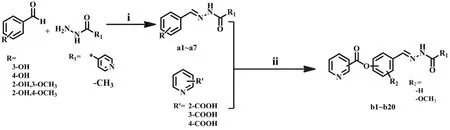
图 2 目标化合物 b1 ~ b20 合成路线Figure 2 Synthetic routes of target compounds b1 - b20
2 结果
2.1 目标化合物的合成
共合成 20 个新型酰腙席夫碱类化合物,目标化合物结构(图 3)均经1H-NMR 和 MS 确证。
2.1.1 (E)-4-[(2-异烟酰肼基)甲基]苯基烟酸酯(b1) 白色固体,收率 73.3%,mp:236 ~ 237 ℃。1H-NMR(500 MHz,DMSO-d6)δ 12.16(s,1H),9.29(d,J = 1.2 Hz,1H),8.93 ~ 8.92(m,J = 5.0,1.2 Hz,1H),8.81(d,J = 5.0 Hz,2H),8.57 ~ 8.46(m,2H),7.97 ~ 7.80(m,4H),7.69 ~ 7.66(m,1H),7.47(d,J = 10.0 Hz,2H)。ESI-MS m/z:347.2 [M+H]+。
2.1.2 (E)-4-[(2-异烟酰肼基)甲基]苯基异烟酸酯(b2) 白色固体,收率 59.1%,mp:226 ~ 227 ℃。1H-NMR(500 MHz,DMSO-d6)δ 12.16(s,1H),8.91(d,J = 5.0 Hz,2H),8.81(d,J = 5.0 Hz,2H),8.52(s,1H),8.04(d,J = 5.0 Hz,2H),7.89(d,J = 10.0 Hz,2H),7.85(d,J = 5.0 Hz,2H),7.47(d,J = 10.0 Hz,2H)。ESI-MS m/z:347.2 [M+H]+。
2.1.3 (E)-3-[(2-异烟酰肼基)甲基]苯基吡啶甲酸酯(b3) 淡黄色固体,收率 91.0%,mp:257 ~258 ℃。1H-NMR(400 MHz,DMSO-d6)δ 12.01(s,1H),9.65(s,1H),8.78(d,J = 4.0 Hz,3H),8.37(s,1H),7.81(d,J = 8.0 Hz,2H),7.28 ~ 7.24(m,3H),7.12 ~ 7.10(d,J = 8.0 Hz,1H),6.85~ 6.83(m,2H)。ESI-MS m/z:347.2 [M+H]+。
2.1.4 (E)-3-[(2-异烟酰肼基)甲基]苯基烟酸酯(b4) 淡黄色固体,收率 90.5%,mp:90 ~ 91 ℃。1H-NMR(400 MHz,DMSO-d6)δ 12.19(s,1H),9.30(s,1H),8.93 ~ 8.80(m,3H),8.52 ~ 8.49(m,2H),7.84(d,J = 4.0 Hz,2H),7.73 ~ 7.66(m,3H),7.62 ~ 7.59(m,1H),7.46 ~ 7.44(m,1H)。ESI-MS m/z:347.2 [M+H]+。
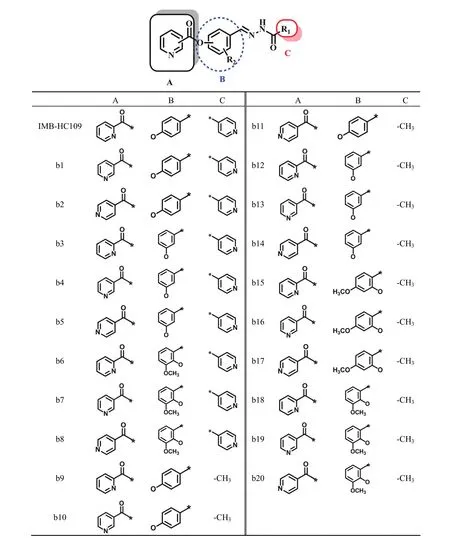
图 3 目标化合物 b1 ~ b20 结构Figure 3 Structure of target compounds b1 - b20
2.1.5 (E)-3-[(2-异烟酰肼基)甲基]苯基异烟酸酯(b5) 淡黄色固体,收率 87.3%,mp:128 ~129 ℃。1H-NMR(500 MHz,DMSO-d6)δ 12.17(s,1H),8.89(d,J = 5.0 Hz,2H),8.78(s,2H),8.49(s,1H),8.03(d,J = 5.0 Hz,2H),7.82(d,J = 5.0 Hz,2H),7.75(s,1H),7.71(d,J = 5.0 Hz,1H),7.61 ~ 7.58(m,1H),7.43(d,J = 5.0 Hz,1H)。ESI-MS m/z:347.2 [M+H]+。
2.1.6 (E)-2-[(2-异烟酰肼基)甲基]-6-甲氧基吡啶甲酸酯(b6) 黄色固体,收率 80.0%,mp:176 ~177 ℃。1H-NMR(400 MHz,DMSO-d6)δ 12.09(s,1H),8.88 ~ 8.86(m,3H),8.57(s,1H),8.33(d,J = 8.0 Hz,1H),8.15 ~ 8.11(m,1H),7.84 ~ 7.73(m,3H),7.64 ~ 7.62(dd,J = 8.0,1.0 Hz,1H),7.42(t,J = 8.0 Hz,1H),7.31(dd,J = 8.0,1.0 Hz,1H),3.81(s,3H)。ESI-MS m/z:377.2 [M+H]+。
2.1.7 (E)-2-[(2-异烟酰肼基)甲基]-6-甲氧基烟酸酯(b7) 黄色固体,收率 83.3%,mp:214 ~215 ℃。1H-NMR(500 MHz,DMSO-d6)δ 11.99(s,1H),9.33(s,1H),8.94(d,J = 5.0 Hz,1H),8.74(d,J = 5.0 Hz,2H),8.54(d,J = 10.0 Hz,2H),7.74(d,J = 5.0 Hz,2H),7.69(dd,J = 5.0,5.0 Hz,1H),7.59(d,J = 5.0 Hz,1H),7.41(t,J = 5.0 Hz,1H),7.30(d,J = 5.0 Hz,1H),3.80(s,3H)。ESI-MS m/z:377.2 [M+H]+。
2.1.8 (E)-2-[(2-异烟酰肼基)甲基]-6-甲氧基异烟酸酯(b8) 深黄色固体,收率 83.1%,mp:222 ~223 ℃。1H-NMR(500 MHz,DMSO-d6)δ 12.03(s,1H),8.92(d,J = 5.0 Hz,2H),8.73(s,2H),8.53(s,1H),8.08(d,J = 5.0 Hz,2H),7.74(d,J = 5.0 Hz,2H),7.59(d,J =10.0 Hz,1H),7.43~ 7.40(m,1H),7.30(d,J = 10.0 Hz,1H),3.80(s,3H)。ESI-MS m/z:377.2 [M+H]+。
2.1.9 (E)-4-[(2-乙酰肼基)甲基]苯基吡啶甲酸酯(b9) 白色固体,收率 77.9%,mp:203 ~ 204 ℃。1H-NMR(500 MHz,DMSO-d6)δ 11.39 ~ 11.27(m,1H),8.81(d,J = 5.0 Hz,1H),8.24 ~ 8.01(m,3H),7.77 ~ 7.73(m,3H),7.38 ~ 7.36(m,2H),2.20 ~ 1.95(m,3H)。ESI-MS m/z:284.2 [M+H]+。
2.1.10 (E)-4-[(2-乙酰肼基)甲基]苯基烟酸酯(b10) 黄色固体,收率 56.6%,mp:171 ~ 172 ℃。1H-NMR(400 MHz,DMSO-d6)δ 11.43-11.30(m,1H),9.28(s,1H),8.92(d,J = 4.0 Hz,1H),8.49(d,J = 8.0,2.0 Hz,1H),8.11(d,J = 68.0 Hz,1H),7.81 ~ 7.77(m,2H),7.43 ~ 7.65(m,J = 4.9 Hz,1H),7.43 ~ 7.40(m,2H),2.22 ~ 1.97(m,3H)。ESI-MS m/z:284.2 [M+H]+。
2.1.11 (E)-4-[(2-乙酰肼基)甲基]苯基异烟酸酯(b11) 黄色固体,收率 67.7%,mp:203 ~ 204 ℃。1H-NMR(500 MHz,DMSO-d6)δ 11.46 ~ 11.33(m,1H),8.90(d,J = 5.0 Hz,2H),8.19 ~ 8.02(m,3H),7.81 ~ 7.77(m,2H),7.43 ~ 7.40(m,2H),2.22 ~ 1.96(m,3H)。ESI-MS m/z:284.2 [M+H]+。
2.1.12 (E)-3-[(2-乙酰肼基)甲基]苯基吡啶甲酸酯(b12) 黄色固体,收率 65.7%,mp:180 ~ 181 ℃。1H-NMR(500 MHz,DMSO-d6)δ 11.45 ~ 11.30(m,1H),8.81(d,J = 5.0 Hz,1H),8.25 ~ 8.01(m,3H),7.75 ~ 7.74(m,1H),7.61 ~ 7.52(m,3H),7.33(d,J = 5.0 Hz,1H),2.19 ~1.94(m,3H)。ESI-MS m/z:284.2 [M+H]+。
2.1.13 (E)-3-[(2-乙酰肼基)甲基]苯基烟酸酯(b13) 黄色固体,收率 63.2%,mp:195 ~ 196℃。1H-NMR(500 MHz,DMSO-d6)δ 11.38 ~ 11.31(m,1H),9.27(s,1H),8.90(s,1H),8.47(d,J = 10.0 Hz,1H),8.09(d,J = 75.0 Hz,1H),7.65 ~7.51(m,4H),7.36(d,J = 5.0 Hz,1H),2.19 ~ 1.95(m,3 H)。ESI-MS m/z:284.2 [M+H]+。
2.1.14 (E)-3-[(2-乙酰肼基)甲基]苯基异烟酸酯(b14) 黄色固体,收率 73.6%,mp:187 ~ 188 ℃。1H-NMR(500 MHz,DMSO-d6)δ 11.45 ~ 11.31(m,1H),8.89(d,J = 5.0 Hz,2H),8.16 ~ 8.01(m,3H),7.66 ~ 7.51(m,3H),7.36(d,J = 10.0 Hz,1H),2.19 ~ 1.94(m,3H)。ESI-MS m/z:284.2 [M+H]+。
2.1.15 (E)-2-[(2-乙酰肼基)甲基]-5-甲氧基吡啶甲酸酯(b15) 紫色固体,收率 64.2%,mp:168 ~169 ℃。1H-NMR(500 MHz,DMSO-d6)δ 11.23 ~11.02(m,1H),8.83(d,J = 5.0 Hz,1H),8.30 ~8.26(m,1H),8.11 ~ 8.00(m,2H),7.87 ~ 7.74(m,2H),7.00 ~ 6.98(m,2H),3.81(s,3H),1.95 ~ 1.85(m,3H)。ESI-MS m/z:314.2 [M+H]+。
2.1.16 (E)-2-[(2-乙酰肼基)甲基]-5-甲氧基烟酸酯(b16) 白色固体,收率 84.2%,mp:198 ~ 199 ℃。1H-NMR(500 MHz,DMSO-d6)δ 11.18 ~ 11.01(m,1H),9.29(s,1H),8.92(d,J = 5.0 Hz,1H),8.52 ~ 8.48(m,1H),8.13 ~ 8.04(m,1H),7.85 ~7.80(m,1H),7.69 ~ 7.66(m,1H),7.03 ~ 6.68(m,2H),3.81(s,3H),1.98 ~ 1.81(m,3H)。ESI-MS m/z:314.2 [M+H]+。
2.1.17 (E)-2-[(2-乙酰肼基)甲基]-5-甲氧基异烟酸酯(b17) 黄色固体,收率 85.4%,mp:220 ~221 ℃。1H-NMR(500 MHz,DMSO-d6)δ 11.18 ~11.02(m,1H),8.91(d,J = 3.3 Hz,2H),8.11 ~8.01(m,3H),7.83 ~ 7.79(m,1H),7.04 ~ 6.69(m,2H),3.81(s,3H),1.97 ~ 1.85(m,3H)。ESI-MS m/z:314.2 [M+H]+。
2.1.18 (E)-2-[(2-乙酰肼基)甲基]-6-甲氧基吡啶甲酸酯(b18) 白色固体,收率 80.1%,mp:198 ~199 ℃。1H-NMR(500 MHz,DMSO-d6)δ 11.36 ~11.14(m,1H),8.84(d,J = 5.0 Hz,1H),8.30 ~8.26(m,1H),8.11 ~ 8.08(m,2H),7.78 ~ 7.76(m,1H),7.48(dd,J = 10.0,5.0 Hz,1H),7.34(t,J = 5.0 Hz,1H),7.23(t,J = 5.0 Hz,1H),3.78(s,3H),2.03 ~ 1.87(m,3H)。ESI-MS m/z:314.2 [M+H]+。
2.1.19 (E)-2-[(2-乙酰肼基)甲基]-6-甲氧基烟酸酯(b19) 白色固体,收率 88.3%,mp:215 ~ 216 ℃。1H-NMR(400 MHz,DMSO-d6)δ 11.34 ~ 11.15(m,1H),9.33 ~ 9.31(m,1H),8.97 ~ 8.95(m,1H),8.55 ~ 8.50(m,1H),8.24 ~ 8.13(m,1H),7.70(dd,J = 8.0,4.0 Hz,1H),7.56 ~ 7.47(m,1H),7.39 ~ 7.25(m,1H),7.27 ~ 7.24(m,1H),3.80(s,3H),2.06 ~ 1.89(m,3H)。ESI-MS m/z:314.2 [M+H]+。
2.1.20 (E)-2-[(2-乙酰肼基)甲基]-6-甲氧基异烟酸酯(b20) 黄色固体,收率 68.6%,mp:193 ~194 ℃。1H-NMR(500 MHz,DMSO-d6)δ 11.31 ~11.12(m,1H),8.92(d,J = 4.0 Hz,2H),8.19 ~8.03(m,3H),7.49 ~ 7.46(m,1H),7.36(t,J = 8.0 Hz,1H),7.24(d,J = 8.0 Hz,1H),3.78(s,3H),2.03 ~ 1.87(m,3H)。ESI-MS m/z:314.2 [M+H]+。
2.2 体外抗结核分枝杆菌活性
采用平皿二倍稀释法测定目标化合物的体外抗结核分枝杆菌标准株(H37Rv)的活性,其最小抑菌浓度(MIC)的结果如表 1 所示。研究结果表明,化合物 b1 ~ b5 具有较强的体外抗结核分枝杆菌活性,MIC 值为 0.25 ~ 0.125 μg/ml,其中化合物 b2、b3 和 b5 体外抗结核分枝杆菌活性最优(MIC < 0.125 μg/ml);化合物 b6 ~ b8 具有中等强度的抗结核活性(MIC 值为 0.5 ~ 2 μg/ml);化合物 b15 ~ b20 则显示了较弱的抗结核分枝杆菌活性(MIC 值为 8 ~ 64 μg/ml)。

表 1 目标化合物的体外抗结核活性(μg/ml)Table 1 In vitro activity of target compounds against MTB-H37Rv (μg/ml)
3 讨论
目标化合物体外抗结核分枝杆菌活性结果表明,化合物 b1 ~ b5 体外抗结核活性优于先导化合物或与其相当,构效关系表明目标化合物结构中 A部分含有 2-吡啶羰基或 4-吡啶羰基片段,B 部分含有 3-苯甲醚或 4-苯甲醚片段,C 部分含有吡啶基片段,有利于提高该类化合物的体外抗结核活性;化合物 b9 ~ b20 的体外抗结核分枝杆菌活性较先导化合物降低了 32 ~ 256 倍,说明 C 部分含有乙酰基片段对抗菌活性不利,而吡啶基片段有利于提高该类化合物抗结核活性。其中化合物 b2、b3 和 b5(MIC < 0.125 μg/ml)的体外抗结核分枝杆菌活性是先导化合物(MIC = 0.25 μg/ml)的 2 倍以上,值得进一步深入研究。为此,我们即将开展对化合物 b2、b3 和 b5 的初步毒性研究及体内抗结核活性评价,结果值得期待。
[1] Tiberi S, Buchanan R, Caminero JA, et al. The challenge of the new tuberculosis drugs. Presse Med, 2017, 46(2 Pt 2):e41-e51.
[2] Tiberi S, Carvalho AC, Sulis G, et al. The cursed duet today: Tuberculosis and HIV-coinfection. Presse Med, 2017, 46(2 Pt 2): e23-e39.
[3] World Health Organization. Global tuberculosis report 2016. World Health Organization, 2016. [2017-02-28]. http://www.who.int/tb/ publications/global_report/en/.
[4] Matteelli A, Sulis G, Capone S, et al. Tuberculosis elimination and the challenge of latent tuberculosis. Presse Med, 2017, 46(2 Pt 2):e13-e21.
[5] Alffenaar JC, Akkerman OW, Anthony RM, et al. Individualizing management of extensively drug-resistant tuberculosis: diagnostics,treatment, and biomarkers. Expert Rev Anti Infect Ther, 2017, 15(1):11-21.
[6] Wang J. Recent advances in the biological activity of acylhydrazone derivatives. GuangZhou Chem Indu Technol, 2012, 40(8):20-22. (in Chinese)王建. 酰腙类化合物生物活性研究进展. 广州化工, 2012, 40(8): 20-22.
[7] Chen L, Xie J, Song H, et al. Design, synthesis, and biological activities of spirooxindoles containing acylhydrazone fragment derivatives based on the biosynthesis of alkaloids derived from tryptophan. J Agric Food Chem, 2016, 64(34):6508-6516.
[8] Wei ZY, Chi KQ, Yu ZK, et al. Synthesis and biological evaluation of chalcone derivatives containing aminoguanidine or acylhydrazone moieties. Bioorg Med Chem Lett, 2016, 26(24):5920-5925.
[9] Xiao W, Zhang HX, Lu ZL, et al. Classification, coordination and properties of acylhydrazone compounds. Acta Scientiarum Naturaliumn Univ Sunyatseni, 2001, 40(1):39-42. (in Chinese)肖文, 张华新, 卢忠林, 等. 酰腙化合物的分类、配位和性质. 中山大学学报(自然科学版), 2001, 40(1):39-42.
[10] Hernández P, Rojas R, Gilman RH, et al. Hybrid furoxanyl N-acylhydrazone derivatives as hits for the development of neglected diseases drug candidates. Eur J Med Chem, 2013, 59:64-74.
[11] Meng J, Yang Y, Xiao C, et al. Identification and validation of aspartic acid semialdehyde dehydrogenase as a new anti-mycobacterium tuberculosis target. Int J Mol Sci, 2015, 16(10):23572-23586.
Design, synthesis and evaluation of novel acylhydrazone schiff base derivatives as potent antituberculosis agents
REN Jin-feng, MENG Jian-zhou, ZHAO Yue, WANG Ju-xian
ObjectiveTo design, synthesize and evaluate the in vitro antituberculosis activity of novel acylhydrazone schiff base derivatives.
MethodsThe title compounds were synthesized from hydroxy benzaldehyde, via hydrazide reaction and condensation reaction. The structure were confirmed by MS and1H-NMR. The MICs of antituberculosis activity (H37Rv) were determined by standard agar dilution method.
ResultsTwenty novel compounds were synthesized, among which compounds b1 - b5 were found to have potential antituberculosis activity. Specifically, the activities of compounds b2, b3 and b5 (MIC < 0.125 μg/ml) were two folds stronger than that of the lead compound IMB-HC109 (MIC = 0.25 μg/ml).
ConclusionIn the title compounds structure, part A bearing 2-pyridyl or 4-pyridyl carbonyl fragments, part B with 3- or 4-methyl-phenoxide fragments, and part C containing pyridyl group can improve in vitro antituberculosis activity. The in vivo antituberculosis activities of compounds b2, b3 and b5 merit further investigation.
Chemistry techniques, synthetic; Antitubercular agents; Acylhydrazone schiff base
WANG Ju-xian, Email: imbjxwang@163.com
10.3969/j.issn.1673-713X.2017.03.002
国家自然科学基金面上项目(81473098);中国医学科学院医学与健康科技创新工程-协同创新团队项目(2016-I2M-3-014)
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所有机合成室
王菊仙,Email:imbjxwang@163.com
2017-02-28
www.cmbp.net.cn 中国医药生物技术, 2017, 12(3):201-206
Author Affiliation: Organic Synthesis Chamber, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China
www.cmbp.net.cn Chin Med Biotechnol, 2017, 12(3):201-206
