热刺激对栉孔扇贝免疫功能和热休克蛋白表达的影响*
2017-06-19刘甜雨陈慕雁
刘甜雨, 王 清, 陈慕雁
(1.海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003;2.中国科学院烟台海岸带研究所 中国科学院海岸带环境过程与生态修复重点实验室, 山东 烟台 264003;3.中国科学院烟台海岸带研究所,牟平海岸带环境综合试验站, 山东 烟台 264003)
热刺激对栉孔扇贝免疫功能和热休克蛋白表达的影响*
刘甜雨1, 王 清2,3**, 陈慕雁1
(1.海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003;2.中国科学院烟台海岸带研究所 中国科学院海岸带环境过程与生态修复重点实验室, 山东 烟台 264003;3.中国科学院烟台海岸带研究所,牟平海岸带环境综合试验站, 山东 烟台 264003)
为探究热刺激对栉孔扇贝(Chlamysfarreri)免疫功能的影响,以及热休克蛋白在应对急性高温胁迫时的作用。本研究对一龄栉孔扇贝进行28℃热刺激,采用流式细胞术于0、1、2、4、8 h测定血细胞的吞噬率和活性氧ROS含量;以鳗弧菌和溶壁微球菌为底物测定血清抗菌、溶菌活力;用彗星实验测定DNA损伤;用AO/EB(吖啶橙/溴化乙啶)荧光染色法检测细胞凋亡;用荧光实时定量PCR检测HSP70和HSP90 mRNA相对表达量。研究表明:热刺激使血细胞中活性氧含量、吞噬活性以及血淋巴抗菌、溶菌活力受到抑制,总体表现为下降趋势;DNA损伤和细胞凋亡受热刺激诱导显著上升,具有明显的时间-效应关系;HSP70、HSP90 mRNA表达量显著上调,反应迅速,且HSP70受热刺激诱导更显著。研究结果表明,热刺激导致栉孔扇贝血细胞发生细胞凋亡、加剧DNA损伤,造成免疫力下降,而机体通过大量表达热休克蛋白HSP70、HSP90保护细胞和组织免受损伤。本研究为探究夏季易发扇贝大规模死亡原因提供了理论依据。
热刺激;栉孔扇贝;血细胞;免疫应答;细胞凋亡;DNA损伤;HSP70;HSP90
栉孔扇贝(Chlamysfarreri)是我国浅海筏式养殖的主要对象之一,自1980年代以来,我国北方沿海逐渐形成了以栉孔扇贝和海湾扇贝为代表的近海贝类养殖业,成为我国沿海地区重要的经济支柱产业之一。1997年以来,盲目追求高密度养殖使得贝类生存环境恶化,局部生态系统失衡,养殖区病害肆虐,导致栉孔扇贝大规模死亡。扇贝大规模死亡多发生于夏季较高水温期间,且由南及北呈传染病样波及[1-2]。大量研究发现,在影响海洋双壳贝类疾病流行的各种环境因子中,温度是影响疾病时空分布的主要因素[3-6]。
在抵御病原体和环境胁迫时,双壳贝类的非特异性免疫发挥着至关重要的作用[7]。其中,细胞吞噬作用是双壳类免疫防御的主要效应方式[8-11],细胞吞噬活性已广泛应用于贝类机体健康状况的评价,以及衡量环境或病原胁迫下机体的免疫防御能力[12-15]。伴随着细胞吞噬,通常会发生呼吸爆发,产生活性氧(Reactive oxygen species,ROS)。ROS能够对病原体产生杀伤作用[12],是反映生物体是否受到不良因素胁迫的重要指标之一。研究表明,血细胞的吞噬活性和ROS含量对温度变化十分敏感[16-20]。除血细胞作用外,贝类还会通过细胞分泌到体液中的各种酶类和肽段进行体液免疫。体液因子能够抑菌、杀菌,包括溶酶体酶、凝集素、抗菌肽和蛋白酶抑制剂等[21]。血清的抗菌、溶菌活力能体现出各体液免疫因子的综合作用[22],是衡量生物体液免疫总体水平的一个重要指标。研究表明,急剧水温变化会影响贝类的免疫功能和抗病力,导致贝类免疫抑制而死亡[18, 23]。
外源性高温还会导致DNA双链结构破坏、DNA链断裂、碱基或碱基对被切除或替换等DNA损伤[24]。DNA损伤进而会诱导细胞的程序性死亡,即细胞凋亡[25]。细胞凋亡是维持机体正常发育和自稳态平衡的一种重要机制,受多种因素诱导发生[26]。在分子水平上,动物体内利用基因调节温度适应性的机制普遍存在,热胁迫可以诱导动物体内热休克蛋白基因的大量表达[27]。热休克蛋白(Heat shock proteins,HSPs)是机体在应激状态下细胞迅速合成的一类蛋白质,其生物学特性在提高细胞耐受力和机体热耐力的研究中具有非常重要的地位,受到人们的普遍关注;另外,因HSPs具有高度的保守性、普遍性和应激性等特性[28],很多研究者利用其广泛存在的特点及其与环境的特殊关系,选择HSPs作为环境监测的标志物[29]。在热休克蛋白家族中,HSP70和HSP90是生物抗逆性和抗感染的重要生物分子[30]。
为了扇贝养殖业的健康可持续发展,需要对贝类生理及抗逆机制有全面、深入、系统的认识,充分了解与应激反应相关的基因和调控机制。目前针对栉孔扇贝已经开展了生理[31-35]、生态[36-40]、病害免疫[41-46]、遗传育种[47, 48]、分子标记[49-53]等多方面研究,但针对扇贝在急性热胁迫下血淋巴细胞损伤、免疫反应和基因表达的综合研究尚不多见。本研究重点关注高温对栉孔扇贝的急性刺激及其响应机制,通过测定热刺激对栉孔扇贝血淋巴细胞的吞噬活性、活性氧水平,抗菌、溶菌活力,DNA损伤,细胞凋亡,以及热休克蛋白HSP70、HSP90 mRNA的相对表达量,多方面综合分析高温刺激在短时间内对栉孔扇贝造成的机体损伤,从而揭示免疫系统和应激蛋白表达调控的启动和变化规律,为探究热刺激对机体相关免疫指标的影响及机体的应对策略,为探索扇贝大规模流行性死亡的发病原因提供理论依据,同时也为养殖贝类环境胁迫评价体系的构建提供基础资料。
1 材料与方法
1.1 实验生物
栉孔扇贝购自山东省青岛市南山市场,均为一龄贝,于实验室循环水槽中暂养1周后进行实验。暂养期间海水温度控制在15℃,盐度30,pH 7.6~8.1,连续充氧,每日投喂螺旋藻2次。
1.2 实验处理
暂养结束后选取规格较一致的栉孔扇贝,直接由暂养温度转移到水温为28 ℃[35,54-55]的海水中,进行急性热胁迫实验。实验过程中,扇贝受外源刺激无闭壳反应时认定为死亡,并立即移除。实验开始后0(对照组)、1、2、4和8 h分别进行扇贝血细胞取样,并测定相关实验指标。每个指标测定的生物学重复为4 ~ 6个个体。
1.3 实验方法
1.3.1 血淋巴的采集和工作液制备 用预冷的1 mL注射器从每个扇贝闭壳肌中抽取约500 μL血淋巴,置于冰水混合物中,每个取样时间随机取扇贝20~30只,每5只混合为一个样本。将每份混合血淋巴与等量抗凝剂(Glucose:20.8 g·L-1,EDTA:20mmol/L,Sodium chloride:20 g·L-1,Tris-HCl:0.05mol/L,pH=7.4)混匀,防止血细胞凝集,混合溶液用作血淋巴工作液。在使用BD公司生产的FACSVantage流式细胞仪进行检测活性氧产物和吞噬活性时,为了防止堵塞仪器,血淋巴样品上样前必须先以50 μm网目的筛绢过滤,去除杂质。
1.3.2 血细胞活性氧产物 取400 μL血淋巴工作液于实验离心管中,置于冰水混合物中,加入4 μL的2’7’-二氯荧光黄(DCFH-DA)(终浓度为0.01 mmol/L),18℃避光抚育1h后上样。DCFH-DA本身不带荧光,渗透入细胞后,DCFH-DA被水解为DCFH,结合在细胞内,被胞内的活性氧产物进一步氧化成为具有强荧光的DCF[56-57],测定活性氧产物的静息值。DCF荧光值以任意单位表示(A.U.)。
1.3.3 血细胞的吞噬活性 实验采用经石芳芳等[58]改进后Delaporte[59]的方法,取200 μL血淋巴工作液在4 ℃,780g离心10 min,去上清,沉淀的血细胞用过滤海水重悬,然后加入浓度为0.3%的荧光微球30 μL,18 ℃避光抚育1 h,再加入230 μL 6%的福尔马林溶液(过滤灭菌海水配置)中止反应,并上样。血细胞吞噬活性用细胞吞噬率表示,即参与吞噬荧光微球的血细胞占所有吞噬细胞的比率。
1.3.4 血淋巴细胞的溶菌活力 以溶壁微球菌(Micrococcuslysodeikticus)冻干粉为底物,将菌体用0.1 mol/L、pH=6.4的无菌磷酸钾盐缓冲液配成一定浓度的菌悬液(OD570nm≈0.3),取3 mL菌悬液置于冰浴中,加入100 μL待测培养上清液混匀,于570 nm波长处测定光密度值(A0),然后置于37℃水浴保温30 min,取出后立即置于冰浴中10 min终止反应,测光密度值(A)。溶菌活力(UL)按下式计算:
UL=(A0-A)/A。
1.3.5 血淋巴细胞的抗菌活力 用0.1 mol/L、pH=6.4的无菌磷酸钾盐缓冲液将鳗弧菌配成一定浓度的菌悬液(OD570nm≈0.3),取3 mL菌悬液置于冰浴中,加入100 μL待测培养上清液混匀,在570 nm波长处测定光密度值(A0),然后移入37 ℃水浴中孵育30 min,取出后立即置于冰浴内10 min终止反应,在570 nm波长处测定光密度值(A)。抗菌活力(Ua)按下式计算:
Ua=(A0-A)/A。
1.3.6 血细胞DNA损伤 参照Singh等[60]的方法,略加改进:将1%的正常熔点琼脂糖100 μL滴加到洁净的磨砂载玻片上,盖玻片铺片,4 ℃凝固10 min,移去盖玻片;将血细胞悬液10 μL(106cell·mL-1)与90 μL0.6%低熔点琼脂糖(37 ℃)混匀,取75 μL上述混合液滴加到第一层胶上,盖玻片铺片,4 ℃凝固10 min,取下盖玻片,然后将载玻片水平浸入4 ℃预冷裂解液中裂解2 h;取出载玻片晾干后移入水平电泳槽中,倒入新配置预冷(4 ℃)的电泳缓冲液中避光解旋20 min,然后室温电泳30 min (电压25V,电流300 mA);电泳结束后用0.4 mol·L-1Tris缓冲液(pH=7.4)浸洗胶板2次,每次15 min;20 μg·mL-1溴化乙啶(EB)染色,在荧光显微镜(10×40)下观察,激发波长510~560 nm,阻断波长590 nm。每个样品作3个重复,每张载玻片上随机观察100个细胞。采用CASP软件分析彗星图像,选择Olive尾矩(OTM值)用于DNA损伤的评价指标,并根据彗星尾长对DNA损伤程度进行分级[61]:无损伤,<5 μm(0);轻度损伤,5~25 μm(+);中度损伤,25~45 μm(++);重度损伤,>45 μm(+++)。
1.3.7 血细胞凋亡 参照Spector等[62]的方法,取50 μL血细胞悬液,加入6 μL浓度为100 μg·mL-1的AO/EB(吖啶橙/溴化乙啶)染液进行荧光染色,混匀后,将细胞悬液滴加到载玻片上,加盖玻片,置于荧光显微镜下观察计数正常活细胞数量、凋亡细胞数量、坏死细胞数量,正常细胞被AO染成绿色,坏死的血细胞被EB染成红色,凋亡初期血细胞呈现橙红色,并带有绿色斑点,凋亡末期细胞呈现橙红色。每个样品计数200个细胞,按以下公式计算细胞凋亡指数。
凋亡指数=B/(A+B+C)×100%;
早期凋亡率=D/(A+B+C)×100%;
晚期凋亡率=E/(A+B+C)×100%。
式中,字母A、B、C、D、E分别代表正常活细胞数量、凋亡细胞总数量、坏死细胞数量、凋亡早期细胞数量、凋亡晚期细胞数量。
1.3.8 血细胞中热休克蛋白HSP70和HSP90的mRNA相对定量表达
1.3.8.1 总RNA的提取、纯化和反转录 为了减小个体间的误差,每个时间点随机选取18只扇贝,每3只扇贝的血淋巴作为一个样品,共设置6个重复。血淋巴样品于4 ℃,3 000g离心5 min收集血细胞。采用Trizol法提取血细胞总RNA,使用PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒(TaKaRa,日本)进行总RNA的纯化和cDNA的反转录。
1.3.8.2荧光定量PCR分析 采用已经发表的HSP70[63]和HSP90[64]的特异性引物用于基因表达分析,内参基因为β-actin(见表1)。基因相对表达水平采用SYBR®Premix Ex TaqTM(Tli RNaseH Plus)试剂盒(TaKaPa,日本)检测;检测过程在7500 型实时荧光定量PCR系统(Applied Biosystems,美国)上进行。
每个样品设置3个重复,特异性引物的退火温度和循环数经优化后如下:95 ℃变性30 s;95 ℃变性5 s,60 ℃退火30 s,此步骤循环40次。在PCR运行结束后制作引物溶解曲线,分析其扩增效率以确保引物特异性和产物的单一性。根据实验结果,以β-actin为内参基因,根据2-△△CT方法计算得到各基因的相对表达量[65]。
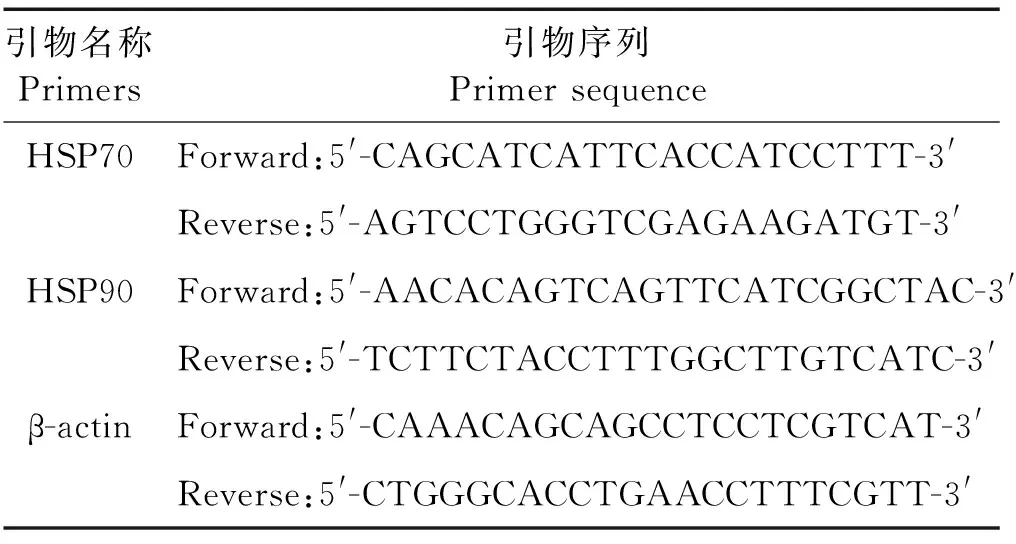
表1 用于基因表达分析的引物信息
1.4 数据处理
流式细胞仪的数据处理采用WinMDIversion28软件;彗星实验用CASP分析获得的数据采用国际常用参数分析方法[66],结果数值表示为“平均数±标准差”;数据统计采用SPSS17.0和Excel 2010软件统计分析,用单因素方差分析(One-way,ANOVA)和Duncan's多重比较法对组间进行差异分析,若P<0.05,则定义为差异显著。
2 结果与分析
2.1 热刺激对血细胞内活性氧含量的影响
活性氧水平采用DCF荧光值(AU)表示,实验结果如图1所示,热刺激开始4 h内,扇贝血细胞活性氧水平变化较小;8 h时ROS水平明显下降,与对照组(0 h)差异显著(P<0.05)。
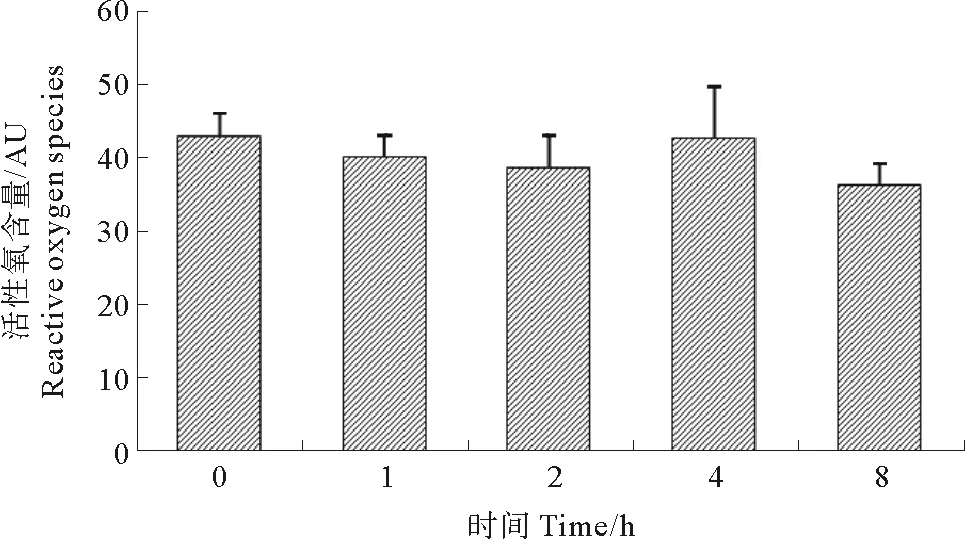
(*表示与对照组(0 h)组间差异显著(P< 0.05)。* Indicates groups significantly different from the controls (P< 0.05).)
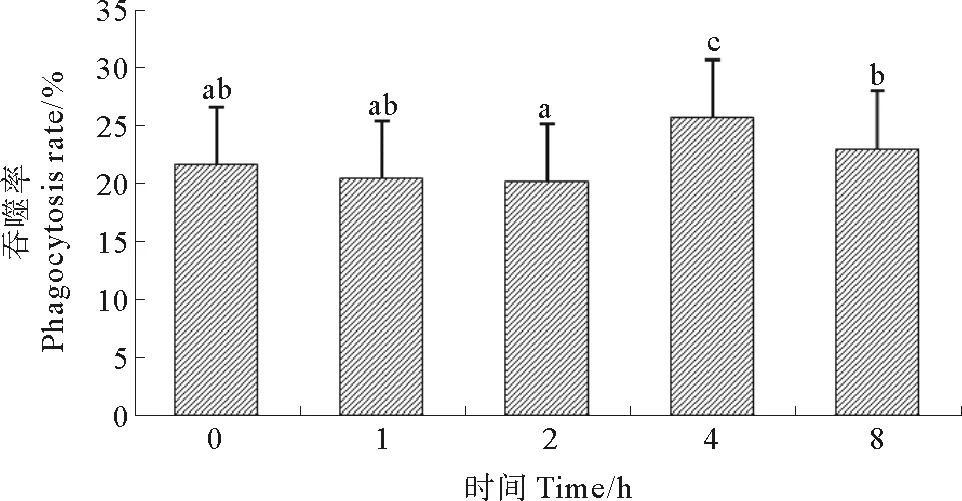
2.2 热刺激对血细胞吞噬活性的影响
栉孔扇贝血细胞的吞噬活性受高温胁迫的影响极显著(P<0.01)。实验开始时,细胞吞噬率约为21.7%,胁迫2 h内吞噬活性无显著变化,4 h吞噬活性明显增大(P<0.05),吞噬率达到25.8%,热刺激8 h后,降为23.1%,显著低于4 h时的吞噬率,并与初始吞噬率差异不显著(P>0.05)(见图2)。
2.3 热刺激对血淋巴细胞溶菌、抗菌活力的影响
栉孔扇贝血淋巴细胞的抗菌、溶菌活力测定结果见表2,随时间的变化规律如图3所示:血淋巴细胞在不同高温胁迫时间下,抗菌活力差异不显著(P>0.05),对照组(实验开始0 h)抗菌活力最大,热刺激6 h内,抗菌活力略有下降,8 h活力降到最小值,并显著低于对照组(P<0.05);溶菌活力随着热刺激时间的延长变化明显(P<0.05),对照组溶菌活力最大,热刺激后其活力平缓上升后缓慢下降,于实验开始4 h时与
对照组产生显著性差异,随后溶菌活力稍下降并达到最低值(见图3)。
(小写字母为Duncan分析结果,含有完全不同字母的表示差异显著(P< 0.05)。Bars showing different lowercase letters are significantly >different from each other by Duncan analysis (P<0.05).)
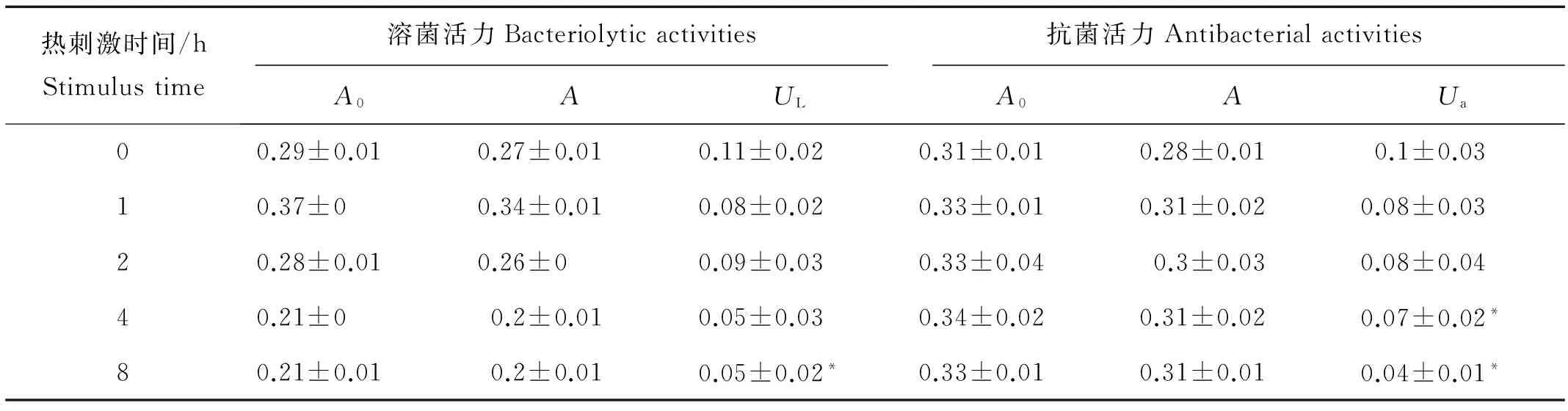
热刺激时间/hStimulustime溶菌活力Bacteriolyticactivities抗菌活力AntibacterialactivitiesA0AULA0AUa00.29±0.010.27±0.010.11±0.020.31±0.010.28±0.010.1±0.0310.37±00.34±0.010.08±0.020.33±0.010.31±0.020.08±0.0320.28±0.010.26±00.09±0.030.33±0.040.3±0.030.08±0.0440.21±00.2±0.010.05±0.030.34±0.020.31±0.020.07±0.02*80.21±0.010.2±0.010.05±0.02*0.33±0.010.31±0.010.04±0.01*
注:*表示与对照组(0 h)组间差异显著(P< 0.05)。
Note: * indicates groups significantly different from the controls (P< 0.05).
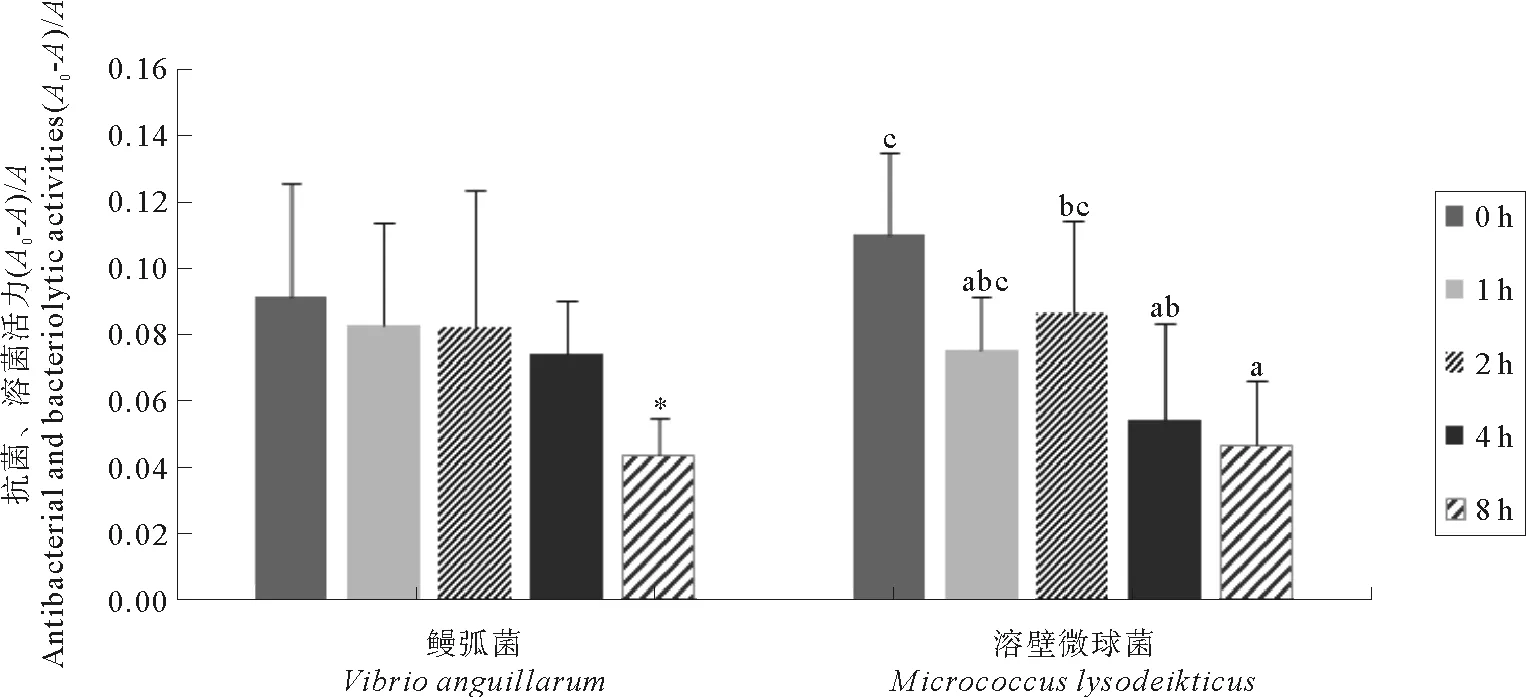
(左侧:血淋巴细胞对鳗弧菌的抗菌活力,右侧:血淋巴细胞对溶壁微球菌的溶菌活力;*表示抗菌活力在热刺激8 h后与对照组差异显著(P< 0.05);小写字母为Duncan分析结果,含有完全不同字母的表示差异显著(P< 0.05)。Left: the antibacterial activity of hemolymph onVibrio anguillarum;Right: the bacteriolytic activity of hemolymph on Micrococcus lysodeikticus. * indicates antibacterial activities significantly different from the controls after 8 h treatment (P< 0.05); Bars showing different lowercase letters are significantly different from each other by Duncan analysis (P< 0.05).)
2.4 热刺激对血细胞的DNA损伤
高温胁迫下栉孔扇贝细胞核彗星图像如图4所示。细胞未受高温胁迫时,较少细胞出现拖尾,细胞核影像基本呈规则的圆形,边缘光滑且亮度均匀;高温胁迫开始即出现明显的拖尾现象,细胞拖尾现象随时间推移逐渐明显:胁迫开始2 h内细胞拖尾尾长较短,4~8 h时,彗星头部逐渐变小,彗尾变长,呈扫帚状,且荧光强度增加。如表3显示,高温使血细胞DNA受到严重损伤,并随着胁迫时间的延长DNA损伤程度逐渐增大,高温刺激1 h就达到轻度损伤,实验结束时达到中度损伤。各时间组的尾长、尾部DNA含量、尾矩和Olive尾矩与对照组比较,差异显著(P<0.05),进一步分析表明,1和2 h之间4种参数差异均不显著,其它各时间组之间均具有显著差异。
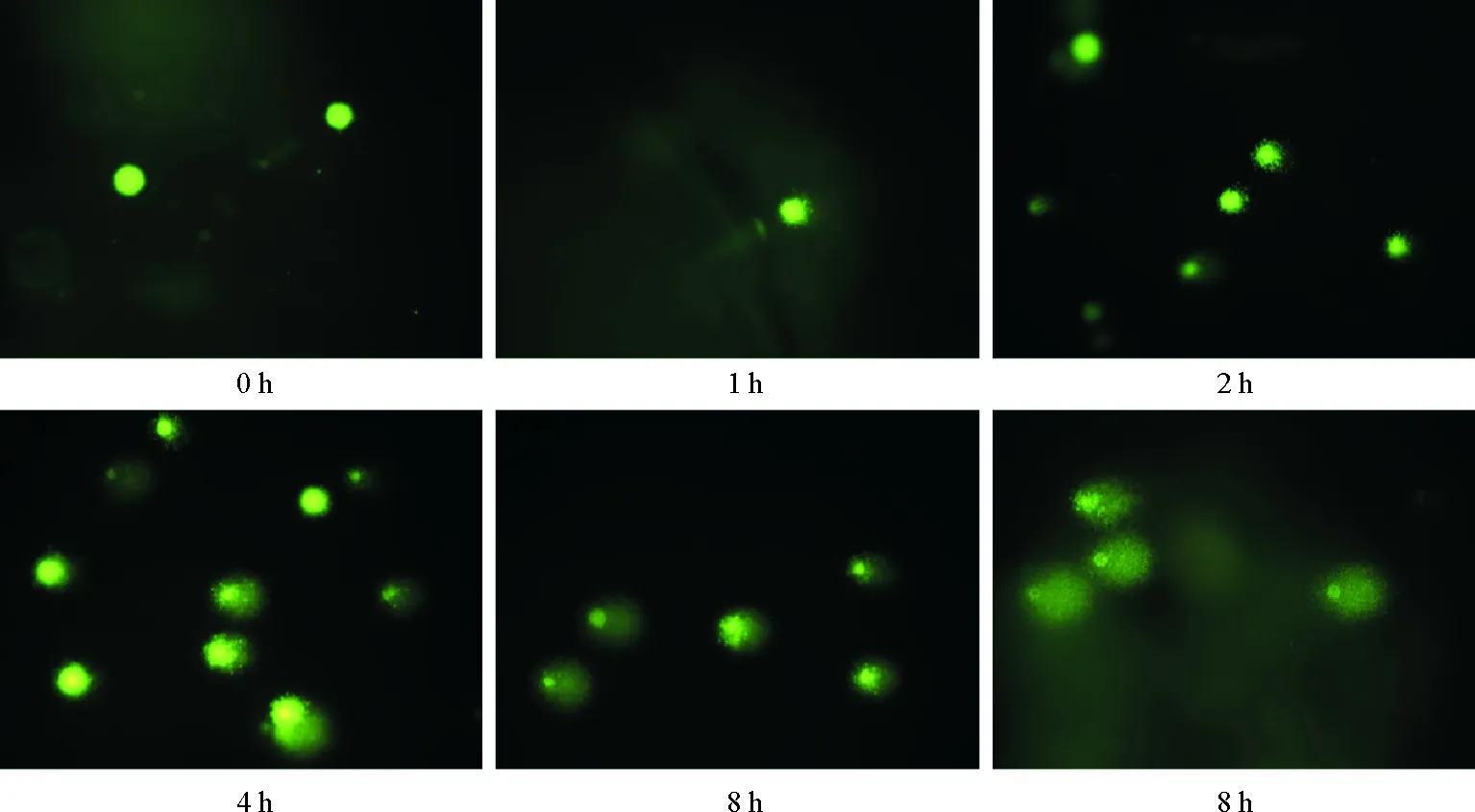
图4 高温刺激不同时间栉孔扇贝血细胞DNA损伤的彗星图像
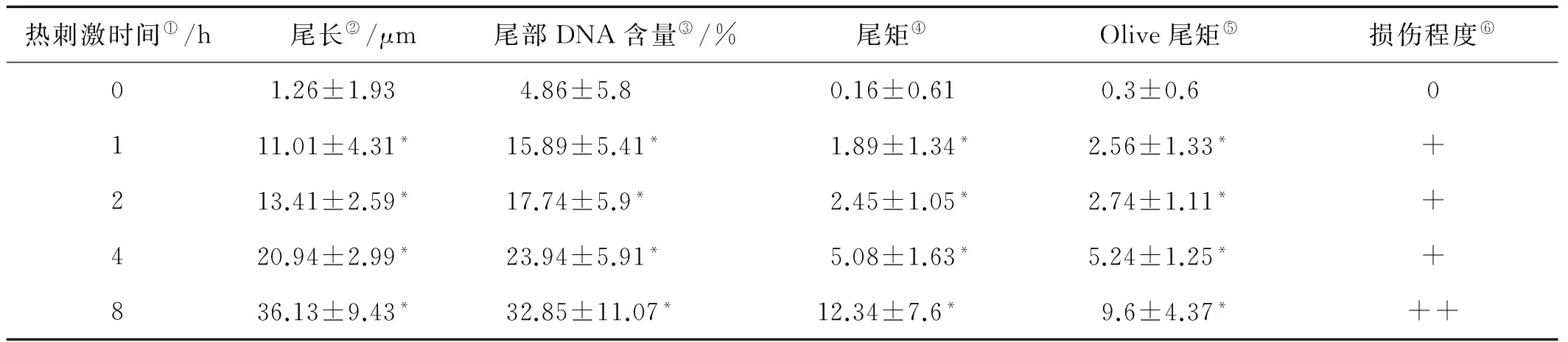
热刺激时间①/h尾长②/μm尾部DNA含量③/%尾矩④Olive尾矩⑤损伤程度⑥01.26±1.934.86±5.80.16±0.610.3±0.60111.01±4.31*15.89±5.41*1.89±1.34*2.56±1.33*+213.41±2.59*17.74±5.9*2.45±1.05*2.74±1.11*+420.94±2.99*23.94±5.91*5.08±1.63*5.24±1.25*+836.13±9.43*32.85±11.07*12.34±7.6*9.6±4.37*++
注:*表示与对照组(0 h)差异显著(P<0.05)。损伤程度划分:无损伤,<5 μm(0);轻度损伤,5~25 μm(+);中度损伤,25~45 μm(++);重度损伤,>45 μm(+++)。
Note: * indicates groups significantly different from the controls (P< 0.05). Damage degree: no DNA damage, < 5 μm(0); mild DNA damage, 5~25 μm(+); moderate DNA damage, 25~45 μm (++); severe DNA damage, > 45 μm (+++).
①Stimulus time;②Tail length;③Tail DNA;④Tail moment;⑤Olive tail moment;⑥Damage degree
2.5 热刺激对血细胞凋亡的影响
热刺激后,栉孔扇贝血细胞凋亡指数、早期凋亡率和晚期凋亡率随时间的延长逐渐增加,并具有统计学意义(P<0.05),且早期和晚期凋亡率的强度相似(P>0.05)(见图5)。分析结果显示,在未进行热刺激时,扇贝血细胞凋亡指数较低(0.5%),早期凋亡率和晚期凋亡率相等。热刺激1 h后,凋亡细胞数量增加,且早期凋亡率大于晚期凋亡率;热刺激2 h后,血细胞的凋亡指数,早期、晚期凋亡率与对照组产生显著差异(P<0.05);到8 h时,凋亡指数最高,达到3.72%,早期凋亡率仍略大于晚期凋亡率,分别为2.02%和1.72%。
2.6 热刺激下热休克蛋白HSP70和HSP90的差异表达
利用实时荧光定量PCR技术,检测栉孔扇贝受热刺激后血细胞中HSP70和HSP90基因mRNA相对表达量的变化。如图6所示,高温28℃刺激下,HSP70和HSP90基因mRNA表达影响受热处理时间极显著(P<0.01)。HSP70转录水平随热处理时间延长显著升高,热刺激4和8 h后,分别增至初始表达量的3.90和7.27倍;HSP90在各取样时间的转录水平差异显著(P<0.05),但增长较平缓,8 h后的表达量仅为初始表达量的2.32倍。扇贝血细胞中热休克蛋白HSP70和HSP90的初始转录水平相近,高温刺激后HSP70转录水平的升高速度大于HSP90,且在8 h时产生显著性差异(P<0.05)。
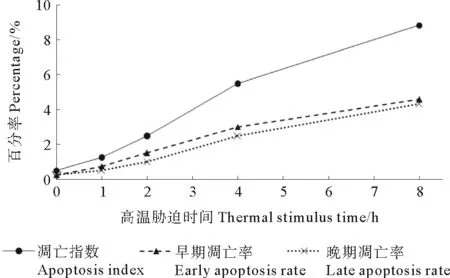
图5 高温刺激后栉孔扇贝血细胞的细胞凋亡率
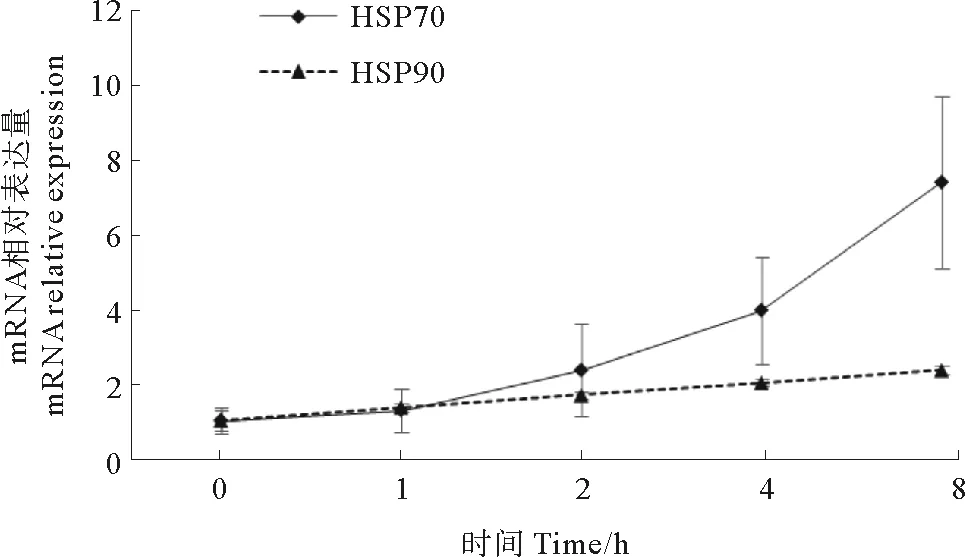
图6 热刺激下HSP70和HSP90的相对表达量
3 讨论
3.1 热应激对栉孔扇贝血细胞活性氧含量和吞噬活性的影响
本研究结果显示,在28℃高温胁迫8 h内,扇贝血细胞的吞噬活性先下降后升高,在4 h时达到峰值,随后迅速降低,活性氧含量8h后显著低于初始水平。分析结果得到,急性高温刺激使血细胞活性氧产物升高[16],但一段时间后可能由于持续高温胁迫使细胞内活性氧累积增多,损害机体细胞,导致血细胞的死亡率增加,进而造成吞噬活力下降,ROS生产力降低。本研究中细胞凋亡实验结果可对此解释提供理论支持:血细胞凋亡率在热刺激2 h后显著增加,8 h达到最大。大量研究表明,高温会使细胞分裂及增殖受到抑制,血细胞数量减少[35],且颗粒血细胞的数量和比例更易受温度影响而降低[71],而颗粒细胞在贝类血细胞中起吞噬作用,这可能是本研究中栉孔扇贝受到高温胁迫8 h时血细胞吞噬活力显著降低的主要原因。同时,细胞吞噬活性与贝类血细胞的表面特征有关,而持续高温对细胞表面的受体数量产生影响,也可能是吞噬活性降低的原因之一[16, 19-20, 72]。
3.2 热刺激对栉孔扇贝血细胞抗菌、溶菌活力的影响
贝类的体液免疫主要通过细胞分泌到细胞和体液中的各种酶类和肽段来完成,起到异物识别、清除及维持自身内环境稳定的作用。各体液免疫因子的综合作用可以通过血清的抗菌活力和溶菌活力体现[73]。本研究选用鳗弧菌和溶壁微球菌作为底物,测定了高温刺激对栉孔扇贝抗菌、溶菌活力的影响。实验结果显示,栉孔扇贝的血淋巴的抗菌、溶菌活力在28 ℃热刺激下受到抑制,存在时间—效应关系,并在实验结束时显著低于初始活力,但热刺激刚开始时,抗菌、溶菌活力出现了短暂增强。相关研究也得到了类似的结论,Ottaviani等[74]用细菌注射刺激蜗牛Planorbariuscorneus后,发现在注射后2 h内细菌清除率最高;Dang等[75]的研究表明,短期水温升高会使欧洲鲍(Haliotisrubra)的抗菌活力和抗病毒活力上升,但长时间高温胁迫会导致欧洲鲍抗菌活力和抗病毒活力受到抑制;李晓英等[76]发现短期温度骤升能提升青蛤(Cyclinasinensis)超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活力,但长期高温刺激会抑制两种酶活性;时少坤[77]对鲍的研究中发现,鲍血淋巴碱性磷酸酶(AKP)、溶菌酶(LZM)活力受高温刺激(水温30℃)48 h后均显著低于对照组。以上研究表明,高温胁迫会严重降低机体免疫酶活力,进而导致机体免疫力降低。
溶菌酶能够破坏溶解细菌细胞壁中的肽聚糖,具有较强的溶菌能力[78]。其特点之一是底物特异性强,不同来源的溶菌酶作用的底物不同[79],本实验结果显示,当以鳗弧菌为底物时,扇贝血淋巴抗菌活性变化不明显;而当底物为溶壁微球菌时,其溶菌活力受高温影响更加显著。可能是由于实验使用的鳗弧菌为菌悬液,而溶壁微球菌为冻干粉,后者更容易被溶菌酶降解;或者可能是鳗弧菌和溶壁微球菌细胞壁中的肽聚糖含量不同,造成溶菌酶的降解能力存在差异。
3.3 热刺激造成栉孔扇贝血细胞DNA损伤和细胞凋亡
动物体内DNA在受到来自体内外各种因素的刺激时,例如:外源性的高温高压、紫外线、射线、重金属、强氧化剂、强酸和强碱等物理化学因素和内源性ROS、酸碱不平衡及DNA在复制和传递过程中出现的错误等,会发生DNA双链结构破坏、DNA链断裂、碱基或碱基对被切除或替换等DNA损伤[24]。DNA损伤还会进一步诱导细胞凋亡。细胞凋亡又称细胞程序性死亡,存在于多细胞生物的整个生命过程当中,可及时清除机体内多余和受损伤的细胞,是机体内细胞死亡的重要途径,也是维持机体正常发育和自稳态平衡的一种重要机制。
彗星实验(Comet assay),又称单细胞凝胶电泳技术(Single cell gel electrophoresis,SCGE),是一种简便、快速和灵敏的检测DNA损伤的新方法[80],目前已广泛应用于生物监测、临床病理和遗传毒理学等领域[81-82]。在电泳过程中,损伤的DNA断链及片段分子量小,会离开核DNA向阳极移动,形成彗星状的图像,而未损伤的DNA部分保持球形。大多研究认为以OTM(Olive尾矩)为指标的结果最为可靠因为它可以反映尾部的面积、尾部的DNA含量以及尾部的DNA所占总DNA的百分比[83]。
本研究结果表明,随着热刺激时间延长,栉孔扇贝血细胞细胞彗星尾长增加、尾部荧光强度增强,这是说明热刺激导致血细胞产生数量较多的小DNA断片,受损较为严重。进一步采用尾长、尾部DNA含量、尾矩,Olive尾矩等作为分析指标,结果发现,高温刺激(28℃)可导致栉孔扇贝血细胞DNA受到明显的损伤,并与高温胁迫存在时间-效应关系。研究表明,外源性高温和内源性ROS都是导致动物细胞DNA损伤的因素[24],但本实验中,DNA损伤在活性氧含量显著变化前就已发生,且损伤程度持续升高,推测外源性高温诱导扇贝血细胞DNA损伤作用大于内源性影响因素ROS。细胞凋亡随时间延长而显著增加,与DNA损伤的变化规律相似,这可能是细胞凋亡过程中细胞染色体上DNA发生特异性降解所致[25]。
3.4 热休克蛋白HSP70、HSP90对高温刺激的响应
在动物体内,利用基因调节温度适应性的机制普遍存在。热休克蛋白(heat shock proteins,HSPs),又称为应激蛋白,是机体在应激状态下细胞迅速合成的一类蛋白质。当细胞或机体处于正常状态时,HSPs主要维持细胞正常的生理机能[84]。当细胞或机体处于应激状态时,HSPs大量诱导表达,增加细胞抵抗不良环境的能力[85],参与维持细胞内环境的相对稳定[86]。
按照分子量大小,Morimote等[87]将热休克蛋白分成4个家族:HSP90家族(分子量约83~110 kDa),HSP70家族(分子量约66~78 kDa),HSP60家族及小分子量smHSP(分子量约12~43 kDa)家族。其中,HSP90是真核生物体内最丰富的细胞质蛋白之一,参与机体免疫调节和信号传导以及细胞周期调控等[88];HSP70是目前研究比较深入的一种蛋白质,应激状态下参与降解错误折叠和变性的蛋白质以及其调节过程[89],同时还有抗细胞凋亡、抗氧化以及提高细胞耐受力,促进细胞增殖等基本的功能,且在热休克蛋白家族中,HSP70对环境的扰动最为敏感[90]。这在本实验中也得到体现:在受到热刺激后,HSP70的转录水平和增长速度显著大于HSP90,表明HSP70的诱导受温度影响更明显。目前,普遍认为HSP70的细胞保护功能构成了细胞应激耐受的基础[91-92]。研究表明,热胁迫可以诱导动物体内HSPs基因的大量表达[93-95],这在本实验中得到印证。结果显示,栉孔扇贝在受到高温刺激后,HSP70和HSP90的转录水平随时间均显著提高,表明扇贝会通过诱导增加HSP70和HSP90基因mRNA的表达应对高温胁迫,还有研究发现应激状态下HSP70 mRNA主要通过增强其自身的稳定性以及优先翻译来保证机体需要[96]。Fehrenbach等[97]发现高温环境中HSPs的表达可以降低DNA损伤,但在本实验中,DNA损伤一直处于增长状态,HSP70、HSP90 mRNA表达量随时间显著增加,说明DNA损伤可能是诱导细胞过表达HSPs的原因之一。目前,关于HSPs与细胞凋亡的研究较多,但它们之间的具体关系不是十分清楚。大量研究表明HSPs可以抑制细胞凋亡,HSP70[98]、HSP90[88, 99]可以在凋亡体形成的不同阶段发挥阻断作用,但Ishiyama等[100]研究发现如果细胞凋亡已启动,再用应激因子诱导细胞表达HSPs,HSPs不但不能抵抗细胞凋亡,甚至还可以促进细胞凋亡。
另外,HSP70家族成员众多,有学者在牡蛎中发现HSP70基因发生了明显扩张,数目高达88个[101]。由于扇贝基因组信息尚未公布,本研究仅对栉孔扇贝其中一个HSP70基因进行了研究,有关栉孔扇贝HSP70基因家族其它成员对热刺激的表达响应机制有待进一步研究。
4 结语
本研究表明,在受到热刺激后,扇贝会通过非特异性免疫系统应对胁迫,且体液免疫比细胞免疫反应迅速。28℃热刺激下,外源性高温诱导扇贝血细胞DNA损伤作用大于内源性影响因素ROS,并可直接诱导细胞凋亡,血细胞凋亡可能是导致细胞吞噬活性下降的重要原因,进而降低血淋巴细胞的免疫、抗菌能力,使扇贝的免疫功能受到严重的抑制,为病原体的入侵和繁殖提供可乘之机;同时热刺激后,热休克蛋白HSP70和HSP90转录水平显著提高且反应迅速,HSP70的转录受温度影响更明显,表明诱导热休克蛋白,特别是HSP70的过量表达,是机体应对热刺激的重要机制。综合分析表明,夏季水温若达到28℃高温,短时间内即可造成栉孔扇贝细胞损伤,抗菌能力显著下降,极易受到病原菌侵害,增大扇贝大规模死亡的可能性。本研究初步探究了热刺激后扇贝防御系统的启动,综合分析了扇贝对热刺激的抗逆机制,为探究夏季易发扇贝大规模死亡原因提供了理论依据。
[1] 张福绥, 杨红生. 山东沿岸夏季栉孔扇贝大规模死亡原因分析[J]. 海洋科学, 1999(1): 44-47. Zhang F S, Yang H S. Analysis of mass mortality of farmingChlamysFarreriin summer in coastal areas of Shandong, China[J]. Marine Sciences, 1999(1): 44-47.
[2] 商志强, 张益额, 孙召波. 栉孔扇贝死亡原因分析及防治措施[J]. 中国水产, 1998(12): 36-37. Shang Z Q, Zhang Y E, Sun Z B. Discussion on the cause of death and its preventionof scallopChlamysfarreri[J]. China Fisheries, 1998(12): 36-37.
[3] Chu F E. Defense mechanisms of marine bivalves[J]. Recent Advances in Marine Biotechnology, 2000, 5: 1-42.
[4] Xiao J, Ford S E, Yang H, et al. Studies on mass summer mortality of cultured zhikong scallops (ChlamysfarreriJones et Preston) in China[J]. Aquaculture, 2005, 250(3-4): 602-615.
[5] Harvell C D, Kim K, Burkholder J M, et al. Emerging marine diseases--climate links and anthropogenic factors[J]. Science, 1999, 285(5433): 1505-1510.
[6] 许友卿, 吴卫君, 蒋伟明, 等. 温度对贝类免疫系统的影响及其机理研究进展[J]. 水产科学, 2012(3): 176-180. Xu Y Q, Wu W J, Jiang W M, et al. Effect of temperature on immune system and the mechanism in shellfish[J]. Fisheries Science, 2012(3): 176-180.
[7] Song L, Wang L, Qiu L, et al. Bivalve immunity[C]//Soderhall K. Advances in Experimental Medicine and Biology. US: Spinger, 2010: 44-65.
[8] Lopez C, Carballal M J, Azevedo C, et al. Differential phagocytic ability of the circulating haemocyte types of the carpet shell clamRuditapesdecussatus(Mollusca: Bivalvia)[J]. Diseases of Aquatic Organisms, 1997, 30(3): 209-215.
[9] Mortensen S, Glette J. Phagocytic activity of scallop (Pectenmaximus) haemocytes maintained in vitro[J]. Fish & Shellfish Immunology, 1996, 6(2): 111-121.
[10] Tripp M R. Phagocytosis by hemocytes of the hard clam,Mercenariamercenaria[J]. Journal of Invertebrate Pathology, 1992, 59(3): 222-227.
[11] Mourton C, Boulo V, Chagot D, et al. Interactions betweenBonamiaostreae(Protozoa: Ascetospora) and hemocytes ofOstreaedulisandCrassostreagigas(Mollusca: Bivalvia): in vitro system establishment[J]. Journal of Invertebrate Pathology, 1992, 59(3): 235-240.
[12] 刘世良, 麦康森. 贝类免疫系统和机理的研究进展[J]. 海洋学报(中文版), 2003(2): 95-105. Liu S L, Mai K S. The progress of studies on molluscs immunological system and mechanism-a review[J]. Acta Oceanologica Sinica, 2003(2): 95-105.
[13] Hégaret H, Wikfors G H, Soudant P. Flow cytometric analysis of haemocytes from eastern oysters,Crassostreavirginica, subjected to a sudden temperature elevation[J]. Journal of Experimental Marine Biology and Ecology, 2003, 293(2): 249-265.
[14] 张朝霞, 王军, 丁少雄, 等. 贝类免疫学研究新进展[J]. 厦门大学学报(自然科学版), 2006(S2): 90-96. Zhang C X, Wang J, Ding S X, et al. Recent progresses of shellfish’s immunology[J]. Journal of Xiamen University(Natural Science), 2006(S2): 90-96.
[15] 张峰, 李光友. 贝类血细胞活性氧体内防御作用的研究进展[J]. 海洋科学, 1999(2): 16-19. Zhang F, Li G Y. Progress on researches of reactive oxygen intermediates of molluscs hemocytes in internal defense[J]. Marine Science, 1999(2): 16-19.
[16] Cheng W, Hsiao I, Hsu C, et al. Change in water temperature on the immune response of Taiwan abaloneHaliotisdiversicolorsupertexta and its susceptibility to Vibrio parahaemolyticus[J]. Fish & Shellfish Immunology, 2004, 17(3): 235-243.
[17] Gagnaire B, Frouin H, Moreau K, et al. Effects of temperature and salinity on haemocyte activities of the Pacific oyster,Crassostreagigas(Thunberg)[J]. Fish & Shellfish Immunology, 2006, 20(4): 536-547.
[18] Monari M, Matozzo V, Foschi J, et al. Effects of high temperatures on functional responses of haemocytes in the clamChameleagallina[J]. Fish & Shellfish Immunology, 2007, 22(1-2): 98-114.
[19] Fisher W S, Auffret M, Balouet G. Response of European flat oyster (Ostreaedulis) hemocytes to acute salinity and temperature changes[J]. Aquaculture, 1987, 67(1): 179-190.
[20] Liu S, Jiang X, Hu X, et al. Effects of temperature on non-specific immune parameters in two scallop species:Argopectenirradians(Lamarck 1819) andChlamysfarreri(Jones & Preston 1904)[J]. Aquaculture Research, 2004, 35(7): 678-682.
[21] 洪一江, 余颖, 郭红军, 等. 池蝶蚌(Hyriopsisschlegeli)血淋巴的抗菌力、溶菌酶和酚氧化酶活力[J]. 南昌大学学报(理科版), 2008(1): 66-69. Hong Y J, Yu Y, Guo H J, et al. The Activities of the Antibacterial, bacteriolysis and phenoloxidase in the haemolymph ofHyriopsisschlegeli[J]. Journal of Nanchang University (Natural Science), 2008(1): 66-69.
[22] 王雷, 李光友, 毛远兴. 中国对虾血淋巴中的抗菌、溶菌活力与酚氧化酶活力的测定及其特性研究[J]. 海洋与湖沼, 1995(2): 179-185. Wang L, Li G Y, Mao Y X. Studies on the activities and characteristics of the antibacteria, bacteriolysis and phenoloxidase in the haemolymph ofPenaeuschinensis[J]. Oceanologia Et Limnologia Sinica, 1995(2): 179-185.
[23] Yu J H, Song J H, Choi M C, et al. Effects of water temperature change on immune function in surf clams,Mactraveneriformis(Bivalvia: Mactridae)[J]. Journal of Invertebrate Pathology, 2009, 102(1): 30-35.
[24] 冉茂良, 高环, 尹杰, 等. 氧化应激与DNA损伤[J]. 动物营养学报, 2013, 25(10): 2238-2245. Ran M L, Gao H, Yin J, et al. Oxidative stress and DNA injury[J]. Acta Zoonutrimenta Sinica, 2013, 25(10): 2238-2245.
[25] 苗国英. 栉孔扇贝(Chlamysfarreri)凋亡相关基因功能研究[D]. 青岛: 中国科学院研究生院(海洋研究所), 2014. Miao G Y. The study of apoptosis-related genes in Zhikong scallopChlamysfarreri[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2014.
[26] 李敏, 林俊. 细胞凋亡途径及其机制[J]. 国际妇产科学杂志, 2014(2): 103-107. Li M, Lin J. The apoptotic pathways and their mechanisms [J]. Journal of International Obstetrics and Gynecology, 2014(2): 103-107.
[27] Yang F, Xu B, Zhao S, et al. De novo sequencing and analysis of the termite mushroom (Termitomycesalbuminosus) transcriptome to discover putative genes involved in bioactive component biosynthesis[J]. Journal of Bioscience and Bioengineering, 2012, 114(2): 228-231.
[28] Craig E A, Schlesinger M J. The heat shock response [J]. CRC Critical Reviews in Biochemistry, 1985, 18(3): 239-280.
[29] Schr O Der H C, Batel R, Hassanein H, et al. Correlation between the level of the potential biomarker, heat-shock protein, and the occurrence of DNA damage in the dab, Limanda limanda: a field study in the North Sea and the English Channel[J]. Marine Environmental Research, 2000, 49(3): 201-215.
[30] 胡晓丽. 高温胁迫和鳗弧菌感染对栉孔扇贝基因表达影响的分析及相关基因的克隆与表达[D]. 青岛: 中国海洋大学, 2005. Hu X L. Effect of Heat Stress and vibrio anguillarum challenge on gene expression of scallop (Chlamysfarreri) and cloning and expression of related genes[D]. Qingdao: Ocean University of China, 2005.
[31] 杜美荣, 刘毅, 蒋增杰, 等. 底播虾夷扇贝数量性状的相关性和通径分析[J]. 水产科学, 2015(1): 8-13. Du M R, Liu Y, Jiang Z J, et al. Correlation and path analysis of quantitative traits in bottom-cultured yesso scallopPatinopectenyessoensis[J]. Fisheries Science, 2015(1): 8-13.
[32] 任加云, 李树峰. 多氯联苯(PCB_(1254))对栉孔扇贝消化盲囊和鳃丝EROD、GST酶活力的影响[J]. 中国水产科学, 2008(2): 342-346. Ren J Y, Li S F. Effects of polychlorinated biphenyls 1254 (PCB1254) on two enzyme activity of biotransformation in digestive gland and gills of scallopChlamysferrari[J]. Journal of Fishery Sciences of China, 2008(2): 342-346.
[33] 王俊, 姜祖辉, 唐启升. 栉孔扇贝耗氧率和排氨率的研究[J]. 应用生态学报, 2002, 13(9): 1157-1160. Wang J, Jiang Z H, Tang Q S, Oxygen consumption and ammonia-N excretion rates ofChlamysfarreri[J]. Chinese Journal of Applied Ecology, 2002, 13(9): 1157-1160.
[34] 徐英江, 田秀慧, 任传博, 等. 氨基脲在栉孔扇贝体内的生物富集与消除规律[J]. 水产学报, 2013(3): 443-449. Xu Y J, Tian X H, Ren C B, et al. Research on accumulation and elimination of semicarbazide inChlamysfarreri[J]. Journal of Fisheries of China, 2013(3): 443-449.
[35] 张冬冬, 邢婧, 战文斌. 温度骤变对栉孔扇贝全血细胞和颗粒血细胞数量的影响[J]. 中国海洋大学学报(自然科学版), 2014, 44(5): 40-45. Zhang D D Xing J, Zhan W B. Influence of temperature shock on the numerical variation of scallop hemocytes and granulocytes[J]. Periodical of Ocean University of China, 2014, 44(5): 40-45.
[36] 梁玉波, 张福绥. 温度、盐度对栉孔扇贝(Chlamysfarreri)胚胎和幼虫的影响[J]. 海洋与湖沼, 2008(4): 334-340. Liang Y B, Zhang F S. Effects of temperature/salinity on development of embryos and larve of scallopChlamysfarreri[J]. Oceanologia Et Limnologia Sinica, 2008(4): 334-340.
[37] 马元庆, 张秀珍, 孙玉增, 等. 栉孔扇贝对重金属的富集效应研究[J]. 水产学报, 2010(10): 1572-1578. Ma Y Q, Zhang X Z, Sun Y Z, et al. The research of heavy metal enrichment inChlamysfarreri[J]. Journal of Fisheries of China, 2010(10): 1572-1578.
[38] 王彩理, 王秀华, 王东升, 等. 扇贝的产业化及可持续发展概述[J]. 天津农业科学, 2016(2): 48-52. Wang C L, Wang X H Wang D S, et al. Sustainable development of scallop industrial integration[J]. Tianjin Agricultural Sciences, 2016(2): 48-52.
[39] 张明亮, 邹健, 方建光, 等. 海洋酸化对栉孔扇贝钙化、呼吸以及能量代谢的影响[J]. 渔业科学进展, 2011(4): 48-54. Zhang M L, Zou J, Fang J G, et al. Impacts of marine acidification on calcification, respiration and energy metabolism of Zhikong scallopChlamysfarreri[J]. Marine Fisheries Research, 2011(4): 48-54.
[40] 张明亮, 邹健, 毛玉泽, 等. 养殖栉孔扇贝对桑沟湾碳循环的贡献[J]. 渔业现代化, 2011(4): 13-16. Zhang M L, Zou J, Mao Y Z, et al. Contribution of culturing scallop to carbon cycle in Sanggou Bay [J]. Fishery Modernization, 2011(4): 13-16.
[41] 栗志民, 钱佳慧, 劳翠英, 等. 温度和盐度对华贵栉孔扇贝免疫相关酶的联合效应[J]. 海洋科学进展, 2015(2): 227-238. Li Z M, Qian J H, Lao C Y, et al. Synergistic effects of temperature and salinity on the activities of immune-related enzymes ofChlamysnobilis(Reeve)[J]. Advances in Marine Science, 2015(2): 227-238.
[42] 连姗姗, 李雪, 邢强, 等. 繁殖和高温对栉孔扇贝抗氧化能力的影响[J]. 中国海洋大学学报(自然科学版), 2015, 45(10): 18-24. Lian S S, Li X, Xing Q, et al. Effects of reproduction and heat stress on the antioxidant ability of zhikong scallop (Chlamysfarreri)[J]. Periodical of Ocean University of China, 2015, 45(10): 18-24.
[43] 牟海津, 江晓路. 免疫多糖对栉孔扇贝酸性磷酸酶、碱性磷酸酶和超氧化物歧化酶活性的影响[J]. 青岛海洋大学学报: 自然科学版, 1999, 29(3): 463-468. Mou H J, Jiang X L. Effects of immunopolysaccharide on activities of acid phosphatase akaline phosphatase and superoxide dismutase inChlamysfarreri[J]. Periodical of Ocean University of China, 1999, 29(3): 463-468.
[44] 钱佳慧, 栗志民, 申玉春, 等. 温度和盐度对华贵栉孔扇贝抗氧化酶活性的联合效应研究[J]. 南方水产科学, 2015(6): 49-57. Qian J H, Li Z M, Shen Y C, et al. Synergistic effect of temperature and salinity on antioxidant enzymes activities ofChlamysnobilis[J]. South China Fisheries Science, 2015(6): 49-57.
[45] 徐翊轩, 战文斌, 邢婧. 温度与脂多糖对栉孔扇贝血细胞吞噬活力的影响[J]. 中国海洋大学学报(自然科学版), 2015, 45(6): 31-38. Xu Y X, Zhan W B, Xing J. Effect of water temperature on phagocytic activitiy of the haemocytes of scallop (Chlamysfarreri) after stimulated by lipopolysaccharide[J]. Periodical of Ocean University of China, 2015, 45(6): 31-38.
[46] 张维翥, 吴信忠, 李登峰, 等. 栉孔扇贝血液细胞的免疫功能[J]. 动物学报, 2005, 51(4): 669-677. Zhang W Z, Wu X Z, Li D F, et al. Immunological functions of blood cells in the scallopChlamysfarreri[J]. Acta Zoologica Sinica, 2005, 51(4): 669-677.
[47] 李红蕾, 宋林生, 刘保忠, 等. 栉孔扇贝不同种群的遗传结构及其杂种优势[J]. 海洋与湖沼, 2002(2): 188-195. Li H L, Song L S, Liu B Z, et al. Studies on the genetic structure of different population ofChlamysfarreriand their hybrids' heterosis[J]. Oceanologia Et Limnologia Sinica, 2002(2): 188-195.
[48] 宋林生, 李俊强, 李红蕾, 等. 用 RAPD 技术对我国栉孔扇贝野生种群与养殖群体的遗传结构及其遗传分化的研究[J]. 高技术通讯, 2002, 12(7): 83-86. Song L S, Li J Q, Li H L, et al. The genetic structure and genetic differentiation of the natural population and the hatchery stock ofChlamysfarrerirevealed by RAPD analysis[J]. Chinese High Technology Letters, 2002, 12(7): 83-86.
[49] 程洁, 张玲玲, 黄晓婷, 等. 栉孔扇贝 Fosmid 文库的构建及基因组结构特征分析[J]. 中国海洋大学学报(自然科学版), 2008, 38(1): 78-88. Cheng J, Zhang L L, Huang X T, et al. Fosmid library construction and genomic structure analysis in zhikong scallop (Chlamysfarreri)[J]. Periodical of Ocean University of China, 2008, 38(1): 78-88.
[50] 刘亚军, 喻子牛, 姜艳艳, 等. 栉孔扇贝 16S rRNA 基因片段序列的多态性研究[J]. 海洋与湖沼, 2002, 33(5): 477-483. Liu Y J, Yu Z N, Jiang Y Y, et al. Sequence polymorphism of mitochondrial 16S rRNA gene fragment in scallopChlamysfarreri[J]. Oceanologia Et Limnologia Sinica, 2002, 33(5): 477-483.
[51] 苗国英, 亓海刚, 李莉, 等. 栉孔扇贝 BI-1 基因的克隆与表达分析[J]. 海洋与湖沼, 2014, 45(6): 1251-1257. Miao G Y, Qi H G, Li L, et al. Cloning and expression of Bax inhibitor-1 gene of zhikong scallopChlamysfarreri[J]. Oceanologia Et Limnologia Sinica, 2014, 45(6): 1251-1257.
[52] 潘鲁青, 刘娜, 王静. 栉孔扇贝在B[a]P胁迫下生物标志物筛选的研究[J]. 水生生物学报, 2012, 36(2): 299-306. Pan L Q, Liu N, Wang J. Study of biomarkers selection of the ScallopChlamysfarreriexposed to B[a]P[J]. Acta Hydrobiologica Sinica, 2012, 36(2): 299-306.
[53] 张秀英, 张晓军, 赵翠, 等. 栉孔扇贝BES-SSR的开发及遗传多样性分析[J]. 水产学报, 2012(6): 815-824. Zhang X Y, Zhang X J, Zhao C, et al. The development of BAC-end sequence-based microsatellite markers and analysis on population genetic diversity in Zhikong scallop (Chlamysfarreri)[J]. Journal of Fisheries of China, 2012(6): 815-824.
[54] Zhang H, Zhou Z, Yue F, et al. The modulation of catecholamines on immune response of scallopChlamysfarreriunder heat stress[J]. General and Comparative Endocrinology, 2014, 195: 116-124.
[55] Sun Z, Yang C, Wang L, et al. The protein expression profile in hepatopancreas of scallopChlamysfarreriunder heat stress and Vibrio anguillarum challenge[J]. Fish & Shellfish Immunology, 2014, 36(1): 252-260.
[56] Knight J A. Review: Free radicals, antioxidants, and the immune system[J]. Annals of Clinical and Laboratory Science, 2000, 30(2): 145-158.
[57] Haugland R P. Handbook of Fluorescent Probes and Research Products[M]. [s.1]: Molecular Probes, 2002.
[58] 石芳芳, 李成华, 宋林生, 等. 用流式细胞仪测定扇贝血细胞吞噬活性[J]. 生物技术通报, 2006(S1): 430-433. Shi F F, Li C H, Song L S, et al. Application of flow cytometry in the measurement of phagocytic activity in scallop haemocytes[J]. Biotechnology Bulletin, 2006(S1): 430-433.
[59] Delaporte M. Effect of a mono-specific algal diet on immune functions in two bivalve species -CrassostreagigasandRuditapesphilippinarum[J]. Journal of Experimental Biology, 2003, 206(17): 3053-3064.
[60] Singh N P, Mc Coy M T, Tice R R, et al. A Simple technique for quantitation of low levels of DNA damage in individual cells[J]. Experimental Cell Research, 1988, 175(1): 184-191.
[61] 徐谦, 杨进波, 蒋长征, 等. 热休克蛋白70的表达在苯并[a]芘致DNA损伤中的作用[J]. 中华劳动卫生职业病杂志, 2004(2): 20-23. Xu Q, Yang J B, Jiang C Z, et al. Role of heat shock protein 70 expression in DNA damage induced by benzo(a)pyrene[J]. Chinese Journal of Industrial Hygiene and Occupational Diseases, 2004(2): 20-23.
[62] Spector D L, Goldman R D, Leinwand L A. Cell: A Laboratory Manual. Culture and Biochemical Analysis of Cells, vol. 1[Z]. New York: Cold Spring Harbor Laboratory Press, 1998.
[63] Gong X, Pan L, Miao J, et al. Application of SSH and quantitative real time PCR to construction of gene expression profiles from scallopChlamysfarreriin response to exposure to tetrabromobisphenol A[J]. Environmental Toxicology and Pharmacology, 2012, 34(3): 911-918.
[64] Gao Q, Song L, Ni D, et al. cDNA cloning and mRNA expression of heat shock protein 90 gene in the haemocytes of Zhikong scallopChlamysfarreri[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2007, 147(4): 704-715.
[65] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods, 2001, 25(4): 402-408.
[66] 曹玉伟. 利用彗星实验研究硝基苯对烟草基因组DNA的损伤[D]. 哈尔滨: 哈尔滨师范大学, 2009. Cao Y W. Toxicological Effects of Nitrobenzene on Tobacco[D]. Harbin: Harbin Normal University, 2009.
[67] 冼健安, 苟妮娜, 陈晓丹, 等. 流式细胞术检测虾类血细胞活性氧含量方法的建立[J]. 海洋科学, 2012(2): 29-33. Xian J A, Gou N N, Chen X D, et al. Measurement of reactive oxygen species (ROS) production in shrimp haemocyte by flow cytometry[J]. Marine Sciences, 2012(2): 29-33.
[68] Le Moullac G, Haffner P. Environmental factors affecting immune responses in Crustacea[J]. Aquaculture, 2000, 191(1-3): 121-131.
[69] 马淇, 刘垒, 陈佺. 活性氧、线粒体通透性转换与细胞凋亡[J]. 生物物理学报, 2012(7): 523-536. Ma Q, Liu L, Chen Q. Reactive oxygen species, mitochondrial permeability transition and apoptosis[J]Acta Biophysica Sinica, 2012(7): 523-536.
[70] Fisher W S, Chintala M M, Moline M A. Annual variation of estuarine and oceanic oysterCrassostreavirginicaGmelin hemocyte capacity[J]. Journal of Experimental Marine Biology and Ecology, 1989, 127(2): 105-120.
[71] Malagoli D, Casarini L, Sacchi S, et al. Stress and immune response in the musselMytilusgalloprovincialis[J]. Fish & Shellfish Immunology, 2007, 23(1): 171-177.
[72] Monari C, Bistoni F, Vecchiarelli A. Glucuronoxylomannan exhibits potent immunosuppressive properties[J]. Fems Yeast Research, 2006, 6(4):537-542.
[73] 黄勇超, 刘志昕. 鲍非特异性免疫研究进展[J]. 水产科学, 2008, 27(1): 51-54. Huang Y C, Liu Z X. Progress on the Nonspecific immunity in abalone[J]. Fisheries Science, 2008, 27(1): 51-54.
[74] Ottaviani E, Aggazzotti G, Tricoli S. Kinetics of bacterial clearance and selected enzyme activities in serum and haemocytes of the freshwater snailPlanorbariuscorneus(L. )(Gastropoda, Pulmonata) during the primary and secondary response to Staphylococcus aureus[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1986, 85(1): 91-95.
[75] Dang V T, Speck P, Benkendorff K. Influence of elevated temperatures on the immune response of abalone,Haliotisrubra[J]. Fish & Shellfish Immunology, 2012, 32(5): 732-740.
[76] 李晓英, 董志国, 薛洋, 等. 温度骤升和窒息条件对青蛤酸性磷酸酶和溶菌酶的影响[J]. 水产科学, 2009(6): 321-324. Li X Y, Dong Z G, Xue Y, et al. The impact of sharp increase in water temperature and hypoxia on activities of acid phosphatase (ACP) and lysozyme (LSZ) in clamCyclinasinensis[J]. Fisheries Science, 2009(6): 321-324.
[77] 时少坤. 环境因子对贝类几种免疫因子影响的研究[D]. 上海: 上海海洋大学, 2013. Shi S K. Studies on the immune parameters of mollusc stimulated by environmental factors[D]. Shanghai: Shanghai Ocean University, 2013.
[78] 刘志鸿. 海洋双壳贝类的免疫特性及调节[D]. 青岛: 中国海洋大学, 2004. Liu Z H. Immune Characteristics and Regulation of Marine Bivalves[D]. Qingdao: Ocean University of China, 2004.
[79] 刘益丽, 邓霄禹, 江明锋. 溶菌酶抑菌活性及检测方法研究进展[J]. 中国畜牧兽医, 2013(8): 189-194. Liu Y L, Deng X Y, Jiang M F. Research progress on antibacterial activity and detection method of lysozyme[J]. China Animal Husbandry & Veterinary Medicine, 2013(8): 189-194.
[80] 林爱军, 张旭红, 朱永官. 镉对小麦叶片DNA伤害的彗星实验研究[J]. 环境科学学报, 2005(3): 329-333. Lin A J, Zhang X H, Zhu Y G. The comet assay detects Cd-induced DNA damages in wheat leaves[J]. Acta Scientiae Circumstantiae, 2005(3): 329-333.
[81] Valverde M, Rojas E. Environmental and occupational biomonitoring using the Comet assay[J]. Mutation Research/Reviews in Mutation Research, 2009, 681(1): 93-109.
[82] Konca K, Lankoff A, Banasik A, et al. A cross-platform public domain PC image-analysis program for the comet assay[J]. Mutation Research, 2003, 534(1-2): 15-20.
[83] 罗明志, 齐浩, 陈文芳, 等. 彗星实验检测紫外线诱导的K562细胞DNA损伤[J]. 癌变. 畸变. 突变, 2006(5): 400-403. Luo M Z, Qi H, Chen W F, et al. DNA damage induced by UV in K562 cells measured by comet assay[J]. Carcinogenesis, Teratogenesis, and Mutagenesis, 2006(5): 400-403.
[84] Georgopoulos C, Welch W J. Role of the major heat shock proteins as molecular chaperones[J]. Annual Review of Cell Biology, 1993, 9(1): 601-634.
[85] Yang X D, Feige U. Heat shock proteins in autoimmune disease. From causative antigen to specific therapy?[J]. Experientia, 1992, 48(7): 650-656.
[86] Robert J. Evolution of heat shock protein and immunity[J]. Developmental & Comparative Immunology, 2003, 27(6-7): 449-464.
[87] Morimoto R I. Cells in stress: Transcriptional activation of heat shock genes[J]. Science, New Series, 1993, 259(5100): 1409-1410.
[88] Pandey P, Saleh A, Nakazawa A, et al. Negative regulation of cytochrome c-mediated oligomerization of Apaf-1 and activation of procaspase-9 by heat shock protein 90[J]. The EMBO Journal, 2000, 19(16): 4310-4322.
[89] Mayer M P, Bukau B. Hsp70 chaperones: Cellular functions and molecular mechanism[J]. Cellular and Molecular Life Sciences, 2005, 62(6): 670-684.
[90] 陈慕雁. 栉孔扇贝Chlamysfarreri生态免疫机制的基础研究[D]. 青岛: 中国科学院研究生院(海洋研究所), 2007. Chen M Y. Mechanism of Ecological Immunity inChlamysfarreri[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2007.
[91] Morimoto R I, Tissieres A, Georgopoulos C. 1 progress and perspectives on the biology of heat shock proteins and molecular chaperones[J]. Cold Spring Harbor Monograph Archive, 1994, 26: 1-30.
[92] Lindquist S, Craig E A. The heat-shock proteins[J]. Annual Review of Genetics, 1988, 22(1): 631-677.
[93] 郝振林, 刘京哲, 唐雪娇, 等. 高温下 3 种壳色虾夷扇贝存活率, 代谢率, 免疫酶活力及 HSP70 表达的比较研究[J]. 海洋科学, 2015, 39(11): 108-115. Hao Z L, Liu J Z, Tang X J, et al. A comparative study of survival, metabolism, immune indi-cators and HSP70 expression in three kinds of shell colors Japanese scallopMizuhopectenyessoensisunder high tem-perature stress[J]. Marine Sciences, 2015, 39(11): 108-115.
[94] 曲凌云, 相建海, 孙修勤, 等. 温度刺激下栉孔扇贝不同组织热休克蛋白HSP70的表达研究[J]. 高技术通讯, 2005, 15(5): 96-100. Qu L Y, Xiang J H, Sun X Q, et al. Expression analysis of HSP70 in various tissues ofChlamysfarreriunder thermal stress[J]. Chinese High Technology Letters, 2005, 15(5): 96-100.
[95] Yang C, Wang L, Siva V S, et al. A novel cold-regulated cold shock domain containing protein from scallopChlamysfarreriwith nucleic acid-binding activity[J]. PLoS One, 2012, 7(2): 32012.
[96] 谢彦海. 褶纹冠蚌热休克蛋白基因克隆与表达及2种淡水蚌的血细胞分析[D]. 南昌: 南昌大学, 2011. Xie Y H. Cloning and expression analysis of heat shock proteins gene fromCristariaplicataand analysis hemocytes of two types of fresh water mussels[D]. Nanchang: Nanchang University, 2011.
[97] Fehrenbach E, Veith R, Schmid M, et al. Inverse response of leukocyte heat shock proteins and DNA damage to exercise and heat. [J]. Free Radical Research, 2003, 37(9): 975-982.
[98] Samali A, Cotter T G. Heat shock proteins increase resistance to apoptosis. [J]. Experimental Cell Research, 1996, 223(1): 163-170.
[99] Yahara I, Minami Y, Miyata Y. The 90kDa stress protein, Hsp90, is a novel molecular chaperone. [J]. Annals of the New York Academy of Sciences, 1998, 851(1): 54-60.
[100] Ishiyama T, Koike M, Akimoto Y, et al. Heat shock-enhanced T cell apoptosis with heat shock protein 70 on T cell surface in multicentric Castleman's disease[J]. Clinical and Experimental Immunology, 1996, 106(2): 351-356.
[101] Zhang G, Fang X, Guo X, et al. The oyster genome reveals stress adaptation and complexity of shell formation[J]. Nature, 2012, 490(7418): 49-54.
责任编辑 朱宝象
Effect of Thermal Stimulus on Immune Function and Heat Shock Protein Expression of ScallopChlamysfarreri
LIUTian-Yu1,WANGQing2, 3,CHENMu-Yan1
(1.TheKeyLaboratoryofMariculture(OceanUniversityofChina),MinistryEducation,Qingdao266003,China; 2.TheKeyLaboratoryofCoastalZoneEnvironmentProcessesandEcologicalRemediation,YantaiInstituteofCoastalZoneResearch,ChineseAcademyofSciences,Yantai264003,China; 3.MupingCoastalEnvironmentResearchStation,YantaiInstituteofCoastalZoneResearch,ChineseAcademyofSciences,Yantai264003,China)
The objective of this study was to evaluate the effect of thermal stimulus on the scallop,Chlamysfarreri, which was generally recognized as a temperature sensitive bivalve species. Immune response, DNA damage, apoptosis and transcription of heat shock protein (HSP70 and HSP90) genes in hemocytes were evaluated over a short period of thermal stimulus. The hemocyte of scallops was obtained on 0, 1, 2, 4, 8 h after being treated at 28 ℃. By using flow cytometry, reactive oxygen species (ROS) production and phagocytosis activity of hemocytes were estimated. The results demonstrated that both ROS and phagocytosis activity reached the highest level in 4 h and reduced markedly by 8 h. The stress also significantly decreased antibacterial and bacteriolytic activities. By contrast, the DNA damage (mainly DNA breakages) level in hemocytes as was detected by the alkaline comet assay increased following high-temperature exposure, and hemocyte apoptosis was observed under fluorescence microscope. Significant increases in the transcription of HSP70 and HSP90 genes were also detected in hemocytes, while the transcription of HSP70 grew faster than HSP90 did and reached to a higher level. This study demonstrated that immune response, DNA damage level and apoptosis of hemocytes in the scallop were strongly affected within several hours, and the transcripts of HSPs genes were strengthe-ned so as to protect the cells and tissues from injury whenC.farrerisubjected to short-term high temperature stressing.
thermal stimulus;Chlamysfarreri;hemocyte; immune response; apoptosis; DNA damage; HSP70; HSP90
山东省自然科学基金项目(ZR2012CQ016);中国科学院海洋生态与环境科学重点实验室开放基金项目(KLMEES201301);中国科学院青年创新促进会项目(2016196)资助 Supported by Natural Science Foundation of Shandong Province, China (ZR2012CQ016);Open Fund of Key Laboratory of Marine Ecology and Environmental Science,Institute of Oceanology, Chinese Academy of Sciences (KLMEES201301);Youth Innovation Promotion Association of CAS (2016196)
2016-10-26;
2017-01-19
刘甜雨(1992-),女,硕士生。E-mail:liutianyu_92@163.com
** 通讯作者:E-mail:qingwang@yic.ac.cn
S917.4
A
1672-5174(2017)08-031-13
10.16441/j.cnki.hdxb.20160366
刘甜雨, 王清, 陈慕雁. 热刺激对栉孔扇贝免疫功能和热休克蛋白表达的影响[J]. 中国海洋大学学报(自然科学版), 2017, 47(8): 31-43.
LIU Tian-Yu, WANG Qing, CHEN Mu-Yan. Effect of thermal stimulus on immune function and heat shock protein expression of scallopChlamysfarreri[J]. Periodical of Ocean University of China, 2017, 47(8): 31-43.
