△1-哌啶酸(P2C)及其衍生物的合成综述*
2017-06-19李国强刘小玲李平林罗祥超唐旭利
李国强, 刘小玲, 李平林, 罗祥超, 唐旭利
(中国海洋大学 1.医药学院,海洋药物教育部重点实验室,山东 青岛 266003; 2.化学化工学院,山东 青岛 266100)
综 述
△1-哌啶酸(P2C)及其衍生物的合成综述*
李国强1, 刘小玲1, 李平林1, 罗祥超2, 唐旭利2
(中国海洋大学 1.医药学院,海洋药物教育部重点实验室,山东 青岛 266003; 2.化学化工学院,山东 青岛 266100)
△1-哌啶酸(P2C)是一种特殊的六元环席夫碱,是合成L-哌啶酸必需的前体分子。P2C和L-哌啶酸是赖氨酸在生物体内重要的代谢产物,更是化学合成中重要的手性构建模块和多种生物活性分子的关键组成片段。特别是,P2C及其衍生物可通过与生物体内乙酰胆碱受体、FKBP12结合蛋白、NO合酶等多种底物相互作用而介导特定的生理过程,对生命活动的正常进行和一些疾病的防治具有重要意义。因此,P2C片段及其衍生物的合成具有重要研究意义。通常以L-赖氨酸为原料制备P2C,但是,赖氨酸难以氧化脱氨,以及P2C的固有不稳定性,一直是干扰P2C稳定获取的关键问题。目前,在赖氨酸氧化脱氨和酶催化合成P2C方面已经有了一些成功的尝试。本文首次对有关△1-哌啶酸及其衍生物的合成研究进行总结,以期为△1-哌啶酸这一特殊席夫碱的研究和应用提供参考。
△1-哌啶酸;衍生;合成
1 △1-哌啶酸(P2C)及其衍生物的结构特征及应用
1.1 △1-哌啶酸(P2C)的发现与结构特征
1952年法国里尔学院的Boulanger P等[1]报道了海龟肝脏中L-氨基酸脱氢酶催化L-赖氨酸(1)形成不饱和哌啶酸(2)及L-哌啶酸(3)的生物化学过程,并在此后十多年的时间里持续对该生物化学过程进行了深入探索,详尽研究了L-赖氨酸的酶催化反应,提出了L-赖氨酸作为该酶底物的特异性[2-4]。随后研究者相继在大鼠肝脏[3]和哺乳动物脑部[5-6]、绿色木霉菌等各种微生物[7]以及蛇毒液中发现了L-赖氨酸的酶催化转化途径。近四十年来,研究者在此基础上发现了L-赖氨酸转化产物,即不饱和哌啶酸和L-哌啶酸,在生物体内可介导抗肿瘤、抗菌等各种生理病理过程。目前研究已证实,L-赖氨酸主要经过两种途径被生物体代谢、吸收和利用,即L-哌啶酸途径和酵母氨酸途径[8-11](见图1)。L-哌啶酸的生物代谢前体即为不饱和哌啶酸,又称△1-哌啶酸(2,简称P2C)[12]。依据此生源途径,L-赖氨酸可作为合成P2C的首选原料,P2C在生物体内可进一步代谢为L-哌啶酸,是生物和化学制备L-哌啶酸的必需前体分子。
P2C是一种具有环内C=N的特征席夫碱,由于它同时具有环内C=N和2-位COOH,其异构体处于平衡体系,而亚胺可迅速水解为相应的酮和胺(7),进而发生一系列脱羧、水解等变化[13-15](见图2)。P2C的这种结构不稳定性给其分离、纯化和保存带来一定困难,从而限制了其合成和工业化生产。为解决这一问题,研究者对影响P2C稳定性的因素进行了深入研究。1971年美国克莱克森工业学院的Robert A. Clark和Donald C. Parker报道了溶剂极性对于亚胺/烯胺互变异构现象的影响。研究表明,极性溶剂有利于烯胺形式的存在,但对其结构的顺反异构无明显影响[16]。1986年日本北里大学的Yoshihisa Kurasawa和Atsushi Takada报道了乙烯胺/缩醛亚胺的互变异构现象,以及两种异构体之间的相对能量的计算研究。计算结果表明,亚胺比烯胺的能量低3.9 kcal·mol-1,而溶液介电常数的改变对这种互变过程影响很小[17]。1990年香港大学的Brian Capon 和 吴振平 报道了在一级和二级烯胺β-碳上引入合适的取代基,如取代的苯基等,形成C=N与苯环的p-π共轭,可以增强其稳定性[18]。1998年北卡罗来纳三角研究园的S.P.-LU和 Anita H. Lewin[19]研究了不同氘代溶剂以及溶液pH对四种α-氨基酸及P2C的亚胺/烯胺存在比例的影响。核磁共振氢谱表明,烯胺形式和亚胺形式的酯在氘代氯仿中各占50%;在氘代水中,亚胺形式的盐占75%,而烯胺形式盐占25%。紫外吸收研究进一步表明,碱性环境有利于维持亚胺/烯胺互变体系的稳定性。以上这些研究成果为P2C及其衍生物的合成研究提供了基础理论依据。
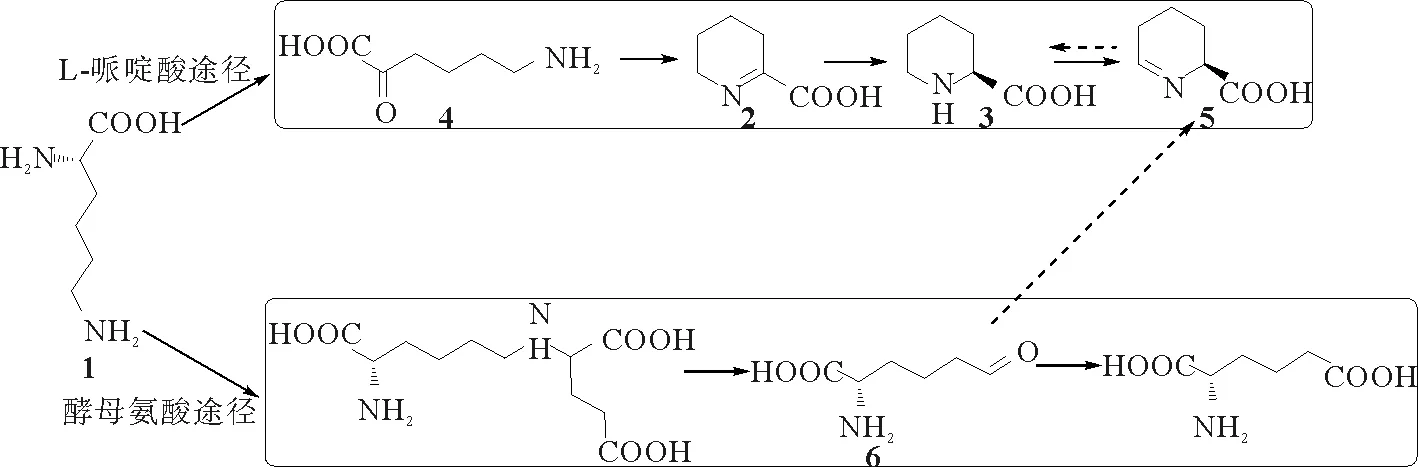
图1 赖氨酸的体内代谢过程
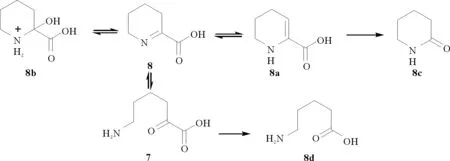
图2 P2C的互变异构现象
1.2 天然来源P2C衍生物及其药理活性
P2C和L-哌啶酸及其衍生物是构成多种生物活性分子的关键模块。例如,尼克霉素Z(9)[20]是由链霉菌产生的核苷二肽化合物,它的结构与几丁质合成酶的底物UDP-N-乙酰氨基葡萄糖相似,最大差别在于尼克霉素Z中含有P2C单元。尼克霉素Z可与几丁质合成酶竞争,从而抑制几丁质在真菌细胞中的生物合成,最终导致真菌细胞渗透性溶解。尼克霉素Z对真菌如粗球孢子菌和皮炎芽生菌有抗致病双相性,但其抗念珠菌的效力较低。与其它抗真菌药物如氟康唑、特比萘芬等联合应用,可大大增强抗真菌效能。2002年[21]和2004年[22]美国德雷克塞尔大学Marilyn Schuman Jorns课题组相继报道了尼克霉素Z的生物合成途径(见图3),即以L-赖氨酸为原料,在nikC(一种氨基转移酶)催化下转化成α-酮酸,再以氧气作为电子供体,经nikD(一种强氧化剂,能参与两个连续的电子传递或同时发生的两个电子的传递)催化P2C的氧化成picolinate,进而参与形成尼克霉素Z。
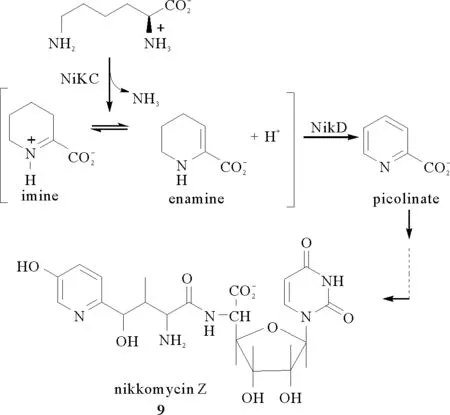
图3 以L-赖氨酸为原料经P2C合成尼克霉素的过程
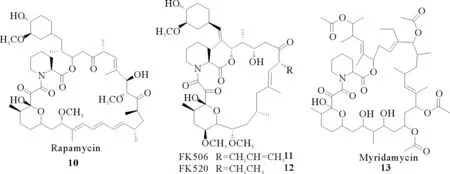
雷帕霉素(10)、FK506(11)和FK520(12)是从链霉菌代谢物中分离得到的含有哌啶酸结构片段的大环内酯类天然产物,最初被发现是作为抗真菌剂。后来研究发现它们在多巴胺神经元中通过哌啶酸乙酯片段与FKBP12结合,从而发挥免疫抑制作用。因此它们可作为强效免疫抑制剂应用于器官移植、皮肤病、心脏病等治疗研究领域。2006年美国伊利诺伊大学的Gatto J等[23]对这三个化合物进行了微生物体内产生过程研究:三者均是以L-赖氨酸为原料,经P2C途径形成L-哌啶酸,再通过NH形成酰胺键和2-羧基形成酯键而嵌入大环分子。从临床应用来看,雷帕霉素有很好的抗排斥作用,且与环孢霉素A和FK506等有良好的协同作用,是一种疗效好、低毒、无肾毒性的新型免疫抑制剂。2011年美国辉瑞制药研发部郝江等[24]报道了雷帕霉素的类似物—美力达霉素(13)的生物合成研究,美力达霉素由链霉菌代谢产生,目前作为神经保护剂用于临床。
1989年日本北里大学的Oshima Y等[25]报道了一类来自甲藻的鱼类毒素—polonicumtoxin A, B和C(14)的化学结构,即为2-位烃基取代的P2C衍生物。1995年日本研究者Sachiko Tsukamoto从海绵中分离到的化合物15和15a可作为海鞘幼体变态诱导剂[26],其结构为P2C β-位共轭化合物。2008年美国乔治亚州立大学的Ko-Chun Ko等[27]报道了海兔墨汁中强效抗菌活性成分,即为L-赖氨酸代谢形成的P2C及其一系列衍生物的混合体系。2011年澳大利亚墨尔本大学的Voula Mitsakos等[28]报道了一种新的G+菌细胞壁损坏机制,即L-赖氨酸(是细菌细胞壁的组成成分)在G+菌体内经二氢吡啶二羧酸合成酶代谢为细菌细胞壁的裂解产物-二氢吡啶二羧酸(16),该研究在抗菌机制方面具有一定的意义。
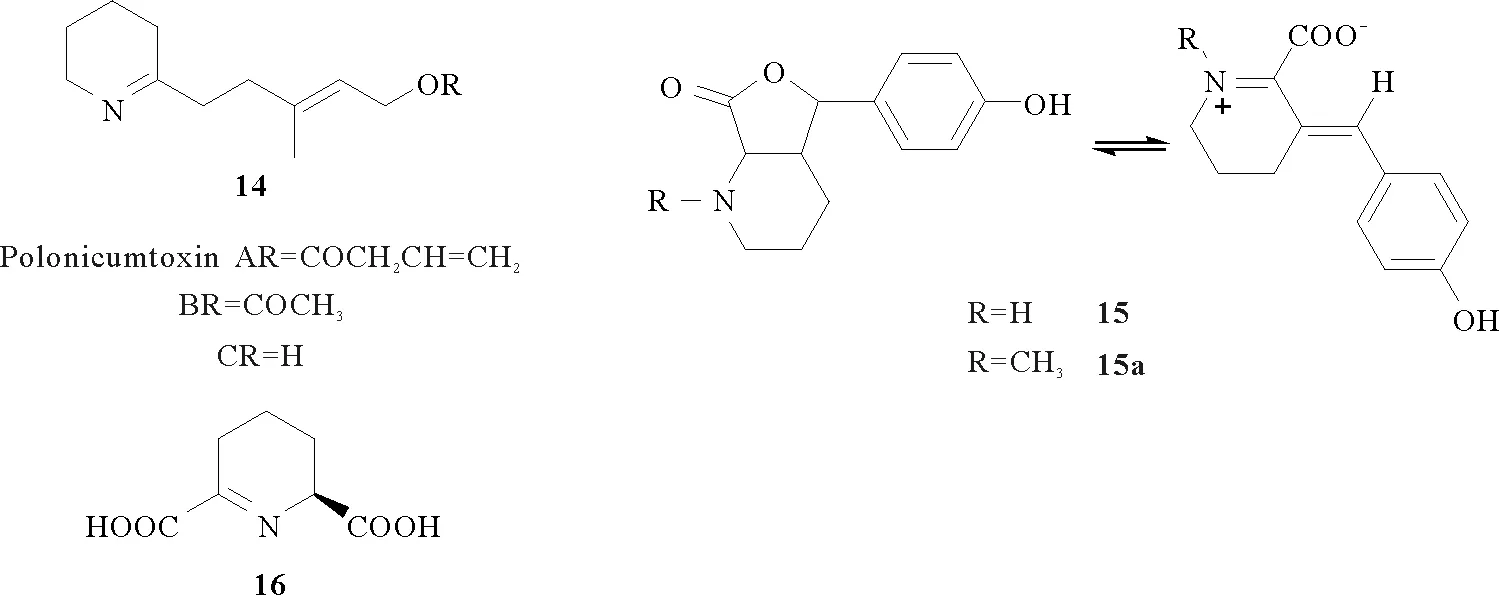
1.3 P2C及其衍生物在合成中的应用现状
1993年美国弗罗里达大学的John A. Zoltewicz等[29]报道了由芳醛(17)和假木贼碱(18,一种海洋昆虫体内毒素分子,P2C的一种脱羧衍生物)缩合而得的化合物19(见图4)。2002年日本岛根大学Y. Ozoe课题组相继报道了该类生物碱与昆虫烟碱乙酰胆碱受体的亲和作用[30]及其构效关系[31],有望成为昆虫烟碱乙酰胆碱受体的探针分子。2006年日本岛根大学的Izumi I等[32]报道了该类生物碱类似物(19a)与美洲大蠊虫体内神经节乙酰胆碱受体的结合作用及其构效关系,为该受体激动剂和拮抗剂的研发提供了新途径。同年,美国加利福尼亚大学的Todd T. Talley等[33]报道了此类生物碱与乙酰胆碱受体结合蛋白结合体的紫外吸收研究,发现该类生物碱与乙酰胆碱受体具有很高的结合率。2009年Izumi I等[34]报道了该类化合物与虫体内烟碱乙酰胆碱受体结合的构效关系,有望开发成为一种新型杀虫剂。而小鼠体内的相关研究结果表明,该类化合物有望成为阿尔兹海默症、帕金森等疾病的候选药物。近年又有研究者报道了此类生物碱与乙酰胆碱受体结合蛋白结合的在线分析研究[35-36],为该类生物碱的药理活性研究奠定了基础。
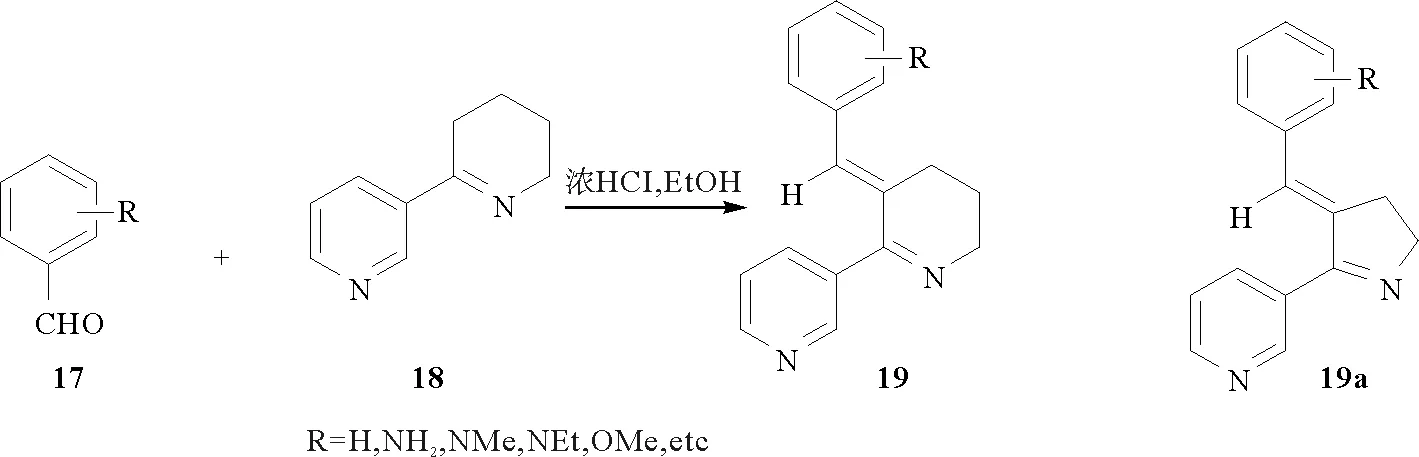
图4 化合物19的化学合成
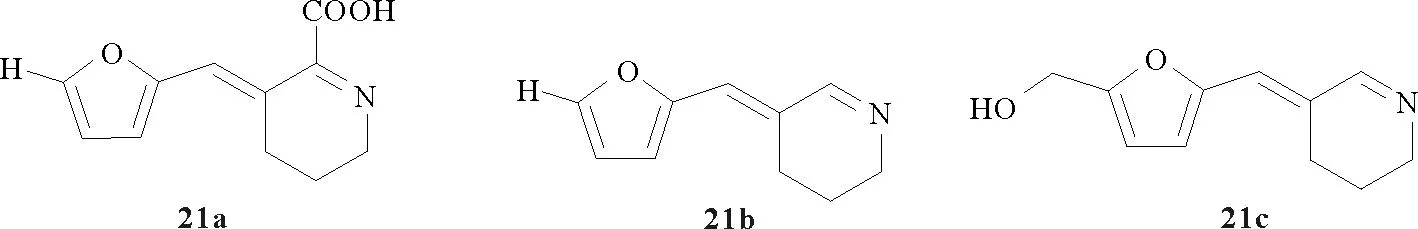
2007年日本研究者Masatsune Murata等[37]以L-赖氨酸和2-呋喃甲醛(20)为原料,通过一锅煮的方法,得到了系列新型P2C衍生物—furpipate(21和21a),反应如图5所示。2009年该课题组又发现了furpipate的黄色脱羧产物(21b和21c),该发现可用于工业食品分析和米拉德反应的调控[38]。2015年哥伦比亚大学David D课题组[39]报道了21c的化学合成方法,并发现它在结肠癌细胞Caco-2中表现出显著的剂量依赖性的NO抑制活性。这一活性研究表明fupipate类在预防肠道感染方面具有潜在的深入研究价值。

图5 furpipate的一锅煮合成法
2016年兰州大学的厍学功课题组[40]报道了一种新型抗丙肝病毒生物碱—α,β-myrifabral A/B(23a和23b)的简化全合成路线(见图6),即直接以脱羧哌啶酸(22)作为合成子,经曼尼希加成—酰胺化连续反应即得目标产物。
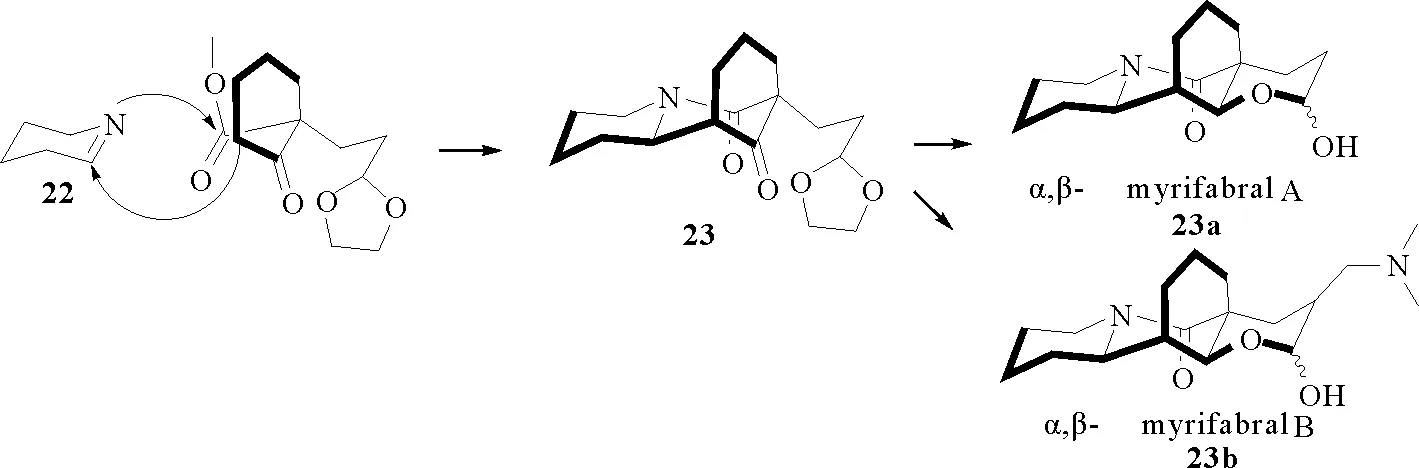
图6 α,β-myrifabral 的合成路线
2000年比利时根特大学的Tuyen Nguyen Van 和 Norbert De Kimpe[41]报道了一类来自甲藻的鱼类毒素polonicumtoxin(14)的合成路线,即以2-CH3取代的哌啶为合成子,经N-氯代,脱氯化氢,再与侧链连接而成(见图7),这一研究为淡水水体的保护提供了研究思路。
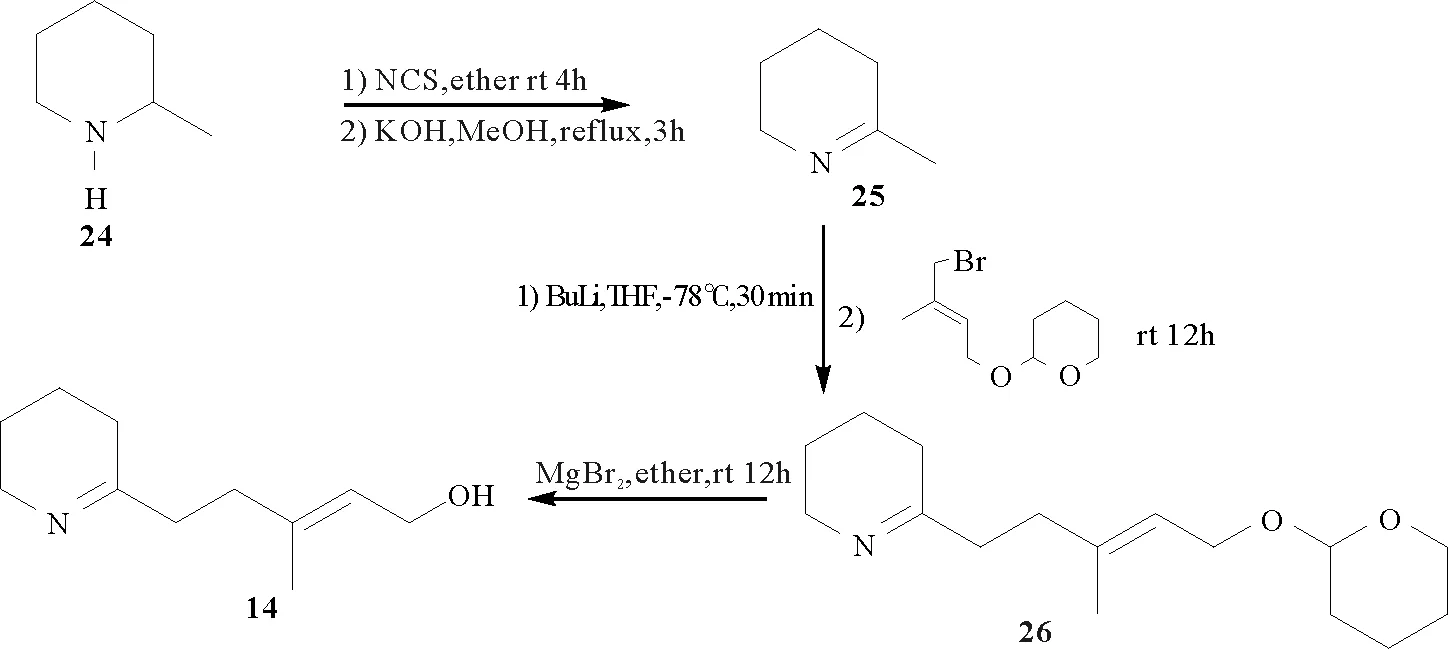
图7 polonicumtoxin的化学合成途径
此外,2011年墨尔本大学的Voula Mitsakos等[28]利用邻氨基苯甲醛(27)和二氢吡啶二羧酸(16)缩合合成的紫色载色体(28)(见图8),可应用于二氢吡啶二羧酸合成酶生化过程的分析检测。
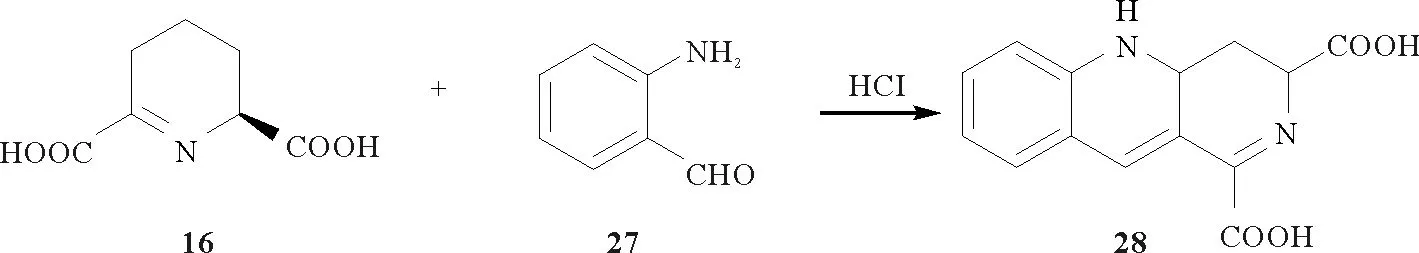
图8 P2C衍生物19a的化学合成
综上,P2C可以嵌入多种结构分子中,形成具有多种生物活性的席夫碱衍生物。因此,对于P2C结构片段的合成研究,有助于活性分子的全合成及构效关系研究。
2 △1-哌啶酸(P2C)及其衍生物的合成研究
2.1 酶催化合成途径研究
研究发现,利用微生物体内(如大肠杆菌、恶臭假单胞菌等)的酶经L-哌啶酸途径可直接将L-赖氨酸转换成P2C。根据酶的种类不同主要分为以下四种:
(1)来自蛇毒的L-赖氨酸氧化酶(LAO)[42-46]:LAO是普遍存在于蛇毒中的一种黄素酶,在黄素腺嘌呤二核苷酸(FAD)辅助下可催化L-氨基酸的氧化脱氨,产生α-酮酸、氨以及过氧化氢,α-酮酸可自发缩合形成P2C(见图9)。研究表明,蛇毒LAO是非共价键结合的二聚体糖蛋白,也是金属离子结合蛋白,金属离子有助于保持其结构完整性,但不影响其生物活性,同时,引入某些外源性金属离子可增加酶活性。来自蛇毒的LAO分子量均为57 kDa左右,其等电点约为4.9,具有热不稳定性。其活性强弱也与缓冲液离子强度和pH有关,一般在4 ℃中性条件下可长期保持酶活性,在-5~-60 ℃会使酶失活,最易失活温度为-20 ℃。这些基本特性可为酶反应条件提供参考。
(2)来自绿色木霉菌的L-赖氨酸氧化酶:L-赖氨酸是生物体的一种必需氨基酸,在生物体内经L-赖氨酸氧化酶代谢而参与多种生物途径[5],人们曾在蛇毒液、大鼠肾脏、鸟类肝脏以及各种无脊椎动物中发现L-赖氨酸氧化酶。1978年日本东京大学研究者Hitoshi Kusakabe等[47]从绿色木霉菌Y244-2麦糠培养液中首次发现并分离得到L-赖氨酸氧化酶,并发现该酶在鼠体内外均有抗肿瘤活性。1980年Kusakabe研究团队[48]又报道了这种酶的基本特性:该酶类似于蛇毒液中的赖氨酸氧化酶,为结合两单位FAD的同源二聚体,分子量约为116 000,单体分子量约为56 000,在277、388、466以及490 nm波长下均有吸收,对L-赖氨酸的催化具有高度专一性。此发现掀起了L-赖氨酸氧化酶研究的热潮,之后的近四十年里陆续有相关研究被报道[49-50],目前该酶被商品化生产并广泛应用于P2C和L-哌啶酸的体内外合成研究。
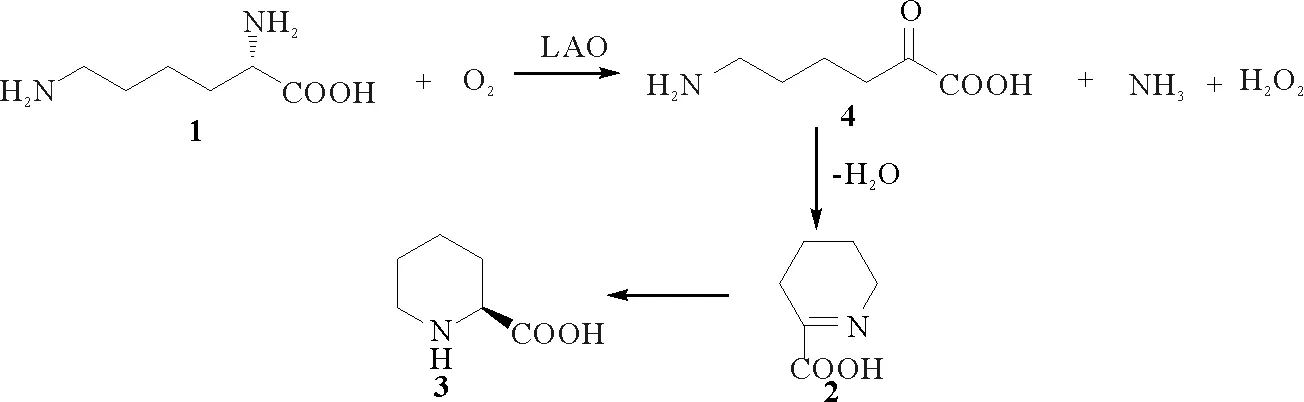
图9 L-赖氨酸经赖氨酸氧化酶催化形成P2C的机理
(3)escapin酶:2005年乔治亚州立大学的Charles D.课题组从海兔分泌的墨汁中分离得到一种新型L-赖氨酸氧化酶—escapin,这是一种分子量为60 kDa的单体蛋白,可长期稳定存在[51]。海兔可通过escapin催化体内L-赖氨酸代谢产生一系列化合物来消灭身边的一些有害微生物,并对捕食者的攻击进行防御。2008年该课题组的Ko-Chun KO等[27]报道了escapin参与的海兔抗菌机制;2009年同一课题组对escapin体外催化L-赖氨酸产生P2C及其衍生物的化学过程进行了系统性研究和报道[52](见图10);2010年该课题组继而发现了escapin参与海兔的抗捕食机制[53]。该课题组对escapin多年的系统性研究,为P2C及其衍生物的合成提供了一种新途径,更全面系统地阐述了escapin作为一种赖氨酸氧化酶催化赖氨酸分解代谢的动态过程。
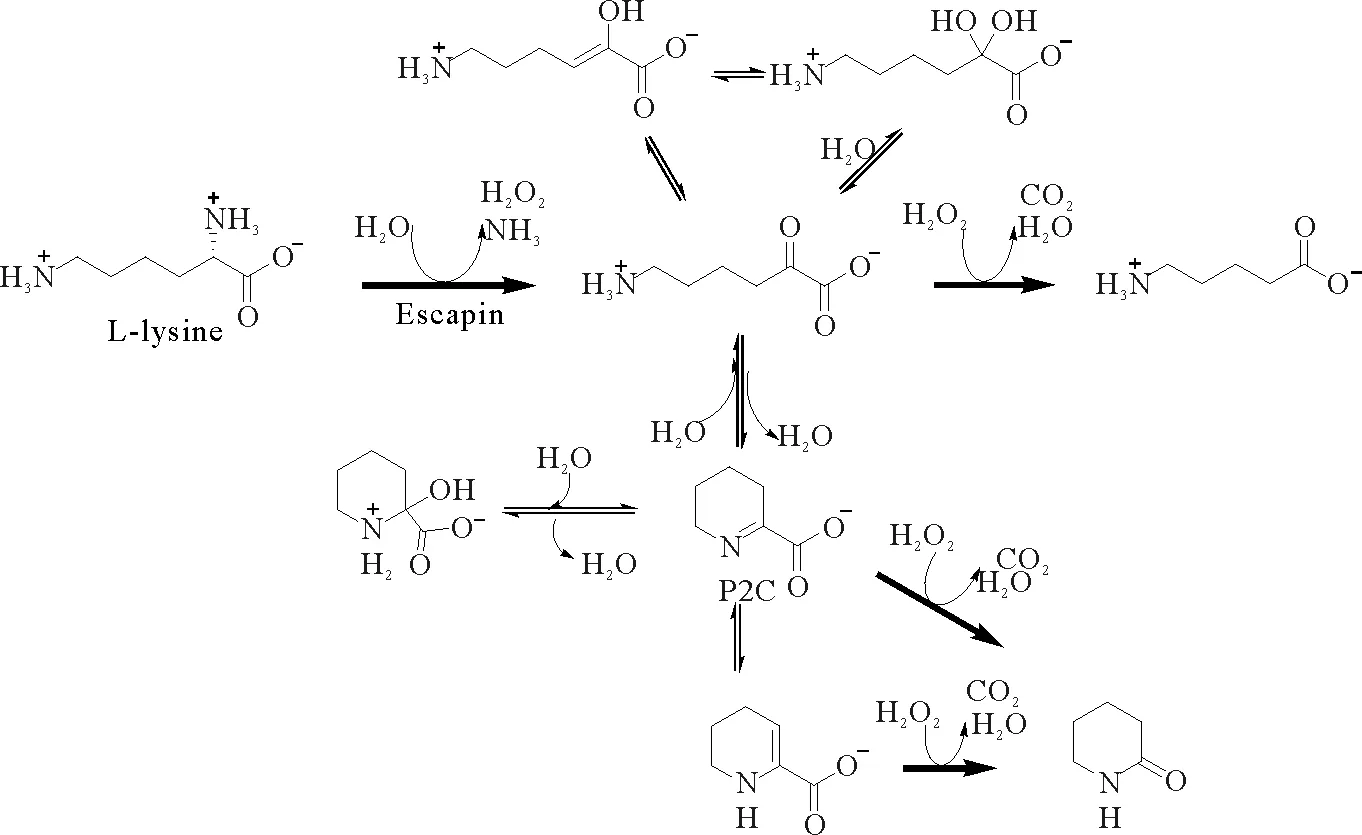
图10 海兔体内L-赖氨酸代谢机制
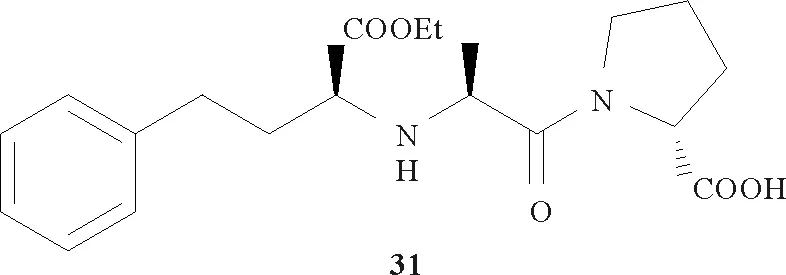
(4)L-氨基转移酶[28,54-55](以天冬氨酸氨基转移酶为例):2005年日本研究者Tadashi FUJII等[55]报道了利用经基因改造的大肠杆菌体内的天冬氨酸氨基转移酶(一种L-氨基转移酶)非对称合成L-高苯丙氨酸(30)的生物合成途径(见图11),即以L-赖氨酸和2-氧代-4-苯基丁酸(29)为原料,在L-氨基转移酶的作用下,两者的α-羰基和α-氨基互相交换即得目标产物。L-高苯丙氨酸是血管紧张素转换酶抑制剂(如依那普利,即化合物31)的结构片段,该反应同时也得到了P2C。
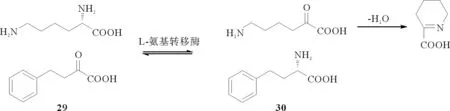
图11 L-赖氨酸经氨基转移酶代谢过程
以上P2C的酶合成途径具有副反应少、转化率高的优点,但因P2C只是反应中的不稳定中间体,其大量合成及分离纯化仍然需要深入探索。目前的酶催化合成P2C仍限于实验室微量研究。然而,在酶合成途径中P2C可进一步转化为稳定的L-哌啶酸,后者为手性分子,在手性药物合成领域有较大的应用价值。此外,以L-赖氨酸为原料的生物合成研究,也为P2C及其衍生物的化学合成途径提供了思路。
2.2 化学合成途径研究
综合考虑到化学合成中的原子经济性和原料廉价易得性,对P2C进行逆合成分析可发现,L-赖氨酸是最经济理想的原料。以L-赖氨酸为原料生物合成P2C是经过L-哌啶酸途径实现,这意味着从L-赖氨酸开始合成P2C的关键在于赖氨酸α-位的氧化脱氨。汇总近六十年的相关研究,目前只有两种典型的氧化脱氨试剂,即过硫酸氢钾和碱性铁氰化钾:
(1)经过硫酸氢钾在醋酸/醋酸钠缓冲液体系(pH介于3.6~5.2)中进行催化氧化[56]:过硫酸氢根夺取L-赖氨酸的α-H,形成亚胺碱,亚胺极易水解为α-酮酸,继而自发缩合为P2C(见图12)。
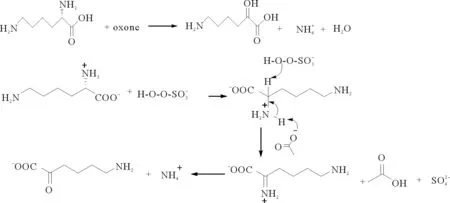
图12 L-赖氨酸经过硫酸氢钾氧化脱氨
(2)经碱性铁氰化钾在铱离子(Ir3+)的催化下进行反应[57-58]:铱离子先与游离的赖氨酸负离子结合,再与Fe3+结合,形成三聚复合物,从而把Fe3+定位到赖氨酸的α-NH2上,使其顺利被氧化成α-酮酸,同时释放出铱离子(见图13)。
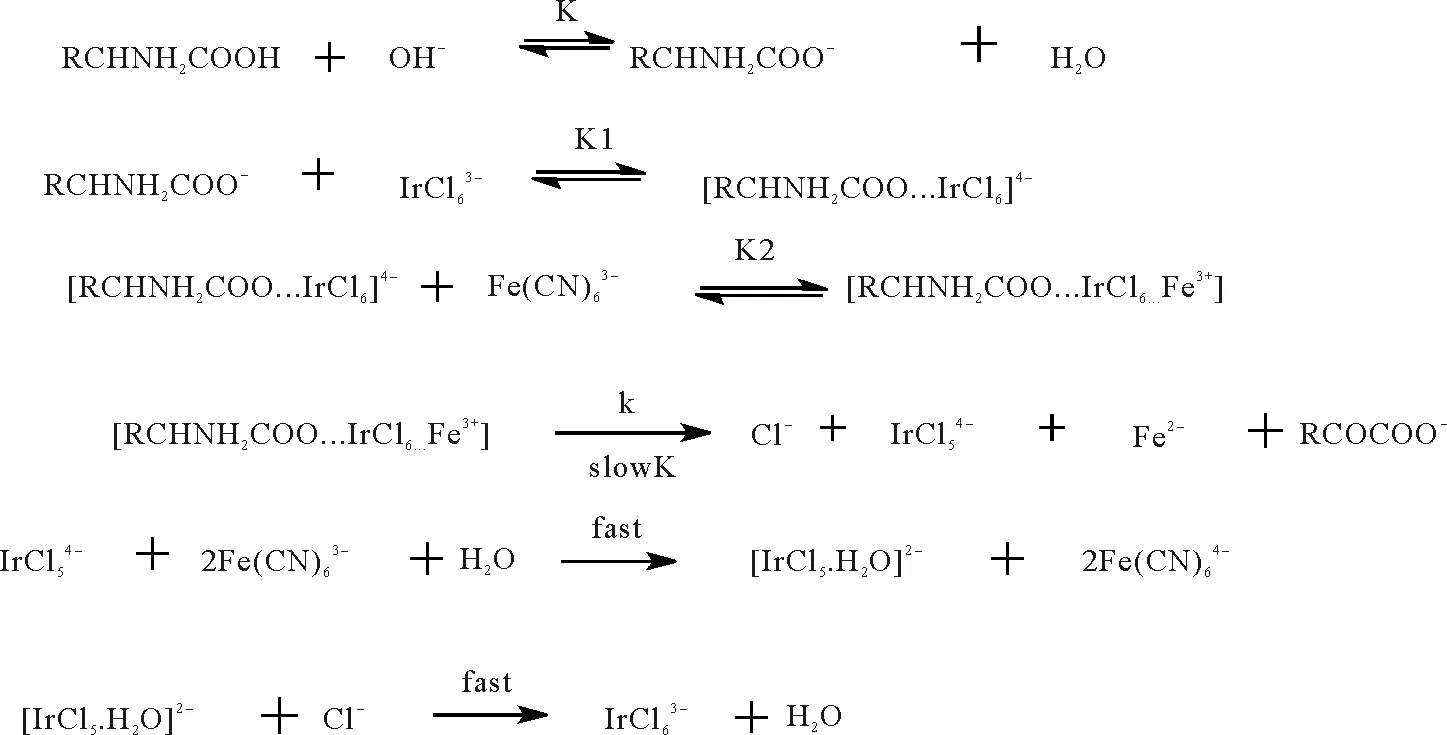
图13 L-赖氨酸经在Ir3+催化下经碱性铁氰化钾氧化脱氨
以上两种方法仍存在着转化率低、成本较高、实验条件要求过高、后处理困难等问题。结合现有研究成果,推测L-赖氨酸氧化脱氨的难处在于其α-NH2与COOH形成稳定的分子内氢键(1a和1b)[59],从而阻碍了α-NH2与氧化剂的作用。
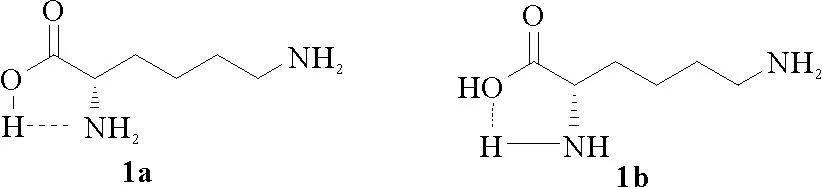
因此许多化学工作者提出了以2-取代哌啶(32)为原料,通过氯代、脱氯化氢的方法合成P2C及其类似物或衍生物的方法[19,39,41,60-62]。基本过程为:以次氯酸叔丁酯或次氯酸钠做氯代试剂,以乙醚、甲苯或甲基叔丁基醚作溶剂,氮气保护下0 ℃进行反应,然后以叔丁醇钾、氢氧化钠、DABCO、三乙胺或甲醇钠等碱作脱氯化氢的试剂。其基本反应过程如图14:1998年美国三角园区研究所的S.P.-LU和 AnitaH. Lewin报道了钠盐形式的P2C(34b)及其它几种α,β-不饱和氨基酸的合成途径[19],即以L-哌啶酸为原料,经酯化、氯代丁二酰亚胺(NCS)氯代、1,4-二氮杂[2.2.2]二环辛烷(DABCO)脱HCl、NaOH水解四步反应(见图15),得到目标化合物34b。
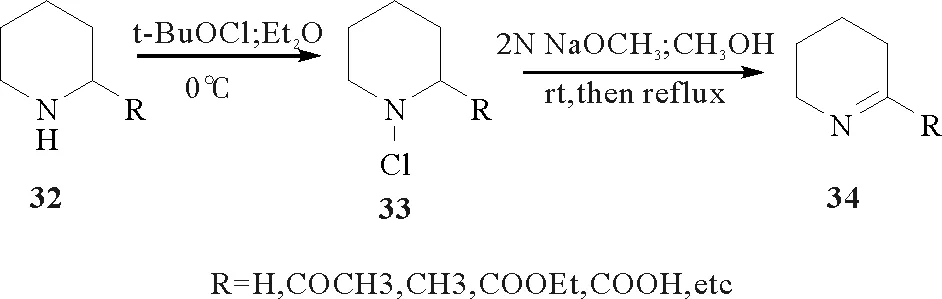
图14 以2-取代哌啶为原料合成P2C及其衍生物的过程
该合成途径较为成熟,且转化率高,越来越多地被应用于各类分子片段的构建。但其原料来源主要依赖于各种氨基酸的生物合成转化产物,如哌啶、L-哌啶酸。
综上,P2C与其衍生物的化学合成途径存在原料和氧化脱氨方法的选择两个主要问题。以L-赖氨酸为原料的路线,氧化脱氨试剂种类有限,且仅有一篇关于过硫酸氢钾的文献报道;以2-取代哌啶为原料的路线,产物转化率较高,但其原料相对于前者成本较高,且步骤较多,操作复杂,有待进一步改善。
3 总结与展望
△1-哌啶酸(P2C)及其衍生物是多种药物或先导化合物分子的重要组成片段,对其进行结构修饰或改造,有利于设计合成具有理想药理活性的新型骨架或药物。然而,由于P2C环内C=N及α-位COOH给其结构带来的不稳定性,目前不存在P2C的商品化单体,需要临时制备。而以L-赖氨酸为原料合成P2C的关键,在于α-位的氧化脱氨,但其稳定的分子内氢键很大程度阻碍了这一过程。目前发现的L-赖氨酸氧化脱氨试剂种类有限,且反应条件要求较高。多种L-赖氨酸氧化酶的发现解决了氧化脱氨问题,但目前仍受限于实验室研究,且主要关于反应产物及中间体的分析和鉴定,尚未出现有关大量酶催化合成P2C的报道。因此,要实现以收率为导向地合成P2C及其衍生物,在当前研究的基础上需要从以下三方面进行探索:一是进一步研究P2C结构稳定性的影响因素,为其存放和反应条件提供参考;二是尝试寻找或研发新的L-赖氨酸氧化脱氨试剂,实现P2C的可控高效合成方法;三是改善酶促反应的受控因素,提高P2C的分离纯化效率,降低成本。
[1] Boulanger P, Osteux R. Products of deamination of diamino acids by the L-diamino acid dehydrogenase of turkey liver[J]. Compt Rend, 1952, 235: 524-525.
[2] Boulanger P, Osteux R. The products from the action of amino acid dehydrogenase of turkey liver on arginine, ornithine, and lysine[J]. Compt Rend, 1955, 241: 125-127.
[3] Boulanger P, Sacquet E, Osteux R. The fate of L-pipecolic acid and Δ1-piperidine-2-carboxylic acid in sterile white rats[J]. Compt Rend, 1963, 257(3): 788-790.
[4] Boulanger P, Sacquet E, Osteux R, et al. Formation of14CO2from labeled lysine, Δ1-piperidine-2-carboxylic acid, and pipecolic acid in the germ-free rat[J]. Compt Rend, 1964, 259(4): 932-933.
[5] Murthy S N, Janardanasarma M K. Identification of L-amino acid/L-lysine α-amino oxidase in mouse brain[J]. Mol Cell Biochem, 1999, 197(1&2): 13-23.
[6] Garweg G, Von Rehren D, Hintze U. L-Pipecolate formation in the mammalian brain. Regional distribution of Δ1-pyrroline-2-carboxylate reductase activity[J]. J Neurochem, 1980, 35(3): 616-621.
[7] Kusakabe H, Kodama K, Kuninaka A, et al. A new antitumor enzyme, L-lysine α-oxidase from Trichoderma viride. Purification and enzymological properties[J]. J Biol Chem, 1980, 255(3): 976-981.
[8] Carson N A J, Scally B G, Neill D W, et al. Saccharopinuria: a new inborn error of lysine metabolism[J]. Nature, 1968, 218(5142): 679.
[9] Fellows F C, Carson N A. Enzyme studies in a patient with saccharopinuria: a defect of lysine metabolism[J]. Pediatr Res, 1974, 8(1): 42-49.
[10] Chang Y. Lysine metabolism in the rat brain: the pipecolic acid-forming pathway[J]. J Neurochem, 1978, 30(2): 347-354.
[11] Struys E A, Jakobs C. Metabolism of lysine in α-aminoadipic semialdehyde dehydrogenase- deficient fibroblasts: Evidence for an alternative pathway of pipecolic acid formation[J]. FEBS Lett, 2010, 584(1): 181-186.
[12] Chang Y F, Charles A K. Uptake and metabolism of delta 1-piperidine-2-carboxylic acid by synaptosomes from rat cerebral cortex[J]. BBA, 1995, 1238(1): 29-33.
[13] Hope D B, Horncastle K C, Aplin R T. Dimerization of Δ1-piperdine-2-carboxylic acid[J]. Biochem J, 1967, 105(2): 663-667.
[14] Nishina Y, Sato K, Shiga K. Isomerization of Δ1-piperideine-2-carboxylate to Δ2-piperideine-2-carboxylate on complexation with flavoprotein D-amino acid oxidase[J]. J Biochem, 1991, 109(5): 705-710.
[15] Lu S P, Lewin A H. Enamine/imine tautomerism in α, β-unsaturated α-amino acids[J]. Tetrahedron, 1998, 54(50): 15097-15104.
[16] Clark R A, Parker D C. Imine-enamine tautomerism. I. 2-(N-Cyclohexylimino)-1, 3- diphenylpropane[J]. J Am Chemical Soc, 1971, 93(26): 7257-7261.
[17] Kurasawa Y, Takada A. Characteristic tautomerism and isomerization in quinoxaline chemistry[J]. Heterocycles, 1986, 24(8): 2321-2355.
[18] Capon B, Wu Z P. Comparison of the tautomerization and hydrolysis of some secondary and tertiary enamines[J]. J Org Chem, 1990, 55(8): 2317-2324.
[19] Lu S P, Lewin A H. Enamine/imine tautomerism in α, β-unsaturated α-amino acids[J]. Tetrahedron, 1998, 54(50): 15097-15104.
[20] 肖异珠, 李桂明. 尼克霉素Z与氟康唑或特比萘芬抗白念珠菌的体外实验[J]. 中华皮肤科杂志, 2001(5): 51. Xiao Yizhu, Li Guiming. In vitro study of nikkomycin Z and Fluconazole or Terbinafine against Candida[J]. Chin J Dermatol, 2001(5): 51.
[21] Venci D, Zhao G, Jorns M S. Molecular characterization of NikD, a new flavoenzyme important in the biosynthesis of nikkomycin antibiotics[J]. Biochemistry, 2002, 41(52): 15795-15802.
[22] Bruckner R C, Zhao G, Venci D, et al. Nikkomycin biosynthesis: formation of a 4-electron oxidation product during turnover of NikD with its physiological substrate[J]. Biochemistry, 2004, 43(28): 9160-9167.
[23] Jr. Gatto G J, Boyne M T I, Kelleher N L, et al. Biosynthesis of pipecolic acid by rapl, a lysine cyclodeaminase encoded in the rapamycin gene cluster[J]. J Am Chem Soc, 2006, 128(11): 3838-3847.
[24] Jiang H, Haltli B, Feng X, et al. Investigation of the biosynthesis of the pipecolate moiety of neuroprotective polyketide meridamycin[J]. J Antibiot, 2011, 64(8): 533-538.
[25] Oshima Y, Minami H, Takano Y, et al. Ichthyotoxins in a freshwater dinoflagellate Peridinium polonicum[M]. Elsevier, 1989.
[26] Tsukamoto S, Kato H, Hirota H, et al. Pipecolate derivatives, anthosamines A and B, inducers of larval metamorphosis in ascidians, from a marine sponge Anthosigmella aff. raromicrosclera[J]. Tetrahedron, 1995, 51(24): 6687-6694.
[27] Ko K C, Wang B, Tai P C, et al. Identification of potent bactericidal compounds produced by escapin, an l-amino acid oxidase in the ink of the sea hare aplysia californica[J]. Antimicrob Agents Ch, 2008, 52(12): 4455-4462.
[28] Mitsakos V, Devenish S R A, O Donnell P A, et al. LC-MS and NMR characterization of the purple chromophore formed in the o-aminobenzaldehyde assay of dihydrodipicolinate synthase[J]. Bioorgan Med Chem, 2011, 19(4): 1535-1540.
[29] Zoltewicz J A, Prokai-Tatrai K, Bloom L, et al. Long range transmission of polar effects in cholinergic 3-arylideneanabaseines. Conformations calculated by molecular modeling[J]. Heterocycles, 1993, 35(1): 171-180.
[30] Sultana I, Hosokawa C, Nishimura K, et al. Benzylidene anabaseines act as high-affinity agonists for insect nicotinic acetylcholine receptors[J]. Insect Biochem Molec, 2002, 32(6): 637-643.
[31] Sultana I, Ikeda I, Ozoe Y. Structure-activity relationships of benzylidene anabaseines in nicotinic acetylcholine receptors of cockroach nerve cords[J]. Bio Med Chem, 2002, 10(9): 2963-2971.
[32] Ikeda I, Utsunomiya T, Sadamitsu M, et al. Affinity of 3-benzylidene- and 3-cinnamylidenemyo -smine analogues for Periplaneta americana nicotinic acetylcholine receptors[J]. J Pestic Sci, 2006, 31(4): 417-419.
[33] Talley T T, Yalda S, Ho K, et al. Spectroscopic analysis of benzylidene anabaseine complexes with acetylcholine binding proteins as models for ligand-nicotinic receptor interactions[J]. Biochemistry, 2006, 45(29): 8894-8902.
[34] Ikeda I, Utsunomiya T, Hirohara A, et al. 3-(4-Hydroxybenzylidene)anabaseine: High-affinity ligand for Periplaneta americana nicotinic acetylcho[J]. J Pestic Sci, 2009, 34(2): 96-99.
[35] Kool J, de Kloe G E, Bruyneel B, et al. Online fluorescence enhancement assay for the acetylcholine binding protein with parallel mass spectrometric identification[J]. J Med Chem, 2010, 53(12): 4720-4730.
[36] Slavov S H, Radzvilovits M, LeFrancois S, et al. A computational study of the binding of 3-(arylidene) anabaseines to two major brain nicotinic acetylcholine receptors and to the acetylcholine binding protein[J]. Eur J Med Chem, 2010, 45(6): 2433-2446.
[37] Murata M, Totsuka H, Ono H. Browning of furfural and amino acids, and a novel yellow compound, furpipate, formed from lysine and furfural[J]. Biosci Biotech Bioch, 2007, 71(7): 1717-1723.
[38] Totsuka H, Tokuzen K, Ono H, et al. A novel yellow compound and furpipate derivatives formed from furfural or 5-hydroxymethylfurfural in the presence of lysine[J]. Food Sci Technol Res, 2009, 15(1): 45-50.
[39] Chen X, Chen G, Chen H, et al. Elucidation of the chemical structure and determination of the production conditions for a bioactive maillard reaction product, [5-(5, 6-Dihydro-4H-pyridin-3-ylidenemethyl) furan-2-yl]methanol, isolated from a Glucose-Lysine Heated Mixture[J]. J Agr Food Chem, 2015, 63(6): 1739-1746.
[40] Song D, Wang Z, Mei R, et al. Short and scalable total synthesis of myrioneuron alkaloids (±)-α, β-myrifabral A and B[J]. Org Lett, 2016, 18(4): 669-671.
[41] Van T N, Kimpe N D. New Synthesis of the Alkaloid Polonicumtoxin C[J]. Tetrahedron, 2000, 56(40): 7969-7973.
[42] 刘杰武, 柴敏强, 杜晓燕, 等. 江浙蝮蛇毒L-氨基酸氧化酶的分离纯化及其性质鉴定[J]. 生物化学与生物物理学报, 2002(3): 305-310. Liu Jiewu, Chai Minqiang, Du Xiaoyan, et al. Purification and characterization of L-Amino acid oxidase from agkistrodon halys pallas venom[J]. Acta Bioch Bioph Sin, 2002(3): 305-310.
[43] 李丽兰, 黎肇炎. 蛇毒L-氨基酸氧化酶抗肿瘤作用研究进展[J]. 蛇志, 2006, 18(2): 127-130. Li Lilan, Li Zhaoyan. Research progress of snake venom l-animo acid oxidase[J]. Journal of Snake, 2006, 18(2): 127-130.
[44] 林丽珊, 张志强, 陈洲, 等. 舟山眼镜蛇毒L-氨基酸氧化酶的分离纯化、理化及酶学性质[J]. 福建医科大学学报, 2007(4): 308-311. Lin Lishan , Zhang Zhiqiang, Chen Zhou, et al. Purification and properties of the L-amino acid oxidase from Chinese cobra(najaatra) venom[J]. Journal of Fujian University, 2007(4): 308-311.
[45] 甘宗辉, 刘贤慧, 李云龙, 等. L-型氨基酸氧化酶的研究进展(综述)[C]. 北京: 中国畜牧兽医学会养牛学分会2011年学术研讨会论文集, 2011. Gan Zong-hui, Liu Xian-hui, Li Yun-long, et al. Research progress of L-Animo acid Oxidase[C]. Beijing: Chinese Institute of Animal Husbandry and Veterinary Science Symposium on Cattle Branch in 2011 set, 2011.
[46] 郭春梅, 刘淑清, 孙明忠. 蛇毒L-氨基酸氧化酶的生物学作用[J]. 天然产物研究与开发, 2012, 24: 205-212. Guo Chunmei,Liu Shuqing,SUN Mingzhong. Biological functions of snake venom L-amino acid oxidases[J]. Nat Prod Res Dev, 2012, 24: 205-212.
[47] Kusakabe H, Kodama K, Machida H, et al. Occurrence of a novel enzyme, L-lysine oxidase with antitumor activity in a culture extract of Trichoderma viride[J]. Agr Bio Chem, 1979, 43(2): 337-343.
[48] Kusakabe H, Kodama K, Kuninaka A, et al. A new antitumor enzyme, L-lysine α-oxidase from Trichoderma viride. Purification and enzymological properties[J]. J Bio Chem, 1980, 255(3): 976-981.
[49] Arinbasarova A Y, Ashin V V, Makrushin K V, et al. Isolation and properties of L-lysine-α-oxidase from the fungus Trichoderma cf. aureoviride RIFAI VKM F-4268D[J]. Microbiol, 2012, 81(5): 549-554.
[50] Amano M, Mizuguchi H, Sano T, et al. Recombinant expression, molecular characterization and crystal structure of antitumor enzyme, L-lysine-oxidase from Trichoderma viride[J]. J Biochem, 2015, 157(6): 549-559.
[51] Yang H, Johnson P M, Ko K, et al. Cloning, characterization and expression of escapin, a broadly antimicrobial FAD-containing L-amino acid oxidase from ink of the sea hare Aplysia californica[J]. J Exp Bio, 2005, 208(18): 3609-3622.
[52] Kamio M, Ko K, Zheng S, et al. The chemistry of escapin: identification and quantification of the components in the complex mixture generated by an L-Amino acid oxidase in the defensive secretion of the sea snail aplysia californica[J]. Chem-Eur J, 2009, 15(7): 1597-1603.
[53] Nusnbaum M, Derby C D. Effects of sea hare ink secretion and its escapin-generated components on a variety of predatory fishes[J]. Biol Bull-US, 2010, 218(3): 282-292.
[54] Fujii T, Mukaihara M, Agematu H, et al. Biotransformation of L-lysine to L-pipecolic acid catalyzed by L-lysine 6-aminotransferase and pyrroline-5-carboxylate reductase[J]. Biosci Biotech Bioch, 2002, 66(3): 622-627.
[55] Lo H, Hsu S, Lin W, et al. Asymmetrical synthesis of l-homophenylalanine using engineered escherichia coli aspartate aminotransferase[J]. Biotechnol Prog, 2005, 21(2): 411-415.
[56] Sundar M, Easwaramoorthy D, Kutti Rani S, et al. Mechanistic investigation of the oxidation of lysine by oxone[J]. J Solution Chem, 2007, 36(9): 1129-1137.
[57] Laloo D, Mahanti M K. Kinetics of oxidation of amino acids by alkaline hexacyanoferrate(III)[J]. J Chem Soc Dalton: Inorg Chem (1972-1999), 1990(1): 311-313.
[58] Goel A, Sharma R. A kinetic and mechanistic study on the oxidation of arginine and lysine by hexacyanoferrate (III) catalysed by iridium (III) in aqueous alkaline medium[J]. J Chem Eng Mater Sci, 2012, 3(1): 1-6.
[59] 王美婷. 若干氨基酸分子构象与电离能的理论研究[D]. 新乡:河南师范大学物理与信息工程学院, 2014: 49. Wang Meiting. Theoretical Study of Amino Acids: Conformers and Ionization Energies. Xinxiang: Henan Normal University School of physics and Information Engineering, 2014: 49
[60] De Kimpe N, Stevens C. A convenient synthesis of 6-acetyl-1, 2, 3, 4-tetrahydropyridine, the principle bread flavor component[J]. J Org Chem, 1993, 58(10): 2904-2906.
[61] Zhong Y, Zhou H, Gauthier D R, et al. Practical and efficient synthesis of N-halo compounds[J]. Tetrahedron Lett, 2005, 46(7): 1099-1101.
[62] Deblander J, Van Aeken S, Adams A, et al. New short and general synthesis of three key Maillard flavour compounds: 2-Acetyl-1-pyrroline, 6-acetyl-1, 2, 3, 4-tetrahydropyridine and 5-acetyl-2, 3-dihydro-4H-1, 4-thiazine[J]. Food Chem, 2015, 168: 327-331.
责任编辑 徐 环
Research Progress on the Synthesis of △1-Pipecolic Acid (P2C) and Its Derivatives
LI Guo-Qiang1, LIU Xiao-Ling1, LI Ping-Lin1, LUO Xiang-Chao2, TANG Xu-Li2
(Ocean University of China, 1. College of Fisheries, Qingdao 266003, China; 2. Qingdao Baishan School, Qingdao 266102, China)
3, 4, 5, 6-tetrahydro-pyridine-2-carboxylic acid (P2C), an unique Schiff base with six-member ring structure, is an indispensable intermediate for L-pipecolic acid. And P2C and L-pipecolic acid are both very important metabolites in organisms and can be used as chiral modularity in synthesis and pharmaceutically important building block in many bioactive compounds. Especially, P2C and its derivatives can interact with acetylcholine receptor (nAChR), FK506-binding protein (FKBP12), and nitric oxide synthase (NOS) to mediate physiological responses, which can be used to treat many diseases. However, synthesis of P2C and its derivatives is a big issue because of instability of P2C and a synthetic challenging of deamination of L-lysine. Interestingly, there have been some attempts involving chemical and enzymatic synthesis methods. The paper firstly reviews research on synthesis of P2C and its derivatives referring all the references during the past 60 years.
3, 4, 5, 6- tetrahydropyridine -2- carboxylic acid; derivatives; synthesis
广东省海洋经济创新发展区域示范项目(GD2012-D01-001);国家海洋局公益项目(201405038)资助 Supported by Special Financial Fund of Innovative Development of Marine Economic Demonstration Project(GD2012-D01-001);State Oceanic Administration Public Welfare Project(201405038)
2016-09-12;
2017-01-11
李国强(1963-),男,教授。E-mail:liguoqiang@ouc. edu. cn
R914.5
A
1672-5174(2017)08-082-11
10.16441/j.cnki.hdxb.20160320
李国强, 刘小玲, 李平林, 等. △1-哌啶酸(P2C)及其衍生物的合成综述[J]. 中国海洋大学学报(自然科学版), 2017, 47(8): 82-92.
LI Guo-Qiang, LIU Xiao-Ling, LI Ping-Lin, et al. Research progress on the synthesis of △1-pipecolic acid (P2C) and its derivatives[J]. Periodical of Ocean University of China, 2017, 47(8): 82-92.
